Резюме
Актуальність. Неконтрольований артеріальний тиск в осіб (АТ) пов’язаний із чотириразовим збільшенням ризику розвитку серцево-судинних подій порівняно з пацієнтами з АГ, які досягли цільового рівня АТ. Мета: оцінити загальну характеристику пацієнтів із резистентною АГ, які проходили стаціонарне лікування у відділенні симптоматичних гіпертензій ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України», та визначити досягнення цільового рівня артеріального тиску в пацієнтів із резистентною АГ, які приймають 3 антигіпертензивні препарати та більше. Матеріали та методи. У дослідження було включено 1146 пацієнтів із резистентною АГ, які приймали 3 антигіпертензивні препарати та більше і лікувалися у відділенні симптоматичних гіпертензій ДУ «ННЦ «Інститут кардіології ім. акад. М.Д. Стражеска» НАМН України». Рівень офісного АТ при надходженні хворих у відділення при прийомі 3 антигіпертензивних препаратів і більше становив ≥ 140/90 мм рт.ст.: середній рівень систолічного (САТ)/діастолічного АТ (ДАТ) був 174,60 ± 0,64/100,50 ± 0,38 мм рт.ст. Пацієнтам проводили такі обстеження: вимірювання зросту та маси тіла, офісного АТ, добове моніторування артеріального тиску, ехокардіографічне дослідження, вимірювання швидкості поширення пульсової хвилі та центрального артеріального тиску, визначення нічного апное сну, загальний аналіз крові, біохімічний аналіз крові, визначення рівнів тиреотропного гормона, Т3, Т4, реніну крові, альдостерону крові та їх співвідношення, визначення метанефринів сечі, кортизолу. Результати. Серед пацієнтів із резистентною артеріальною гіпертензією жінок було більше, ніж чоловіків, — 62,7 проти 36,7 % відповідно. Серед них у 5 % була виявлена вторинна АГ, де в структурі переважну частку становили ренопаренхімна артеріальна гіпертензія, аденома наднирників із гіперальдостеронізмом та порушення функції щитоподібної залози з гіпотиреозом. У 16,6 % пацієнтів із резистентною АГ відмічався цукровий діабет 2-го типу, 15,8 % пацієнтів перенесли порушення мозкового кровообігу в анамнезі, де переважав ішемічний інсульт — 12,8 %. У пацієнтів, у яких не було досягнуто цільового САТ (31 %), спостерігались достовірно вищі показники АТ при надходженні в стаціонар. У них відмічались достовірно вищий рівень кортизолу крові (155,0 ± 44,0 нг/л проти 35,9 ± 20,8 нг/л), вищий індекс маси міокарда лівого шлуночка (147,50 ± 3,46 г/м2 проти 135,30 ± 1,74 г/м2), частіше спостерігались ожиріння (42,9 проти 37,5 %), аномалії розвитку нирок (2,7 проти 0,8 %), облітеруючий атеросклероз нижніх кінцівок (2,0 проти 0,2 %), структурні зміни наднирників (3,0 проти 1,2 %), нефропатія (1,3 проти 0,2 %), вищий ступінь серцевої недостатності (СН 2А стадії; 16,9 проти 8,5 %). Ступінь зниження офісного АТ серед пацієнтів, які приймали 3 антигіпертензивні препарати та більше, загалом становив для САТ 43,47 ± ± 0,65 мм рт.ст., для ДАТ — 20,33 ± 0,74 мм рт.ст., р < 0,001 для обох значень. ДАТ між пацієнтами, які приймали 3 препарати та 4 препарати і більше, достовірно не відрізнявся та становив 19,88 і 20,81 мм рт.ст. відповідно, а офісний САТ достовірно більше знизився в пацієнтів, які приймали 4 препарати та більше, — на 45,78 мм рт.ст. порівняно з групою, яка приймала 3 препарати, — 41,3 мм рт.ст., р < 0,001. Висновки. Вторинна артеріальна гіпертензія була виявлена в 5 % хворих із резистентною гіпертензією, в структурі найбільшу частку становили ренопаренхімна гіпертензія, аденома наднирників із гіперальдостеронізмом та порушення функції щитоподібної залози з гіпотиреозом.
Актуальность. Неконтролируемое артериальное давление у лиц (АД) связано с четырехкратным увеличением риска развития сердечно-сосудистых событий по сравнению с пациентами с АГ, достигшими целевого уровня АД. Цель: оценить общую характеристику пациентов с резистентной АГ, которые проходили стационарное лечение в отделении симптоматических гипертензий ГУ «ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» НАМН Украины», и определить достижения целевого уровня артериального давления у пациентов с резистентной АГ, принимающих 3 антигипертензивных препарата и более. Материалы и методы. В исследование были включены 1146 пациентов с резистентной АГ, принимавших 3 антигипертензивных препарата и более, которые лечились в отделении симптоматических гипертензий ГУ «ННЦ «Институт кардиологии им. акад. Н.Д. Стражеско» НАМН Укра-ины». Уровень офисного АД у больных при поступлении в отделение при приеме 3 антигипертензивных препаратов и более составлял ≥ 140/90 мм рт.ст.: средний уровень систолического (САД)/диастолического АД (ДАД) был 174,60 ± 0,64/100,50 ± 0,38 мм рт.ст. Пациентам проводили следующие обследования: измерение роста и массы тела, офисного АД, суточное мониторирование артериального давления, эхокардиографическое исследование, измерение скорости распространения пульсовой волны и центрального артериального давления, определение ночного апноэ сна, общий анализ крови, биохимический анализ крови, определение уровней тиреотропного гормона, Т3, Т4, ренина крови, альдостерона крови и их соотношения, определение метанефринов мочи, кортизола. Результаты. Среди пациентов с резистентной артериальной гипертензией женщин было больше, чем мужчин, — 62,7 % против 36,7 % соответственно. Среди них у 5 % была обнаружена вторичная АГ, в структуре которой преобладающую долю составляли ренопаренхимная артериальная гипертензия, аденома надпочечников с гиперальдостеронизмом и нарушение функции щитовидной железы с гипотиреозом. У 16,6 % пациентов с резистентной АГ отмечался сахарный диабет 2-го типа, 15,8 % пациентов перенесли нарушение мозгового кровообращения в анамнезе, где преобладал ишемический инсульт — 12,8 %. У пациентов, у которых не было достигнуто целевое САД (31 %), наблюдались достоверно более высокие показатели АД при поступлении в стационар. У них отмечались достоверно более высокий уровень кортизола крови (155,0 ± 44,0 нг/л против 35,9 ± 20,8 нг/л), более высокий индекс массы миокарда левого желудочка (147,50 ± 3,46 г/м2 против 135,30 ± 1,74 г/м2), чаще наблюдались ожирение (42,9 против 37,5 %), аномалии развития почек (2,7 против 0,8 %), облитерирующий атеросклероз нижних конечностей (2,0 против 0,2 %), структурные изменения надпочечников (3,0 против 1,2 %), нефропатия (1,3 против 0,2 %), высокая степень сердечной недостаточности (СН 2А стадии; 16,9 против 8,5 %). Степень снижения офисного АД у пациентов, принимавших 3 антигипертензивных препарата и более, в целом составила для САД 43,47 ± ± 0,65 мм рт.ст., для ДАД — 20,33 ± 0,74 мм рт.ст., р < 0,001 для обоих значений. ДАД между пациентами, которые принимали 3 препарата и 4 препарата и более, достоверно не отличалось и составило 19,88 и 20,81 мм рт.ст. соответственно, а офисное САД достоверно больше снизилось у пациентов, принимавших 4 препарата и более, — на 45,78 мм рт.ст. по сравнению с группой, принимавшей 3 препарата, — 41,3 мм рт.ст., р < 0,001. Выводы. Вторичная артериальная гипертензия была обнаружена у 5 % больных с резистентной гипертензией, в структуре наибольшую долю составляли ренопаренхимная гипертензия, аденома надпочечников с гиперальдостеронизмом и нарушение функции щитовидной железы с гипотиреозом.
Background. Patients with uncontrolled blood pressure (BP) have a fourfold increase in the risk of developing cardiovascular events compared to those with hypertension who have reached the target blood pressure. The purpose of the study was to evaluate the structural characteristics of patients with resistant arterial hypertension (AH) undergoing in-patient treatment at the department of symptomatic hypertensions of the SI “NSC “M.D. Strazhesko Institute of Cardiology” of the National Academy of Medical Sciences of Ukraine” and to determine the achievement of the target blood pressure in patients with resistant AH taking three or more antihypertensive drugs. Materials and methods. The study included 1,146 patients with resistant AH who received 3 or more antihypertensive drugs and were treated at the department of symptomatic hypertensions of the SI “NSC “M.D. Strazhesko Institute of Cardiology” of the National Aca-demy of Medical Sciences of Ukraine”. The level of office BP at admission to the department was ≥ 140/90 mmHg if patients took 3 or more AH drugs. The average level of systolic (SBP)/diastolic blood pressure (DBP) was 174.60 ± 0.64/100.50 ± 0.38 mmHg. Patients underwent the following examinations: body height and weight measurements, office BP, daily blood pressure monitoring, echocardiography, pulse wave velocity and central blood pressure, sleep apnea determination, general blood count, blood biochemical analysis, evaluating the levels of thyroid-stimulating hormone, Т3, Т4, blood renin, blood aldosterone and their correlation, determination of urine metanephrine, cortisol. Results. Among patients with resistant arterial hypertension, there were more women (63 %) than men (37 %). Secondary hypertension was found in 5 %; renoparenchymal arterial hypertension, adrenocortical adenoma with hyperaldesononism and abnormal thyroid function with hypothyroidism predominated in the structure. 16.6 % of patients with resistant arterial hypertension had type 2 diabetes mellitus, 15.8 % — a history of cerebrovascular accident, with an ischemic stroke prevalence of 12.8 %. Patients who did not achieve target SBP (31 %) had significantly higher blood pressure at admission. They had a significantly higher blood cortisol level (155.0 ± 44.0 ng/l vs 35.9 ± 20.8 ng/l), higher left ventricular mass index (147.50 ± 3.46 g/m2 vs 135.30 ± 1.74 g/m2), obesity (42.9 vs 37.5 %), kidney abnormality (2.7 vs 0.8 %), obliterating lower limb atherosclerosis (2.0 vs 0.2 %), structural alterations in the adrenal gland (3.0 vs 1.2 %), nephropathy (1.3 vs 0.2 %), and higher degree of heart failure (16.9 vs 8.5 %). The degree of office blood pressure reduction among patients who received 3 or more drugs was 43.47 ± 0.65 mmHg for SBP and 20.33 ± 0.74 mmHg for DBP, p < 0.001 for both values. The DBP did not differ significantly between patients taking 3 and 4 drugs or more — 19.88 and 20.81 mmHg, respectively, and the office SBP significantly decreased in patients taking 4 drugs or more — by 45.78 mmHg compared with the group taking 3 drugs — 41.3 mmHg, p < 0.001. Conclusions. Secondary arterial hypertension was found in 5 % of patients with resistant hypertension; renoparenchymal hypertension, adrenocortical adenoma with hyperaldesononism and abnormal thyroid function with hypothyroidism prevailed in the structure.
Вступ
Резистентна артеріальна гіпертензія (АГ) є актуальною проблемою, оскільки неконтрольований артеріальний тиск (АТ) в осіб пов’язаний із чотириразовим збільшенням ризику розвитку серцево-судинних подій порівняно з пацієнтами з АГ, які досягли цільового рівня АТ [4, 6, 7, 10–13, 17, 37]. У 2008 році Американська асоціація серця опублікувала рекомендації щодо резистентної артеріальної гіпертензії (РАГ) [38, 44]. Відтоді було проведено багато досліджень щодо важливості правильного визначення діагнозу та вибору найкращого лікування. Останніми роками спостерігається все більша зацікавленість у виявленні РАГ, тому що неконтрольований АТ є патологічним станом із поганим прогнозом. Визначення поняття «резистентна АГ» різняться. Сьомий звіт Об’єднаного національного комітету із запобігання, виявлення, оцінки і лікування високого АТ визначає РАГ як нездатність досягти цільового АТ, незважаючи на прихильність до лікування, повними дозами принаймні 3 препаратами, включаючи діуретик [9, 27].
Попередні дослідження показали, що з резистентною АГ пов’язане ожиріння [20], інші засвідчили зв’язок з цукровим діабетом [25, 33]. Також в дослідженнях виявлено, що РАГ пов’язана із збільшенням віку, жіночою статтю, негроїдною расою, наявністю цукрового діабету, ожирінням, хронічним захворюванням нирок і гіпертрофією лівого шлуночка (ЛШ) [17–19, 21, 26, 29]. Раннє виявлення РАГ й агресивна терапія можуть зменшити частоту як серцево-судинної захворюваності, так і смертності. Проте точна поширеність резистентної АГ не відома через різноманітність її визначення та різноманістність місць проведення дослідження [42, 43]. За даними низки досліджень, РАГ зустрічається у 5–50 % випадків [48].
Підвищений АТ є одним із найважливіших факторів ризику розвитку інсульту [3, 5, 40], а неконтрольована АГ збільшує цей ризик [22]. Поширеність АГ в азіатських країнах майже однакова, як і в більшості розвинених країн, багато пацієнтів в Азії мають неконтрольовану АГ порівняно з розвиненими країнами [48]. У розвинених країнах рівень контролю АТ становить близько 52–60 %, але, наприклад, у Малайзії цей показник становить 26 % [8, 15, 23, 30, 48]. В Україні контроль АТ у міській популяції становить 14 %, в сільській популяції — 8 % [1, 2]. Резистентна АГ — одна з причин неконтрольованої АГ.
Мета нашої роботи: визначити досягнення цільового рівня артеріального тиску в пацієнтів із резистентною артеріальною гіпертензією, які приймають 3 антигіпертензивні препарати та більше.
Матеріали та методи
У дослідження було включено 1146 пацієнтів із резистентною АГ, які приймали 3 антигіпертензивні препарати та більше, які лікувались у відділенні симптоматичних гіпертензій ДУ «ННЦ «Інститут кардіології ім. акад. М.Д. Стражеска» НАМН України». Рівень офісного АТ при надходженні у відділення при прийомі 3 антигіпертензивних препаратів і більше становив ≥ 140/90 мм рт.ст.: середній рівень систолічного (САТ)/діастолічного АТ (ДАТ) був 174,60 ± 0,64/100,50 ± 0,38 мм рт.ст.
Усім пацієнтам на початку, крім загального клінічного обстеження, проводили такі дослідження, як вимірювання маси тіла та зросту, розрахунок індексу маси тіла (ІМТ). ІМТ визначали за формулою:
ІМТ = маса тіла/(ріст)2, кг/м2.
Діагноз надлишкової ваги тіла або ожиріння встановлювали відповідно до критеріїв Всесвітньої організації охорони здоров’я (1997). Надлишкову вагу тіла визначали при значенні ІМТ від 25 до 29,9 кг/м2, ожиріння I ступеня — від 30 до 34,9 кг/м2, II ступеня — від 35 до 39,9 кг/м2, III ступеня — ІМТ більше ніж 40,0 кг/м2.
Усім хворим проводили вимірювання офісного САТ, ДАТ та частоти серцевих скорочень (ЧСС), добове моніторування АТ (ДМАТ), ехокардіографію за загальноприйнятою методикою, визначення швидкості поширення пульсової хвилі по артеріях еластичного (ШППХе) та м’язового (ШППХм) типів, обчислення центрального САТ, біохімічне дослідження крові (визначення рівнів калію, натрію, креатиніну, сечової кислоти, аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ), білірубіну, глюкози, тиреотропоного гормона (ТТГ), трийодтироніну (Т3), тироксину (Т4), реніну, альдостерону, ренін-альдостеронового співвідношення), визначали ліпідний обмін крові, що включав встановлення вмісту загального холестерину (ХС), тригліцеридів (ТГ), холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ), низької щільності (ХС ЛПНЩ), дуже низької щільності (ХС ЛПДНЩ), індекс атерогенності (ІА), визначали вміст метанефринів у добовій сечі.
Вимірювання САТ та ДАТ у кабінеті лікаря проводили за методом Короткова на початку дослідження, після семиденної (за необхідності) відміни усіх антигіпертензивних препаратів та наприкінці лікування (перед випискою). Вимірювали АТ у положенні сидячи тричі з інтервалом 1–2 хвилини. Встановлювали середнє з трьох вимірів. ЧСС визначали після другого вимірювання.
Реєстрацію електрокардіографії проводили на шестиканальному самописці «Юнікард» (Україна). Визначали наявність загальноприйнятих ознак гіпертрофії ЛШ (індекс Соколова (SV1 + RV5/RV6) > 35 мм, вольтажний індекс Корнела (R aVL + S V3) > 28 мм у чоловіків та > 20 мм у жінок, індекс тривалості Корнела (вольтаж помножити на тривалість) > 2400 мм • мс, індекс Ромхілт — Estes > 5 балів) та порушення ритму.
ДМАТ проводили за допомогою апаратів АВРМ-04М (фірма «Медитек», Угорщина). Обробку даних — за допомогою програмного забезпечення апарата на ПК. Моніторування здійснювали в такому режимі: у денний час — кожні 15 хвилин, вночі (з 22:00 до 6:00 годин) — кожні 30 хвилин. Хворі вели звичайний спосіб життя, виконуючи побутові фізичні і психоемоційні навантаження. При цьому вивчали такі показники: середньодобовий, денний, нічний САТ, середньодобовий, денний, нічний ДАТ, ЧСС. При аналізі ДМАТ для САТ і ДАТ розраховували індекс часу (ІЧ), що характеризує часове перевантаження тиском протягом доби та визначається як відсоток вимірів АТ, що перевищує 140/90 мм рт.ст. вдень і 120/80 мм рт.ст. вночі. Також визначали індекс навантаження тиском (ІП), що є площею між кривою підвищеного АТ та лінією границі норми, а також індекс варіабельності (СВ), який обчислювали як стандартне відхилення величини АТ. Крім того, за допомогою програмного забезпечення вираховували добовий індекс (ДІ) — процент зниження нічного АТ порівняно з денним. За норму прийняли значення артеріального тиску, рекомендовані в 1998 році Американським національним комітетом із питань діагностики та лікування АГ у шостих рекомендаціях: для середнього денного САТ — 135 мм рт.ст., для середнього денного ДАТ — 85 мм рт.ст. У 1999 році експерти Всесвітньої організації охорони здоров’я та Міжнародного товариства гіпертензії рекомендували до використання як норму показник артеріального тиску для середнього добового САТ 125 мм рт.ст., для середнього добового ДАТ — 80 мм рт.ст.
ІЧ (навантаження тиском) розраховували як процент вимірів, що перевищують нормальні показники. ІЧ для САТ вважається нормальним до 20 %, а для ДАТ — до 15 %. Динаміка індексу навантаження тиском дає змогу оцінити адекватність лікування.
При оцінці добового ритму АТ нормальним вважається зменшення АТ вночі під час сну на 10–20 % порівняно з денним періодом. Ступінь нічного зниження САТ та ДАТ або ДІ розраховували за формулою (окремо для САТ та ДАТ):
ДІ = (серАТд – серАТн) • 100 %/серАТд,
де серАТд — середньоденний АТ (САТ чи ДАТ), серАТн — середньонічний АТ (САТ чи ДАТ).
За нормальне зниження АТ вночі (статус dipper) приймали зниження на 10–20 %, недостатнє зниження (статус non-dipper) — на 0–10 %, підвищений ступінь нічного зниження (статус hyper-dipper) — більше 20 % та стійке підвищення АТ вночі, коли нічний АТ був більше денного (статус night-peaker). Варіабельність САТ та ДАТ розраховували як стандартне відхилення від середнього значення, тобто як коефіцієнт варіабельності середньої величини САТ і ДАТ за добу, день, ніч.
Ехокардіографію проводили за стандартною методикою за допомогою ультразвукового діагностичного апарата Sonoline SL-1 (Siemens, Франція) у М- та В-режимі. Визначали розмір лівого передсердя (ЛП), кінцево-діастолічний розмір ЛШ, кінцево-систолічний розмір (КСР) ЛШ, фракцію викиду лівого шлуночка. Маса міокарда лівого шлуночка розраховувалась за формулою Американського товариства ехокардіографії (American Society of Echocardiography):
ММЛШ (г) = 0,8 • (1,04 [(КДР + ТЗС + ТМШП)3 – (КДР)3]) + 0,6 г,
де КДР — кінцево-діастолічний розмір (см), ТЗС — товщина задньої стінки ЛШ (см), ТМШП — товщина міжшлуночкової перегородки (см), 1,04 — розрахунковий коефіцієнт, 0,8 — розрахунковий коефіцієнт.
Індекс маси міокарда лівого шлуночка (ІММЛШ) розраховувався за формулою:
ІММЛШ (г/м2) = ММЛШ/площа поверхні тіла.
Біохімічні аналізи виконувалися на автоматичному фотометрі Livia (Сormay, Польща) в лабораторії ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України». Визначали рівень креатиніну, калію, натрію, глюкози, загального ХС, ТГ, ХС ЛПВЩ, ХС ЛПНЩ, ХС ЛПДНЩ сироватки крові. Рівень реніну, альдостерону крові, ренін-альдостеронового співвідношення та метанефрину в добовій сечі, гормонів щитоподібної залози — Т3, Т4, ТТГ визначали в лабораторії «ДІЛА». Кліренс креатиніну, що відображає швидкість клубочкової фільтрації (ШКФ), виявляли розрахунково за формулою CKD-EPI (онлайн-калькулятор, норма — рШКФ > 90 мл/хв/1,73 м2) або Cockroft — Gault ((ШКФ = 1,23 • ((140 – вік (роки) • маса тіла (кг))/(креатинін крові (мкмоль/л)) — для чоловіків (норма — 90–150 мл/хв); (ШКФ = 1,05 × ((140 – вік (роки) • маса тіла (кг))/(креатинін крові (мкмоль/л)) — для жінок (норма — 90–130 мл/хв)). Вміст загального ХС, ТГ, ХС ЛПНЩ, ХС ЛПДНЩ визначали в ммоль, ІА — в умовних одиницях. Фракції ХС ЛПНЩ, ХС ЛПДНЩ та ІА розраховували за формулою W. Friedwald:
ХС ЛПНЩ = ЗХ – (ХС ЛПВЩ + ТГ/2,2), ммоль/л,
ХС ЛПДНЩ = ТГ/2,2, ммоль/л,
ІА = (ЗХ – ХС ЛПВЩ)/ХС ЛПВЩ, ум.од.
ШППХ та центральний АТ визначалися на апараті Sphygmocor-PVx (AtCor Medical Pty Ltd, Австралія), з’єднаному з персональним комп’ютером, що дозволяє проводити аналіз форми пульсової хвилі та визначати ШППХе та ШППХм. П’єзодатчики встановлювали на загальній правій, стегновій та радіальній артерії правого передпліччя під візуальним (на моніторі) та автоматичним контролем якості, що здійснювався за відповідною програмою приладу. Час запізнювання та швидкість поширення пульсової хвилі, центральний АТ визначалися автоматично за допомогою програмного забезпечення приладу після введення величини відстані між датчиками, що вимірювалася сантиметровою смужкою. Для оцінки пружно-еластичних властивостей артерій еластичного типу ШППХ визначали на сегменті «сонна артерія — стегнова артерія», м’язового типу — на сегменті «сонна артерія — радіальна артерія». Окрім ШППХ, визначали також центральний АТ за допомогою програмного забезпечення приладу на основі артеріального тиску на плечовій артерії та форми отриманої пульсової хвилі у висхідній аорті (формула визначена виробником, та проведена стандартизація при інтрааортальному вимірюванні артеріального тиску). У частини пацієнтів з ожирінням виявлялась наявність нічного апное сну та ступінь нічного апное-гіпопное сну. Основні клініко-демографічні показники обстежених пацієнтів подані в табл. 1.
/51-1.jpg)
Статистичну обробку результатів проводили на персональному комп’ютері після створення баз даних у системах Microsoft Excel. Середні показники обстежених пацієнтів визначали за допомогою пакета аналізу в системі Microsoft Excel. Усі інші статистичні розрахунки проводили за допомогою програми SPSS 21.0. Достовірність різниці середніх між групами визначалася методом незалежного t-тесту для середніх. Порівняння динаміки показників на етапах лікування проводили за допомогою парного двовибіркового t-тесту для середніх. Кореляційний аналіз здійснювали після визначення характеру розподілу за Spearman.
Результати
По-перше, ми оцінили поширеність основних клінічних станів серед пацієнтів із РАГ. Дані подані в табл. 2. Як видно з табл. 2, жінок порівняно з чоловіками було більше — 62,7 проти 36,7 %. У 95,1 % пацієнтів була виявлена есенціальна АГ: переважала АГ II ст. — 72,4 %, АГ III ст. становила 21,7 % та АГ I ст. — 1,0 %. У 4,9 % пацієнтів була виявлена вторинна артеріальна гіпертензія: найбільшу частку становили ренопаренхімна гіпертензія та аденома наднирникової залози з гіперальдостеронізмом. Дисліпідемія визначена в 64,8 % пацієнтів, ожиріння — майже в 40 %, ішемічна хвороба серця (ІХС) — у 42 % хворих без перенесеного інфаркту міокарда в анамнезі, порушення мозкового кровообігу в анамнезі або транзиторна ішемічна атака були зареєстровані в 15,8 % пацієнтів, фібриляція передсердь (ФП) — у 8,1 % хворих із РАГ, що значно частіше, ніж у загальній популяції, за даними епідеміологічних досліджень [1], цукровий діабет II типу — в 16,6 % пацієнтів, патологія щитоподібної залози (ЩЗ) — у 10,4 %, серед порушень функції ЩЗ частіше зустрічався гіпотиреоз.
Дані щодо розподілу прийому кількості антигіпертензивних препаратів, що були призначені, подано в табл. 3. Так, переважна більшість пацієнтів (51,4 %) приймали 3 антигіпертензивні препарати. Решта пацієнтів (48,6 %) — 4–6: серед них більшість (37,1 %) приймала 4 антигіпертензивні препарати, 9,1 % — 5 та 2,4 % — 6.
/52-1.jpg)
Частота призначення різних класів антигіпертензивних засобів в обстежених хворих подана в табл. 4. У структурі призначень антигіпертензивних препаратів частіше були інгібітори ангіотензинперетворюючого ферменту (АПФ) — 65,5 %, антагоністи кальцію — 69,9 % та діуретики (петльові, тіазидні та тіазидоподібні) — 91,8 %. Бета-адреноблокатори приймали 75,6 % пацієнтів, блокатори рецепторів до ангіотензину II — 33,5 %, блокатори рецепторів альдостерону — 12,8 %, препарати центральної дії — 18,6 %, статини — 63,8 %. Серед тих, кому призначали комбіновану терапію, переважна більшість (71,9 %) приймали фіксовані комбінації антигіпертензивних препаратів. Звертала на себе увагу низька частота призначення блокаторів рецепторів альдостерону (12,8 %), що пояснюється тим, що дослідження проводилося переважно до 2015 року, коли з’явилися наукові докази необхідності їх застосування як 4-го препарату.
Для подальшого аналізу ми розподілили наших пацієнтів залежно від кількості антигіпертензивних препаратів, що вони приймали. Хоча у визначенні РАГ використовується 3 та більше антигіпертензивні препарати, ми розподілили наших пацієнтів на дві групи: перша — ті, хто приймав 3 препарати, друга — 4 та більше препаратів. Порівняння демо-графічних характеристик та рівня АТ у цих групах подано в табл. 5. Як видно з табл. 5, групи в середньому не відрізнялися за віком та статтю, але пацієнти, які приймали ≥ 4 препаратів, мали достовірно більшу масу тіла та ІМТ порівняно з групою пацієнтів, які приймали 3 препарати. Також у них були достовірно вищі рівні офісного АТ як при надходженні в стаціонар, так і при виписці. Слід зазначити, що в обох группах величина індексу апное-гіпопное була високою, але не відрізнялася між собою.
За даними лабораторних обстежень пацієнти, які приймали ≥ 4 препаратів, мали достовірно вищий рівень глюкози крові натще — 6,20 ± 0,09 ммоль/л порівняно з пацієнтами, які приймали 3 препарати, — 5,90 ± 0,14 ммоль/л, (р < 0,05) та вищий рівень реніну плазми крові — 218,30 ± 15,73 нг/л проти 31,10 ± 5,91 нг/л (р < 0,05). Ренін-альдостеронове співвідношення було майже вдвічі вищим — 3,90 ± ± 0,95 ум.од. проти 2,20 ± 0,65 ум.од.), хоча і достовірно не відрізнялося між групами пацієнтів. Дані подані в табл. 6.
За даними ехокардіографії, при надходженні в клініку пацієнти обох груп достовірно відрізнялися за діаметром кореня аорти, товщиною міжшлуночкової перегородки, задньої стінки лівого шлуночка та ІММЛШ. Всі вищенаведені показники були достовірно більшими в групі пацієнтів, які приймали 4 антигіпертензивні препарати та більше, що абсолютно закономірно, оскільки рівень АТ навіть за умови лікування в даної групи пацієнтів був початково вищим, що відповідає більш тяжкому ураженню серця як органа-мішені (табл. 7).
Аналізуючи, як відрізнялися пацієнти обох груп за основними клінічними станами, ми встановили, що в пацієнтів, які приймали 4 антигіпертензивні препарати та більше достовірно частіше зустрічалось ожиріння (45,6 проти 34,0 %), частіше виявлялась вторинна АГ (5,4 проти 2,5 %) за рахунок стенозу ниркових артерій (1,6 проти 0,2 %) та гіперальдостеронізму (2,3 проти 0,2 %), частіше відмічалися цукровий діабет II типу (24,7 проти 9,5 %), патологія ЩЗ (12,6 проти 8,4 %) за рахунок гіпотиреозу (4,1 проти 1,5 %), ХХН (5,0 проти 1,5 %), хронічний пієлонефрит (18,9 проти 14,0 %), ІХС (47,0 проти 37,2 %) із зсувом стенокардії напруження до більш тяжкого ФК: стенокардія напруження III ФК (7,4 проти 3,4 %), серцева недостатність (15,0 проти 9,3 %) (табл. 8).
Ми оцінили структуру призначення антигіпертензивних препаратів та виявили, що групи достовірно відрізнялися між собою за всіма групами призначених антигіпертензивних препаратів. Так, у групі пацієнтів, які приймали ≥ 4 препаратів, достовірно більше призначалися антагоністи кальцію, бета-адреноблокатори, діуретики, статини, альфа-адреноблокатори, блокатори рецепторів до АТ II, препарати центральної дії та блокатори рецепторів альдостерону. У групі пацієнтів, які приймали 3 препарати, частіше призначалися тільки інгібітори АПФ та аспірин (табл. 9).
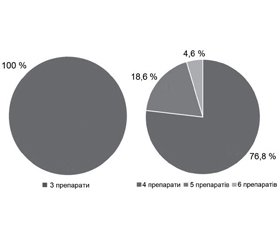
У групі пацієнтів, які приймали 4 антигіпертензивні препарати та більше, більшість пацієнтів приймали 4 антигіпертензивні препарати — 76,8 %, 5 — 18,6 % і тільки 4,6 % пацієнтів приймали 6 антигіпертензивних препаратів (рис. 1).
При аналізі ступеня зниження АТ ми встановили, що загалом ступінь зниження офісного АТ серед пацієнтів, які приймали 3 препарати та більше, становив для САТ 43,47 ± 0,65 мм рт.ст., для ДАТ — 20,33 ± 0,74 мм рт.ст., р < 0,001 для обох значень.
Аналіз ступеня зниження АТ залежно від кількості препаратів показав, що ДАТ між пацієнтами, які приймали 3 препарати та 4 і більше препаратів, достовірно не відрізнявся та становив 19,88 та 20,81 мм рт.ст. відповідно, а офісний САТ достовірно більше знизився в пацієнтів, які приймали 4 та більше препаратів, — на 45,78 мм рт.ст. порівняно з групою, що приймала 3 препарати, — 41,3 мм рт.ст., р < 0,001 (табл. 10).
Ступінь зниження САТ загалом по групі достовірно відрізнявся за САТ та не відрізнялася за ДАТ (табл. 11).
Ступінь зниження АТ серед пацієнтів, які приймали 3 препарати, достовірно відрізнявся за ДАТ між тими, кому вдалося та не вдалося досягти цільо-вого АТ. У пацієнтів, які приймали 4 та більше препаратів, достовірно відрізнявся ступінь зниження САТ між тими, у кого досягуто та не досягнуто цільо–вий АТ (табл. 12).
У пацієнтів, у яких не було досягнуто цільового САТ (31 %), спостерігались достовірно вищі показники АТ при надходженні в стаціонар. У них був достовірно вищий рівень кортизолу крові (155,0 ± 44,0 нг/л проти 35,9 ± 20,8 нг/л), вищий ІММЛШ (147,50 ± 3,46 г/м2 проти 135,30 ± 1,74 г/м2), частіше спостерігалось ожиріння (42,9 проти 37,5 %), аномалії розвитку нирок (2,7 проти 0,8 %), облітеруючий атеросклероз нижніх кінцівок (2,0 проти 0,2 %), структурні зміни наднирників (3,0 проти 1,2 %), нефропатія (1,3 проти 0,2 %), вищий ступінь серцевої недостатності (СН 2А стадії; 16,9 проти 8,5 %) (табл. 13–16).
/57-1.jpg)
/58-1.jpg)
/59-1.jpg)
/60-1.jpg)
Серед пацієнтів, які не досягли цільового рівня САТ, частіше призначалися антагоністи кальцію, препарати центральної дії, блокатори рецепторів альдостерону, менше — фіксовані комбінації. Такий результат можна пояснити тим, що пацієнтам була необхідна більша кількість препаратів для зниження АТ, а для тих, у кого було досягнення цільового АТ, було достатньо потрійної або подвійної фіксованої комбінації та не було необхідності додавати 4–6-й препарати (табл. 17).
За кількістю антигіпертензивних препаратів серед пацієнтів, які досягли цільового рівня АТ, переважало призначення 3 препаратів, оскільки було достатньо для досягнення цільового рівня АТ. У групі пацієнтів, які не досягли цільового САТ, переважало призначення 4 та 5 антигіпертензивних препаратів (табл. 18).
Чим старше були пацієнти, тим гірше знижувався ДАТ. Чим вищий був ступінь АГ, тим гірше знижувався САТ. У пацієнтів із порушеною толерантністю до вуглеводів гірше знижувався САТ, із гіпертензивним серцем — як САТ, так і ДАТ, із ХХН — ДАТ, із нефропатією — САТ, а в пацієнтів із нічним апное — ДАТ. Чим вищий був рівень креатиніну в пацієнтів, тим гірше знижувався САТ. При відключеній нирці — теж САТ. Підвищений рівень індексу атерогенності сприяв гіршому зниженню ДАТ. Більш високий рівень калію крові — теж ДАТ. Чим вищий був ІММЛШ, тим сильніше знижувався САТ (табл. 19).
Обговорення
Наші дані продемонстрували, що серед пацієнтів із резистентною артеріальною гіпертензією жінок було більше, ніж чоловіків, — 62,7 проти 36,7 % відповідно. Серед них у 5 % була виявлена вторинна артеріальна гіпертензія: у структурі переважну частку становили ренопаренхімна артеріальна гіпертензія, аденома наднирників із гіперальдостеронізмом та порушення функції щитоподібної залози з гіпотиреозом. 16,6 % пацієнтів із резистентною АГ мали цукровий діабет 2-го типу, у 15,8 % пацієнтів було перенесене порушення мозкового кровообігу в анамнезі, де переважав ішемічний інсульт — 12,8 %. У нашому дослідженні фібриляція передсердь спостерігалась у 8,1 % пацієнтів із резистентною АГ, що значно частіше, ніж у загальній популяції, що свідчить про тяжкість даної категорії пацієнтів.
Yook Chin Chia та Siew Mooi Ching вивчали поширеність та предиктори резистентності до АГ терапії в жителів Південно-Східної Азії [48]. Поширеність АГ на первинному огляді в їх дослідженні становила 8,8 %. Їх дані також показують, що в пацієнтів із хронічним захворюванням нирок (ХЗН) в 2,9 раза частіше зустрічалась резистентна АГ порівняно з пацієнтами без ХЗН. Це узгоджується з висновками в інших дослідженнях [12, 14]. Автори пояснюють це тим, що у хворих із ХЗН підвищена чутливість до солі, у результаті чого відбувається затримка натрію та рідини, що призводить до більш складного конт-ролю АТ [48]. Пацієнти в дослідженні Yook Chin Chia були віком у середньому 66,9 року. Резистентна АГ у даному дослідженні негативно була пов’язана з віком, що автори пояснюють з ефектом виживання хворих, які піддалися лікуванню, порівняно з тими пацієнтами, у яких вже виникли ускладнення від неконтрольованої АГ. Багато досліджень показали, що більшості пацієнтів із АГ потрібні 2 препарати або більше для досягнення цільового рівня АТ [14, 16, 24, 28, 30, 31]. Середня кількість антигіпертензивних препаратів, використаних в їх дослідженні, була 2. Вони також виявили поганий рівень контролю АТ серед тих, хто приймав лише 2 препарати, навіть у тих, хто отримував 3 препарати, рівень контролю АТ був меншим за 50 %. Однак загалом використання діуретиків в їх дослідженні було низьким.
L. Holmqvist зі співавт. досліджували прихильність до лікування в пацієнтів із резистентною АГ, які контролювали або не контролювали АТ, та те, які фактори сприяли неприхильності до лікування. 5846 пацієнтів протягом 2 років пройшли лікування 3 антигіпертензивними препаратами та більше [23]. Пацієнти, які досягали цільових рівнів АТ, були старші за віком та мали менше цукрового діабету. Початково пацієнти мали прихильність більше 80 %. Протягом першого року лікування прихильність знизилася на 11 % незалежно від контрольованого чи неконтрольованого АТ. Вища прихильність спостерігалась тільки в пацієнтів із цукровим діабетом та АГ, що автори пояснюють структурованістю лікування такого пацієнта.
Резистентна АГ пов’язана із суттєвими несприятливими наслідками, включаючи підвищений ризик розвитку серцево-судинних подій та смерті, а також зниження якості життя [39, 47]. Точні механізми, що лежать в основі розвитку резистентної АГ, залишаються незрозумілими, хоча було запропоновано кілька механізмів [34–36, 46]. Збільшення вмісту рідини та рівня альдостерону відіграє вирішальну роль у розвитку РАГ, тоді як посилена активація симпатоадреналової системи істотно сприяє рефрактерній гіпертензії [30, 32, 41]. У пацієнтів з істинною РАГ оптимізація антигіпертензивного режиму повинна бути початковим фармакотерапевтичним підходом, що включає перехід до ідеальної комбінації з 3 лікарськими засобами: інгібітор АПФ або блокатор рецепторів до АТ II, антагоніст кальцію та тіазидний чи тіазидоподібний діуретик. Антагоністи альдостону є препаратом вибору як 4-й препарат для лікування РАГ з урахуванням значного зниження АТ, що спостерігалося в клінічних випробуваннях [45].
Висновки
1. Вторинна артеріальна гіпертензія була виявлена в 5 % хворих із резистентною гіпертензією, у структурі найбільшу частку становили ренопаренхімна гіпертензія, аденома наднирників із гіперальдостеронізмом та порушення функції щитоподібної залози з гіпотиреозом.
2. Ступінь зниження офісного АТ серед пацієнтів, які приймали 3 антигіпертензивні препарати та більше, загалом становив для САТ 43,47 ± 0,65 мм рт.ст., для ДАТ — 20,33 ± 0,74 мм рт.ст., р < 0,001 для обох значень. ДАТ між пацієнтами, які приймали 3 препарати та 4 і більше препаратів, достовірно не відрізнявся та становив 19,88 та 20,81 мм рт.ст. відповідно, а офісний САТ достовірно більше знизився в пацієнтів, які приймали 4 та більше препаратів, — на 45,78 мм рт.ст. порівняно з групою, що приймала 3 препарати, — 41,3 мм рт.ст., р < 0,001.
3. Серед пацієнтів із резистентною артеріальною гіпертензією 3 антигіпертензивні препарати приймали 51,4 % пацієнтів, 4 — 37,1 %, 5 — 9,1 %, 6 — 2,4 %.
4. У структурі призначень частіше призначались інгібітори АПФ — у 65,5 % пацієнтів, антагоністи кальцію — у 69,9 %, діуретики — у 91,8 %. Бета-адреноблокатори приймали 75,5 % пацієнтів, блокатори рецепторів до АТ II — 33,5 %, блокатори рецепторів альдостерону — 12,8 %. Фіксовані комбінації при-ймали 71,9 % пацієнтів.
5. У пацієнтів, у яких не було досягнуто цільового САТ (31 %), спостерігались достовірно вищі показники АТ при надходженні в стаціонар. У них був достовірно вищий рівень кортизолу крові (155,0 ± 44,0 нг/л проти 35,9 ± 20,8 нг/л), вищий ІММЛШ (147,50 ± 3,46 г/м2 проти 135,30 ± 1,74 г/м2), частіше спостерігались ожиріння (42,9 проти 37,5 %), аномалії розвитку нирок (2,7 проти 0,8 %), облітеруючий атеросклероз нижніх кінцівок (2,0 проти 0,2 %), структурні зміни наднирників (3,0 проти 1,2 %), нефропатія (1,3 проти 0,2 %), вищий ступінь серцевої недостатності (СН 2А стадії; 16,9 проти 8,5 %).
6. Пацієнти, які приймали ≥ 4 препаратів, мали достовірно вищий рівень глюкози крові натще — 6,20 ± 0,09 ммоль/л порівняно з пацієнтами, які приймали 3 препарати, — 5,90 ± 0,14 ммоль/л (р < 0,05) та вищий рівень реніну плазми крові — 218,30 ± ± 15,73 нг/л проти 31,10 ± 5,91 нг/л (р < 0,05). Ренінальдостеронове співвідношення було майже вдвічі вищим (3,90 ± 0,95 ум.од. проти 2,20 ± 0,65 ум.од.), хоча і достовірно не відрізнялося між групами пацієнтів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Горбась І.М., Смирнова І.П., Вакалюк І.П. та ін. Епідеміологічна ситуація щодо артеріальної гіпертензії у сільській популяції України // Ліки України. — 2013. — № 7. — С. 88-91.
2. Кваша Е.А., Горбась И.М., Смирнова И.П., Срибная И.В. Артериальная гипертензия: 35-летняя динамика распространенности и эффективности ее контроля на популяционном уровне среди мужчин, проживающих в городе // Артериальная гипертензия. — 2016. — № 3. — С. 18-23.
3. Hwang A.Y., Dietrich E., Pepine C.J., Smith S.M. Resistant Hypertension: Mechanisms and Treatment // Curr. Hypertens Rep. — 2017. — 19. — 56. doi: 10.1007/s11906-017-0754-x.
4. Bangalore S., Fayyad R., Laskey R. et al. Prevalence, predictors, and outcomes in treatment-resistant hypertension in patients with coronary disease // Am. J. Med. — 2014. — 127(1). — Р. 71-81. — e71.
5. Benjamin E.J., Blaha M.J., Chiuve S.E. et al. Heart di-sease and stroke statistics — 2017 update: a report from the American Heart Association // Circulation. — 2017.
6. Brandani L. Resistant hypertension: a therapeutic challenge // J. Clin. Hypertens. — 2018. — 20. — С. 76-78.
7. Calhoun D.A., Jones D., Textor S. et al. Resistant hypertension: diagnosis, evaluation, and treatment: a scientific statement from the American Heart Association Professional Education Committee of the Council for High Blood Pressure Research // Circulation. — 2008. — 117(25). — Р. 510-526.
8. Carris N.W., Ghushchyan V., Libby A.M., Smith S.M. Health-related quality of life in persons with apparent treatment-resistant hypertension on at least four antihypertensives // J. Hum. Hypertens. — 2016. — 30(3). — Р. 191-196.
9. Chobanian A.V., Bakris G.L., Black H.R. et al. The se–venth report of the Joint National Committee on prevention, detection, evaluation, and treatment of high blood pressure: the JNC 7 report // JAMA. — 2003. — 289(19). — Р. 2560-2572.
10. Daugherty S.L., Powers J.D., Magid D.J. et al. Incidence and prognosis of resistant hypertension in hypertensive patients // Circulation. — 2012. — 125(13). — Р. 1635-1642.
11. Dudenbostel T., Acelajado M.C., Pisoni R., Li P., Oparil S., Calhoun D.A. Refractory hypertension: evidence of heightened sympathetic activity as a cause of antihypertensive treatment failure // Hypertension. — 2015. — 66(1). — Р. 126-133. This study identified several markers of elevated SNS activity associated with the refractory hypertension phenotype.
12. Dudenbostel T., Siddiqui M., Oparil S., Calhoun D.A. Refractory hypertension: a novel phenotype of antihypertensive treatment failure // Hypertension. — 2016. — 67(6). — Р. 1085-1092.
13. Duprez D.A. Aldosterone and the vasculature: mechanisms mediating resistant hypertension // J. Clin. Hypertens (Greenwich). — 2007. — 9(1 Suppl. 1). — Р. 13-18.
14. Ernst M.E., Moser M. Use of diuretics in patients with hypertension // N. Engl. J. Med. — 2009. — 361(22). — Р. 2153-2164.
15. European Society of Hypertension-European Society of Cardiology Guideline Committee. 2003 European Society of Hypertension — European Society of Cardiology Guidelines for the management of arterial hypertension // J. Hypertens. — 2003. — 21(6). — Р. 1011-1053.
16. Feng W., Dell’Italia L.J., Sanders P.W. Novel paradigms of salt and hypertension // J. Am. Soc. Nephrol. — 2017. — 28(5). — Р. 1362-1369.
17. Gaddam K.K., Nishizaka M.K., Pratt-Ubunama M.N. et al. Characterization of resistant hypertension: association between resistant hypertension, aldosterone, and persistent intravascular volume expansion // Arch. Intern. Med. — 2008. — 168(11). — Р. 1159-1164.
18. Garg J.P., Elliott W.J., Folker A., Izhar M., Black H.R. Resistant hypertension revisited: a comparison of two university-based cohorts // Am. J. Hypertens. — 2005. — 18(5 Pt 1). — Р. 619-626.
19. Gerritsen J., Dekker J.M., TenVoorde B.J. et al. Impaired autonomic function is associated with increased mortality, especially in subjects with diabetes, hypertension, or a history of cardiovascular disease: the Hoorn study // Diabetes Care. — 2001. — 24(10). — Р. 1793-1798.
20. Gifford R.W. Jr, Tarazi R.C. Resistant hypertension: diagnosis and management // Ann. Intern. Med. — 1978. — 88(5). — Р. 661-665.
21. Hall J.E., do Carmo J.M., da Silva A.A., Wang Z., Hall M.E. Obesity-induced hypertension: interaction of neurohumoral and renal mechanisms // Circ. Res. — 2015. — 116(6). — Р. 991-1006.
22. Hermida R.C., Ayala D.E., Smolensky M.H., Fernandez J.R., Mojon A., Portaluppi F. Chronotherapy with conventional blood pressure medications improves management of hypertension and reduces cardiovascular and stroke risks // Hypertens Res. — 2016. — 39(5). — Р. 277-292.
23. Holmqvist L., Boström K.B., Kahan T., Schiöler L., Qvarnström M., Wettermark B., Hjerpe P., Hasselström J., Manhem K. Drug adherence in treatment resistant and in controlled hypertension-Results from the Swedish Primary Care Cardiovascular Database (SPCCD) // Pharmacoepidemiol. Drug. Saf. — 2018, Jan 19. doi: 10.1002/pds.4388.
24. Humphrey J.D., Harrison D.G., Figueroa C.A., Lacolley P., Laurent S. Central artery stiffness in hypertension and aging: a problem with cause and consequence // Circ. Res. — 2016. — 118(3). — Р. 379-381.
25. Hwang A.Y., Dave C., Smith S.M. Trends in antihypertensive medication use among US patients with resistant hypertension, 2008 to 2014 // Hypertension. — 2016. — 68(6). — Р. 1349-1354.
26. Irvin M.R., Booth J.N. 3rd, Shimbo D. et al. Apparent treatment- resistant hypertension and risk for stroke, coronary heart disease, and all-cause mortality // J. Am. Soc. Hypertens. — 2014. — 8(6). — Р. 405-413.
27. James P.A., Oparil S., Carter B.L. et al. 2014 evidence-based guideline for the management of high blood pressure in adults: report from the panel members appointed to the Eighth Joint National Committee (JNC 8) // JAMA. — 2014. — 311(5). — Р. 507-520.
28. Kumbhani D.J., Steg P.G., Cannon C.P. et al. Resistant hypertension: a frequent and ominous finding among hypertensive patients with atherothrombosis // Eur. Heart J. — 2013. — 34(16). — Р. 1204-1214.
29. Le Jemtel T.H., Richardson W., Samson R., Jaiswal A., Oparil S. Pathophysiology and potential non-pharmacologic treatments of obesity or kidney disease associated refractory hypertension // Curr. Hypertens Rep. — 2017. — 19(2). — Р. 18.
30. Mills K.T., Bundy J.D., Kelly T.N. et al. Global disparities of hypertension prevalence and control: a systematic analysis of population-based studies from 90 countries // Circulation. — 2016. — 134(6). — Р. 441-450.
31. Oparil S., Schmieder R.E. New approaches in the treatment of hypertension // Circ. Res. — 2015. — 116(6). — Р. 1074-1095.
32. Pimenta E., Gaddam K.K., Oparil S. et al. Effects of dietary sodium reduction on blood pressure in subjects with resistant hypertension: results from a randomized trial // Hypertension. — 2009. — 54(3). — Р. 475-481.
33. Rimoldi S.F., Messerli F.H., Bangalore S., Scherrer U. Resistant hypertension: what the cardiologist needs to know // Eur. Heart J. — 2015. — 36(40). — Р. 2686-2695.
34. Rimoldi S.F., Scherrer U., Messerli F.H. Secondary arterial hypertension: when, who, and how to screen? // Eur. Heart J. — 2014. — 35(19). — Р. 1245-1254.
35. Roush G.C., Holford T.R., Guddati A.K. Chlorthalidone compared with hydrochlorothiazide in reducing cardiovascular events: systematic review and network meta-analyses // Hypertension. — 2012. — 59(6). — Р. 1110-1117.
36. Salles G.F., Ribeiro F.M., Guimaraes G.M., Mux-feldt E.S., Cardoso C.R. A reduced heart rate variability is independently associated with a blunted nocturnal blood pressure fall in patients with resistant hypertension // J. Hypertens. — 2014. — 32(3). — Р. 644-651. This cross-sectional study found potential association of SNS activity with a blunted nocturnal BP fall in resistant hypertension.
37. Sarafidis P.A., Georgianos P., Bakris G.L. Resistant hypertension — its identification and epidemiology // Nat. Rev. Nephrol. — 2013. — 9(1). — Р. 51-58.
38. Sever P.S., Messerli F.H. Hypertension management 2011: optimal combination therapy // Eur. Heart J. — 2011. — 32(20). — Р. 2499-2506.
39. Sharman J.E., Boutouyrie P., Laurent S. Arterial (aortic) stiffness in patients with resistant hypertension: from assessment to treatment // Curr. Hypertens Rep. — 2017. — 19(1). — Р. 2.
40. Siddiqui M., Dudenbostel T., Calhoun D.A. Resistant and refractory hypertension: antihypertensive treatment resistance vs treatment failure // Can. J. Cardiol. — 2016. — 32(5). — Р. 603-606.
41. Smith S.M., Gong Y., Handberg E. et al. Predictors and outcomes of resistant hypertension among patients with coronary artery disease and hypertension // J. Hypertens. — 2014. — 32(3). — Р. 635-643.
42. Taler S.J., Textor S.C., Augustine J.E. Resistant hypertension: comparing hemodynamic management to specialist care // Hypertension. — 2002. — 39(5). — Р. 982-988.
43. Vlase H.L., Panagopoulos G., Michelis M.F. Effectiveness of furosemide in uncontrolled hypertension in the elderly: role of renin profiling // Am. J. Hypertens. — 2003. — 16(3). — Р. 187-193.
44. Weber M.A., Schiffrin E.L., White W.B. et al. Clinical practice guidelines for the management of hypertension in the community: a statement by the American Society of Hypertension and the International Society of Hypertension // J. Clin. Hypertens (Greenwich). — 2014. — 16(1). — Р. 14-26.
45. Williams B., MacDonald T.M., Morant S. et al. Spironolactone versus placebo, bisoprolol, and doxazosin to determine the optimal treatment for drug-resistant hypertension (PATHWAY-2): a randomised, double-blind, crossover trial // Lancet. — 2015. — 386(10008). — Р. 2059-2068.
46. Xiong S., Li Q., Liu D., Zhu Z. Gastrointestinal tract: a promising target for the management of hypertension // Curr. Hypertens Rep. — 2017. — 19(4). — Р. 31.
47. Zygmuntowicz M., Owczarek A., Elibol A., Olszanecka-Glinianowicz M., Chudek J. Blood pressure for optimal health- related quality of life in hypertensive patients // J. Hypertens. — 2013. — 31(4). — Р. 830-839.
48. Yook Chin Chia, Siew Mooi Ching. Prevalence and predictors of resistant hypertension in a primary care setting: a cross-sectional study // Chia and Ching BMC Family Practice. — 2014. — 15. — Р. 131. — http://www.biomedcentral.com/1471-2296/15/131
/58-1.jpg)
/59-1.jpg)
/60-1.jpg)

/51-1.jpg)
/52-1.jpg)
/53-1.jpg)
/54-1.jpg)
/55-1.jpg)
/56-1.jpg)
/57-1.jpg)
/61-1.jpg)
/62-1.jpg)