Резюме
Актуальність. Артеріальна гіпертензія (АГ) — провідний фактор ризику кардіальної та цереброваскулярної патології. Одним із патологічних станів, що часто співіснує з АГ та сприяє підвищенню серцево-судинного ризику таких хворих, є синдром обструктивного апное сну (СОАС). Мета роботи — оцінити фактори кардіометаболічного ризику хворих із АГ та СОАС. Матеріали і методи. Обстежено 185 пацієнтів з АГ (49,79 ± 0,80 року), серед яких 148 хворих з АГ та СОАС і 37 пацієнтів з АГ без порушень дихання під час сну (група контролю). Хворим проводились наступні обстеження: вимірювання зросту та маси тіла з розрахунком індексу маси тіла, вимірювання офісного артеріального тиску (АТ), добове моніторування АТ, оцінка денної сонливості за опитувальною шкалою Епворта, сомнологічне обстеження, ехокардіографія, біохімічне дослідження, вимірювання центрального АТ та швидкості поширення пульсової хвилі. Результати. Пацієнти обох груп були співставними за віком, але хворі групи АГ та СОАС (середній індекс апное-гіпопное (ІАГ) — 38,08 ± 2,51 події/годину) мали достовірно більший індекс маси тіла — 35,23 ± ± 0,57 кг/м2 проти 30,57 ± 0,79 кг/м2 в групі контролю (р < 0,001), більшу частоту цукрового діабету ІІ типу — 16,9 % проти 2,0 % (р < 0,02), вищі рівні глюкози крові — 5,95 ± 0,12 ммоль/л проти 5,44 ± 0,14 ммоль/л (р = 0,045), сечової кислоти (СК) — 367,16 ± 8,45 мкмоль/л проти 329,79 ± ± 17,7 мкмоль/л (р = 0,048), більший індекс маси міокарда лівого шлуночка — 115,79 ± 2,39 г/м2 проти 104,64 ± 4,56 г/м2 (р = 0,035), вищий центральний систолічний АТ — 133,43 ± 1,67 мм рт.ст. проти 125,22 ± 3,41 мм рт.ст. (р = 0,027) та більшу швидкість поширення пульсової хвилі по артеріях еластичного типу — 11,19 ± 0,20 м/с проти 10,10 ± 0,41 м/с (р = 0,014), ніж хворі групи контролю (ІАГ — 3,02 ± 0,25 події/годину). У хворих з АГ та СОАС рівень СК асоціювався з підвищенням систолічного АТ, причому у зв’язку з чоловічою статтю (r = 0,218; p = 0,013), вищим рівнем креатиніну плазми крові (r = 0,237, p = 0,007) і тригліцеридів (r = 0,237; p = 0,007), а також артеріальною жорсткістю, вираженою Aix75 (r = –0,270; p = 0,003). Висновки. Хворі з АГ та СОАС характеризувались достовірно більшою кількістю кардіометаболічних факторів ризику, через які реалізуються несприятливі впливи СОАС у хворих з АГ.
Актуальность. Артериальная гипертензия (АГ) — ведущий фактор риска сердечно-сосудистой и церебровас-кулярной патологии. Состоянием, часто сочетающимся с АГ и способствующим повышению риска у таких пациентов, является синдром обструктивного апноэ сна (СОАС). Цель работы — оценить факторы кардиометаболического риска больных с АГ и СОАС. Материалы и методы. Обследовано 185 пациентов с АГ (49,79 ± 0,80 года), среди которых 148 больных с АГ и СОАС и 37 пациентов с АГ без нарушений дыхания во время сна (группа контроля). Больным проводились следующие обследования: измерение роста и массы тела с расчетом индекса массы тела, измерение офисного артериального давления (АД), суточное мониторирование АД, оценка дневной сонливости по опросной шкале Эпворта, сомнологическое обследование, эхокардиография, биохимическое исследование, измерение центрального АД и скорости распространения пульсовой волны. Результаты. Пациенты обеих групп были сопоставимы по возрасту, однако больные группы АГ и СОАС (средний индекс апноэ-гипопноэ (ИАГ) — 38,08 ± 2,51 события/час) имели достоверно больший индекс массы тела — 35,23 ± 0,57 кг/м2 против 30,57 ± 0,79 кг/м2 в группе контроля (р < 0,001), большую частоту сахарного диабета типа ІІ — 16,9 % против 2,0 % (р < 0,02), более высокие уровни глюкозы крови — 5,95 ± 0,12 ммоль/л против 5,44 ± ± 0,14 ммоль/л (р = 0,045), мочевой кислоты (МК) — 367,16 ± 8,45 мкмоль/л против 329,79 ± 17,7 мкмоль/л (р = 0,048), больший индекс массы миокарда левого желудочка — 115,79 ± 2,39 г/м2 против 104,64 ± 4,56 г/м2
(р = 0,035), более высокое центральное систолическое АД — 133,43 ± 1,67 мм рт.ст. против 125,22 ± 3,41 мм рт.ст. (р = 0,027) и большую скорость распространения пульсовой волны по артериям эластичного типа — 11,19 ± 0,20 м/с против 10,10 ± 0,41 м/с (р = 0,014), чем больные группы контроля (ИАГ — 3,02 ± 0,25 события/час). У больных с АГ и СОАС уровень МК ассоциировался с повышением систолического АД, причем в связи с мужским полом (r = 0,218; p = 0,013), более высоким уровнем креатинина плазмы крови (r = 0,237; p = 0,007) и триглицеридов (r = 0,237; p = 0,007), а также артериальной жесткостью, выраженной Aix75 (r = –0,270; p = 0,003). Выводы. Больные с АГ и СОАС характеризовались достоверно большим количеством кардиометаболических факторов риска, посредством которых реализуются неблагоприятные воздействия СОАС у больных с АГ.
Background. Arterial hypertension (AH) is one of the common causes of cardiovascular and cerebrovascular diseases. Obstructive sleep apnea (OSA) often coexists with AH and increases cardiovascular risk of these patients. The purpose of the study was to assess the cardiovascular risk factors in patients with AH and OSA. Materials and methods. 185 hypertensive patients (average age 49.79 ± 0.80 years) were enrolled in the study and consequently divided into groups: those with OSA (n = 148) and without it (controls, n = 37). They underwent clinical and special examination: somnography by dual-channel portable monitor device, estimation of daily sleepiness by Epworth Sleepiness Scale, office and ambulatory blood pressure measurements, biochemical examination, echocardiography, applanation tonometry with evaluation of central blood pressure and pulse wave velocity. Results. Patients with AH and OSA (mean apnea-hypopnea index 38.08 ± 2.51/h) had significantly higher body mass index — 35.23 ± 0.57 kg/m2 vs 30.57 ± 0.79 kg/m2 (р < 0.001), glucose level — 5.95 ± 0.12 mmol/l vs 5.44 ± ± 0.14 mmol/l (р = 0.045), diabetes mellitus II type rate — 16.9 vs 2.0 % (р < 0.02), uric acid level — 367.16 ± 8.45 µmol/l vs 329.79 ± 17.70 µmol/l (р = 0.048), left ventricular myocardial mass index — 115.79 ± 2.39 g/m2 vs 104.64 ± 4.56 g/m2 (р = 0.035), higher carotid-femoral pulse wave velocity — 11.19 ± ± 0.20 m/s vs 10.10 ± 0.41 m/s (р = 0.014) and central systolic blood pressure — 133.43 ± 1.67 mm Hg vs 125.22 ± 3.40 mm Hg (р = 0.027) vs controls (apnea-hypopnea index 3.02 ± 0.25/h). In OSA patients, uric acid level was associated with increased systolic blood pressure in relation to male sex (r = 0.218, p = 0.013), higher blood levels of creatinine (r = 0.237, p = 0.007) and triglycerides (r = 0.237, p = 0.007), as well as arterial stiffness expressed in terms of Aix75 (r = –0.270. p = 0.003). Conclusions. Patients with AH and OSA had a significantly higher number of cardiometabolic risk factors, by which adverse effects of OSA are realized in patients with AH.
Вступ
Артеріальна гіпертензія (АГ) — провідний фактор ризику кардіальної та цереброваскулярної патології. Одним із патологічних станів, що часто співіснує з АГ та сприяє підвищенню серцево-судинного ризику таких хворих, є синдром обструктивного апное сну (СОАС).
СОАС — це стан, при якому у пацієнта під час сну виникають численні зупинки дихання внаслідок повного перекриття (апное) або часткового звуження (гіпопное) дихальних шляхів на рівні глотки, припинення легеневої вентиляції при збережених дихальних зусиллях. Клінічно СОАС проявляється наявністю хропіння, зниженням рівня кисню в крові, грубою фрагментацією сну з частими пробудженнями, надмірною денною сонливістю та підвищенням артеріального тиску (АТ), особливо в нічний час [1].
СОАС є дуже поширеним станом в популяції. За даними останніх досліджень, СОАС середнього та тяжкого ступенів уражає: чоловіків віком 30–49 років (10 %) і 50–70 років (17 %), жінок віком 30–49 років (3 %) та 50–70 років (9 %) [32], і частота його поширеності останніми роками прогресивно зростає відповідно до старіння населення та поширення епідемії ожиріння, яке є найважливішим фактором ризику СОАС.
СОАС, особливо тяжкого ступеня, асоціюється з фатальними та нефатальними серцево-судинними подіями [13], у тому числі серцево-судинною смертю [7], раптовою серцевою смертю [14], інсультом [18], розвитком та прогресуванням застійної серцевої недостатності (СН) [37], дорожніми пригодами внаслідок денної сонливості і засинання за кермом, передчасною смертністю від усіх причин [10, 31], а надмірна денна сонливість, хропіння, порушення уваги та когнітивних функцій значно погіршують якість життя таких хворих [41].
Одним із факторів серцево-судинного ризику, зокрема у пацієнтів високого ризику [21], до яких належать і хворі з АГ та СОАС, є гіперурикемія. Але даних щодо зв’язку АГ, СОАС та метаболічних факторів ризику недостатньо.
Мета дослідження — оцінити фактори кардіометаболічного ризику, через які реалізуються несприятливі впливи СОАС у хворих з АГ.
Матеріали і методи
У дослідження було включено 185 пацієнтів з АГ, середній вік — 49,79 ± 0,80 року, жінок — 36 (19,5 %), чоловіків — 149 (80,5 %). Хворих було розподілено на дві групи: 148 хворих із СОАС та 37 хворих з АГ без порушень дихання під час сну, які увійшли до групи контролю.
Критерії включення у дослідження: вік пацієнтів 20–80 років, наявність есенціальної АГ І–ІІІ стадії, згода пацієнта на участь у дослідженні та відсутність критеріїв невключення. Діагноз АГ встановлювався при виявленні офісного систолічного артеріального тиску (САТ) > 140 мм рт.ст. і/або діастолічного артеріального тиску (ДАТ) > 90 мм рт.ст., або хворий приймав антигіпертензивну терапію.
Критерії невключення у дослідження: вік молодше 20 та старше 80 років; діагностована симптоматична АГ; синдром нічного апное центрального характеру; груба патологія верхніх дихальних шляхів; хронічна СН ≥ ІІА стадії; гостре порушення мозкового кровообігу або інфаркт міокарда, перенесені < 3 місяців тому; цукровий діабет (ЦД) у стані декомпенсації; постійна або персистуюча форма фібриляції передсердь (під час пароксизму); ураження нирок зі швидкістю клубочкової фільтрації (ШКФ) < 30 мл/хв; психічні розлади, залежності.
Протокол дослідження було затверджено комітетом з етики ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України».
Обстеження пацієнтів та діагностика АГ здійснювались відповідно до Настанови та Уніфікованого клінічного протоколу надання медичної допомоги «Артеріальна гіпертензія», затверджених Наказом МОЗ № 384 від 24.05.2012 [1].
Хворим проводились загальноклінічні обстеження, вимірювання маси тіла та зросту з розрахунком індексу маси тіла (ІМТ). Вимірювання офісних САТ і ДАТ виконували тричі з інтервалом 1–2 хв в положенні пацієнта сидячи, після 10 хвилин перебування у спокої. До протоколу вносили середнє значення.
Добове моніторування АТ виконували за допомогою приладу АВРМ-04 (Meditech, Угорщина). Визначали середньодобові (24гСАТ, 24гДАТ), середньоденні (24гСАТдень, 24гДАТдень) та середньонічні (24гСАТніч, 24гДАТніч) рівні САТ і ДАТ. Вимірювання АТ виконувалось з частотою кожні 15 хвилин у денний час та кожні 30 хвилин — у нічний час [29].
Діагностика СОАС здійснювалась за допомогою портативного монітора Somnocheck micro (Weinmаnn, Німеччина). Частота респіраторних подій позначалась як індекс апное-гіпопное (ІАГ) або індекс респіраторних розладів. Апное визначали як припинення повітряного потоку мінімум на 10 секунд, гіпопное — як зниження амплітуди дихального сигналу щонайменше на 50 % мінімум на 10 секунд, що супроводжувалось зниженням сатурації кисню (SpO2) мінімум на 4 % або ознаками фізіологічного пробудження. Діагноз СОАС встановлювали при кількості обструктивних подій (апное, гіпопное + пробудження, зумовлені респіраторними подіями) більше ніж 15 подій/годину або більше ніж 5 подій/годину у пацієнтів зі скаргами на нічні пробудження; денну сонливість, сон, який не освіжає, втому, безсоння, порушення дихання, які призводили до пробудження, задуху, гучне хропіння, переривання дихання під час сну, що описувались пацієнтом або родичами. Тяжкість СОАС визначалась як легка при ІАГ ≥ 5 та < 15 подій/годину, середня — при ІАГ ≥ 15 та < 30 подій/годину і тяжка — при ІАГ ≥ 30 подій/годину [9, 12]. У сумнівних випадках діагноз верифікували полісомнографією.
Оцінювання денної сонливості здійснювали методом опитування за шкалою сонливості Епворта (Epworth Sleepiness Scale — ESS), що включала 8 запитань, за якими пацієнти визначали вірогідність заснути в різних побутових ситуаціях. Вірогідність наявності СОАС визначали як відсутність СОАС — 8,0 ± 3,5 бала, СОАС легкого ступеня — 11,0 ± 4,2 бала, СОАС середнього ступеня тяжкості — 13,0 ± 4,7 бала, СОАС тяжкого ступеня — 16,2 ± 3,3 бала [1].
Дослідження пружно-еластичних властивостей артерій та центрального АТ (ЦАТ) здійснювалось методом апланаційної тонометрії за допомогою приладу SphygmoCor (AtCor, Medical Pty Ltd., Австралія), з’єднаного з персональним комп’ютером. Програмне забезпечення апарата за допомогою трансферної функції здійснювало контурний аналіз пульсової хвилі із визначенням центрального САТ (ЦСАТ), ДАТ (ЦДАТ), центрального пульсового АТ (ЦПАТ), індексу аугментації (Aix) та стандартизованого за частотою серцевих скорочень (ЧСС) 75 ударів/хв індексу аугментації (Aix75), суб-
ендокардіального індексу життєздатності (SEVR) та тривалості викиду (ED). Усі показники та їх референтні значення для кожного пацієнта прилад визначав автоматично на основі рівня АТ, виміряного на плечовій артерії, та форми пульсової хвилі у висхідній аорті.
Визначення швидкості поширення пульсової хвилі (ШППХ) по артеріях еластичного (ШППХел) та м’язового (ШППХм) типів здійснювалось за стандартним протоколом методом швидкісного аналізу пульсової хвилі шляхом розташування датчика на правій спільній сонній і правій стегновій артеріях та на правій спільній сонній і правій променевій артеріях. Відстань між артеріями вимірювали за допомогою сантиметрової стрічки [44].
Біохімічне дослідження крові виконували на автоматичному біохімічному аналізаторі А25 (BioSystems, Іспанія).
Ехокардіографію виконували за допомогою ультразвукового діагностичного апарата Imagic Agile (Kontron Medical, Франція) в М- та В-режимі за стандартним протоколом [24]. Визначались: розмір аорти, лівого передсердя (ЛП), кінцево-діастолічний розмір (КДР) та кінцево-систолічний розмір (КСР) лівого шлуночка (ЛШ), кінцево-систолічний (КСО) і кінцево-діастолічний (КДО) об’єми ЛШ та фракція викиду (ФВ) ЛШ.
Індекс маси міокарда лівого шлуночка (ІММЛШ) вираховувався за формулою:
ІММЛШ (г/м2) = ММЛШ / площа поверхні тіла.
Ехокардіографічними критеріями гіпертрофії ЛШ вважали: ІММЛШ для чоловіків > 115 г/м2, для жінок — > 95 г/м2 [27].
Також хворим за показаннями виконувались інші лабораторні й інструментальні дослідження для виключення симптоматичної АГ.
Статистичну обробку результатів здійснювали за допомогою програмного забезпечення IBM Statistics SPSS 21. Достовірною вважали відмінність при коефіцієнті достовірності р < 0,05. Достовірність результатів визначали за допомогою парного двовибіркового тесту з використанням t-критерію Стьюдента для середніх величин. Також виконували парний факторний кореляційний аналіз з розрахунком r — коефіцієнта кореляції за Спірменом та багатофакторний регресійний аналіз.
Результати
Характеристики пацієнтів наведено в табл. 1.
Пацієнти обох груп були співставними за віком, зростом, але хворі із СОАС мали достовірно більшу масу тіла (р < 0,001) та, відповідно, ІМТ (р < 0,001). Обидві групи пацієнтів не відрізнялись за кількістю хворих на ішемічну хворобу серця (ІХС), але у групі СОАС достовірно вищою була частота цукрового діабету ІІ типу (р < 0,02).
Хворі з АГ та СОАС мали достовірно вищий ІАГ, що відповідає СОАС тяжкого ступеня, достовірно нижчі рівні сатурації крові під час сну, достовірно вищий індекс десатурацій, максимальну тривалість пауз у диханні та відсоток часу хропіння під час сну (р < 0,001 для всіх). Як і очікувалось, хворі групи СОАС мали достовірно вищий рівень денної сонливості, оцінений суб’єктивно за допомогою ESS (р = 0,003), хоча слід зауважити, що у групі СОАС рівень денної сонливості загалом невисокий. Достовірно відрізнялись відповіді на питання № 3 (можливість заснути при знаходженні у громадському місці без активності) (р = 0,039) та № 8 (можливість заснути у машині під час зупинки у пробці протягом декількох хвилин) (р = 0,022).
При проведенні регресійного аналізу у хворих групи контролю незалежного зв’язку ІАГ з жодним із показників виявлено не було. У хворих групи СОАС спостерігався незалежний зв’язок ІАГ лише з індексом десатурацій, що є цілком закономірним (β = 0,978; р < 0,001).
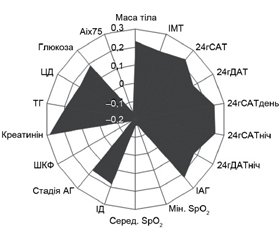
Денна сонливість у хворих з АГ та СОАС асоціювалась зі структурною перебудовою і гіршою перфузією міокарда та більшою жорсткістю артерій: з оцінкою за шкалою сонливості Епворта незалежно корелювали тривалість хропіння (β = –0,008; р = 0,021), товщина міжшлуночкової перетинки (МШП) (β = 0,023; р = 0,026), маса міокарда лівого шлуночка (ММЛШ) (β = –0,037; р = 0,039) та показники контурного аналізу пульсової хвилі ED (β = –0,020; р < 0,001) і SEVR (β = –0,224; р = 0,012) (рис. 1).
У хворих групи АГ та СОАС тяжкість нічної гіпоксемії асоціювалась зі збільшенням аугментації аортальної пульсової хвилі та підвищенням центрального АТ: з індексом десатурацій незалежно корелювали Aix (β = 4,167; р = 0,009), Aix75 (β = –3,929; р = 0,006) та центральний ДАТ (β = 0,151; р = 0,004), тоді як у хворих групи контролю такої кореляції не спостерігалось.
Нами було проведено аналіз частоти виявлення СОАС у хворих з АГ різних стадій, результати наведено у табл. 2.
Таким чином, з підвищенням стадії АГ збільшувалась частота виявлення СОАС, досягаючи більше 90 % у хворих з АГ ІІІ стадії, хоча ІАГ був достовірно більшим у хворих з АГ ІІ стадії порівняно із хворими з АГ І стадії (р = 0,006). Достовірно вищим у хворих з АГ ІІ стадії виявився також індекс десатурацій (р = 0,022) порівняно з АГ І стадії та рівень денної сонливості (р = 0,049) порівняно з АГ І стадії. Час хропіння та максимальна тривалість пауз у диханні під час сну достовірно не відрізнялись.
Дані лабораторних та інструментальних методів обстеження хворих груп порівняння наведені у табл. 3.
Хворі обох груп мали співставні показники офісних САТ і ДАТ, але хворі із СОАС мали достовірно вищі середньодобові (для 24гСАТ — на 9,40 ± 3,32 мм рт.ст., р = 0,005, та для 24гДАТ — на 5,19 ± 1,95 мм рт.ст., р = 0,024), а також середньоденні (для 24гСАТдень — на 8,48 ± 3,27 мм рт.ст., р = 0,010, та для 24гДАТдень — на 5,10 ± 2,23 мм рт.ст., р = 0,015) та середньонічні (для 24гСАТніч — на 11,60 ± 3,48 мм рт.ст., р = 0,001, та для 24гДАТніч — на 6,08 ± 2,48 мм рт.ст., р = 0,015) САТ і ДАТ.
У хворих групи СОАС достовірно вищими були рівні глюкози крові натще (на 0,51 ± 0,25 ммоль/л; р = 0,045) та сечової кислоти (СК) (на 37,36 ± 18,76 мкмоль/л; р = 0,048).
Серед пацієнтів групи контролю гіперурикемію (рівень СК > 360 мкмоль/л) було виявлено у 13 (35,1 %) хворих, серед хворих з АГ та СОАС — у 66 (44,6 %). Різниця у частоті реєстрації
гіперурикемії між групами недостовірна (р > 0,2), але загалом частота її виявлення дуже висока як у хворих із СОАС, так і у групі АГ без порушень дихання під час сну.
У всій вибірці хворих рівень СК асоціювався з більшою масою тіла, вищим рівнем тригліцеридів (ТГ) плазми крові, вищими рівнями САТ як у денний, так і в нічний час, та ДАТ у нічний час, більшою кількістю епізодів апное-гіпопное під час сну та гіршою сатурацією крові в нічний час, нижчою ШКФ, вищими рівнями глюкози крові натще, більшою частотою ЦД та артеріальною жорсткістю.
Фактори, з якими корелював рівень СК у хворих груп порівняння, наведені на рис. 2–4.
У пацієнтів групи контролю рівень СК асоціювався з більшою масою тіла (r = 0,369; р = 0,032), вищими середньодобовими (для 24гСАТ — r = 0,469, р = 0,005; для 24гДАТ — r = 0,399, р = 0,020) і середньоденними рівнями АТ (для 24гСАТдень — r = 0,513, р = 0,002; для 24гДАТдень — r = 0,404,
р = 0,018), а також зі структурною перебудовою міокарда, а саме: більшою товщиною МШП (r = 0,343; р = 0,047), вищою стадією АГ (r = 0,388; р = 0,024) та більшим ІАГ (r = 0,354; р = 0,040).
У хворих з АГ та СОАС рівень СК асоціювався з вищими показниками систолічного АТ: 24гСАТ (r = 0,182; p = 0,048), 24гСАТдень (r = 0,194; p = 0,035), 24гСАТніч (r = 0,215; p = 0,022), причому у зв’язку з чоловічою статтю (r = 0,218; p = 0,013), а також з гіршими показниками функції нирок, вираженими рівнем креатиніну плазми крові (r = 0,237; p = 0,007), вищим рівнем ТГ (r = 0,237; p = 0,007) та артеріальною жорсткістю, вираженою Aix75 (r = –0,270; p = 0,003).
Також у хворих групи СОАС достовірно більшою була товщина задньої стінки лівого шлуночка (ЗСЛШ) (на 0,10 ± 0,03 см; р = 0,003), МШП (на 0,11 ± 0,04 см; р = 0,006), ММЛШ (на 35,54 ± ± 13,83 г; р = 0,011) та, відповідно, ІММЛШ (на 11,15 ± 5,24 г/м2; р = 0,035). Слід зауважити, що ознаки гіпертрофії лівого шлуночка було виявлено у пацієнтів обох груп, що є закономірним, оскільки всі пацієнти мали діагностовану АГ.
Рівень глюкози крові у всій вибірці асоціювався зі старшим віком (r = 0,153; р = 0,039), більшою масою тіла (r = 0,262; р < 0,001) та ІМТ (r = 0,295; р < 0,001), що цілком закономірно, вищими рівнями систолічного АТ (для 24гСАТ — r = 0,167, р = 0,030; для 24гСАТдень — r = 0,182; р = 0,018), більшим ІАГ (r = 0,347; р < 0,001), гіршими показниками нічної сатурації крові (для мін. SpO2 — r = –0,252, р = 0,001; для серед. SpO2 — r = –0,293, р < 0,001; для індексу десатурацій (ІД) — r = 0,347, р < 0,001), більшою тривалістю хропіння (r = 0,290; р < 0,001) та пауз в диханні під час сну (r = 0,276; р = 0,001), вищим ступенем денної сонливості (r = 0,222; р = 0,003), вищою стадією АГ (r = 0,203; р = 0,006), наявністю СН (r = 0,176; р = 0,017) та ІХС (r = 0,214; р = 0,004), більшими розмірами порожнин серця та більшим ІММЛШ (r = 0,248; р = 0,001) (рис. 5).
/40-1.jpg)
У групі хворих з АГ та СОАС вищий рівень глюкози асоціювався з більшою масою тіла (r = 0,297; р = 0,001) та ІМТ (r = 0,339; р < 0,001), вищим ІАГ (r = 0,276; р = 0,002), гіршими показниками сатурації крові під час сну (для мін. SpO2 — r = –0,204, р = 0,021; для середньої SpO2 — r = –0,276, р = 0,002; для індексу десатурацій — r = 0,320, р < 0,001), більшою тривалістю хропіння (r = 0,290; р = 0,002) та вищим рівнем денної сон-ливості (r = 0,310; р < 0,001), наявністю ІХС (r = = 0,191; р = 0,031), структурним ремоделюванням лівого шлуночка з більшою товщиною його стінок, більшим розміром порожнин та більшою масою ЛШ (r = 0,219; р = 0,014).
У той же час у групі контролю рівень глюкози асоціювався лише зі структурною перебудовою міокарда ЛШ: з рівнем глюкози корелювали КДР (r = 0,377; р = 0,028), товщина МШП (r = 0,502; р = 0,002), ЗСЛШ (r = 0,444; р = 0,009) та ІММЛШ (r = 0,467; р = 0,005).
Нами було проведено оцінку пружно-еластичних властивостей артерій, результати наведено в табл. 4.
Таким чином, хворі з АГ та СОАС мали достовірно більшу ШППХел (на 1,09 ± 0,44 м/с; р = 0,014), ніж хворі групи контролю, ШППХм достовірно не відрізнялась.
Для визначення факторів, з якими незалежно корелювала ШППХел у хворих груп порівняння, нами було проведено регресійний аналіз, у результаті якого було виявлено незалежний зв’язок ШППХел лише з віком хворих у групі СОАС (β = 0,347; р = 0,003), у хворих групи контролю достовірний зв’язок не спостерігався з жодним із показників.
Було виявлено, що хворі з АГ та СОАС мали достовірно вищий ЦСАТ порівняно з пацієнтами групи контролю (на 8,22 ± 3,68 мм рт.ст.; р = 0,027) при тому, що офісні САТ та ДАТ були порівнюваними у пацієнтів обох груп. Достовірно та незалежно з рівнем ЦСАТ у хворих групи СОАС були пов’язані офісні САТ (β = 0,175; р < 0,001) і ДАТ (β = 0,493; р < 0,001), розмір лівого передсердя (β = 0,014; р = 0,016), ММЛШ (β = –0,036; р = 0,029), ЦДАТ (β = 0,124; р = 0,020), ЦПАТ (β = 0,523; р < 0,001) та тиск аугментації (β = 0,087; р = 0,022). У хворих без СОАС незалежний зв’язок ЦСАТ спостерігався лише з ЦДАТ (β = 0,645; р < 0,001) і ЦПАТ (β = 0,592; р < 0,001).
На підставі виявлення достовірно вищих показників ШППХел та ЦСАТ можна зробити висновки про роль СОАС у підвищенні артеріальної жорсткості у хворих з АГ. Наявність незалежного зв’язку ЦСАТ із ММЛШ та розміром ЛП у хворих з АГ та СОАС може свідчити про значення саме ЦАТ в ураженні серця як органа-мішені у таких пацієнтів.
Обговорення
Таким чином, було виявлено, що хворі з АГ та СОАС характеризувались більшою кількістю серцево-судинних (достовірно вищі середньодобові САТ і ДАТ та центральний САТ, гіпертрофія лівого шлуночка, підвищена артеріальна жорсткість) та метаболічних факторів ризику (достовірно більша маса тіла, достовірно вищі рівні глюкози та сечової кислоти).
Між наявністю гіперурикемії та СОАС існує двосторонній взаємозв’язок. З одного боку, підвищені рівні СК асоціюються з наявністю СОАС, з іншого — СОАС характеризується порушенням обміну пуринів і підвищенням рівнів СК.
У нашому дослідженні було виявлено достовірно вищі рівні сечової кислоти сироватки крові у хворих з АГ та СОАС порівняно з пацієнтами без порушень дихання уві сні (р = 0,048).
Подібні результати було виявлено в популяційному дослідженні Camila Hirotsu та співавт., що проводилось у Сан-Пауло та включало 1042 учасники [19]. Було показано, що хворі із СОАС мали вищі рівні СК (5,7 ± 0,1 мг/дл проти 4,9 ± 0,1 мг/дл; р < 0,0001) порівняно з контролем незалежно від статі, а також після контролю за іншими факторами. Була виявлена достовірна асоціація між гіперурикемією та наявністю СОАС (χ2 = 40,6; р < 0,0001). Було показано, що підвищення рівня сечової кислоти на 1 мг/дл збільшує ризик СОАС на 16 % (95% довірчий інтервал = 1,01–1,33). З іншого боку, мінімальна SpO2 є незалежним предиктором, що пояснює 10% варіабельність рівня СК в комплексі з іншими факторами, такими як чоловіча стать, креатинін, тригліцериди, ІМТ > 26,8 кг/м2, САТ та рівні калію плазми крові. Також Н. Sahebjami [38] було показано підвищення екскреції СК у хворих із СОАС, що нормалізувалась після лікування постійним позитивним тиском у дихальних шляхах (СРАР-терапія).
Одним із механізмів, завдяки яким СОАС сприяє підвищеній серцево-судинній смертності, є оксидативний стрес [47]. Провідну роль в оксидативному стресі відіграє ксантиноксидаза — ензим, внаслідок активації якого утворюється СК. Таким чином, продукція СК супроводжується підвищеним синтезом реактивних кисневих часточок (РКЧ), які відіграють визначальну роль в зумовленому гіпоксією пошкодженні тканин [33]. Множинні цикли де-/реоксигенації при СОАС супроводжуються підвищенням продукції РКЧ, які змінюють напрямок клітинних метаболічних процесів — зменшення утворення аденозинтрифосфату (АТФ), що призводить до деградації АТФ до аденозиндифосфату й аденозинмонофосфату [39], вивільнення проміжних продуктів пуринового обміну (аденозин, інозин, гіпоксантин, ксантин). Завершується цей процес гіперпродукцією СК — кінцевого продукту катаболізму пуринів.
У дослідженні M. Bombelli та ін. було показано, що підвищення рівня сечової кислоти сироватки крові на 1 мг/дл призводило до підвищення ризику виникнення АГ на 34 % за показниками домашніх вимірювань АТ (р = 0,02) та на 29 % (р = 0,01) — при амбулаторних вимірюваннях. Результати метааналізу P.C. Grayson і спіавт. вказують на роль гіперурикемії у розвитку АГ: ризик виникнення АГ підвищувався на 41 % за наявності гіперурикемії, а підвищення рівня сечової кислоти на 1 мг/дл асоціювалось з підвищенням ризику АГ на 13 % [15].
За результатами популяційного дослідження в США було показано, що навіть безсимптомна гіперурикемія є предиктором серцево-судинної та загальної смертності [42]. А підвищення рівня сечової кислоти сироватки крові на 1 мг/дл асоціювалось зі зростанням ризиків серцево-судинної та загальної смертності на 22 % (р = 0,03) і 12 % (р = 0,04) відповідно [4].
Позитивну асоціацію гіперурикемії з ожирінням, порушенням толерантності до вуглеводів, АГ, анамнезом ІХС та смертністю було показано у великому Фінському когортному популяційному дослідженні (вік — 40–69 років) [35]. Більше того, ряд досліджень показали, що підвищений рівень СК асоціювався не лише з наявністю серцево-судинних захворювань, але й з гіршим прогнозом стабільної ІХС [3], гострого інфаркту міокарда [11, 25], хронічної СН [22], інсульту [23] та метаболічного синдрому [6], тобто тих станів, що часто поєднуються із СОАС та АГ.
У нашому дослідженні також було виявлено асоціацію між рівнями СК та показниками АТ, причому як у пацієнтів з АГ та СОАС, так і в загальній вибірці хворих. Таким чином, підвищення рівнів СК у хворих із СОАС можна вважати одним із факторів, що робить негативний внесок у розвиток АГ і підвищення серцево-судинного ризику таких хворих. А вимірювання СК є важливим при веденні пацієнтів із АГ, СОАС та їх ускладеннями.
З іншого боку, СОАС порушує обмін глюкози, сприяє інсулінорезистентності та асоціюється з розвитком ЦД ІІ типу.
Декілька перехресних досліджень показали, що СОАС асоціюється з розвитком інсулінорезистентності незалежно від ожиріння [34, 40], і ризик корелює з тяжкістю нічної гіпоксемії [5].
Ожиріння є ключовим посередником впливу СОАС на ЦД ІІ типу. Показано, що СОАС — фактор ризику та тяжкості ЦД ІІ типу незалежно від віку та ожиріння. Це значимо, оскільки ожиріння є фактором ризику як для СОАС, так і для ЦД ІІ типу.
Тривалі когортні дослідження показали знач-не зростання ризику виникнення цукрового діабету у хворих із СОАС, особливо середнього та тяжкого ступенів [8, 28]. Дані метааналізу підтверджують, що ризик ЦД за наявності СОАС середнього та тяжкого ступенів зростає на 63 % [45]. Також було встановлено, що СОАС, особливо середнього та тяжкого ступенів, асоціюється з гіршим метаболічним контролем у пацієнтів із ЦД ІІ типу [43].
Стосовно впливу СОАС на прогноз у пацієнтів з ЦД було показано, що тяжкість СОАС, виражена індексом апное-гіпопное, достовірно асоціюється з ризиком інсульту (у 2,5 раза) у пацієнтів з ЦД ІІ типу [36]. Також СОАС незалежно сприяє прогресуванню хронічної хвороби нирок у хворих з ЦД [2]. Проведений метааналіз продемонстрував достовірну асоціацію між тяжкістю СОАС та підвищеним ризиком діабетичної хвороби нирок з відношенням ризиків 1,73 [26].
З іншого боку, рандомізовані плацебо-контрольовані дослідження показали, що СРАР-терапія мала сприятливий вплив на обмін глюкози в популяції з ожирінням та без нього у пацієнтів з предіабетом [30, 46] та покращувала індекс інсулінорезистентності порівняно з плацебо у пацієнтів з ЦД ІІ типу [20]. Ефект СРАР-терапії підвищувався зі збільшенням прихильності до лікування і був більш вираженим при СОАС середнього та тяжкого ступенів, ожирінні та у випадках погано конт-рольованого діабету [17, 46].
Важливо зазначити: наявні дані вказують на те, що сприятливий вплив СРАР на обмін глюкози більш виражений в популяції з предіабетом, ніж із встановленим ЦД ІІ типу. Досліджень з цього приводу недостатньо для остаточних висновків, але, можливо, за рахунок того, що хворі з ЦД ІІ типу старші та мають супутні захворювання. Ці спостереження вказують на необхідність ранньої діагностики та лікування СОАС в популяції з ризиком або встановленим ЦД ІІ типу, оптимізації прихильності до лікування [16].
Таким чином, хворі з АГ та СОАС характеризуються значною кількістю кардіометаболічних факторів ризику. Саме тому рання діагностика та лікування СОАС у хворих з АГ є вкрай важливими для зниження серцево-судинного ризику таких хворих.
Висновки
1. Хворі з артеріальною гіпертензією та синдромом обструктивного апное сну мали достовірно вищі рівні глюкози крові натще (5,95 ± ± 0,12 ммоль/л проти 5,44 ± 0,14 ммоль/л; р = = 0,045) та достовірну більшу частоту цукрового діабету (16,9 % проти 5,4 %; р < 0,02) порівняно з пацієнтами без порушень дихання уві сні.
2. Хворі з артеріальною гіпертензією та синдромом обструктивного апное сну мали достовірно вищі рівні сечової кислоти крові (367,16 ± 8,45 мкмоль/л проти 329,79 ± 17,7 мкмоль/л; р = 0,048) порівняно з пацієнтами без порушень дихання уві сні, при цьому частота гіперурикемії є дуже високою в обох групах хворих (44,6 та 35,1 % відповідно).
3. У хворих з артеріальною гіпертензією та синдромом обструктивного апное сну концентрація сечової кислоти асоціювалась з чоловічою статтю (r = 0,218; p = 0,013), рівнем креатиніну (r = 0,237; p = 0,007), тригліцеридів (r = 0,237; p = 0,007) крові та показниками систолічного АТ.
4. Встановлено, що наявність синдрому обструктивного апное сну у хворих з артеріальною гіпертензією сприяла збільшенню жорсткості артерій еластичного типу та підвищенню центрального систолічного артеріального тиску, що підтверджувалось виявленням незалежного кореляційного зв’язку індексу десатурацій з індексом аугментації (β = 4,167; р = 0,009), стандартизованим за частотою серцевих скорочень індексом аугментації (β = 3,929; р = 0,006) та центральним діастолічним артеріальним тиском (β = 0,151; р = 0,004).
5. При веденні хворих з артеріальною гіпертензією та синдромом обструктивного апное сну необхідне дослідження рівнів глюкози та сечової кислоти крові з корекцією їх порушень.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці статті.
Список литературы
1. Наказ МОЗ України № 384 від 24.05.2012 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при артеріальній гіпертензії» [Електронний ресурс] // Режим доступу до ресурсу: https://www.moz.gov.ua/portal/dn_20120524_384.html.
2. Adeseun G.A. The impact of obstructive sleep apnea on chronic kidney disease / Adeseun G.A., Rosas S.E. // Curr. Hypertens. Rep. — 2010. — Vol. 12. — P. 378-383.
3. Bickel C. Serum uric acid as an independent predictor of mortality in patients with angiographically proven coronary artery disease / Bickel C., Rupprecht H.J., Blankenberg S. [et al.] // Am. J. Cardiol. — 2002. — Vol. 89. — P. 12-17.
4. Bombelli M. Prognostic value of serum uric acid: new-onset in and out-of-office hypertension and long-term mortality // J. Hypertens. — 2014. — Vol. 32. — P. 1237-1244.
5. Borel A.L. The severity of nocturnal hypoxia but not abdominal adiposity is associated with insulin resistance in non-obese men with sleep apnea / Borel A.L., Monneret D., Tamisier R. [et al.] // PLoS One. — 2013. — Vol. 8. — Р. e71000.
6. Brodov Y. Effect of the metabolic syndrome and hyperuricemia on outcome in patients with coronary artery disease (from the Bezafibrate Infarction Prevention Study) / Brodov Y., Behar S., Boyko V., Chouraqui P. // Am. J. Cardiol. — 2010. — Vol. 106. — P. 1717-1720.
7. Campos-Rodriguez F. Cardiovascular mortality in women with obstructive sleep apnea with or without continuous positive airway pressure treatment: a cohort study / Francisco Campos-Rodriguez, M.A. Martinez-Garcia, I. de la Cruz-Moron, C. Almeida-Gonzalez [et al.] // Ann. Intern. Med. — 2012. — Vol. 156, № 2. — P. 115-122.
8. Celen Y.T. Impact of gender on incident diabetes mellitus in obstructive sleep apnea: a 16-year follow-up / Celen Y.T., Hedner J., Carlson J., Peker Y. // J. Clin. Sleep Med. — 2010. — Vol. 6. — P. 244-250.
9. Collop N.A. Clinical Guidelines for the Use of Unattended Portable Monitors in the Diagnosis of Obstructive Sleep Apnea in Adult Patients / Nancy A. Collop, W. McDowell Anderson, Brian Boehlecke [et al.] // J. Clin. Sleep Med. — 2007. — Vol. 3, № 7. — P. 737-747.
10. Colvin L.J. Commercial Motor Vehicle Driver Obstructive Sleep Apnea Screening and Treatment in the United States: An Update and Recommendation Overview / Loretta J. Colvin, Nancy A. Collop // J. Clin. Sleep Med. — 2016. — Vol. 12, № 1. — P. 113-125.
11. Duran M. High levels of serum uric acid predict severity of coronary artery disease in patients with acute coronary syndrome / Duran M., Kalay N., Akpek M. [et al.] // Angiology. — 2012. — Vol. 63. — P. 448-452.
12. Epstein L.J. Clinical guideline for the evaluation, ma–nagement and long-term care of obstructive sleep apnea in adults / Lawrence J. Epstein, David Kristo, Patric J. Strollo [et al.] // J. Clin. Sleep Med. — 2009. — Vol. 5, № 3. — P. 263-276.
13. Floras J.S. Sleep apnea and cardiovascular risk / John S. Floras // Journal of Cardiology. — 2014. — Vol. 63. — P. 3-8.
14. Gami A.S. Obstructive sleep apnea and the risk of sudden cardiac death: a longitudinal study of 10,701 adults / Apoor S. Gami, Eric J. Olson, Win K. Shen [et al.] // J. Am. Coll. Cardiol. — 2013. — Vol. 62, № 7. — P. 610-616.
15. Grayson P.C. Hyperuricemia and incident of hypertension: a systematic review and meta-analysis / P.C. Grayson, S.Y. Kim, M. LaValley [et al.] // Arthritis Care Res. — 2011. — Vol. 63. — P. 102-110.
16. Grimaldi D. Association of obstructive sleep apnea in rapid eye movement sleep with reduced glycemic control in type 2 diabetes: therapeutic implications / Grimaldi D., Beccuti G., Touma C., Van Cauter E., Mokhlesi B. // Diabetes Care. — 2014. — Vol. 37. — P. 355-363.
17. Guest J.F. Clinical outcomes and cost-effectiveness of continuous positive airway pressure to manage obstructive sleep apnea in patients with type 2 diabetes in the U.K. / Guest J.F., Panca M., Sladkevicius E., Taheri S., Stradling J. // Diabetes Care. — 2014. — Vol. 37. — P. 1263-1271.
18. Hermann D.M. Role of sleep-disordered breathing and sleep-wake disturbances for stroke and stroke recovery / D.M. Hermann, C.L. Bassetti // Neurology. — 2016. — Vol. 87, № 13. — P. 1407.
19. Hirotsu C. Association Between Uric Acid Levels and Obstructive Sleep Apnea Syndrome in a Large Epidemiological Sample / Camila Hirotsu, Sergio Tufik, Camila Guindalini [et al.] // PLoS ONE. — 8(6). — Р. e66891. — doi: 10.1371/journal.pone.0066891.
20. Iftikhar I.H. Meta-analysis: continuous positive airway pressure improves insulin resistance in patients with sleep apnea without diabetes / Iftikhar I.H., Khan M.F., Das A., Magalang U.J. // Ann. Am. Thorac. Soc. — 2013. — Vol. 10. — P. 115-120.
21. Ioachimescu A.G. Serum uric acid is an independent predictor of all-cause mortality in patients at high risk of cardiovascular disease: a preventive cardiology information system (PreCIS) database cohort study / Ioachimescu A.G., Brennan D.M., Hoar B.M. [et al]. // Arthritis Rheum. — 2008. — Vol. 58. — P. 623-630.
22. Jankowska EA. Hyperuricaemia predicts poor outcome in patients with mild to moderate chronic heart failure / Jankowska E.A., Ponikowska B., Majda J. [et al.] // Int. J. Cardiol. — Vol. 115. — P. 151-155.
23. Karagiannis A. Serum uric acid as an independent predictor of early death after acute stroke / Karagiannis A., Mikhailidis D.P., Tziomalos K. [et al.] // Circ. J. — 2007. — Vol. 71. — P. 1120-1127.
24. Lang R.M. Recommendations for chamber quantification / Roberto M. Lang, Michelle Bierig, Richard B. Devereux [et al.] // Eur. J. Echocardiogr. — 2006. — Vol. 7. — P. 79-108.
25. Lazzeri C. Uric acid in the acute phase of ST elevation myocardial infarction submitted to primary PCI:its prognostic role and relation with inflammatory markers: a single center experience / Lazzeri C., Valente S., Chiostri M. [et al.] // Int. J. Cardiol. — 2010. — Vol. 138. — P. 206-209.
26. Leong W.B. The association between obstructive sleep apnea and diabetic kidney disease: a systematic review and meta-analysis / Leong W.B., Jadhakhan F., Taheri S., Thomas G.N., Adab P. // Sleep. — Electronically published ahead of print on 31 August 2015. — Р. sp-00037-15.
27. Mancia G. 2013 ESH/ESC Guidelines for the management of arterial hypertension. The Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) / Giu-seppe Mancia, Robert Fagard, Krzysztof Narkiewicz [et al.] // J. Hypertens. — 2013. — Vol. 31, № 7. — P. 1281-1357.
28. Marshall N.S. Is sleep apnea an independent risk factor for prevalent and incident diabetes in the Busselton Health Study? / Marshall N.S., Wong K.K., Phillips C.L. [et al.] // J. Clin. Sleep Med. — 2009. — Vol. 5. — P. 15-20.
29. O’Brien E. European Society of Hypertension position paper on ambulatory blood pressure monitoring / E. O’Brien, G. Parati, G. Stergiou [et al.] // J. Hypertens. — 2013. — Vol. 31, № 9. — P. 1731-1767.
30. Pamidi S. Eight hours of nightly continuous positive airway pressure treatment of obstructive sleep apnea improves glucose metabolism in patients with prediabetes: a randomized controlled trial / Pamidi S., Wroblewski K., Stepien M. [et al.] // Am. J. Respir. Crit. Care Med. — 2015. — Vol. 192. — P. 96-105.
31. Pan L. Obstructive sleep apnoea and risks of all-cause mortality: preliminary evidence from prospective cohort studies / Lei Pan, Хiaomei Хie, Dayue Liu [et al.] // Sleep and Brea–thing. — 2016. — Vol. 20, № 81. — P. 345-353.
32. Peppard P.E. Increased prevalence of Sleep-Disordered Breathing in adults / Paul E. Peppard, Terry Young, Jodi H. Barnet [et al.] // Am. J. Epidemiol. — 2013. — Vol. 177. — P. 1006-1014.
33. Puig J.G. Uric acid as a cardiovascular risk factor in arterial hypertension / Puig J.G., Ruilope L.M. // J. Hypertens. — 1999. — Vol. 17. — P. 869-872.
34. Punjabi N.M. Sleep-disordered breathing, glucose intole-rance, and insulin resistance: the Sleep Heart Health Study / Punjabi N.M., Shahar E., Redline S. [et al.] // Am. J. Epidemiol. — 2004. — Vol. 160. — P. 521-530.
35. Reunanen A. Hyperuricemia as a risk factor for cardiovascular mortality / Reunanen A., Takkunen H., Knekt P., Aromaa A. // Acta Med. Scand. — 1982. — Suppl. 668. — P. 49-59.
36. Rice T.B. The relationship between obstructive sleep apnea and self-reported stroke or coronary heart disease in overweight and obese adults with type 2 diabetes mellitus / Rice T.B., Foster G.D., Sanders M.H. [et al.] // Sleep. — 2012. — Vol. 35. — P. 1293-1298.
37. Roca G.Q. Sex-Specific Association of Sleep Apnea Severity With Subclinical Myocardial Injury, Ventricular Hypertrophy, and Heart Failure Risk in a Community-Dwelling Cohort: The Atherosclerosis Risk in Communities-Sleep Heart Health Study / G.Q. Roca, S. Redline, B. Claggett [et al.] // Circulation. — 2015. — Vol. 132, № 14. — P. 1329-1337.
38. Sahebjani H. Changes in urinary uric acid excretion in obstructive sleep apnea before and after therapy with nasal continuous positive airway pressure // Chest. — 1998 — Vol. 113. — P. 1604-1608.
39. Saito H. Tissue hypoxia in sleep apnea syndrome assessed by uric acid and adenosine / Saito H., Nishimura M., Shibuya E. [et al.] // Chest. — 2002. — Vol. 122. — P. 1686-1694.
40. Seicean S. Sleep-disordered breathing and impaired glucose metabolism in normal-weight and overweight/obese individuals: the Sleep Heart Health Study / Seicean S., Kirchner H.L., Gottlieb D.J. [et al.] // Diabetes Care. — 2008. — Vol. 31. — P. 1001-1006.
41. Shayamsunder A.K. Sleepiness, sleeplessness, and pain in end-stage renal disease: distressing symptoms for patients / Archana K. Shayamsunder, Samir S. Patel, Vivek Jain [et al.] // Semin. Dial. — 2005. — Vol. 18. — P. 109-118.
42. Stack A.G. Independent and conjoint associations of gout and hyperuricaemia with total and cardiovascular mortality / A.G. Stack, A. Hanley, L.F. Casserly [et al.] // QJM. — 2013. — Vol. 106. — P. 647-658.
43. Tamura A. Relationship between the severity of obstructive sleep apnea and impaired glucose metabolism in patients with obstructive sleep apnea / Tamura A., Kawano Y., Watanabe T., Kadota J. // Respir. Med. — 2008. — Vol. 102. — P. 1412-1416.
44. Van Bortel L.M. Expert consensus document on the measurement of aortic stiffness in daily practice using carotid-femoral pulse wave velocity / Luc M. Van Bortel, Stephane Laurent, Pierre Boutouyrie [et al.] // J. Hypertens. — 2012. — Vol. 30. — P. 445-448.
45. Wang X. Obstructive sleep apnoea and the risk of type 2 diabetes: a meta-analysis of prospective cohort studies / Wang X., Bi Y., Zhang Q., Pan F. // Respirology. — 2013. — Vol. 18. — P. 140-146.
46. Weinstock T.G. A controlled trial of CPAP therapy on metabolic control in individuals with impaired glucose tolerance and sleep apnea / Weinstock T.G., Wang X., Rueschman M. [et al.] // Sleep. — 2012. — Vol. 35. — P. 617-625B.
47. Wysocka E. Blood antioxidant status, dysglycemia and obstructive sleep apnea / Wysocka E., Cofta S., Pioru-nek T. [et al.] // Adv. Exp. Med. Biol — 2013. — Vol. 756. — P. 121-129.

/37-1.jpg)
/36-1.jpg)
/38-1.jpg)
/39-1.jpg)
/39-2.jpg)
/40-1.jpg)
/40-2.jpg)