Высокая заболеваемость и смертность от сердечно-сосудистых заболеваний (ССЗ) привели к необходимости широкого использования антитромбоцитарных средств в клинической практике. При этом наиболее перспективной представляется комбинированная антиагрегантная терапия с использованием средств, имеющих различные механизмы влияния на тромбоцитарное звено гемостаза, за счет чего можно добиться синергического антитромбоцитарного эффекта [6, 16]. В нашей стране наиболее назначаемой комбинацией является комбинация ацетилсалициловой кислоты (АСК) с клопидогрелем, которую часто называют двойной антитромбоцитарной терапией (ДАТ). Согласно руководству Европейского общества кардиологов и Европейской ассоциации кардиоторакальных хирургов по ДАТ у пациентов с ишемической болезнью сердца (ИБС), к ДАТ также может быть отнесен одновременный прием АСК и прасугреля или АСК и тикагрелора [34]. Следует отметить, что тикагрелор в отличие от прасугреля зарегистрирован на фармацевтическом рынке Украины.
Фармакологические преимущества ДАТ заключаются в ингибировании сразу двух важнейших физиологических путей индукции агрегации тромбоцитов: тромбоксан-А2-зависимого и аденозиндифосфатзависимого [6, 8, 16]. АСК необратимо ингибирует циклооксигеназу, нарушая синтез циклических эндопероксидов, которые являются субстратом для образования тромбоксана А2 — важнейшего эндогенного индуктора агрегации тромбоцитов [6].
Клопидогрель — селективный антагонист пуриновых P2Y12-рецепторов тромбоцитов, специфическим лигандом для которых является АДФ — другой значимый индуктор агрегации. Блокировка пуриновых P2Y12-рецепторов приводит к инактивации стимулирующего воздействия АДФ на тромбоциты, предотвращая тем самым АДФ-зависимый путь инициации агрегации [6, 15, 16]. Описанные выше механизмы антитромбоцитарного действия АСК и клопидогреля представлены на рис. 1.
Преимущества ДАТ перед монотерапией АСК были продемонстрированы в ряде масштабных клинических исследований [11, 13, 30, 33]. При анализе полученных результатов обращал на себя внимание тот факт, что у пациентов с высоким кардиоваскулярным риском ДАТ была достоверно более эффективна, чем монотерапия АСК, в предупреждении тяжелых неблагоприятных сердечно-сосудистых событий (инфаркт миокарда (ИМ), инсульт) и смерти [11, 13, 15, 30, 33].
Результаты проведенных исследований нашли свое отражение в рекомендациях Европейского общества кардиологов и Европейской ассоциации кардиоторакальных хирургов по ДАТ у пациентов с ИБС. В соответствии с современными стандартами ДАТ является приоритетной антиагрегантной терапией у пациентов с острым коронарным синдромом (инфаркт миокарда с подъемом сегмента ST, инфаркт миокарда без подъема сегмента ST, нестабильная стенокардия) и после чрескожных коронарных вмешательств (ЧКВ). При этом длительность такой терапии может составлять от 1 до 36 месяцев (зависит от степени геморрагического риска) [34].
Вместе с тем применение ДАТ нередко бывает ассоциировано с побочными явлениями, в частности с развитием гастропатии, осложненной в ряде случаев желудочно-кишечным кровотечением. Для уменьшения рисков желудочно-кишечных осложнений при использовании ДАТ рекомендован прием ингибиторов протонной помпы (ИПП). Эти же рекомендации распространяются на пациентов, принимающих только клопидогрель и имеющих множественные факторы риска, такие как эрозивные поражения слизистой, наличие H.pylori, язвенная болезнь желудка и/или двенадцатиперстной кишки, желудочно-кишечные кровотечения в анамнезе, возраст более 60 лет, параллельный прием антикоагулянтов, глюкокортикоидов, наличие гастроэзофагеальной рефлюксной болезни и др. [12].
На сегодняшний день ИПП не только используются в качестве терапии прикрытия, но и занимают главенствующее место в структуре антисекреторной терапии, являясь безоговорочным золотым стандартом в лечении кислотозависимых заболеваний (КЗЗ) [3]. С учетом столь широкого применения в клинической практике ИПП и клопидогреля любые потенциальные риски взаимодействия между ними имеют большое значение.
В исследованиях последних лет нередко упоминается, что одновременное использование ИПП и клопидогреля способствует в перспективе повышению риска развития тяжелых неблагоприятных сердечно-сосудистых событий, к которым относят ИМ, инсульт, нестабильную стенокардию, необходимость повторных коронарных вмешательств и коронарную смерть [1, 21, 23, 25]. Ключом к пониманию феномена такого межлекарственного взаимодействия препаратов являются их фармакодинамические характеристики.
Клопидогрель является пролекарством, и его биотрансформация в активный тиольный метаболит проходит в печени под действием системы микросомальных ферментов цитохрома Р450 с участием следующих ее изоформ: CYP1A2, CYP2B6, CYP2C9, CYP2C19, CYP3A4, CYP3A5 [4, 16, 19, 22]. При этом главенствующую роль в метаболизме клопидогреля играет изоформа CYP2C19, которая участвует в трансформации препарата как в его промежуточный (2-оксиклопидогрель), так и в активный (тиольное производное) метаболит [22]. Следует отметить, что эта же изоформа цитохрома Р450 играет ключевую роль и в метаболизме ИПП.
Как и клопидогрель, ИПП являются пролекарствами, однако их биотрансформация в активный метаболит — сульфенамид — происходит не в печени, а неэнзиматическим путем в кислой среде (рН ≤ 1) в канальцах париетальных клеток [3]. Сульфенамид с помощью дисульфидных связей ковалентно связывается с цистеиновыми группами протонной помпы, что приводит к ингибированию Н+/К+-АТФазы и угнетению секреции HCl. Роль изоформы CYP2C19 в метаболизме ИПП в отличие от клопидогреля сводится к биотрансформации ИПП в неактивные метаболиты — инактивации [24]. Соответственно ИПП могут конкурентно ингибировать CYP2C19, снижая тем самым метаболизм других лекарств, в том числе и клопидогреля [24].
Описанные выше пути метаболизма клопидогреля и ИПП с участием системы микросомальных ферментов цитохрома Р450 представлены на рис. 2.
Именно конкурентное ингибирование изоформы CYP2C19 и является в настоящий момент главной гипотезой межлекарственного взаимодействия ИПП и клопидогреля. Этот феномен приводит к уменьшению биотрансформации клопидогреля в его активный метаболит, т.е. к супрессии его антитромбоцитарного эффекта [5, 18, 23, 25]. Существует также предположение, что у пациентов, принимающих ИПП, уменьшается абсорбция клопидогреля за счет более высокого интрагастрального рН, однако этот вопрос остается дискутабельным [27].
На сегодняшний день межлекарственное взаимодействие ИПП и клопидогреля является предметом многих клинических исследований, результаты которых имеют противоречивый характер [27].
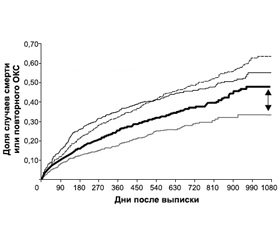
В трех крупных обсервационных исследованиях было установлено небольшое, но статистически значимое увеличение числа неблагоприятных сердечно-сосудистых событий у пациентов, принимавших клопидогрель в сочетании с ИПП, по сравнению с теми, кто принимал только клопидогрель [20, 21, 32]. В частности, были опубликованы результаты крупного ретроспективного когортного исследования, в котором М.Р. Но и соавторы проследили исходы больных, принимавших клопидогрель одновременно с ИПП или без них после госпитализации по поводу острого коронарного синдрома (ОКС) [20]. Из 8205 пациентов, получавших клопидогрель, 5244 (63,9 %) были прописаны ИПП при выписке или во время дальнейшего наблюдения, а 2961 (36,1 %) — нет. Смерть или повторная госпитализация из-за ОКС имели место у 615 (20,8 %) больных, принимавших клопидогрель без ИПП, и у 1561 (29,8 %) пациента, получавшего клопидогрель с ИПП (рис. 3).
/20-1.jpg)
Многофакторный анализ выявил, что использование клопидогреля с ИПП было сопряжено с достоверным повышением риска смерти или повторной госпитализации в связи с ОКС по сравнению с применением клопидогреля без ИПП (ОР 1,25; 95% ДИ 1,11–1,14).
Среди 5244 больных, которые принимали клопидогрель после выписки и которым назначали ИПП в любой момент на протяжении наблюдения, периоды совместного использования клопидогреля с ИПП были связаны с более высоким риском смерти или регоспитализации по поводу ОКС по сравнению с периодами использования клопидогреля без ИПП (ОР 1,27; 95% ДИ 1,10–1,46).
Таким образом, результаты этого исследования показали, что добавление ИПП может сопровождаться явным уменьшением пользы от клопидогреля после ОКС.
Вместе с тем в пяти исследованиях похожего дизайна не продемонстрировано значительное увеличение рисков возникновения неблагоприятных сердечно-сосудистых событий в группах пациентов, принимающих ИПП и клопидогрель [14, 27, 29, 31].
К текущему моменту существует только одно проспективное рандомизированное двойное слепое плацебо-контролируемое исследование, в рамках которого целенаправленно изучали влияние ИПП на возникновение сердечно-сосудистых событий у пациентов, получающих клопидогрель (исследование COGENT). В указанном исследовании пациенты, получающие ДАТ, были рандомизированы на 2 группы, одна из которых получала омепразол, а другая — плацебо. К сожалению, исследование было прекращено досрочно, до достижения запланированных параметров длительности и намеченных конечных точек, в связи с банкротством компании-спонсора. Предварительный анализ полученных данных не выявил значительной тенденции к повышению частоты тяжелых неблагоприятных сердечно-сосудистых событий (отношение рисков (ОР) 0,99; 95% доверительный интервал (ДИ) 0,68–1,44; р = 0,96). В этом же исследовании было показано статистически значимое снижение частоты неблагоприятных желудочно-кишечных событий (ОР 0,34; 95% ДИ 0,18–0,63; р < 0,001) [7, 10].
Еще одно недавнее ретроспективное когортное исследование также не продемонстрировало существенного риска возникновения серьезных сердечно-сосудистых событий, связанных с приемом ИПП и клопидогреля. В этом исследовании было показано, что частота госпитализаций по поводу кровотечения из верхних отделов желудочно-кишечного тракта была на 50 % ниже у пациентов, которые принимали ИПП (ОР 0,50; 95% ДИ 0,39–0,65) [29].
Противоречивые результаты вышеуказанных исследований показывают, что, возможно, более высокий риск развития неблагоприятных сердечно-сосудистых событий может быть ассоциирован с профилем фармакологического взаимодействия различных ИПП и клопидогреля [23, 25].
Как известно, у разных ИПП характер метаболизма имеет некоторые особенности, что может детерминировать неодинаковую степень ингибирования CYP2C19. По результатам лабораторных исследований, в которых изучалось ингибирующее действие на CYP2C19, ИПП можно расположить в следующем порядке (по убыванию): лансопразол, омепразол, эзомепразол, рабепразол, пантопразол (табл. 1) [24].
/21-1.jpg)
Подтверждением этому предположению стали результаты нескольких исследований. В одном из них было осуществлено сравнение количества активного метаболита клопидогреля в крови и его влияния на тромбоциты (противосвертывающее действие) у пациентов, принимавших клопидогрель с омепразолом и принимавших только клопидогрель. У больных, получавших клопидогрель с омепразолом, обнаружено уменьшение уровня активного метаболита примерно на 45 % по сравнению с теми, кто принимал только клопидогрель. Действие клопидогреля на тромбоциты у пациентов, которым был назначен клопидогрель с омепразолом вместе, также было снижено на 47 %. Эти эффекты наблюдались как при одновременном приеме лекарств, так и при их приеме с промежутком в 12 часов [18].
Другое крупное исследование по типу «случай — контроль» было проведено в Канаде [21]. В него вошли пациенты с ИМ в возрасте 66 лет и старше, которым в течение 3 дней после выписки из стационара был назначен клопидогрель (на фоне АСК). В качестве «случаев» рассматривались больные, повторно госпитализированные по поводу ИМ в пределах 90 дней после выписки. Пациенты без событий (группа контроля, n = 2057) и с событиями (случаи, n = 734) были сопоставимы по таким показателям, как возраст, проведенным ЧКВ в анамнезе и риску развития сердечно-сосудистых осложнений. Прием ИПП был охарактеризован как текущий (в пределах 90 дней), предшествовавший (31–90 дней) и давний (91–180 дней).
Текущий прием ИПП был сопряжен с повышенным риском реинфаркта (ОР 1,27; 95% ДИ 1,03–1,57). При рассмотрении препаратов ИПП отдельно оказалось, что прием пантопразола, который минимально взаимодействует с CYP2C19, не ассоциировался с повышенной частотой повторных госпитализаций вследствие ИМ (рис. 4).
Результаты данного исследования указывают на то, что безответственное применение ИПП может привести к тысячам дополнительных случаев рецидивов ИМ ежегодно, которых можно было бы потенциально избежать, избирательно используя пантопразол у больных, получающих клопидогрель и требующих лечения ИПП.
Таким образом, необходима персонификация подхода к каждому конкретному пациенту, заключающаяся в обоснованности назначения ДАТ, выявлении сопутствующих КЗЗ и характера их течения, а также определении потенциальных рисков развития желудочно-кишечных кровотечений [23, 25].
В руководстве Европейского общества кардиологов и Европейской ассоциации кардиоторакальных хирургов по ДАТ у пациентов с ИБС (2017) указывается на необходимость назначения ИПП всем пациентам, получающим ДАТ, для уменьшения риска желудочно-кишечных кровотечений. Также делается акцент на том, что если одним из компонентов ДАТ является клопидогрель, то с целью минимизации лекарственного взаимодействия препаратом выбора из ИПП должен быть пантопразол [34].
В случае монотерапии клопидогрелем требуется оценить имеющиеся показания к назначению ИПП. При наличии КЗЗ, протекающих с осложнениями, как на момент назначения терапии, так и в анамнезе (желудочно-кишечное кровотечение, перфоративная язва и др.) терапия ИПП является оправданной для предотвращения прогрессирования и рецидивирования КЗЗ. При КЗЗ, протекающих без осложнений, таких как неэрозивная рефлюксная болезнь или функциональная диспепсия, необходимо по возможности снижать дозу ИПП, обеспечивая при этом адекватный контроль динамики заболевания с дальнейшей перспективой перехода на антациды или ИПП по требованию [17].
Назначение ИПП только с гастропротективной целью требует стратификации рисков развития желудочно-кишечного кровотечения у конкретного пациента [12]. Для пациентов с высоким риском развития желудочно-кишечных кровотечений в перспективе, например при одновременном приеме антикоагулянтов, НПВП или глюкокортикоидов, терапия ИПП является оправданной [26].
Следует отметить, что в случае монотерапии клопидогрелем и необходимости назначения ИПП препаратом выбора также должен быть пантопразол.
Пантопразол существенно отличается от других ИПП несколькими свойствами. Фармакокинетика данного препарата характеризуется быстрым всасыванием из желудочно-кишечного тракта. Биодоступность при приеме внутрь составляет 77 %, а время достижения максимальной концентрации — 2,5–4 часа. При регулярном приеме пантопразола значение максимальной концентрации препарата сохраняется постоянным. Показатель площади под фармакокинетической кривой «концентрация — время» (AUC) отражает количество препарата, достигшее мишени действия — молекул протонной помпы, и коррелирует с выраженностью антисекреторного эффекта. Для пантопразола AUC составляет 9,93 ммоль/(л × ч), что является самым высоким показателем среди всех ИПП [2].
В настоящее время украинские врачи имеют возможность использовать в своей практической деятельности доступный современный генерический пантопразол. Он хорошо известен отечественному потребителю под торговым названием –Улсепан (компания World Medicine). В одной таблетке –Улсепана содержится 40 мг пантопразола, что является стандартной дозой для этого ИПП. Характерная особенность –Улсепана — наличие кишечнорастворимой оболочки, предохраняющей активное вещество от предварительного высвобождения и разрушения.
На кафедре внутренней медицины 3 ГУ «Днепропетровская медицинская академия МЗ Украины» было проведено сравнительное исследование по изучению безопасности и эффективности омепразола и пантопразола у пациентов с ИБС, получающих ДАТ. В связи с предположительным влиянием применения ИПП на эффективность ДАТ в нашем исследовании в качестве основного критерия безопасности рассматривалась частота развития сердечно-сосудистых, в первую очередь тромботических, осложнений — повторного ИМ, нестабильной стенокардии, инсульта/транзиторной ишемической атаки, смерти. Также учитывались частота развития побочных явлений, приверженность пациентов к терапии. Эффективность использования ИПП оценивалась по частоте развития желудочно-кишечных осложнений, в том числе желудочно-кишечных кровотечений. В исследование было включено 100 больных, перенесших ОКС. Все пациенты получали ДАТ (АСК 100 мг в сутки + клопидогрель 75 мг в сутки) и базисную терапию (ингибиторы АПФ/сартаны, бета-адреноблокаторы, статины, триметазидин). В 1-ю группу вошли 50 больных, которым был рекомендован омепразол (40 мг в сутки внутрь); во 2-ю — 50 пациентов, которым был назначен пантопразол (Улсепан в дозе 40 мг в сутки внутрь). Период наблюдения составил 6 месяцев. За весь отчетный период в обеих группах не был зарегистрирован ни один случай желудочно-кишечного кровотечения, однако в группе больных, получавших омепразол, 3 пациента были госпитализированы по поводу ОКС (1 случай ИМ, 2 случая нестабильной стенокардии).
Таким образом, Улсепан является эффективным препаратом для профилактики желудочно-кишечных кровотечений у пациентов, страдающих ИБС и получающих ДАТ (АСК + клопидогрель), а также безопасным средством, которое не повышает риск развития сердечно-сосудистых осложнений за счет угнетения антитромбоцитарной активности клопидогреля.
В заключение необходимо отметить, что современная фармакология, как и вся медицинская наука, не стоит на месте, и постепенно в клиническую практику внедряются новые представители антитромбоцитарных средств. В частности, новое поколение селективных антагонистов пуриновых P2Y12-рецепторов представлено такими препаратами, как прасугрель и тикагрелор (табл. 2).
Прасугрель, как и клопидогрель, является пролекарством и требует своей печеночной биотрансформации в активный метаболит, однако его метаболизм менее зависим от изоформы CYP2C19 [16, 28]. Тикагрелор является первым прямым антагонистом пуриновых P2Y12-рецепторов, а следовательно, не требует превращения в активный метаболит. Процессы метаболизма этого препарата не зависят от изоформы CYP2C19 [9].
Резюмируя приведенные выше данные, следует еще раз отметить, что в руководстве Европейского общества кардиологов и Европейской ассоциации кардиоторакальных хирургов по ДАТ у пациентов с ИБС (2017) настоятельно рекомендуется назначение ИПП всем пациентам, получающим ДАТ, для уменьшения риска желудочно-кишечных кровотечений. Если одним из компонентов ДАТ является клопидогрель, то с целью минимизации лекарственного взаимодействия препаратом выбора из ИПП должен быть пантопразол. Если в качестве компонентов ДАТ используются прасугрель или тикагрелор, риск лекарственных взаимодействий с ИПП либо практически отсутствует (прасугрель), либо отсутствует вовсе (тикагрелор).
Конфликт интересов. Не заявлен.
Список литературы
1. Каратеев А.Е. Шесть ножей в спину ингибиторам протонной помпы / А.Е. Каратеев // Научно-практическая ревматология. — 2013. — № 51 (3). — С. 332-340.
2. Колесникова Е.В. Медикаментозная профилактика и лечение гастропатий, связанных с приемом нестероидных противовоспалительных препаратов / Е.В. Колесникова, Т.А. Соломенцева // Сучасна гастроентерологія. — 2016. — № 3 (89). — С. 91-96.
3. Лапина Т.Л. Фармакологические основы антисекреторной терапии / Т.Л. Лапина // Русский медицинский журнал. — 2005. — № 1. — С. 23-27.
4. Маев И.В. Лекарственное взаимодействие ингибиторов протонной помпы и клопидогреля при их совместном приеме / И.В. Маев, А.А. Самсонов, В.А. Годило-Годлевский // Клиническая медицина. — 2013. — № 5. — С. 15-21.
5. Марцевич С.Ю. Совместное использование клопидогреля и ингибиторов протонной помпы: есть ли нерешенные вопросы сегодня / С.Ю. Марцевич, А.Ю. Суворов // Рациональная фармакотерапия в кардиологии. — 2014. — № 10. — С. 665-671.
6. Никонов В.В. Тромбоцитарный гемостаз и антитромбоцитарная терапия при остром коронарном синдроме / В.В. Никонов, Е.И. Киношенко // Медицина неотложных состояний. Избранные клинические лекции. — 2007. — Т. 2. — С. 216-236.
7. Пархоменко А.Н. Безопасность и эффективность двойной антитромбоцитарной терапии ацетилсалициловой кислотой и клопидогрелем на фоне применения ингибитора протонной помпы после перенесенного острого коронарного синдрома: результаты многоцентрового украинского исследования / А.Н Пархоменко, Я.М. Лутай, О.И. Иркин // Укр. мед. часопис. — 2011. — № 1(81). — С. 45-49.
8. Харкевич Д.А. Фармакология / Харкевич Д.А. — М.: ГЭОТАР-Медиа, 2006. — 402 с.
9. Belavic J.M. Ticagrelor: A new option for ACS / J.M. Belavic // Nurse Pract. — 2012. — Vol. 37(3). — P. 9-11.
10. Bhatt D.L. Clopidogrel with or without omeprazole in coronary heart disease / D.L. Bhatt, B. Cryer, C.F. Contant // N. Engl. J. Med. — 2010. — Vol. 363. — P. 1909-1917.
11. Bhatt D.L. CHARISMA Investigators. Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events / D.L. Bhatt, K.A. Fox, W. Hacke // N. Engl. J. Med. — 2006. — Vol. 354(16). — P. 1706-1717.
12. Bhatt D.L. ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risk of antiplatelet therapy and NSAID use: A report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents / D.L. Bhatt, J. Scheiman, N.S. Abraham // Circulation. — 2008. — Vol. 118. — P. 1894-1909.
13. Chen Z.M. COMMIT (ClOpidogrel and Metoprolol in Myocardial Infarction Trial) collaborative group. Addition of clopidogrel to aspirin in 45 852 patients with acute myocardial infarction: randomized placebo-controlled trial / Z.M. Chen, L.X. Jiang, Y.P. Chen // Lancet. — 2005. — Vol. 366(9497). — P. 1607-1621.
14. Collet J.P. Cytochrome P450 2C19 polymorphism in young patients treated with clopidogrel after myocardial infarction / J.P. Collet, J.S. Hulot, A. Pena // Lancet. — 2009. — Vol. 373. — P. 309-317.
15. Eshaghian S. Role of clopidogrel in managing atherothrombotic cardiovascular disease / S. Eshaghian, S. Kaul, S. Amin // Ann. Intern. Med. — 2007. — Vol. 146(6). — P. 434-441.
16. Fintel Dan J. Oral antiplatelet therapy for atherothrombotic disease: overview of current and emerging treatment options / Dan J. Fintel // Vasc. High Risk Manag. — 2012. — Vol. 8. — P. 77-89.
17. Inadomi J.M. Step-down from multiple- to single-dose proton pump inhibitors (PPIs): a prospective study of patients with heartburn or acid regurgitation completely relieved with PPIs / J.M. Inadomi, L. McIntyre, L. Bernard // Am. J. Gastroente-rol. — 2003. — Vol. 98. — P. 1940-1944.
18. Gilard M. Influence of omeprazole on the antiplatelet action of clopidogrel associated with aspirin: the randomized, double-blind OCLA (Omeprazole, CLopidogrel, Aspirin) study / M. Gilard, B. Arnaud, J. Cornily // J. Am. Coll. Cardiol. — 2008. — Vol. 51. — P. 256-260.
19. Hagihara K. Comparison of human cytochrome P450 inhibition by the thienopyridines prasugrel, clopidogrel, and ticlopidine / K. Hagihara, Y. Nishiya, A. Kurihara // Drug Metab. Pharmacokinet. — 2008. — Vol. 23. —
P. 412-420.
20. Ho P.M. Risk of adverse outcomes associated with concomitant use of clopidogrel and proton pump inhibitors following acute coronary syndrome / P.M. Ho, T.M. Maddox, L. Wang // J.A.M.A. — 2009. — Vol. 301. — P. 937-944.
21. Juurlink D.N. A population-based study of the drug interaction between proton pump inhibitors and clopidogrel / D.N. Juurlink, T. Gomes, D.T. Ko // Can. Med. Assoc. J. — 2009. — Vol. 180. — P. 713-718.
22. Kazui M. Identification of the human cytochrome P450 enzymes involved in the two oxidative steps in the bioactivation of clopidogrel to its pharmacologically active metabolite / M. Kazui, Y. Nishiya, T. Ishizuka // Drug Metab. Dispos. — 2010. — Vol. 38(1). — P. 92-99.
23. Laine L. Proton pump inhibitor and clopidogrel interaction: fact or fiction? / L.Laine, C. Hennekens // Am. J. Gastroenterol. — 2010. — Vol. 105. — P. 34-41.
24. Li X.Q. Comparison of inhibitory effects of the proton pump-inhibiting drugs omeprazole, esomeprazole, lansoprazole, pantoprazole, and rabeprazole on human cytochrome P450 activities / X.Q. Li, T.B. Andersson, M. Ahlstrom // Drug Metab. Disp. — 2004. — Vol. 32. — P. 821-827.
25. Madanick R.D. Proton pump inhibitor side effect and drug interaction: much ado about nothing? / R.D. Madanick // Cleveland Clin. J. Med. — 2011. — Vol. 78. — P. 39-49.
26. Mistry S.D. Impact of proton pump inhibitors on efficacy of clopidogrel: Review of evidence / S.D. Mistry, H.R. Trivedi, D.M. Parmar // Indian. J. Pharmacol. — 2011. — Vol. 43(2). — P. 183-186.
27. O’Donoghue M.L. Pharmacodynamic effect and clinical efficacy of clopidogrel and prasugrel with or without a proton pump inhibitor: An analysis of two randomized trials / M.L. O’Donoghue, E. Braunwald, E.M. Antman // Lancet. — 2009. — Vol. 374. — P. 989-997.
28. Paikin J.S. New antithrombotic agents — insights from clinical trials // J.S. Paikin, J.W. Eikelboom, J.A. Cairns // Nature Rev. Cardiol. — 2010. — Vol. 7(9). — P. 498-509.
29. Ray W. Outcomes with concurrent use of clopidogrel and proton pump inhibitors: a cohort study / W. Ray, K.T. Murray, M.R. Griffin // Ann. Inern. Med. — 2010. — Vol. 152. — P. 337-345.
30. Sabatine M.S. CLARITY-TIMI 28 Investigators. Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with ST-segment elevation / M.S. Sabatine, C.P. Cannon, C.M. Gibson // N. Engl. J. Med. — 2005. — Vol. 352(12). — P. 1179-1189.
31. Simon T. French Registry of Acute ST-Elevation and Non-ST-Elevation Myocardial Infarction (FAST-MI) Investigators. Genetic determinants of response to clopidogrel and cardiovascular events / T. Simon, C. Verstuyft, M. Mary-Krause // N. Engl. J. Med. — 2009. — Vol. 360. — P. 363-375.
32. Stanek E.J. A National Study of the Effect of Individual Proton Pump Inhibitors on Cardiovascular Outcomes in Patients Treated with Clopidogrel Following Coronary Stenting: The Clo-pidogrel Medco Outcomes Study / E.J. Stanek, R.E. Aubert, D.A. Flockhart // Program and abstracts of the 32nd Annual SCAI scientific sessions. May 6, 2009, Las Vegas, Nevada. — 2009. — P. 107-115.
33. Steinhubl S. CREDO Investigators. Clopidogrel for the Reduction of Events During Observation. Early and sustained dual oral antiplatelet therapy following percutaneous coronary interbention: a randomized controlled trial / S. Steinhubl, P. Ber-ger, J. Mann // J.A.M.A. — 2002. — Vol. 288(19). — P. 2411-
2420.
34. Valgimigli M. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS / M. Valgimigli // European Heart Journal. — 2017. — 0. — P. 1-48. doi: 10.1093/eurheart/ehx419.

/18-1.jpg)
/19-1.jpg)
/20-1.jpg)
/21-1.jpg)
/21-2.jpg)
/22-1.jpg)