Резюме
Актуальність. Важливе питання профілактики ішемічного інсульту можна реалізувати шляхом поліпшення надання медичної допомоги хворим і проведення профілактичних заходів, спрямованих на запобігання виникненню захворювання. Окремим питанням профілактики повторних тромбозів церебральних судин є медикаментозна профілактика гіпергомоцистеїнемії, що призводить до ряду фізіологічних патологій, серед яких можна назвати атеросклероз, атеротромбоз та венозний тромбоз. Мета роботи — розробка з урахуванням генетичних критеріїв більш досконалого й ефективного способу медикаментозної профілактики повторного мозкового ішемічного інсульту. Матеріали та методи. Нами було обстежено 150 пацієнтів, які перенесли ішемічний інсульт (чоловіків було 86, жінок — 64), віком від 45 до 84 років (середній вік — 65,2 ± 9,7 року) на базі нейрохірургічного відділення № 2 клінічної міської лікарні швидкої медичної допомоги м. Києва. Всім пацієнтам проводилося генетичне тестування у вигляді забору венозної крові та виявлення характеру мутації гена MTHFR C677T (СС, СТ або ТТ варіанти). Результати. Пацієнтів було розподілено на групи згідно з виявленими мутаціями гена MTHFR C677T та призначеним профілактичним лікуванням. У групу СС1 (n = 45) було включено пацієнтів із мутацією MTHFR C677T типу СС, яким призначався додатково до основного профілактичного лікування препарат фолієвої кислоти (вітамін В9) у дозі 1 мг (оптимізована профілактика). Пацієнти групи СС2 (n = 45) мали таку саму мутацію, але отримували лише основне профілактичне лікування (еналаприл 20 мг 2 р/д, аспірин 100 мг 1 р/д та розувастатин 20 мг 1 р/д). Так само були розподілені пацієнти груп СТ1 (n = 21), СТ2 (n = 21), ТТ1 (n = 9) та ТТ2 (n = 9). За умови призначення оптимізованої медикаментозної профілактики ризик інсульту серед пацієнтів із мутаціями СС та СТ вірогідно не відрізнявся (р > 0,1). Проте в разі мутації ТТ дані показали як високий ризик повторного інсульту через генетично обумовлену гіпергомоцистeїнемію, так і значну різницю в частоті повторної церебральної події на тлі лікування фолієвою кислотою (0 та 33,3 % відповідно). Висновки. Таким чином, оптимізована методика медикаментозної профілактики гострого ішемічного інсульту дозволяє ефективно запобігати виникненню повторного ішемічного інсульту залежно від генетичних особливостей пацієнта.
Актуальность. Важный вопрос профилактики ишемического инсульта можно реализовать путем улучшения оказания медицинской помощи больным и проведения профилактических мероприятий, направленных на предотвращение возникновения заболевания. Отдельным вопросом профилактики повторных тромбозов церебральных сосудов является медикаментозная профилактика гипергомоцистеинемии, которая приводит к ряду физиологических патологий, среди которых можно назвать атеросклероз, атеротромбоз и венозный тромбоз. Цель работы — разработка с учетом генетических критериев более совершенного и эффективного способа медикаментозной профилактики повторного мозгового ишемического инсульта. Материалы и методы. Нами было обследовано 150 пациентов, перенесших ишемический инсульт (мужчин было 86, женщин — 64) в возрасте от 45 до 84 лет (средний возраст — 65,2 ± 9,7 года) на базе нейрохирургического отделения № 2 клинической городской больницы скорой медицинской помощи г. Киева. Всем пациентам проводилось генетическое тестирование в виде забора венозной крови и выявления характера мутации гена MTHFR C677T (СС, СТ или ТТ варианты). Результаты. Пациенты были разделены на группы согласно выявленным мутациям гена MTHFR C677T и назначенному профилактическому лечению. В группу СС1 (n = 45) были включены пациенты с мутацией MTHFR C677T типа СС, которым назначался дополнительно к основному профилактическому лечению препарат фолиевой кислоты (витамин В9) в дозе 1 мг (оптимизированная профилактика). Пациенты группы СС2 (n = 45) имели такую же мутацию, но получали лишь основное профилактическое лечение (эналаприл 20 мг 2 р/д, аспирин 100 мг 1 р/д и розувастатин 20 мг 1 р/д). Подобным образом были распределены пациенты групп СТ1 (n = 21), СТ2 (n = 21), ТТ1 (n = 9) и ТТ2 (n = 9). При условии назначения оптимизированной медикаментозной профилактики риск инсульта среди пациентов с мутациями СС и СТ достоверно не отличался (р > 0,1). Однако в случае мутации ТТ данные показали как более высокий риск повторного инсульта из-за генетически обусловленной гипергомоцистeинемии, так и значительную разницу в частоте повторного церебрального события на фоне лечения фолиевой кислотой (0 и 33,3 % соответственно). Выводы. Таким образом, оптимизированная методика медикаментозной профилактики острого ишемического инсульта позволяет эффективно избегать повторного ишемического инсульта в зависимости от генетических особенностей пациента.
Background. An important task regarding the prevention of ischemic stroke can be realized by improving the provision of medical care to patients and the implementation of measures aimed at preventing the onset of the disease. A separate issue of prevention of recurrent thrombosis of cerebral vessels is the drug prophylaxis of hyperhomocysteinemia, which leads to a number of physiological pathologies, among which one can indicate atherosclerosis, atherothrombosis and venous thrombosis. Purpose: development of a more perfect and effective method for medical prevention of recurrent cerebral ischemic stroke using genetic criteria. Materials and methods. We have examined 150 patients who had an ischemic stroke (86 men, 64 women), aged 45–84 years (mean age 65.2 ± 9.7 years) at the premises of neurosurgery department N 2 of the Kyiv Clinical Emergency Hospital. All patients were genetically tested in the form of venous blood collection and detection of the mutation pattern of the gene MTHFR C677T (CC, CT or TT variants). Results. The patients were divided into groups according to detected MTHFR C677T gene mutations and prophylactic treatment. Patients with a MTHFR C677T type mutation were included in the CC1 (n = 45) group, which in addition to the main prophylactic treatment received folic acid (vitamin B9) in a dose of 1 mg (optimized prevention). The CC2 group (n = 45) had the same mutation, but received only the main prophylactic treatment (enalapril 20 mg 2 times a day, aspirin 100 mg once daily and rosuvastatin 20 mg once daily). Similarly, patients were included in groups CT1 (n = 21), CT2 (n = 21), TT1 (n = 9) and TT2 (n = 9). The risk of stroke among patients with CC and CT mutations did not significantly differ (p > 0.1) in case of optimized pharmacological prevention. However, in TT mutation, the data has shown a high probability of recurrent stroke due to genetically determined hyperhomocysteinemia and a significant difference in the incidence of repeated cerebral events on the background of treatment with folic acid (0 and 33.3 %, respectively). Conclusions. Thus, an optimized method of pharmacological prevention of acute ischemic stroke allows to effectively prevent recurrent ischemic stroke, depending on the genetic features of the patient.
Вступ
За даними літератури, в Україні близько 110 тис. жителів країни щорічно переносять мозковий інсульт. Третина інсультів виникає в людей праце–здатного віку. Знизити смертність від інсульту можна шляхом поліпшення надання медичної допомоги хворим і проведення профілактичних заходів, спрямованих на запобігання виникненню захворювання. Стратегія профілактики інсульту базується на використанні комплексу заходів, що включають виявлення та корекцію факторів ризику мозкового інсульту шляхом модифікації зовнішніх факторів (гіподинамія, ожиріння, куріння, зловживання алкоголем тощо) та медикаментозної корекції внутрішніх та генетичних факторів ризику (артеріальна гіпертензія, хвороби серця, цукровий діабет, гіперхолестеринемія, ризик тромбозу, патологія фолатної системи та ін.) (American Heart Association, 2014).
Окремим питанням профілактики повторних тромбозів церебральних судин є медикаментозна профілактика гіпергомоцистеїнемії. Гомоцистеїн — це біологічно активна речовина, що є продуктом амінокислотного розпаду в організмі людини. Гіпергомоцистеїнемія призводить до ряду фізіологічних патологій, серед яких атеросклероз, атеротромбоз та венозний тромбоз (Смульська Н.О. та співавт., 2014).
Серед причин гіпергомоцистeїнемії можна вказати дефіцит вітаміну B9 в організмі, супутні захворювання, незадовільний загальний стан організму, неправильне вживання медикаментів, фактори впливу зовнішнього середовища і дефект певних генів, відповідальних за синтез метилентетрагідрофолатредуктази (зокрема, MTHFR С7661Т) — ферменту, необхідного для метаболізму фолієвої кислоти і переробки гомоцистеїну в метіонін (фолатний цикл) (Arsene D. et al., 2011).
Порушення ферментів фолатного циклу (MTHFR, CBS, MTR, MTRR) призводить до накопичення гомоцистеїну в клітинах і підвищення загального рівня гомоцистеїну в плазмі. А це, зі свого боку, призводить до тромбофілії та інших порушень (Jin P. et al., 2013).
Мутації гена MTHFR С7661Т можуть мати такий вигляд: СС — нативна гомозиготна форма; СТ — гетерозиготна форма; ТТ — мутована гомозиготна форма. За результатами досліджень, саме ТТ-форма гена найбільше сприяє виникненню гіпергомоцистeїнемії, а значить, і високому ризику тромбоутворення (Soltanpour M.S. et al., 2013).
Яскравим прикладом методики профілактики мозкового ішемічного інсульту є медикаментозна схема, описана професором І.С. Зозулею та співавторами (Зозуля І.С., Головченко Ю.І., Оноприєнко О.П., 2010): пацієнту підбирають індивідуалізовану профілактичну медикаментозну схему антигіпертензивних, антитромботичних препаратів та статинів. Лікування починається з підбору стандартних препаратів (еналаприл 20 мг 2 р/д, аспірин 100 мг 1 р/д та розувастатин 20 мг 1 р/д) із подальшим підбором дозування в індивідуальному порядку. Дана терапевтична схема має ряд переваг, дозволяючи медикаментозно коректувати артеріальний тиск, показники згортання крові та рівень холестерину. Проте її недоліками є загальний підхід без урахування генетичних особливостей пацієнта і відсутність препаратів, що мали б вплив на порушення фолатного обміну.
Таким чином, в офіційних рекомендаціях щодо профілактики ішемічного інсульту використовуються медикаментозні схеми, що не передбачають корекції порушень фолатного обміну, що знижує ефективність всієї профілактики (Zhang M.J. et al., 2014).
Мета роботи: розробка з використанням генетичних критеріїв більш досконалого та ефективного способу медикаментозної профілактики повторного мозкового ішемічного інсульту.
Матеріали та методи
Нами було обстежено 150 пацієнтів, які перенесли ішемічний інсульт (чоловіків було 86, жінок — 64), віком від 45 до 84 років (середній вік — 65,2 ± 9,7 року) на базі нейрохірургічного відділення № 2 клінічної лікарні швидкої медичної допомоги м. Києва. При обстеженні хворих застосовували клініко-неврологічні методи з використанням структурованих шкал для оцінки неврологічного статусу. Діагноз мозкового інсульту та визначення локалізації інсультного вогнища проводили за допомогою клінічних методів, а також методів нейровізуалізації. У всіх пацієнтів здійснювалося генетичне тестування у вигляді забору венозної крові та виявлення характеру мутації гена MTHFR C677T (СС, СТ або ТТ варіанти). Статистичний аналіз даних проводився шляхом використання стандартних методів оцінки відмінностей у групах порівняння за допомогою непараметричних тестів на базі цифрових програм статистичного аналізу Microsoft Excel 2003 та програми SPSS 13.0 (Statistical Package for the Social Sciences). Статистично вірогідною вважали різницю при р < 0,05.
Результати та обговорення
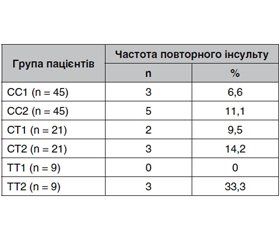
Для контролю ефективності вторинної профілактики пацієнтів було розподілено на групи згідно з виявленими мутаціями гена MTHFR C677T та призначеним профілактичним лікуванням. У групу СС1 (n = 45) було включено пацієнтів із мутацією MTHFR C677T типу СС, яким призначався додатково до основного профілактичного лікування (еналаприл 20 мг 2 р/д, аспірин 100 мг 1 р/д та розувастатин 20 мг 1 р/д) (Зозуля І.С., Головченко Ю.І., Оноприєнко О.П., 2010) препарат фолієвої кислоти (вітамін В9) в дозі 1 мг (оптимізована профілактика). Пацієнти групи СС2 (n = 45) мали таку саму мутацію, але отримували лише основне профілактичне лікування (еналаприл 20 мг 2 р/д, аспірин 100 мг 1 р/д та розувастатин 20 мг 1 р/д). Подібним чином були розподілені пацієнти груп СТ1 (n = 21), СТ2 (n = 21), ТТ1 (n = 9) та ТТ2 (n = 9).
У результаті спостереження за пацієнтами протягом одного календарного року була показана частота повторного ішемічного мозкового інсульту (табл. 1).
Результати табл. 1 свідчать, що навіть за умови призначення оптимізованої медикаментозної профілактики ризик інсульту серед пацієнтів із мутаціями СС та СТ вірогідно не відрізнявся (р > 0,1). Це вказує на те, що в даному випадку гіпергомоцистeїнемія не відіграє головної ролі в патогенезі повторного інсульту, тому призначення вітаміну В9 не справляло значного впливу на частоту повторних цереброваскулярних катастроф. Проте в разі мутації ТТ дані показали як високий ризик повторного інсульту через генетично обумовлену гіпергомоцистeїнемію, так і значну різницю в частоті повторної церебральної події на тлі лікування фолієвою кислотою (0 та 33,3 % відповідно).
Також нами було відмічено, що рівень інвалідизації за модифікованою шкалою Rankin (мШР) серед пацієнтів обраних нами груп також демонстрував певну диференціацію на кінець 1-го року спостереження порівняно з моментом виписки хворих (табл. 2).
/118-1.jpg)
Отримані дані показують, що оптимізація медикаментозної схеми шляхом додавання препарату фолієвої кислоти мала також позитивний вплив на відновлення функціонального стану пацієнтів. Так, різниця між пацієнтами з вираженим дефіцитом (мШР = 1–3 бали) та пацієнтами, які мали високий ступінь відновлення (мШР = 4–5 балів) у групах оптимізованої терапії, становила близько 15 % на користь останніх, що підтверджує тенденцію позитивного впливу препаратів фолієвої кислоти на відновлення пацієнтів з ішемічним інсультом. Причому через рік лікування в групі ТТ1 позитивна різниця досягала 23,3 % порівняно з групою ТТ2, що додатково вказує на залежність швидкості відновлення стану даної групи пацієнтів від компенсації генетично обумовлених порушень системи фолатного обміну.
Висновки
Таким чином, оптимізована методика медикаментозної профілактики гострого ішемічного інсульту дозволяє ефективно проводити лікування та профілактику повторного ішемічного інсульту залежно від генетичних особливостей пацієнта, що підтверджує важливість генетичного тестування та картування як запоруки індивідуалізації в лікуванні та профілактиці гострого ішемічного інсульту.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. American Heart Association. Heart disease and stroke statistics — 2014 update: a report from the American Heart Association / Go A.S., Mozaffarian D., Roger V.L., Benjamin E.J., Berry J.D. et al. / American Heart Association Statistics Committee and Stroke Statistics Subcommittee // Circulation. — 2014. — Vol. 129(3). — 292 p.
2. Association between MTHFR gene polymorphisms, smoking, and the incidence of vascular dementia / P. Jin, S. Hou, B. Ding et al. // Asia Pac. J. Public. Health. — 2013 Jul. — Vol. 25 (4 Suppl.). — P. 57-63. — doi: 10.1177/1010539513492819. — Epub. 2013, Jul. 15.
3. C677T and A1298C methylenetetrahydropholate reductase (MTHFR) polymorphisms as factors involved in ischemic stroke / Arsene D., Găină G., Bălescu C., Ardeleanu C. // Rom. J. Morphol. Embryol. — 2011. — 52(4). — P. 1203-1207.
4. Methylenetetrahydrofolate reductase C677T mutation and risk of retinal vein thrombosis / M.S. Soltanpour, Z. Soheili, A. Shakerizadeh, A.A. Pourfathollah, S. Samiei, R. Meshkani, M. Shahjahani, A. Karimi // J. Res. Med. Sci. — 2013 Jun. — 18(6). — Р. 487-491.
5. A Meta-Analysis of the Relationship between MTHFR Gene A1298C Polymorphism and the Risk of Adult Stroke / M.J. Zhang, Z.C. Hu, Y.W. Yin et al. // Cerebrovasc. Dis. — 2014. — № 38(6). — P. 425-432. — doi: 10.1159/000369122. — Epub. 2014, Dec. 3.
6. Інсульти: тактика, стратегія ведення, профілактика, реабілітація та прогноз / Зозуля І.С., Головченко Ю.І., Оноприєнко О.П. — К., 2010. — 320 с.
7. Асоціація поліморфних варіантів генів MTHFR (C677T), MTHFR (A1298C), MTRR (A66G), FV (G1691A), FII (G20210A), ACE (I/D) та їх комбінацій у ризику розвитку ішемічного інсульту в дитячому віці / Смульська Н.О., Кир’яченко С.П., Горовенко Н.Г., Зозуля І.С. // Український медичний часопис. — 2014. — № 3(101). — V/VI. — С. 131-134.

/117-1.jpg)
/118-1.jpg)