Резюме
Актуальність. Однією з основних причин і важливим фактором ризику виникнення гострого інсульту (ГІ) є цукровий діабет (ЦД), який погіршує перебіг інсульту, збільшує ризик розвитку ускладнень і смертельного наслідку. Для зменшення неврологічного дефіциту та поліпшення результатів лікування ГІ у даний час широко використовують нейропротектори, зокрема цитиколін і препарати магнію. Мета. Дослідження ефективності застосування комбінації цитиколіну та магнію сульфату як нейропротекторної терапії у хворих на ГІ на тлі супутнього ЦД. Матеріали та методи. Було проведено комплексне клініко-неврологічне та лабораторне обстеження 346 хворих (165 жінок та 181 чоловік), які перенесли гострий ішемічний інсульт. Цим хворим призначали цитиколін 1000 мг 1 раз на добу та розчин магнію сульфату 25% 30 мл на добу у 2–3 введення. В групі контролю (46 хворих — 25 жінок та 21 чоловік) використовували різні препарати із заявленою нейропротективною дією (крім цитиколіну та магнію сульфату). Результати. В групах, де використовувалися для нейропротекції цитиколін і магнію сульфат, починаючи з 5-ї доби, рівень свідомості відновлювався більш швидко, ніж у групі традиційного лікування. Згідно з аналізом за шкалою FOUR, на 10-й день лікування різниця між 1-ю, 2-ю групами та контролем стає відчутною і досягає рівня вірогідності (p < 0,05). На 3-тю добу лікування у хворих усіх груп рівень нейронспецифічної енолази (NSE) перевищував нормальні показники, причому найбільшою мірою — у хворих контрольної групи, в яких рівень NSE зріс у 10 разів (з 9,2 до 96,4 нг/мл). У подальшому спостерігалося швидке зниження рівня NSE, який в основних групах хворих на 10-ту добу лікування досягнув нормальних показників. У контрольній групі динаміка зниження NSE не була такою вираженою і на 10-й день лікування рівень NSE не досяг референтних значень. У хворих контрольної групи спостерігалося різке зниження rSO2 (особливо на 3-тю — 4-ту добу) з подальшим тривалим і повільним його підвищенням. Висновки. Комбінація цитиколіну з магнію сульфатом була вірогідно ефективною під час лікування хворих на ГІ на тлі супутнього ЦД. У хворих зі станами предіабету та у хворих без ЦД і з транзиторними гіперглікеміями спостерігалася менша ефективність цієї комбінації, а у групі хворих, які отримували традиційне лікування, вірогідних відмінностей у динаміці клініко-лабораторних показників виявлено не було. Таким чином, у хворих на ГІ на тлі супутнього ЦД комбінація цитиколіну та магнію сульфату є однією з можливих перспективних комбінацій препаратів, що мають нейропротекторні властивості.
Актуальность. Одной из основных причин и важным фактором риска возникновения острого инсульта (ОИ) является сахарный диабет (СД), который ухудшает течение инсульта, увеличивает риск развития осложнений и смертельного исхода. Для уменьшения неврологического дефицита и улучшения результатов лечения ОИ широко используются нейропротекторы, в частности цитиколин и препараты магния. Цель. Исследование эффективности применения комбинации цитиколина и магния сульфата в качестве нейропротекторной терапии у больных с ОИ на фоне сопутствующего СД. Материалы и методы. Проведено комплексное клинико-неврологическое и лабораторное обследование 346 больных (165 женщин и 181 мужчина), перенесших острый ишемический инсульт. Этим больным назначали цитиколин 1000 мг 1 раз в сутки и раствор магния сульфата 25% 30 мл в сутки за 2–3 введения. В группе контроля (46 больных — 25 женщин и 21 мужчина) использовали различные препараты с заявленным нейропротекторным действием (кроме цитиколина и магния сульфата). Результаты. В группах, где использовались для нейропротекции цитиколин и магния сульфат, начиная с 5 суток, уровень сознания восстанавливался более быстро, чем в группе традиционного лечения. Согласно анализу по шкале FOUR, к 10-му дню лечения разница между 1-й и 2-й группами и контролем становится ощутимой и достигает уровня достоверности (p < 0,05). На 3-и сутки лечения у больных всех групп уровень нейронспецифической енолазы (NSE) превышал нормальные показатели, причем в наибольшей степени — у больных контрольной группы, у которых уровень NSE вырос в 10 раз (с 9,2 до 96,4 нг/мл). В дальнейшем наблюдалось быстрое снижение уровня NSE, который в основных группах на 10-й день лечения достиг нормальных показателей. В контрольной группе динамика снижения NSE не была такой выраженной и на 10-й день лечения уровень NSE не достиг референтных значений. У больных контрольной группы наблюдалось резкое снижение rSO2 (особенно на 3-и — 4-е сутки) с последующим длительным и медленным его повышением. Выводы. Комбинация цитиколина с магния сульфатом была достоверно эффективной при лечении больных с ОИ на фоне сопутствующего СД. У больных с состояниями преддиабета и у больных без СД и с преходящими гипергликемиями наблюдалась меньшая эффективность этой комбинации, а в группе больных, получавших традиционное лечение, достоверных различий в динамике клинико-лабораторных показателей выявлено не было. Таким образом, у больных с ОИ на фоне сопутствующего СД комбинация цитиколина и магния сульфата является одной из возможных перспективных комбинаций препаратов, обладающих нейропротекторными свойствами.
Background. One of the main causes and an important risk factor for acute stroke (AS) is diabetes mellitus (DM), which aggravates the course of a stroke, increases the risk of complications and fatal outcome. Inappropriate treatment of diabetes, especially in acute stroke, can significantly increase the risk of recurring stroke or the area of ischemic focus. Neuroprotectors are now widely used to reduce neurological deficits and to improve the results of AS treatment. One of the promising neuroprotective drugs is citicoline. It is a natural endogenous compound that is an intermediate metabolite in the biosynthesis of phosphatidylcholine — one of the main structural components of the cell membrane, consists of two main molecules — cytidine and choline. Among the drugs recommended for use as neuroprotectors, magnesium preparations should also be mentioned. Magnesium reduces the selection of proinflammatory cytokines and free radicals, has vasodilation and antiplatelet action, antihypertensive and anti-edema activity, sedative and antiepileptic effects. The purpose was to investigate the effectiveness of the combination of citicoline and magnesium sulfate as a neuroprotective therapy in patients with acute stroke anddconcomitant diabetes mellitus. Materials and methods. The comprehensive clinical-neurological and laboratory examination was carried out in 346 patients (165 women and 181 men) who suffered acute ischemic stroke on the background of carbohydrate metabolic disorders (main groups) and without it. In the main groups of patients, as a neuroprotective agent, citicoline 1000 mg 1 time per day was administered and 25% magnesium sulfate solution 30 ml per day in 2–3 injections. The treatment lasted from the first to the tenth day of stay in the hospital. To determine the effectiveness of the developed scheme of intensive care, a separate group (46 patients — 25 women and 21 men) was selected, in which treatment was carried out according to the traditional approach (control group). In the control group, various preparations with neuroprotective action declared by manufacturer (except for citicoline and magnesium sulfate) were used. As criteria for the effectiveness of cerebroprotective therapy, we chose the recommended parameters in the literature: assessment of the level of consciousness on the Glasgow Coma Scale and the Full Outline of UnResponsiveness (FOUR) score; score on the National Institutes of Health Stroke Scale (assessment of the severity of stroke) and the Bartel index (evaluation of daily activity); level of neuronspecific enolase (NSE; marker of neuronal damage); indicators of cerebral oximetry (rSO2; marker of brain oxygenation); the state of cerebral hemodynamics according to the data of ultrasound Doppler of the vessels of the brain in the dynamics from admission to the moment of discharge. Results. Analysis of the dynamics of scores according to the Glasgow Coma Scale allows us to conclude that in groups that used of citicoline and magnesium sulfate for neuroprotection, starting from day 5, the level of consciousness was restored faster than in the conventional treatment group. Somewhat better grades were in patients in group 1. Due to the fact that not all patients had the opportunity to use the Glasgow Coma Scale (the presence of an intubation tube, aphasia), it was rational to assess the state of consciousness of the patient on the FOUR scale. According to the analysis of the FOUR scale, up to 10 days of treatment, the difference between 1 and 2 groups and control one became significant and reached a level of reliability (p < 0.05). At the first day of hospitalization, the level of NSE did not exceed the reference values (< 13.00 ng/ml) in all patients, but already on day 3 of treatment in patients in all groups, it exceeded normal rates, and to a large extent — in patients in the control group whose NSE level increased 10-fold (from 9.2 to 96.4 ng/ml). Subsequently, there was a rapid decrease in the NSE level, which reached normal rates within 10 days of treatment in the main groups of patients. Moreover, the deeper was the violation of carbohydrate metabolism in patients, the faster the level of NSE normalized. In the control group, the dynamics of the reduction in NSE was not so pronounced, and up to 10 days of treatment NSE level did not reach the reference values. Patients in the control group experienced a sharp decrease in rSO2 (especially on days 3–4) with subsequent prolonged and slow increase indicating a lower level of brain protection. Conclusions. The combination of citicoline with magnesium sulfate was reliably effective in treating patients with AS against the background of concomitant DM. In patients with pre-diabetes and patients without diabetes, but with transient hyperglycemia, the effectiveness of this combination was lower, and in the group of patients who received the traditional treatment, the significant differences in the dynamics of clinical and laboratory parameters was not found. The presented materials give the reason to assert that in patients with AS on the background of concomitant DM, the combination of citicoline and magnesium sulfate is one of the possible prospective combinations of drugs possessing neuroprotective properties.
Вступ
Україна посідає одне з перших місць у Європі за показниками захворюваності та смертності від інсульту, що створює велике навантаження на систему охорони здоров’я, соціального забезпечення, економіку та все суспільство. З іншого боку, в численних дослідженнях встановлено, що однією з основних причин і важливим фактором ризику виникнення гострого інсульту (ГІ) є цукровий діабет (ЦД). Некоректна терапія ЦД, особливо в гострий період інсульту, може істотно підвищити ризик повторного інсульту або збільшити площу ішемічного вогнища. Наявність ЦД погіршує перебіг інсульту, збільшує ризик розвитку ускладнень і смертельного наслідку [1].
Для зменшення неврологічного дефіциту та поліпшення результатів лікування інсульту у даний час широко використовують лікувальні засоби (нейро–протектори), що зменшують ушкодження, запобігають загибелі або сприяють відновленню клітин мозку після гострої ішемії або реперфузії. Концепція нейропротекції має достатнє наукове обґрунтування, а потреба у нейропротекторах сьогодні є навіть більшою, ніж раніше. Потенційні мішені для втручань охоплюють ефекти збуджуючих амінокислот, таких як глутамат (ексайтотоксичність), трансмембранні потоки кальцію, активацію протеаз у клітинах, апоптоз, дію вільних радикалів, запалення, а також відновлення мембран і нейромедіаторних систем. В експерименті при ішемічному інсульті досліджено понад 1000 речовин, і в багатьох випадках результати були дуже обнадійливі [2]. Однак у даний час жодна з цих речовин не продемонструвала беззаперечної ефективності у контрольованих клінічних випробуваннях при ішемічному інсульті (ІІ), особливо у хворих із наявною коморбідною патологією, зокрема з ЦД.
Перспективним нейропротекторним препаратом є цитиколін. Він являє собою природну ендогенну сполуку, що є проміжним метаболітом у біосинтезі фосфатидилхоліну — одного з основних структурних компонентів клітинної мембрани складається з двох основних молекул — цитидину та холіну [3]. Цитиколін виявився серед найбільш перспективних препаратів нейропротекторної дії [3–7], що впливає на різні патобіохімічні та молекулярні механізми.
Серед препаратів, що рекомендовані до застосування як нейропротектори, слід назвати також препарати магнію. Магній — це другий за значущістю після калію внутрішньоклітинний катіон, задіяний у понад 600 ензимних реакціях, включаючи енергетичний метаболізм і білковий синтез. Як фізіологічний антагоніст кальцію магній потенційно здатний блокувати NMDA-опосередковану глутаматну ек–сайтотоксичність при різних ураженнях головного мозку. Переваги використання препаратів магнію у хворих на ГІ добре відомі [8]. Він зменшує виділення прозапальних цитокінів і вільних радикалів, має вазодилататорні та антиагрегантні ефекти, гіпотензивну і протинабрякову дію, чинить седативний і протиепілептичний вплив [9, 10].
Додатковим аргументом на користь препаратів магнію є той факт, що приблизно у 90 % хворих на ЦД розвивається гіпомагніємія. Порушення метаболізму магнію може бути спричинене мальабсорбцією внаслідок патології травного тракту, зменшенням його надходження через незбалансований раціон або голодування та/або підвищеними втратами магнію з діурезом. Стресові ситуації, застосування сечогінних, проносних засобів, кортикоїдів, інсуліну часто спричиняють абсолютне зниження рівня магнію в крові й підвищують потребу в ньому [9, 11]. При декомпенсації ЦД спостерігається і порушення надходження магнію з їжею, і підвищені втрати з осмотичним діурезом, і підвищене виділення контрінсулярних гормонів (кортизолу тощо), отже, для лікування застосовується регулярне введення інсуліну.
Таким чином, у хворих на інсульт на тлі супутнього ЦД використання цитиколіну з магнію сульфатом видається перспективним методом лікування з нейропротективним ефектом. Для перевірки цієї гіпотези було проведено це дослідження.
Мета: дослідити ефективність застосування комбінації цитиколіну та магнію сульфату як нейропротекторної терапії у хворих на ГІ на тлі супутнього ЦД.
Матеріали та методи
Для вирішення поставленого завдання було проведено комплексне клініко-неврологічне та лабораторне обстеження 346 хворих (165 жінок та 181 чоловік), які перенесли гострий ішемічний інсульт на тлі порушень вуглеводного обміну (основні групи) та без такого (табл. 1).
Критеріями залучення в дослідження були: хворі, які перенесли гострий первинний ІІ, верифікований клініко-неврологічними та нейровізуалізаційними методами, на тлі ЦД і без вуглеводних порушень.
Критерієм вилучення з дослідження була наявність у хворого тяжкої коморбідної патології (гострий інфаркт міокарда, гостра ниркова, печінкова та дихальна недостатність, епілепсія, пухлина головного мозку, геморагічний інсульт).
Для визначення ефективності розробленої схеми інтенсивної терапії виділена окрема група (46 хворих — 25 жінок та 21 чоловік), у яких лікування проводили за традиційним підходом (контрольна група).
На сьогодні нейропротектори традиційно призначаються майже всім хворим на ГІ, починаючи з 1–2-ї доби. Тому в групі контролю (традиційне лікування) використовувалися різні препарати із заявленою виробником нейропротективною дією. Вони використовувалися без закономірної системи, на розсуд лікаря відділення інтенсивної терапії згідно з його особистими уподобаннями або консультацією невролога. Нерідко після 2–3 днів застосування одного препарату його замінювали на інший, або взагалі припиняли вводити у зв’язку з певними фінансовими проблемами та відсутністю препарату. Застосовували такі засоби: актовегін, церебролізин, препарати янтарної кислоти, цитофлавін, кверцетин, вінпоцетин, інстенон, мексидол, ноотропи (пірацетам, ноотропіл). У деяких випадках призначали по 2–3 нейропротектори одночасно.
В основних групах хворих (1, 2 та 3-й) як нейропротектори призначали цитиколін 1000 мг 1 раз на добу та розчин магнію сульфату 25% 30 мл на добу у 2–3 введення. Лікування тривало від першої до десятої доби перебування у стаціонарі.
Обстеження пацієнтів передбачало клініко-лабораторний моніторинг, біохімічні та коагулогічні аналізи крові. Діагноз ішемічного інсульту та його локалізацію верифіковано за допомогою комп’ютерної (КТ) та/або магнітно-резонансної томографії (МРТ) головного мозку.
Як критерії ефективності церебропротекторної терапії ми обрали рекомендовані у літературі [7] параметри:
— оцінка рівня свідомості за шкалою коми Глазго та шкалою FOUR;
— кількість балів за шкалою NIHSS (оцінка тяжкості інсульту) та індекс Бартел (оцінка повсякденної активності);
— рівень нейронспецифічної енолази (NSE; маркер ушкодження нейронів);
— показники церебральної оксиметрії (rSO2; маркер оксигенації головного мозку);
— стан мозкової гемодинаміки за даними ультразвукової допплерографії судин головного мозку в динаміці від надходження до моменту виписки.
Зазначені параметри визначалися у пацієнтів протягом усього періоду лікування, наприкінці лікування проводили контрольне нейровізуалізаційне дослідження (КТ, МРТ).
Статистичну обробку отриманих результатів проводили з використанням пакетів статистичного аналізу Microsoft Excel 2010 і SPSS 13.0 та непараметричних методів. Вірогідність різниці між середніми кількісними значеннями двох вибірок визначали за t-критерієм Стьюдента. Для оцінки вірогідності різниці декількох відносних величин, пов’язаних між собою, застосовували χ2-критерій Пірсона.
Результати та обговорення
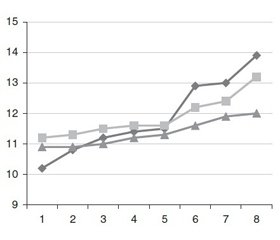
Результати дослідження викладені нами в табл. 2 і рис. 1–4. Зокрема, на рис. 1 наведена динаміка оцінок свідомості хворих за ШКГ. У зв’язку з тим, що не в усіх хворих була можливість застосовувати ШКГ (наявність інтубаційної трубки, афазія), було раціонально оцінити стан свідомості пацієнта за шкалою FOUR (рис. 2).
Поданий на рис. 1 графік дозволяє зробити висновок, що в групах, де використовувалися для нейропротекції цитиколін і магнію сульфат, починаючи з 5-ї доби, рівень свідомості відновлювався більш швидко, ніж у групі традиційного лікування. Дещо кращі оцінки мали хворі 1-ї групи.
На рис. 2 можна прослідкувати динаміку, подіб–ну до рис. 1. Проте, згідно з аналізом шкали FOUR, на 10-й день різниця між 1-ю та 2-ю групами була практично відсутня, а різниця між цими групами та контролем стає відчутною і досягає рівня вірогідності (p < 0,05).
Чому виникла розбіжність у результатах (рис. 1, 2), адже аналізувалися одні й ті самі групи пацієнтів? На нашу думку, це пов’язано з тим, що у шкалі FOUR обмежується вплив на оцінку «фактор мовлення», яка може бути ускладнена (або неможлива) у хворих на інсульт через афазію, дизартрію чи інтубацію трахеї. Особливо це актуально у хворих з ГІ та супутнім ЦД, коли важливо розрізнити причини пригнічення свідомості — чи це метаболічні причини, чи це причини неврологічної природи. Певне значення в такій диференціальній діагностиці має визначення ней–ронспецифічних білків, наприклад нейронспецифічної енолази. На рис. 3 наведена динаміка рівнів цього ферменту в крові у хворих різних груп.
Аналіз діаграми на рис. 3 дає можливість зробити цікаві висновки. На 1-шу добу від госпіталізації в лікарню в усіх хворих рівень NSE не перевищував референтні показники (< 13,00 нг/мл), але вже на 3-тю добу лікування у хворих усіх груп він перевищував нормальні показники, причому найбільше — у хворих контрольної групи, в яких рівень NSE зріс у 10 разів (з 9,2 до 96,4 нг/мл). Таку різницю можна було б пояснити лише більшою тяжкістю ураження гематоенцефалічного бар’єра на фоні більш тяжкого перебігу ГІ, проте в цій групі тяжкість ГІ була цілком порівнянна з іншими групами. В подальшому спостерігалася теж цікава картина: в основних групах виявлялась швидка нормалізація показника, який на 10-ту добу лікування досягнув нормальних значень. Причому, чим глибшим було порушення вуглеводного обміну у хворих, тим швидше нормалізувався рівень NSE (тобто у хворих на ЦД нормалізація проходила швидше, ніж у хворих із стресовими гіперглікеміями). В той же час у контрольній групі динаміка зниження NSE не була такою вираженою і на 10-й день лікування рівень цього нейроферменту не досяг референтних значень.
При оцінці показників церебральної оксиметрії (ЦО) було виявлено, що у хворих різних вікових груп і коморбідних станів цей показник може значно варіювати — від 65 до 90 %. Тому для аналізу ефективності лікувального процесу взагалі та застосування церебропротекторів зокрема цей показник не дуже підходить.
Але слід зважити на те, що у людей без цереброваскулярних захворювань зберігаються приблизно рівні показники ЦО над обома півкулями. Одночасно при ІІ показник ЦО над ураженою півкулею значно знижується. Тому для аналізу ефективності церебропротекторів можна використати різницю в ЦО між здоровою та ураженою півкулею. Ми вирішили проаналізувати цей показник, давши йому назву «коефіцієнт ЦО» (ΔЦО). Динаміка цього показника подана на рис. 4.
Аналіз поданих на рис. 4 графіків дозволяє стверджувати, що хворі основних груп дослідження на фоні застосування запропонованої комбінації церебропротекторів мали подібну динаміку коефіцієнта ЦО. При цьому найменші коливання ΔЦО спостерігалися в 1-й групі (у хворих зі встановленим ЦД). Натомість у хворих контрольної групи спостерігалося різке зростання коефіцієнта ЦО (особливо на 3-тю — 4-ту добу) і тривале та повільне його зниження, що свідчить про більш низький рівень захисту головного мозку.
Стан мозкового кровотоку досліджували за даними транскраніальної допплерографії на 1-й та 7-й дні лікування з обчисленням систолічної, діастолічної і середньої лінійної швидкості кровотоку (ЛШК) у середній мозковій артерії (СМА) та пульсового індексу (ПІ). Останній показник обраховували за формулою: ПІ = (ЛШКс – ЛШКд)/ЛШКсер.
Отримані показники швидкості кровотоку та результати розрахунку ПІ наведені у табл. 2.
При аналізі параметрів, наведених в табл. 2, встановлено, що в групах хворих за показниками транскраніальної допплерографії розбіжностей виявлено не було.
Контрольне нейровізуалізаційне дослідження (КТ, МРТ), яке проводили у день виписки хворих, продемонструвало стабілізацію та покращення стану хворих в усіх групах обстеження.
Висновки
Аналіз поданих матеріалів показав, що комбінація цитиколіну з магнію сульфатом була вірогідно ефективною під час лікування хворих із ГІ на тлі супутнього ЦД.
У хворих зі станами предіабету та у хворих без ЦД, але з транзиторними гіперглікеміями, спостерігалася менша ефективність цієї комбінації, а у групі хворих, які отримували традиційне лікування, вірогідних відмінностей у динаміці клініко-лабораторних показників виявлено не було.
Наведені матеріали дають привід стверджувати, що у хворих із ГІ на тлі супутнього ЦД комбінація цитиколіну та магнію сульфату є однією з можливих перспективних комбінацій препаратів, що мають нейропротекторні властивості.
Для оцінки рівня свідомості у хворих з інсультом на тлі ЦД більш доцільно використовувати не ШКГ, а шкалу FOUR, у якій обмежується вплив на оцінку «фактор мовлення», яка може бути ускладнена (або неможлива) у хворих на інсульт через афазію, дизартрію чи інтубацію трахеї. Особливо це актуально у хворих на ГІ із супутнім ЦД, коли важливо розрізнити метаболічні та неврологічні причини пригнічення свідомості.
Слід зазначити, що покращення спостерігалося в усіх групах хворих. І це наслідок не тільки вдалого вибору комбінації нейропротекторів, що, ймовірно, пов’язано з проведенням активної за всіма пунктами протоколу інтенсивної терапії ГІ та з реалізацією удосконаленого алгоритму ведення хворих на ГІ при супутньому ЦД, а також іншими порушеннями вуглеводного обміну.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Парфенов В.А., Хасанова Д.Р. Ишемический инсульт. — М.: Медицинское информационное агентство, 2002. — 288 с.
2. Сучасні принципи діагностики та лікування хворих із гострим ішемічним інсультом та ТІА (Адаптована клінічна настанова) — К.: Видавець Д.В. Гуляєв, 2012. — 144 с.
3. Стаднік С.М. Сучасні підходи до превентивно-терапевтичної корекції постінсультних когнітивних розладів // Гострі та невідкладні стани в практиці лікаря. — 2017. — № 1(64). — С. 32-38.
4. Overgaard K. The effects of citicoline on acute ischemic stroke: a review // J. Stroke Cerebrovasc. Dis. — 2014 Aug. — 23(7). — 1764-9. doi: 10.1016/j.jstrokecerebrovasdis.2014.01.020.
5. Alvarez-Sabín J., Román G.C. The role of citicoline in neuroprotection and neurorepair in ischemic stroke // Brain. Sci. — 2013 Sep 23. — 3(3). — 1395-414. doi: 10.3390/brainsci3031395.
6. Nomani F., Kamal A.K. Citicoline in the treatment of acute ischaemic stroke: an international, randomized, multicentre, placebo-controlled study (ICTUS trial) is the use of Citicoline is be–neficial for acute ischaemic stroke? // J. Pak. Med. Assoc. — 2013 Nov. — 63(11). — 1445. PubMed PMID: 24392540.
7. Титов И.И. Эффективность, безопасность и переносимость комбинации электролитов и цитиколина (Нейроцитин®) у пациентов с острым ишемическим инсультом: первые результаты исследования // Міжнародний неврологічний журнал. — 2017. — № 1(87). — С. 64-72.
8. Интенсивная терапия: национальное руководство: В 2 т. / Под ред. Б.Р. Гельфанда, А.И. Салтанова. — М.: ГЭОТАР-Медиа, 2009. — Т. I. — 960 с.
9. Соколова Л.І., Довбонос Т.А., Шандюк В.Ю. Застосування сульфату магнію при ішемічному інсульті // Укр. неврологіч. журн. — 2015. — № 4(37). — С. 91-97.
10. Singh H., Jalodia S., Gupta M.S., Talapatra P., Gupta V., Singh I. Role of magnesium sulfate in neuroprotection in acute ischemic stroke // Ann. Indian. Acad. Neurol. — 2012 Jul. — 15(3). — 177-80. doi: 10.4103/0972-2327.99705.
11. Afshari D., Moradian N., Rezaei M. Evaluation of the intravenous magnesium sulfate effect in clinical improvement of patients with acute ischemic stroke // Clin. Neurol. Neurosurg. — 2013 Apr. — 115(4). — 400-4. doi: 10.1016/j.clineuro.2012.06.001.

/88-1.jpg)
/90-2.jpg)
/89-1.jpg)
/90-1.jpg)