Резюме
При артеріальній гіпертензії (АГ) з ожирінням мають значення інтерлейкіни‑2, 6, 10 і С-реактивний білок. Ці маркери запалення регулюють міжклітинні взаємодії, проліферацію мезангію і викликають низку змін на клітинному рівні, тим самим сприяючи запальним процесам. Мета дослідження: виявити особливості маркерів запалення у хворих на артеріальну гіпертензію з ожирінням залежно від тривалості захворювання. Матеріал і методи. Обстежено 52 хворих на АГ II стадії з ожирінням в трьох групах за тривалістю захворювання. У першу групу увійшли 19 хворих з тривалістю захворювання до п’яти років, в другу — 18 хворих з тривалістю захворювання 6–10 років і в третю — 15 пацієнтів з тривалістю захворювання понад 11 років. Активність сироваткових рівнів маркерів запалення визначали імуноферментним методом. Результати. При тривалості захворювання 6–10 років рівень ІЛ‑6 дещо підвищувався порівняно з першими 5 роками, а потім знижувався. Вміст ІЛ‑2 був підвищений в перші 5 років в 3,74 раза, а в подальшому знижувався у 3,15 раза і 3,04 раза відповідно порівняно з контролем. Рівні ІЛ‑10 і СРБ мали таку ж тенденцію, як і ІЛ‑6. Висновки. Встановлено, що хворим з артеріальною гіпертензією та ожирінням притаманне істотне підвищення рівня в крові інтерлейкіну‑2, 6 і 10 і С-реактивного білка (більше рівні прозапальних цитокінів, ніж протизапального). При подовженні тривалості захворювання запальний процес стає менш вираженим, що може свідчити про більш глибокі імунологічні порушення. Після стандартної терапії підвищені початкові концентрації цитокінів і С-реактивного білка в крові значно знижуються, але вірогідно не відрізняються від контролю, крім рівня інтерлейкіну‑2.
При артериальной гипертензии (АГ) с ожирением имеют значение интерлейкины‑2, 6, 10 и С-реактивный белок (СРБ). Эти маркеры воспаления регулируют межклеточные взаимодействия, пролиферацию мезангия и вызывают множество изменений на клеточном уровне, тем самым способствуя воспалительным процессам. Цель исследования: выявить особенности маркеров воспаления у больных артериальной гипертензией с ожирением в зависимости от длительности заболевания. Материал и методы. Обследовано 52 больных АГ II стадии с ожирением в трех группах по длительности заболевания. В первую группу вошли 19 больных с длительностью заболевания до 5 лет, во вторую — 18 больных с длительностью заболевания 6–10 лет и в третью — 15 пациентов с длительностью заболевания более 11 лет. Активность сывороточных уровней маркеров воспаления определяли иммуноферментным методом. Результаты. При продолжительности заболевания 6–10 лет уровень ИЛ‑6 несколько повышался по сравнению с первыми пятью годами, а затем снижался. Содержание ИЛ‑2 было повышено в первые 5 лет в 3,74 раза, а в дальнейшем снижалось до 3,15 и 3,04 раза соответственно по сравнению с контролем. Уровни ИЛ‑10 и СРБ имели такую же тенденцию, как и ИЛ‑6. Выводы. Установлено, что для больных с АГ и ожирением характерно существенное повышение уровня в крови интерлейкинов‑2, 6 и 10 и СРБ (больше уровни провоспалительных цитокинов, чем противовоспалительного). По мере увеличения продолжительности заболевания воспалительный процесс становится менее выраженным, что может свидетельствовать о более глубоких иммунологических нарушениях. После стандартной терапии повышенные исходные концентрации цитокинов и СРБ в крови значительно снижаются, но достоверно не отличаются от контроля, кроме уровня интерлейкина‑2.
Interleukins (IL) 2, 6, 10, and C-reactive protein are crucial in arterial hypertension with obesity. Background. To identify the characteristics of inflammatory markers in patients with arterial hypertension and obesity, in accordance with the disease duration. Materials and Methods. The study involved 52 patients with stage II hypertension and obesity, divided in three groups according to the disease duration. In the first group consisted of 19 patients disease duration was 5 years, in the second (18 patients) — 6–10 years, and in the third one (15 patients) — more than 11 years. The serum levels of inflammatory markers were determined by ELISA. Results. When disease duration is 6–10 years, the IL‑6 level is increased slightly compared to the first group, and then decreased. The content of IL‑2 was increased in the first group by 3.74 times, and further decreased by 3.15 times and 3.04 times, respectively, compared to the controls. Levels of IL‑10 and C-reactive protein have the same tendency, as IL‑6. Conclusions. It was found that levels of interleukin 2, 6, 10, and C-reactive protein are significantly increased in patients with hypertension and obesity (greater levels of pro-inflammatory cytokines than the anti-inflammatory). Lengthening the duration of illness leads to less expressive inflammation that may indicate deeper immunological disorders. Initially increased blood concentration of cytokines and C-reactive protein became significantly reduced under standard therapy, but not significantly different from the controls, except the level of IL‑2.
Статтю опубліковано на с. 40-44
Введение
Сердечно-сосудистые заболевания (ССЗ) занимают первое место по распространенности и являются основной причиной потери трудоспособности и смертности в большинстве экономически развитых стран. Среди этих заболеваний артериальная гипертензия (АГ) в настоящее время является ведущим фактором риска ишемической болезни сердца (ИБС) и ее осложнений.
Связь между АГ и ожирением рассматривается как причинно-следственные отношения через потенциальную двустороннюю взаимосвязь между повышенным артериальным давлением (АД) и ожирением [1]. Поскольку ожирение значительно ухудшает прогноз, способствует прогрессированию сосудистых изменений, ускоряет развитие АГ, определение влияния ожирения на важное звено патогенеза воспаления имеет большое значение [2].
Воспалительные нарушения при АГ с ожирением можно трактовать как фактор, во многом определяющий возникновение и течение заболевания, причину ухудшения его течения, развитие и прогрессирование процесса. Механизмы воспалительного воздействия могут иметь как иммунологическую, так и гемодинамическую, интоксикационную и генетическую основу [3, 4].
Механизмы повреждающего действия иммунологических нарушений представляют собой гиперкоагуляцию вследствие нарушения регуляторной функции прокоагулянтов, активации β-липидоцитов и комплемента с образованием иммунных комплексов, а также образования провоспалительных цитокинов. Оценка этих изменений может служить показателем тяжести заболевания и его дифференциально-диагностическим критерием, так же как и определение интенсивности реакции организма и участия неспецифических индикаторов и промоутеров заполнения [5–7].
Особое значение среди цитокинов в цепи развития АГ с ожирением имеет секреторная форма ИЛ‑2, ИЛ‑6 и ИЛ‑10, продуцируемых моноцитами/макрофагами и Т-хелперами 1-го и 2-го типа соответственно. Указанные интерлейкины регулируют межклеточные взаимодействия, пролиферацию мезангия, экспрессию генов и вызывают множество изменений на клеточном уровне, тем самым способствуя воспалительным процессам [8–10]. Регулятором воспаления выступают про- и противовоспалительные цитокины.
Учитывая многогранность, синергизм/антагонизм и плейотропность эффектов цитокинов, участвующих в различных патологических процессах, корректной является одновременная оценка продукции различных медиаторов.
Цель исследования: выявить особенности изменений содержания цитокинов с про- и противовоспалительными свойствами у больных артериальной гипертензией с ожирением в зависимости от длительности заболевания.
Материалы и методы
Обследовано 52 больных АГ II стадии с ожирением и проявлениями сердечной недостаточности не выше IIА стадии в трех группах по длительности заболевания. В первую группу вошли 19 больных с продолжительностью заболевания до 5 лет, во вторую — 18 больных с длительностью заболевания 6–10 лет и в третью — 15 пациентов с длительностью заболевания более 11 лет. Группы были сопоставимы по полу, возрасту, тяжести клинического состояния, сопутствующей патологии. Все пациенты подписали информированное согласие на участие в исследовании. Контрольную группу составили 20 практически здоровых лиц аналогичного возраста и пола без признаков заболевания.
Критериями включения больных в исследование были наличие у них клинических признаков АГ с ожирением, подтвержденных данными дополнительных методов обследования. Клинический диагноз устанавливали на основании жалоб больного, анамнеза заболевания, данных объективного обследования, лабораторных и инструментальных методов исследования.
Из исследования были исключены пациенты с сопутствующими инфекционными, онкологическими, иммунными заболеваниями и хроническими заболеваниями в фазе обострения, больные АГ с уровнем фракции выброса менее 50 %, анемией, почечной недостаточностью, острым коронарным синдромом в течение предыдущих 3 месяцев, нарушениями ритма и проводимости, хронической обструктивной болезнью легких, окклюзионными заболеваниями сосудов нижних конечностей.
Исследование сывороточных концентраций цитокинов проводили иммуноферментным методом с использованием специальных наборов для определения содержания ИЛ‑2, ИЛ‑6, ИЛ‑10 («Протеиновый контур», СПб., Россия) и для СРБ набором реагентов фирмы «DRG International Inc.» (США) по предоставленной инструкции.
Ожирение оценивали по индексу массы тела (ИМТ), исходя из рекомендаций ВОЗ [2]. Оптимальным считался ИМТ в пределах 18,5–24,9 кг/м2. Критерием избыточной массы был ИМТ 25–29,9 кг/м2 и ожирения — более 30,0 кг/м2. ИМТ, который является результатом соотношения массы тела (кг) с ростом в квадрате (кг/м2) и отражает антропометрические данные, равнялся 30,6 ± 1,4 кг/м2. Кроме массы тела и роста во внимание принималось отношение объема талии (ОТ) к объему бедер (ОБ), устанавливался тип распределения жировой клетчатки: центральный тип считался у женщин при ОТ/ОБ > 0,85; у мужчин при ОТ/ОБ > 1,0 [2].
Работа проведена в соответствии с требованиями Европейской конвенции по защите позвоночных животных (Страсбург, 18.03.1986), положениями Хельсинкской декларации Всемирной медицинской ассоциации, директивой совета Европейского экономического общества по защите позвоночных животных (Страсбург, 24.11.1986), уставом Украинской ассоциации по биоэтике и нормами GCP (1992 г.), требованиями и нормами ИПН GCP (2002 г.), типовыми положениями по вопросам этики МЗ Украины № 66 от 13.02.2006. Все пациенты выразили информированное согласие на участие в исследовании и были полностью осведомлены о методах и объемах исследования.
Поскольку распределение количественных величин во всех сравниваемых группах было приближено к нормальному, нами применены параметрические методы. Критической величиной уровня значимости р выбрана 0,05. Во время выборочного анализа качественные и количественные показатели оценивали с помощью абсолютных и относительных (в процентах) частот, центральную закономерность и вариабельность количественных показателей вычисляли приведением среднего арифметического значения (М) и стандартного отклонения (sd), результаты представляли как М ± sd. Статистическую гипотезу об отсутствии различий между двумя сопоставимыми группами проверяли с использованием соответствующего варианта критерия Стьюдента (для зависимых или независимых выборок). Математические расчеты проводились в Statsoft Statistica 6.0.
Результаты
Проанализировано содержание цитокинов и СРБ в крови больных АГ с ожирением в зависимости от продолжительности заболевания (рис. 1).
Установлено, что при продолжительности заболевания 6–10 лет уровень ИЛ‑6 несколько повышался по сравнению с первыми пятью годами, а затем снижался. Так, при длительности заболевания до 5 лет он превышал контроль в 3,09 раза, 6–10 лет — в 3,19 раза, а 11 и более лет — снижался до 2,88 раза. Содержание ИЛ‑2 было повышено в первые 5 лет в 3,74 раза, а в дальнейшем снижалось до 3,15 раза и 3,04 раза соответственно по сравнению с конт–ролем. Уровни ИЛ‑10 и СРБ имели такую же тенденцию, как и ИЛ‑6. Они повышались в первые 5 лет заболевания в 2,68 и 4,91 раза, через 6–10 лет — в 2,81 и 5,15 раза, а затем их уровень снижался до 2,41 и 3,96 раза соответственно по сравнению с контролем.
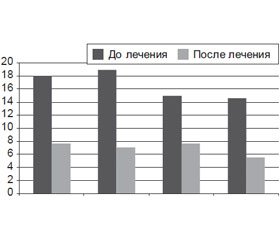
После лечения уровни провоспалительных цитокинов достоверно снижались по сравнению с исходными значениями (ИЛ‑2 — до 8,17 ± 2,05 пг/мл, ИЛ‑6 — до 7,64 ± 2,69 пг/мл, р < 0,05 в обоих случаях), что указывает на значительное затихание патологического процесса (рис. 2). При этом содержание ИЛ‑6 уже достоверно не отличалось от контроля (р > 0,1), ИЛ‑2 — еще оставалось достоверно повышенным — в 1,91 раза (р < 0,05).
Содержание противовоспалительного цитокина ИЛ‑10 в процессе лечения АГ с ожирением снижалось почти вдвое (до 7,65 ± 2,62 пг/мл, р < 0,05), иногда достигая значений контрольной группы, и в целом уже достоверно не отличалось от контроля (p > 0,1). После лечения также снижался уровень СРБ (до 5,52 ± 2,43 мг/л, р < 0,05 по сравнению с исходными данными) и тоже уже статистически не отличался от контроля (р > 0,1).
После проведенной терапии отмечено снижение уровня ИЛ‑6 у 75 % обследованных и уровня ИЛ‑2 у 65 % пациентов с коротким анамнезом болезни. Полное восстановление баланса провоспалительных и противовоспалительного цитокинов при анамнезе болезни до 5 лет имело место в трети случаев, а при продолжительности болезни более 5 лет — только у 25 % пациентов (в течение первых двух недель терапии).
Обсуждение
Обсуждая полученные данные, следует отметить, что ИЛ‑6 является ранним индуцибельным цитокином, быстро накапливается в циркуляции при патологии. Он играет ключевую роль в воспалении, осуществляя провоспалительное действие за счет активации молекул адгезии на эндотелии и хемотаксиса лейкоцитов, повышении проницаемости сосудов, усилении функциональной активности фибробластов, активации острофазового ответа путем индукции синтеза в печени СРБ, сывороточного амилоида А и фибриногена [11–13].
В качестве основного противовоспалительного цитокина ИЛ‑10 подавляет секрецию провоспалительных цитокинов. Он подавляет активность макрофагов: представление антигенов, процесс фагоцитоза. ИЛ‑10 блокирует выброс различных хемокинов нейтрофилов, а также активацию циклооксигеназы‑2 и синтез простагландина Е2 [14].
С другой стороны, резкое усиление продукции ИЛ‑10 ведет к снижению активности противоинфекционной защиты, развитию хронического и неблагоприятного течения воспаления. При этом происходит угнетение антиген- и цитотоксической функции макрофагов. Поэтому считается, что гиперпродукция ИЛ‑10 является одним из существенных дефектов цитокиновой сетки, которая приводит к смещению акцента иммунной реакции в сторону антителообразования [15, 16].
Кроме того, гиперпродукция ИЛ‑10 при воспалении приводит к резкому нарастанию концентрации кислородных радикалов и оксида азота, усиливая интоксикацию [17]. В то же время, являясь одним из самых сильных ингибиторов синтеза ИЛ‑6, ИЛ‑10 производится только в присутствии последнего [18, 19]. Поэтому динамика содержания ИЛ‑10 определяется изменениями уровня ИЛ‑6 в крови и является фактором защиты от чрезвычайной активации процессов пероксидации.
То, что после лечения содержание провоспалительного ИЛ‑2 еще остается повышенным, отражает тот факт, что речь идет о хроническом воспалении, при обострении которого терапия приводит к ремиссии, но сам процесс продолжается.
Повышенный уровень СРБ, возможно, является маркером увеличения образования интерлейкинов‑2, 6 и 10 (провоспалительных и противовоспалительных цитокинов), которые обладают многими свойствами. Кроме того, СРБ самостоятельно активирует моноциты, стимулируя образование тканевых факторов, вызывает выброс интерлейкинов моноцитами и эндотелиальными клетками. Конкретные механизмы возникновения воспалительной реакции остаются только приблизительными и связаны с процессами атерогенеза, окислением липопротеидов низкой плотности или влиянием и персистированием инфекции, механическими свойствами миокарда, его нагрузкой, что приводит к хронической активации цитокинового звена воспаления [20].
B целом по мере повышения продолжительности заболевания изменения маркеров воспаления были менее выраженными. Такие результаты исследования, по нашему мнению, свидетельствуют о более глубоких иммунологических и, возможно, структурных нарушениях в организме, при длительном анамнезе болезни.
У больных с АГ и ожирением в ряде случаев наблюдались значительные индивидуальные колебания иммунологических показателей, что может быть связано с особенностями клинического течения заболевания. В связи с этим необходимо дальнейшее накопление данных для проведения клинико-иммунологических сопоставлений при различных стадиях патологического процесса, формах, сопутствующих заболеваниях и для определения иммунологических критериев, которые объективизируют тактику лечения больных.
Выводы
1. Для больных с артериальной гипертензией и ожирением характерно существенное повышение в крови уровня интерлейкинов‑2, 6, 10 и С-реактивного белка. При этом в большей степени возрастают уровни провоспалительных цитокинов, чем противовоспалительного.
2. По мере повышения продолжительности заболевания артериальной гипертензией с ожирением по уровням исследуемых цитокинов и С-реактивного белка воспалительный процесс становится менее выраженным, что может свидетельствовать о более глубоких иммунологических нарушениях при длительном анамнезе болезни.
3. После стандартной терапии повышенные исходные концентрации цитокинов и С-реактивного белка в крови значительно снижаются, так что достоверно не отличаются от контроля, кроме уровня интерлейкина-2.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов при подготовке статьи.
Список литературы
1. Дружилов М.А. Ожирение как фактор сердечно-сосудистого риска: акцент на качество и функциональную активность жировой ткани / М.А. Дружилов, О.Ю. Дружилова, Ю.Е. Бетелева, Т.Ю. Кузнецова // Российский кардиологический журнал. — 2015. — № 4(120). — С. 111-117. DOI: 10.15829/1560-4071-2015-04-111-117.
2. Біловол О.М. Ожиріння в практиці кардіолога та ендокринолога / О.М. Біловол, О.М. Ковальова, С.С. Попова, О.Б. Тверетинов. — Тернопіль: Укрмедкнига, 2009. — 301 с.
3. Гусев Е.Ю. Системное воспаление: теоретические и методологические подходы к описанию модели общепатологического процесса. Часть 4. Динамика процесса / Е.Ю. Гусев, В.А. Черешнев // Патологическая физиология и экспериментальная терапия. — 2014. — Т. 58, № 4. — С. 4-16.
4. Zhang C. The role of inflammatory cytokines in endothelial –dysfunction / C. Zhang // Basic Res. Cardiol. — 2008. — Vol. 103(5). — Р. 398-406. DOI: 10.1007/s00395-008-0733-0.
5. Симоненко В.Б. Агрегационная функция тромбоцитов у лиц с артериальной гипертонией и абдоминальным oжирением / В.Б. Симоненко, И.Н. Медведєв, Т.Ю. Носова // Клиническая медицина. — 2008. — № 5. — С. 22-24.
6. Helmersson-Karlqvist J. 24-hour ambulatory blood pressure associates inversely with prostaglandin F (2α), interleukin‑6 and F(2)-isoprostane formation in a Swedish population of older men / J. Helmersson-Karlqvist, K. Björklund-Bodegård, A. Larsson, S. Basu // Int. J. Clin. Exp. Med. — 2012. — Vol. 5(2). — Р. 145-53. PMID: 22567175; PMCID: PMC3342711.
7. Levi M. Inflammation and coagulation / M. Levi, T. van der Poll // Crit. Care Med. — 2010. — Vol. 38. — P. 26-34. PMID: 20083910; DOI: 10.1097/CCM.0b013e3181c98d21.
8. Тузанкина И.А. К вопросу о диагностике иммунопатологии / И.А. Тузанкина // Медицинская иммунология. — 2010. — № 6. — С. 485-496. DOI: http://dx.doi.org/10.15789/1563-0625-2010-6-485-496
9. Beghdali W. Mast cell as cellular sensors in inflammation and immunity / W. Beghdali, L.C. Madjene, M. Benhamou // Front. Immunol. — 2011. — Vol. 2. — P. 37-52. PMCID: PMC3342044; DOI: 10.3389/fimmu.2011.00037.
10. George Cr. From Fahrenheit to cytokines: fever, inflammation and the kidney / Сr. George // J. Nephrol. — 2006. — Vol. 19 (Suppl. 10). — P. 88-97. PMID: 16874719.
11. С-реактивный белок при острой соматической боли / В.Г. Овсянников, А.Е. Бойченко, М.В. Бликян [и др.] // Цитокины и воспаление. — 2013. — № 1. — С. 22-25.
12. Cross-regulation of cytokine signalling: pro-inflammatory cytokines restrict IL‑6 signalling through receptor internalisation and degradation / S. Radtke, S. Waller, X. Yang [et al.] // J. Cell. Sci. — 2010. — Vol. 13, № 6. — P. 947-959. DOI: 10.1242/jcs.065326.
13. Kishimoto T. Interleukin‑6: discovery of a pleiotropic cytokine / T. Kishimoto // Arthritis Res. Ther. — 2006. — Vol. 8, Suppl. 2. — P. 2-14. PMID: 16899106; PMCID: PMC3226075; DOI: 10.1186/ar1916.
14. Кетлинский С.А. Цитокины / А.С. Кетлинский, А.С. Симбирцев. — СПб.: Фолиант, 2008. — 408 с.
15. Серебренникова С.Н. Роль цитокинов в воспалительном процессе / С.Н. Серебренникова, И.Ж. Семинский // Сибирский медицинский журнал. — 2008. — № 6. — С. 5-8.
16. Черешнева М.В. Иммунопатологические механизмы локального воспаления / М.В. Черешнева, В.А. Черешнев // Медицинская иммунология. — 2011. — № 6. — С. 557-568.
17. Маркелова Е.В. Патогенетическая роль нарушений в системе цитокинов при инфекционно-воспалительных заболеваниях / Е.В. Маркелова, А.В. Костюшко, В.Е. Красников // Тихоокеанский медицинский журнал. — 2008. — № 3. — С. 24-29.
18. Мухутдинова Ф.И. Цитокины лимфы и крови при лихорадке различной степени выраженности / Ф.И. Мухутдинова, И.Г. Мустафин, Р.Х. Хафизьянова // Бюллетень экспериментальной биологии и медицины. — 2012. — Т. 153, № 4. — С. 438-440.
19. Mast cells and inflammation / T.C. Theoharides, K.D. Alysandratos, A. Angelidou [et.al.] // Biochim. Biophys. Acta. — 2012. — Vol. 1822, № 1. — P. 21-33. PMID: 21185371; PMCID: PMC3318920; DOI: 10.1016/j.bbadis.2010.12.014.
20. Coupling of FcγRI to FcγRIIB by Src Kinase Mediates C-reactive Protein Impairment of Endothelial Function / N.C. Sandgren, W. Zhu, I.S. Yuhanna [et al.] // Circ. Res. — 2011. — Vol. 109, № 10. — P. 1132-1140. DOI: 10.1161/CIRCRESAHA.111.254573.

/40-44/42-1.jpg)
/40-44/42-2.jpg)