Статтю опубліковано на с. 29-34
Синдром гиперандрогении — патологическое состояние, обусловленное избыточной продукцией андрогенов яичниками и/или надпочечниками или повышением локальной тканевой чувствительности к циркулирующим андрогенам. Это наиболее частая эндокринопатия у женщин. Распространенность гиперандрогений среди женщин составляет 10–20 %. Важность своевременной диагностики гиперандрогенных состояний обусловлена их последствиями: нарушениями менструального цикла, эндокринным бесплодием, повышением риска невынашивания беременности, преждевременных родов, гестационного диабета.
Согласно классификации выделяют следующие формы гиперандрогенных состояний [1]:
I. Неопухолевые (функциональные) формы истинной гиперандрогении:
— синдром поликистозных яичников;
— стромальный текоматоз яичников, гипертекоз;
— врожденная дисфункция коры надпочечников (классическая и неклассическая форма);
— гиперпролактинемия;
— гиперкортицизм (болезнь и синдром Иценко — Кушинга);
— акромегалия.
II. Опухолевые формы истинной гиперандрогении:
— андрогенпродуцирующие опухоли яичников (андробластомы, текомы, липидоклеточные опухоли и др.);
— андрогенпродуцирующие опухоли надпочечников (андростеромы, кортикоандростеромы).
III. Транспортные формы гиперандрогении (в результате снижения продукции в печени глобулина, связывающего половые стероиды):
— гепатиты, цирроз;
— гипотиреоз;
— гипоэстрогения;
— прием экзогенных андрогенов, анаболических стероидов, глюкокортикоидов.
IV. Рецепторная форма гиперандрогении (обусловлена повышением активности 5α-редуктазы в клетках-мишенях):
— наследственно-конституциональная (генетическая) форма;
— изменение активности 5α-редуктазной системы под влиянием внешних факторов.
К гиперандрогенным состояниям надпочечникового генеза относят андрогенпродуцирующие опухоли надпочечников, синдром Кушинга, врожденную дисфункцию коры надпочечников. Наиболее быстрого реагирования со стороны врача требуют андрогенпродуцирующие опухоли надпочечников (андростеромы, кортикоандростеромы). Данная патология характеризуется внезапным началом и быстрым прогрессированием симптомов гиперандрогении. Отмечается резкое повышение концентрации андрогенов: ДГЭА-С (чаще > 700 мкг/дл), тестостерона, что требует исключения андрогенпродуцирующей опухоли надпочечников [2]. С этой целью проводят компьютерную томографию (КТ) надпочечных желез.
Врожденная дисфункция коры надпочечников (ВДКН) (врожденная гиперплазия коры надпочечных желез, адреногенитальный синдром) — группа заболеваний с аутосомно-рецессивным типом наследования, в основе которых лежит дефект одного из ферментов или транспортных белков, которые принимают участие в биосинтезе кортизола в коре надпочечников [3]. В результате действия этиологического фактора (дефект фермента или транспортного белка) синтезируется недостаточное количество кортизола. По принципу отрицательной обратной связи повышается секреция адренокортикотропного гормона (АКТГ), что приводит к гиперплазии коры надпочечных желез и накоплению метаболитов, предшествующих дефекту [3, 4]. Общая схема биосинтеза гормонов в надпочечниках представлена на рис. 1.
Согласно систематизации заболеваний коры надпочечных желез различают 7 форм ВДКН [5]:
1. Дефицит 21-гидроксилазы.
2. Дефицит 11β-гидроксилазы.
3. Дефицит 17α-гидроксилазы, что часто сочетается с недостаточностью 17,20-лиазы.
4. Дефицит 3β-гидроксистероиддегидрогеназы.
5. Дефицит оксидоредуктазы.
6. Дефицит 20,22-десмолазы (11α-гидроксилазы).
7. Липоидная гиперплазия коры надпочечников (мутация гена, кодирующего белок StAR-протеина).
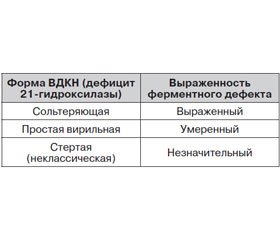
90–95 % всех ферментных дефектов при ВДКН составляет дефицит 21-гидроксилазы, и в зависимости от степени выраженности ферментного дефекта различают 3 формы данной патологии (табл. 1) [3].
ВДКН преимущественно диагностируется в детском возрасте. Но необходимость диагностики дефицита 21-гидроксилазы в репродуктивном возрасте не исключается. Диагностика предусматривает:
— анализ клинических проявлений;
— лабораторные исследования: маркером дефицита 21-гидроксилазы является уровень 17-ОНР;
— инструментальные обследования: УЗИ органов малого таза, КТ надпочечников (при необходимости);
— молекулярно-генетическое исследование (анализ гена CYP21).
При установленном диагнозе ВДКН назначается лечение, включающее назначение препаратов глюкокортикоидов (ГК) и при минералокортикоидной недостаточности — минералокортикоидов (МК). Среди ГК препарат выбора — гидрокортизон 10–15 мг/м2/сут в 3 приема через равные промежутки времени. Возможно назначение преднизолона 2–4 мг/м2/сут ранним утром или в 2 приема — 2/3 утром и 1/3 перед сном, дексаметазона 0,25–0,35 мг/м2/сут в один прием вечером. Минералокортикоидную недостаточность восполняет флудрокортизон 0,05–0,3 мг/сут в 1–2 приема, досаливание пищи.
Цели лечения ВДКН:
— ликвидация дефицита стероидов, секреция которых недостаточна, и снижение уровня стероидов, секреция которых повышена в результате ферментного дефекта. При этом используются минимально эффективные дозы ГК;
— обеспечение нормальной фертильности и профилактика осложнений во время беременности;
— предупреждение развития острой недостаточности надпочечных желез (адреналового криза).
Эффективность лечения ВДКН можно оценить только по регрессии клинической симптоматики. Кратность наблюдения пациенток — 1 раз в 3–6 мес. Учитывая риск развития метаболических нарушений, контролируем вес, артериальное давление. Общепринятых рекомендаций по лабораторной оценке эффективности терапии у взрослых пациентов с ВДКН нет. Оптимальные уровни 17-ОНР не определены [6]. Для подбора дозы флудрокортизона определяют ренин (при недостаточной дозе флудрокортизона уровень ренина в крови повышен).
При отсутствии адекватной компенсации ВДКН у женщин возможно нарушение менструального цикла (от олигоменореи до аменореи), снижение фертильности, склерокистоз яичников (до 74 %). Врожденная дисфункция коры надпочечников — одна из причин ранней потери беременности и рецидивных самопроизвольных абортов [5]. Частота невынашивания беременности при данной патологии — до 26 %. Риск рождения детей с ВДКН у женщин с дефицитом 21-гидроксилазы: с классической формой ≈ 2,5 %, с неклассической формой — не менее 15 % [7].
Принципы ведения беременных с ВДКН следующие [6]:
1. Лечение индивидуальное. Терапия ГК (важен выбор препарата) и МК продолжается в той же дозе. Коррекция дозы необходима при наличии признаков недостаточности (постуральная гипотензия и др.). Во время схваток — стрессовые дозы ГК (исследований по оптимальной дозировке нет).
2. Лабораторные исследования: 17-ОНР, андрогены, кортизол не контролируют при нормальной беременности, поскольку уровни данных гормонов повышены у беременных. Контроль лечения плода с ВДКН осуществляется по уровню тестостерона у матери.
Для пациенток с ВДКН оптимальным вариантом является пренатальная диагностика (определение наличия мутаций в гене, ответственном за развитие врожденной дисфункции коры надпочечников), проведение которой возможно только с 10-й нед. беременности.
В последнее время у подростков и взрослых все чаще диагностируют позднюю (неклассическую — НК-ВДКН) форму ВДКН. Частота НК-ВДКН (в результате дефекта 21-гидроксилазы) в общей популяции составляет 0,3–3,7 % [1], у женщин с признаками гиперандрогении — 1,5–6,8 % [8].
Клиническими проявлениями, требующими исключения НК-ВДКН у женщин репродуктивного возраста, являются:
— признаки андрогензависимой дерматопатии: гирсутизм (по шкале Ферримана — Голлвея 8 баллов и больше), алопеция, асnе vulgaris, повышенная сальность кожи);
— нарушения овариально-менструального цикла;
— склерокистоз яичников;
— нарушения репродуктивной функции (хроническое невынашивание, преждевременные роды, бесплодие).
Дифференциальная диагностика ВДКН, в том числе и НК-ВДКН, подразумевает исключение различных форм гиперандрогений и включает в первую очередь лабораторное обследование. Маркером дефицита 21-гидроксилазы является 17-ОНР. Исследование базального уровня 17-ОНР проводят ранним утром, в фолликулярную фазу [6]. Уровень 17-ОНР ниже 2 нг/мл позволяет исключить ВДКН, при этом не исключается вероятность гетерозиготного носительства. Уровень 17-ОНР > 100 нг/мл подтверждает наличие у пациентки дефицита 21-гидроксилазы. Уровень 17-ОНР от 2 до 100 нг/мл требует исключения НК-ВДКН.
Золотым стандартом в диагностике НК-ВДКН является тест с синактеном (250 мкг) [6]. Методика проведения данного теста следующая: определение базальных уровней 17-ОНР и кортизола утром (в интервале 8.00–9.00), затем внутривенное введение синактена (250 мкг) и определение уровней 17-ОНР и кортизола через 30 и 60 мин после стимуляции. Возможно проведение теста с синактен-депо (1 мг). Методика проведения: в 21–22 часа в/м вводят 1 мг синактен-депо, затем определяют уровни 17-ОНР и кортизола через 10–12 часов и 24 часа.
Интерпретация теста с синактеном (стимулированного уровня 17-ОНР) следующая: уровень 17-ОНР ≤ 10 нг/мл позволяет исключить ВДКН, но при этом есть вероятность гетерозиготного носительства; при выявлении уровня
17-ОНР > 100 нг/мл дефицит 21-гидроксилазы подтверждается; уровень 17-ОНР от 10 до 100 нг/мл свидетельствует о наличии у пациентки НК-ВДКН.
При сомнительных результатах пробы с синактеном (в качестве второго этапа) или при необходимости семейного генетического тестирования проводится молекулярно-генетический анализ. Изначально осуществляется поиск частых мутаций в гене CYP21. Выявление двух мутаций позволяет поставить диагноз (табл. 2). При обнаружении одной мутации проводится полное секвенирование гена CYP21 [5, 9].
Выявление у пациентки НК-ВДКН не всегда предполагает медикаментозное лечение. При сохраненном овуляторном и менструальном цикле и нормальной репродуктивной функции применяется тактика терапевтического нигилизма.
Показаниями к назначению ГК являются нарушения менструального цикла, бесплодие, выраженный гирсутизм. То есть цель лечения — коррекция выраженных проявлений гиперандрогении.
У пациенток с доказанным диагнозом НК-ВДКН при наличии ановуляторного бесплодия и привычного невынашивания беременности препараты ГК назначаются при планировании беременности и в I триместре, поскольку в 12 недель срабатывает защитная роль плацентарной ароматазы [6]. Используемые препараты ГК: гидрокортизон 15–20 мг/сут в 3 приема через равные промежутки, преднизолон 2,5–5 мг/сут ранним утром или в 2 приема — 2/3 утром и 1/3 перед сном, метилпреднизолон 2–4 мг/сут ранним утром или в 2 приема — 2/3 утром и 1/3 перед сном. Дексаметазон, обладающий способностью преодолевать плацентарный барьер, используется для лечения классической ВДКН у плода. Цель лечения — предотвращение гиперплазии надпочечников и вирилизации наружных половых органов у плода с женским генотипом. Контроль лечения — уровень тестостерона у матери.
Использование 17-ОНР в качестве критерия эффективности лечения у пациенток с НК-ВДКН (до беременности) не представляется возможным. Данный показатель не всегда отражает адекватность выбранной дозы препарата. У многих пациенток уровень 17-ОНР сохраняется повышенным даже при больших дозах ГК [6]. Важным при оценке эффективности лечения у таких пациенток является регресс симптомов гиперандрогении: нормализация менструального цикла, восстановление овуляции (как правило, через 3–4 мес.), наступление беременности, коррекция дерматологических проявлений. В дальнейшем возможна комбинация ГК со стимуляторами овуляции.
У пациенток с НК-ВДКН без ановуляторного бесплодия, но с выраженным гирсутизмом возможно лечение с целью коррекции дерматологических проявлений в течение всей беременности [6]. При этом назначаются глюкокортикоиды, не преодолевающие плацентарный барьер. Гидрокортизон, преднизолон, метилпреднизолон не преодолевают плацентарный барьер и не угро–жают подавлением функции коры надпочечников у здорового плода.
У пациенток с ВДКН (классической и неклассической формой) во время беременности обязательно необходимо учитывать возможность развития метаболических нарушений: гестационного диабета, артериальной гипертензии, нефропатии [10].
Возможной причиной гиперандрогении у женщин может быть синдром Кушинга — симптомокомплекс, обусловленный избыточной эндогенной продукцией кортикостероидов. Согласно классификации синдром Кушинга разделяют на АКТГ-зависимый и АКТГ-независимый. Наиболее частая причина АКТГ-зависимого гиперкортицизма — кортикотропинома гипофиза, реже встречается эктопированная опухоль, продуцирующая АКТГ (овсяноклеточный рак легкого, карциноид бронхов, тимуса, поджелудочной железы), и эктопическая продукция кортиколиберина. АКТГ-независимый синдром Кушинга возникает в результате избыточной выработки кортизола надпочечниками (при опухолях, макро- или микронодулярной надпочечниковой гиперплазии).
У женщин патология половой функции в виде нарушения менструального цикла, вплоть до аменореи и бесплодия, снижение либидо, гирсутизм являются ранними проявлениями синдрома Кушинга. Кроме того, для больных с синдромом Кушинга характерно выраженное диспластическое ожирение с преимущественным отложением жира в области плечевого пояса, передней брюшной стенки, лица; истончение конечностей за счет проксимальных амиотрофий. Кожа сухая, тонкая, со сниженным тургором, множественные широкие синюшно-багровые стрии. Характерно развитие остеопороза, нарушений углеводного обмена (от преходящей гипергликемии до стероидного диабета). Но клинически явные варианты болезни и синдрома Кушинга встречаются нечасто: 1–10 случаев на 1 млн населения в год. Чаще встречаются субклинические формы синдрома Кушинга — около 8 случаев на 10 000 населения [11]. Для своевременной диагностики субклинических форм синдрома Кушинга необходимо учитывать физиологические и патофизиологические особенности обмена кортизола.
Большая часть кортизола связана с белками (кортизолсвязывающий глобулин, транскортин, альбумин), что обеспечивает потерю биологической активности гормона. Свободный кортизол (его активная фракция) составляет только 1–2 %. Секреция кортизола в норме подвержена суточному ритму: максимальный уровень — утром, минимальный — ночью. У пациентов с синдромом Кушинга циркадный ритм кортизола нарушен: содержание гормона в плазме крови утром в большинстве случаев остается нормальным, а ночью повышается [12]. Поэтому принципиально важен выбор метода лабораторной диагностики. Использование в диагностике синдрома Кушинга определения уровня АКТГ не всегда результативно, поскольку при опухолях надпочечников секреция кортизола — АКТГ-независимая [13].
Скрининговыми тестами для диагностики синдрома Кушинга являются: дексаметазоновый (1 мг) супрессивный тест, определение суточной экскреции кортизола с мочой, ночное определение кортизола в слюне [14, 15].
В основе ночного супрессивного теста с 1 мг дексаметазона — подавление секреции АКТГ с последующим снижением продукции кортизола. Для проведения данного исследования не требуется предварительной подготовки пациента, и возможно амбулаторное проведение теста. Но важна своевременность приема пациентом дексаметазона. Методика проведения теста следующая: пациент принимает 1 мг дексаметазона в 23.00, в 8–9 часов на следующее утро осуществляется забор крови для исследования уровня кортизола. Синдром Кушинга можно заподозрить при уровне кортизола крови > 1,8 мкг/дл (50 нмоль/л).
При определении экскреции кортизола с суточной мочой важно учитывать, что у 9 % пациентов с гиперкортицизмом как минимум один результат может быть в пределах нормы, поэтому при однократном исследовании возможно получение ложноотрицательного результата.
Наиболее эффективным тестом для диагностики синдрома Кушинга является ночное определение кортизола в слюне, позволяющее оценить концентрацию свободного (биологически активного) гормона, при этом исключить влияние на результат циркадного ритма кортизола. Это единственное исследование, использование которого возможно для диагностики эндогенного гиперкортицизма у беременных.
Исследование кортизола в слюне имеет ряд преимуществ: безболезненность и неинвазивность методики, отсутствие фармакологического вмешательства и необходимости госпитализации пациентки, исключается участие среднего медперсонала. Правила сбора образцов следующие: за 30 мин до сбора слюны не принимать пищу, не пить, не курить, не чистить зубы, за сутки исключить употребление спиртных напитков, избегать образцов, контаминированных кровью (даже слегка красные образцы), исключить попадание частиц губной помады.
При выборе теста для диагностики синдрома Кушинга необходимо учитывать чувствительность и специфичность исследования (табл. 3), а также возможность получения ложноположительных и ложноотрицательных результатов (табл. 4).
С учетом высокой вариабельности физиологической секреции кортизола и ограничений всех существующих тестов в настоящее время для подтверждения или исключения синдрома Кушинга рекомендуется использование как минимум двух тестов (малая проба с дексаметазоном и ночной кортизол в слюне). Комбинация этих исследований позволяет повысить чувствительность методик до 100 %, а специфичность — до 97,4 % [15].
При лабораторном подтверждении гиперсекреции кортизола необходимо дальнейшее инструментальное обследование пациентки (КТ надпочечников, магнитно-резонансная томография гипофиза и др.) с целью выяснения генеза гиперкортицизма.
Таким образом, дифференциальная диагностика гиперандрогенных состояний включает ряд лабораторных и инструментальных исследований, позволяющих исключить или подтвердить надпочечниковый генез гиперандрогений.
Тесты, рекомендованные «Синэво»
2069 17-α-оксипрогестерон (17-OHP)
2214 Кортизол (слюна)

/29-34/29-1.jpg)
/29-34/30-2.jpg)
/29-34/30-1.jpg)
/29-34/32-1.jpg)
/29-34/33-1.jpg)