Резюме
Одним із побічних ефектів інгібіторів протонної помпи, описаних в останнє десятиліття, є потенційний негативний вплив на кісткову тканину з розвитком остеопорозу і наступних переломів кісток. В оглядовій статті наведені останні дані щодо взаємозв’язку між тривалим прийомом інгібіторів протонної помпи і підвищеним ризиком переломів кісток. На сьогодні три великих дослідження «випадок — контроль» і одне ретроспективне когортне дослідження продемонстрували, що терапія інгібіторами протонної помпи підвищує відносний ризик переломів від 1,15 (95% довірчий інтервал (ДІ) 1,10–1,20) до 1,92 (95% ДІ 1,16–3,18); ризики їх розвитку були пов’язані з дозою препаратів і тривалістю впливу. Останні дані зміцнили існуючі докази щодо впливу інгібіторів протонної помпи на розвиток остеопорозу. Отже, тривалий прийом інгібіторів протонної помпи визнаний незалежним чинником ризику остеопоротичних переломів. Підвищення ризику переломів виникає при тривалому (більше 1 року) і високодозовому застосуванні цих препаратів. Однак механізми такого впливу залишаються неясними і продовжують інтенсивно вивчатися. Прямий вплив на всмоктування кальцію або на функцію остеобластів чи остеокластів не може водночас правдоподібно пояснити механізм. Одним із механізмів порушення кісткового метаболізму при тривалому лікуванні інгібіторами протонної помпи у високих дозах може бути пригнічення активності вакуольної Н+-АТФази. При цьому можуть постраждати такі найважливіші функції, як фагоцитарна активність лейкоцитів, кісткова резорбція і ацидифікація сечі. Ще одним гіпотетичним механізмом розвитку остеопорозу і переломів може бути порушення всмоктування вітаміну В12, заліза, магнію і кальцію при тривалому прийомі інгібіторів протонної помпи, що формує мінеральну недостатність. Передбачається також, що використання інгібіторів протонної помпи здатне впливати і на ефективність протиостеопоротичної терапії, зокрема, бісфосфонатів, знижуючи ефективність їх антипереломної дії. Ці дані свідчать про те, що лікарям, ймовірно, слід уникати поєднання інгібіторів протонної помпи і пероральних бісфосфонатів. За наявності патології верхнього поверху шлунково-кишкового тракту або високого ризику розвитку езофагіту перевагу слід надавати парентеральним антирезорбтивним препаратам (ібандронат, золедронат, деносумаб). Зв’язок між використанням інгібіторів протонної помпи і остеопоротичними переломами на сьогодні встановлений, хоча механізми цієї асоціації в повному обсязі незрозумілі. Також поки незрозуміло, чи можуть добавки кальцію і вітаміну D зменшити цей ризик. І хоча підвищений ризик переломів є досить скромним, необхідно пам’ятати, що при тривалій і високодозовій терапії інгібіторами протонної помпи можливий розвиток переломів кісток, особливо у пацієнтів, які вже мають додаткові фактори ризику. Наведені дослідження акцентують увагу на необхідності чітких показань до прийому даного класу препаратів, оскільки їх тривалий безконтрольний прийом може призвести до появи побічних ефектів, в тому числі остеопорозу й остеопоротичних
переломів.
Одним из побочных эффектов ингибиторов протонной помпы, описанных в последнее десятилетие, является потенциальное негативное воздействие на костную ткань с развитием остеопороза и последующих переломов костей. В обзорной статье представлены последние данные о наличие взаимосвязи между длительным приемом ингибиторов протонной помпы и повышенным риском переломов костей. На сегодняшний день три больших исследования «случай — контроль» и одно ретроспективное когортное исследование продемонстрировали, что терапия ингибиторами протонной помпы повышает относительный риск переломов от 1,15 (95% доверительный интервал (ДИ) 1,10–1,20) до 1,92 (95% ДИ 1,16–3,18); риски их развития были связаны с дозой препаратов и длительностью воздействия. Последние данные укрепили существующие доказательства влияния ингибиторов протонной помпы на развитие остеопороза. Таким образом, длительный прием ингибиторов протонной помпы признан независимым фактором риска остеопоротических переломов. Повышение риска переломов возникает при длительном (более 1 года) и высокодозовом применении этих препаратов. Однако механизмы такого влияния остаются неясными и продолжают интенсивно изучаться. Прямое воздействие на всасывание кальция или на функцию остео-бластов или остеокластов не может в настоящее время правдоподобно объяснить механизм. Одним из механизмов нарушения костного метаболизма при длительном и высокодозовом лечении ингибиторами протонной помпы может быть подавление активности вакуольной Н+-АТФазы. При этом могут пострадать такие важнейшие функции, как фагоцитарная активность лейкоцитов, костная резорбция и ацидификация мочи. Еще одним гипотетическим механизмом развития остеопороза и переломов может быть нарушение всасывания витамина В12, железа, магния и кальция при длительном приеме ингибиторов протонной помпы, что формирует минеральную недостаточность. Предполагается также, что использование ингибиторов протонной помпы способно влиять и на эффективность противоостеопоротической терапии, в частности, бисфосфонатов, снижая эффективность их антипереломного действия. Эти данные свидетельствуют о том, что врачам, вероятно, следует избегать сочетания ингибиторов протонной помпы и пероральных бисфосфонатов. При исходной патологии верхнего этажа желудочно-кишечного тракта или высокого риска развития эзофагита предпочтение следует отдать парентеральным антирезорбтивным препаратам (ибандронат, золедронат, деносумаб). Связь между приемом ингибиторами протонной помпы и остеопоротическими переломами на сегодняшний день установлена, хотя механизмы этой ассоциации не полностью понятны. Также пока непонятно, могут ли добавки кальция и витамина D уменьшить этот риск. И хотя повышенный риск переломов является достаточно скромным, необходимо помнить, что при длительной и высокодозовой терапии ингибиторами протонной помпы возможно развитие переломов костей, особенно у пациентов, которые уже имеют дополнительные факторы риска. Приведенные исследования акцентируют внимание на необходимости четких показаний к приему данного класса препаратов, поскольку их длительный бесконтрольный прием может способствовать проявлению побочных эффектов, в том числе остеопороза и остеопоротических переломов.
The potential negative impact on the bone with the development of osteoporosis and subsequent bone fractures is one of side effects of proton pump inhibitors administration which has been much discussed for the last decade. This review covers the latest data on the relationship between the prolonged use of proton pump inhibitors and increased risk of bone fractures. To date, three large case-control studies and one retrospective cohort study demonstrated that proton pump inhibitors treatment increases the relative risk of fractures from 1.15 (95% CI 1.10–1.20) to 1.92 (95% CI 1.16–3.18); risk of the side effect development was related to drug dose (rate of administration) and duration of exposure. New studies have further proved the existing evidence linking the use of proton pump inhibitors to development of osteoporosis. Thus, long-term use of proton pump inhibitors is recognized as an independent risk factor for osteoporotic fractures. Prolonged (more than 1 year) and high rate of administration of those drugs often results in the increased risk of fracture. However, the mechanisms of the influence remain unclear and are being studied intensively. The direct effect on the absorption of calcium or osteoblast or osteoclast function does not explain the mechanism of the effect. Suppression of the activity of vacuolar H+-ATPase during long-term treatment by high dose of proton pump inhibitors can be one of the disorders of bone metabolism mechanisms. In similar cases, such vital functions as phagocytic activity of white blood cells, bone resorption and acidification of urine can be affected. Malabsorption of vitamin B12, iron, magnesium and calcium caused by prolonged administration of proton pump inhibitors and leading to mineral deficiency might be another mechanism of osteoporosis and fractures. It is also assumed that the use of proton pump inhibitors can impede the efficiency of antiosteoporotic therapy, in particular effect of bisphosphonates thus, reducing the effectiveness of their antifracturing action. These findings suggest that physicians should better avoid the combination of proton pump inhibitors and oral bisphosphonates. Parenteral antiresorptive agents (ibandronate, zoledronic acid or denosumab) are preferable in cases of the initial pathology of the upper floors of the gastrointestinal tract or high risk for esophagitis. Currently, interaction between the intake of proton pump inhibitors and osteoporotic fractures has been identified, although the mechanisms of this association are not fully understood. Whether calcium supplements and vitamin D may reduce the risk of fractures is still unclear as well. Although an increased probability of fractures is not very high, there exists the risk of bone fractures, especially in patients who already have additional risk factors under the long and high rate of administration of proton pump inhibitors. Current studies emphasize the need for clear evidence to support this class of medicines prescription, since their long uncontrolled intake may contribute to the development of side effects, including osteoporosis and osteoporotic fractures.
Статтю опубліковано на с. 89-97
Введение
Ингибиторы протонной помпы (ИПП) — хорошо известный и распространенный класс препаратов, широко используемый в терапии кислотозависимых состояний. Широкое использование ИПП позволило существенно улучшить качество жизни людей, страдающих гастроэзофагеальной рефлюксной болезнью (ГЭРБ), эффективно лечить и предупреждать ее опасные осложнения — развитие эрозий, язв, кровотечения и стриктуры пищевода. ИПП рассматриваются сегодня большинством ведущих экспертов и практикующих врачей как единственное приемлемое средство для лечения и профилактики осложнений, связанных с приемом нестероидных противовоспалительных препаратов (НПВП), а также антиагрегантных средств, используемых для предупреждения сосудистых тромбозов [1].
Главные достоинства ИПП, определяющие их популярность (помимо хорошо доказанной, не вызывающей сомнений эффективности), — удобство применения и отличная переносимость. Однако, несмотря на их простоту и доступность, длительное и бесконтрольное использование ИПП может иметь серьезные побочные эффекты. Прежде всего они связаны с потенциальным повышенным риском развития гипокальциемии и гипомагниемии, острой клостридиальной инфекцией (вызванной Clostridium difficile), тяжелыми нарушениями микробного равновесия, развитием пневмонии, негативным фармакологическим взаимодействием с рядом лекарственных препаратов, широко используемых в клинической практике, прежде всего с клопидогрелем и метотрексатом [28]. Побочные эффекты возникают при длительном использовании ИПП (хотя граничная и безопасная длительность терапии не определена) или же при высокодозовой терапии, затрагивают преимущественно определенные субпопуляции пациентов, восприимчивые к развитию данных побочных эффектов вследствие возраста, генетики, коморбидности или факторов окружающей среды (например, совместный прием медикаментов, курение или инфицированность Helicobacter pylori) и др. Рост описываемых побочных эффектов вызывает беспокойство в медицинской среде и способствует разработке рекомендаций и обучению специалистов по рациональному использованию ИПП в реальной клинической практике. Как оказалось, проблема заключается в класс-специфических осложнениях, связанных с основным фармакологическим действием ИПП, а именно — с ингибированием Н+К+-АТФазы (протонного насоса).
Основная часть и дискуссия
Одним из побочных эффектов, описанных в последнее десятилетие, является потенциальное негативное воздействие на костную ткань с развитием остеопороза и последующих переломов костей [3]. Так, сообщение о новом класс-специфическом побочном действии — повышении риска переломов бедра, запястья, позвоночника у пациентов старше 50 лет при приеме высоких доз ИПП более 1 года было опубликовано 25.05.2010 на сайте FDA [36]. Длительный прием ИПП признан независимым фактором риска остеопоротических переломов [3, 11, 38].
На сегодняшний день три больших исследования «случай — контроль» и одно ретроспективное когортное исследование продемонстрировали, что терапия ИПП повышает относительный риск переломов от 1,15 (95% доверительный интервал (ДИ) 1,10–1,20) до 1,92 (95% ДИ 1,16–3,18) [8, 35, 38, 39]; риски их развития были связаны с дозой препаратов и длительностью воздействия. В одном из исследований указывалось, что переломы возникли на фоне развития остеопороза и расценивались как остеопоротические. Однако в других исследованиях было уточнено, что терапия ИПП не ассоциируется с какими-либо заметными изменениями плотности костной ткани [20].
Одним из наиболее серьезных свидетельств реальности этой проблемы стало популяционное исследование, проведенное американскими учеными Y. Yang и соавт. [39]. Исследователи сравнили использование ИПП у 13 556 пациентов, перенесших остеопоротический перелом шейки бедренной кости, и 135 386 лиц, не имевших переломов. Согласно полученным данным, прием ИПП явно и достоверно ассоциировался с нарастанием частоты переломов — отношение шансов (OШ) 1,44 (95% ДИ 1,3–1,59). Использование высоких доз ИПП более 1 года резко увеличивало этот риск — OШ 2,65 (95% ДИ 1,8–3,9). Длительность приема также влияла на частоту переломов: при приеме ИПП до одного года OШ составило 1,22, при 4 годах и более — 1,59 (p < 0,001).
Более позднее исследование L. Targownik и соавт. [35], проведенное в Канаде (2008) и основанное на анализе 15 792 случаев остеопоротических переломов шейки бедра, лучевой кости и позвоночника (контроль — 47 289 лиц), продемонстрировало достаточно близкие результаты. Так, при длительности приема ИПП более 3 лет риск перелома шейки бедренной кости отчетливо нарастал: для 4 лет OШ составило 1,43, для 5 лет — 1,62, для 6 лет — 2,49 и для 7 лет — 4,55. В более поздней работе эти же авторы [33] отметили важную закономерность, которая могла серьезно повлиять на оценку действия ИПП у больных, страдающих остеопорозом. Проанализировав сведения из канадской базы данных, включающей информацию о 8340 пациентах, страдающих этим заболеванием, они пришли к выводу, что лица, принимавшие ИПП, исходно имели более низкую минеральную плотность костной ткани (МПКТ), чем пациенты, не получавшие этих препаратов. При этом через 5 и 10 лет наблюдения более быстрого прогрессирования снижения МПКТ у потребителей ИПП отмечено не было. Тем не менее авторы двух последних метаанализов приходят к выводу о наличии взаимосвязи между приемом ИПП и риском возникновения остеопоротических переломов [34, 35].
Еще одно крупное испытание, которое базировалось на 10 эпидемиологических исследованиях (4 когортных и 6 — «случай — контроль»), также подтвердило взаимосвязь приема ИПП с риском переломов: риск переломов бедра возрастал на 25 % (OШ 1,25; 95% ДИ 1,14–1,37), позвоночника — на 50 % (OШ 1,50; 95% ДИ 1,32–1,72) [22].
Доказательства повышения риска остеопоротических переломов бедра и позвоночника отображены в метаанализе Y. Lau и соавт. [18], обобщившем 14 наблюдательных исследований (с 1980 по 2011 год). Авторы отмечают, однако, что далеко не все исследования подтверждают это положение, а сам риск переломов оценивается как достаточно умеренный.
Среди 5339 женщин, вовлеченных в исследование Study for Osteoporotic Fractures, 234 пациентки, сообщившие о приеме ИПП, имели высокий риск невертебральных переломов (ОР = 1,34; 95% ДИ 1,10–1,64) во время среднего периода наблюдения 5 лет [40].
В 2014 году опубликованы данные еще одного крупного проспективного исследования, посвященного установлению взаимосвязи между долгосрочной терапией ИПП и факторами риска переломов, включая минеральную плотность, падения, способность удерживать баланс в когорте пожилых постменопаузальных женщин [19]. Установлено, что длительная терапия ИПП была связана с повышенным риском падений и госпитализаций, связанных с переломами: ОШ = 2,17; 95% ДИ 1,25–3,77; р = 0,006 и ОШ = 1,95; 95% ДИ 1,20–3,16; р = 0,007 соответственно. Исследователи не выявили связи с нарушением костной структуры и возрастанием риска переломов, однако при долгосрочном применении ИПП существенно повышался риск падений, неустойчивости, шаткости, страха падений, головокружений, онемений ног, что может быть определяющим фактором в возникновении остеопоротических переломов. Таким образом, риск переломов может опосредоваться через увеличение риска падений и самих падений, а не нарушенной структуры кости.
Данные последних исследований по установлению взаимосвязи между приемом ИПП и возникновением переломов костей представлены в табл. 1.
/89-97/91-1.jpg)
Необходимо отметить, что в качестве доказательства возможности развития осложнений приема ИПП, в частности развития остеопоротических переломов, выступают данные популяционных исследований. Хотя подобные работы представляют огромную ценность (поскольку демонстрируют ситуацию в реальной клинической практике), тем не менее они показывают лишь ассоциацию между приемом ИПП и обнаружением исследователями повышенного риска переломов/падений. Но наличие статистической ассоциации не означает наличия причинно-следственной связи. Нельзя исключить, что причиной осложнений могут являться не сами ИПП, а те заболевания или состояния, которые вынудили пациентов их использовать [1]. В последних исследованиях все чаще звучит позиция, что связь между ИПП и риском переломов может быть весьма скромной: большинству пациентов не был диагностирован остеопороз, минеральная плотность кости не мониторировалась в течение приема ИПП, а также отсутствовал дополнительный прием препаратов кальция и витамина D в адекватной дозе; кроме того, не учитывались многочисленные другие факторы, которые могут влиять на минеральную плотности кости и развитие остеопороза (например, прием тиазидных диуретиков, заместительной гормональной терапии, глюкокортикоидов). Таким образом, ряд исследователей считает преждевременным навешивание на ИПП ярлыка препаратов, повышающих риск остеопороза и остеопоротических переломов костей [3, 5].
Тем не менее механизмы возможного влияния ИПП на костный метаболизм продолжают интенсивно –изучаться.
Предполагается, что использование ИПП способно влиять и на эффективность противоостеопоротической терапии, в частности, бисфосфонатов. Такие выводы можно сделать на основании данных, полученных в ходе 3-летнего исследования эффективности ризендроната. Исследуемая группа (n = 5464) включала 482 (8,8 %) пациентов, регулярно принимавших ИПП. Применение ризендроната обеспечило значительный клинический эффект — существенное снижение риска переломов позвоночника. Однако этот эффект оказался более низким у пациентов, принимавших дополнительно ИПП, в сравнении с теми, кто не принимал данные препараты: частота переломов снизилась на 38 и 57 % соответственно [30].
Недавнее исследование базы данных SIDIAP в Каталонии (Испания) определило, что использование ИПП было связано с развитием больших остеопоротических переломов среди пациентов, получавших пероральные бисфосфонаты: ОШ 1,41 (95% ДИ 1,22–1,65) [27]. Примечательным также было то, что не менее 60 % пациентов, принимавших бисфосфонаты, одновременно используют ИПП с целью гастропротекции. Эти данные свидетельствуют о том, что врачам, вероятно, следует избегать сочетания ИПП и пероральных бисфосфонатов. При исходной патологии верхнего этажа желудочно-кишечного тракта или высокого риска развития эзофагита предпочтение следует отдавать парентеральным антирезорбтивным препаратам (ибандронат, золедронат, деносумаб).
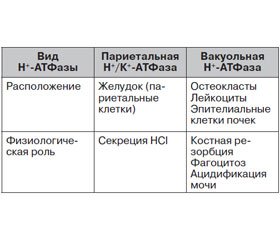
Класс-специфические побочные эффекты ИПП, помимо подавления кислотообразующей функции желудка, могут иметь и совершенно иную природу. Несомненно, что фармакологическая мишень ИПП — Н+К+-АТФаза париетальных клеток — является органоспецифическим ферментом. Однако в цитоплазме многих клеток человеческого организма локализуется близкий по строению фермент — вакуолярная Н+-АТФаза, активность которой в той или иной степени может быть подавлена при использовании ИПП. M. Suzuki и соавт. [32] суммировали данные по механизмам действия этих ферментов (табл. 2). Как видно, при назначении ИПП могут пострадать такие важнейшие функции, как фагоцитарная активность лейкоцитов, костная резорбция и ацидификация мочи. Именно с подавлением вакуольной Н+-АТФазы связывают один из механизмов нарушения костного метаболизма при длительном и высокодозовом лечении ИПП.
/89-97/92-1.jpg)
Еще одним гипотетическим механизмом развития остеопороза и остеопоротических переломов может быть нарушение всасывания витамина В12, железа, магния и кальция при длительном приеме ИПП, что формирует минеральную недостаточность [13, 16].
Еще четверть века назад в эксперименте было показано, что ахлоргидрия способствует снижению всасывания кальция. ИПП гипотетически увеличивают риск переломов вследствие гипохлоргидрии, снижения кишечной абсорбции кальция и последующего отрицательного кальциевого баланса. Хронические нарушения всасывания кальция при длительном подавлении желудочной секреции могут привести к компенсаторным физиологическим изменениям, включая вторичный гиперпаратиреоз. Поскольку растворимость кальция зависит от рН раствора, то абсорбция кальция точно также может зависеть от рН желудочного сока. Это предположение было подтверждено при исследовании 11 пациентов с ахлоргидрией, что продемонстрировало нарушенную абсорбцию кальция из желатиновых капсул карбоната кальция, однако при этом отмечалось нормальное всасывание кальция цитрата [29].
Большое количество исследований, изучающих влияние ИПП на всасывание кальция в кишечнике, ограничивается наблюдением пациентов с почечной недостаточностью, требующей применения гемодиализа, или больных с гипо- и ахлоргидрией — двумя состояниями, которые, как известно, приводят к нарушению метаболизма кальция. Так, несколько исследований с коротким периодом наблюдения с включением небольшого числа пациентов не продемонстрировали значительного повышения уровня сывороточного кальция на фоне ИПП-терапии, но констатировали снижение его всасывания [9, 12, 23].
К настоящему моменту проведено 5 клинических плацебо-контролируемых исследований, в которых изучалось влияние ИПП на всасывание кальция с противоположными результатами. Данные исследований суммированы в табл. 3. В одном исследовании отмечено снижение всасывания кальция у женщин на 41 % при длительном применении омепразола; в другом оказалось, что длительный прием препарата не влияет на всасывание кальция у здоровых лиц [23, 31]. Однако дизайн исследований и их результаты вызывают замечания и критические оценки. Возможно, именно дизайн исследований и повлиял на такие неоднородные результаты. Во-первых, ни в одном из исследований не использовались двойные изотопы измерения абсорбции кальция (что является золотым стандартом), а также повторные измерения концентрации кальция. Во-вторых, продолжительность терапии ИПП составляла менее 12 дней в четырех исследованиях. В-третьих, в одном исследовании [23] измеряли тощаковую абсорбцию кальция, что может не отражать эффективность всасывания кальция с едой. И, наконец, в одном исследовании [31] не измерены показатели абсорбции кальция до начала лечения ИПП. Поэтому остается неясным, является ли ИПП-ассоциированная гипо-хлоргидрия фактором, который действительно уменьшает всасывание кальция [11, 20].
/89-97/93-1.jpg)
Одно из последних крупных исследований постменопаузальных женщин (не менее 5 лет после наступления менопаузы) проследило изменения всасывания кальция при приеме ИПП и без их приема [11]. Основным методом оценки всасывания кальция был метод фракционной абсорбции кальция с использованием метода двойных изотопов. Вначале была трижды оценена фракционная абсорбция кальция в течение 1 месяца для установления базового поглощения кальция и влияющих на него факторов. В последующем все женщины принимали омепразол (40 мг/сут) в течение 30 дней с последующим аналогичным определением абсорбции кальция. Исследование завершила 21 женщина. Статистический анализ — множественный регрессионный анализ — показал, что возраст, рН желудочного сока, сывороточные уровни омепразола, приверженность к приему омепразола, уровень 25-гидроксивитамина D ассоциировались с изменениями фракционной абсорбции кальция, однако только низкий уровень 25-гидроксивитамина D был достоверно связан (р = 0,049) с низкой абсорбцией кальция. ИПП-ассоциированная гипохлоргидрия не уменьшала фракционную абсорбцию кальция в последующие 30 дней приема омепразола.
Интересные данные получены при исследовании маркеров костного метаболизма у 13 пациентов при 13-недельном использовании ИПП при лечении язвы желудка [17]. Зарегистрированы признаки увеличения маркеров резорбции кости, таких как концентрация деоксипиридинолина в моче, что подтверждает гипотезу, что ИПП прямо или косвенно могут стимулировать резорбцию кости. Также два экспериментальных исследования подтверждали гипотезу прямого влияния пантопразола на функции остеокластов и остеобластов [25, 26]. Прямая 7-дневная стимуляция остеокластов приводила к ингибированию процессов деградации и поглощения костного матрикса. Прямая стимуляция остеобластов ассоциировалась с увеличением митохондриальной активности клеток, экспрессии генов и синтеза белков. На основе полученных данных авторы исследований пришли к выводу, что патофизиологический механизм развития остеопороза и связанных с ним переломов костей находится не на клеточном уровне.
В исследовании А.М. Hinson и соавт. [14] было установлено, что развитие «мягкого» гиперпаратиреоза является отличительной чертой длительного использования ИПП (паратгормон — 65,5 пг/мл против 30,3 пг/мл;
р = 0,001).
Будущие исследования должны быть направлены на определение механизмов, с помощью которых ИПП увеличивают риск остеопоротических переломов.
Заключение
Таким образом, связь между приемом ИПП и остеопоротическими переломами установлена, хотя механизмы этой ассоциации не полностью понятны [15]. Также непонятно, могут ли добавки кальция и витамина D уменьшить этот риск. И хотя повышенный риск переломов является достаточно скромным, необходимо помнить, что при длительной и высокодозовой терапии ИПП возможно развитие переломов костей, особенно у пациентов, которые уже имеют дополнительные факторы риска. Приведенные исследования акцентируют внимание на необходимости четких показаний к приему ИПП, поскольку длительный бесконтрольный прием может способствовать проявлению побочных эффектов, в том числе и переломов. В 2011 году FDA пересмотрела данные остеопорозогенных эффектов ИПП, и в заключение было анонсировано, что остеопороз и переломы не являются следствием применения ИПП коротким курсом и в стандартной дозе. Пациенты имеют повышенный риск развития переломов при курсе терапии, превышающем 1 год,
и/или применении высоких доз препарата.
Без сомнения, ИПП являются революционным классом препаратов в лечении кислотозависимых заболеваний желудочно-кишечного тракта. Однако назначение лекарства на длительный срок может приводить не только к снижению симптомов и улучшению качества жизни, но и сопровождаться развитием побочных эффектов. В связи с аспектами, освещенными в данном обзоре, необходимо проведение дополнительных клинических исследований, которые помогут лучше понять изменения минерального обмена, происходящего на фоне терапии ИПП.
Конфликт интересов. Исследование не имело спонсорской поддержки. Автор не получала гонораров за статью. Автор несет полную ответственность за предоставление окончательной версии рукописи в печать.
Список литературы
1. Каратеев А.Е. Шесть ножей в спину ингибиторам протонной помпы // Науч.-практич. ревматол. — 2013. — № 51(3). — С. 332-340.
2. Adams A., Black M.H., Zhang J.L. et al. Proton-pump inhibitor use and hip fractures in men: a population-based case-control study // Ann. Epidemiol. — 2014. — № 24. — Р. 286-290. — http: //doi.org/10.1016/j.annepidem.2014.01.004.
3. Andersen B.N., Johansen P.B., Abrahamsen B. Proton pump inhibitors and osteoporosis // Curr. Opin. Rheum. — 2016. — № 28(4). — Р. 420-425. — doi: 10.1097/BOR.0000000000000291.
4. Cea Soriano L., Ruigomez A., Johansson S., Garcia Rodriguez L.A. Study of the association between hip fracture and acid-suppressive drug use in a UK primary care setting // Pharmacotherapy. — 2014. — № 34. — Р. 570-581. — doi: 10.1002/phar.1410.
5. De Vries F., van Staa T.P., Leufkens H.G.M. Proton pump inhibitors, fracture risk and selection bias: three studies, same database, two answers // Osteopor. Int. — 2010. — № 22. — Р. 1641-1642. — doi: 10.1007/s00198-010-1323-1.
6. Ding J., Heller D.A., Ahern F.M., Brown T.V. The Relationship between proton pump inhibitor adherence and fracture risk in the elderly // Calcif. Tissue Int. — 2014. — № 94. — Р. 597-607. — doi: 10.1007/s00223-014-9855-6.
7. Freedberg D.E., Haynes K., Denburg M.R. et al. Use of proton pump inhibitors is associated with fractures in young adults: a population-based study // Osteopor. Int. — 2015. — № 26. — Р. 2501-2507. — http://doi.org/10.1007/s00198-015-3168-0.
8. Gray S.L., LaCroix A.Z., Larso J. et al. Proton pump inhibitor use, hip fracture, and change in bone mineral density in postmenopausal women // Arch. Int. Med. — 2010. — № 170. — Р. 765-771. — doi: 10.1001/archinternmed.2010.94.
9. Graziani G., Badalamenti S., Como G. et al. Calcium and phosphate plasma levels in dialysis patients after dietary Ca-P overload // Role of gastric acid secretion. Nephron. — 2002. — № 91. — Р. 474-479. — PMID: 12119480.
10. Graziani G., Como G., Badalamenti S. et al. Effect of gastric acid secretion on intestinal phosphate and calcium absorption in normal subjects // Nephrol. Dial. Transplant. — 1995. — № 10. — Р. 1376-1380. — PMID: 8538929.
11. Hansen K.E., Jones A.N., Lindstrom M.J. et al. Do Proton Pump Inhibitors Decrease Calcium Absorption? // J. Bone Miner. Res. — 2010. — № 25(12). — Р. 2786-279. — doi: 10.1002/jbmr.166.
12. Hardy P., Sechet A., Hottelart C. et al. Inhibition of gastric secretion by omeprazole and efficiency of calcium carbonate on the control of hyperphosphatemia in patients on chronic hemodialysis // Artif. Organs. — 1998. — № 22. — Р. 569-573. — PMID: 9684693.
13. Heidelbaugh J.J. Proton pump inhibitors and risk of vitamin and mineral deficiency: evidence and clinical implications // Ther. Adv. Drug. Saf. — 2013. — № 4(3). — Р. 125-133. — doi: 10.1177/2042098613482484.
14. Hinson A.M., Wilkerson B.M., Rothman-Fitts I. et al. Hyperparathyroidism associated with long-term proton pump inhibitors independent of concurrent bisphosphonate the-rapy in elderly adults // J. Am. Geriatr. Soc. — 2015. — № 63. — Р. 2070-2073. — doi: 10.1111/jgs.13661.
15. Insogma K.L. The effect of proton pump-inhibiting drugs on mineral metabolism // Am. J. Gastroenterol. — 2009. — № 104(Suppl. 2). — S2-4. — doi: 10.1038/ajg.2009.44.
16. Ito T., Jensen R.T. Long-term Proton Pump Inhibitor The-rapy with Bone Fractures and effects on Absorption of Calcium, Vitamin B12, Iron, and Magnesium // Curr. Gastroenterol. Rep. — 2010. — № 12(6). — Р. 448-457. — doi: 10.1007/s11894-010-0141-0.
17. Jo Y., Park E., Ahn S.B. et al. A proton pump inhibitor’s effect on bone metabolism mediated by osteoclast action in old age: a prospective randomized study // Gut Liver. — 2015. — № 9. — Р. 1-8. — doi: 10.5009/gnl14135.
18. Lau Y., Ahmed N. Fracture risk and bone mineral density reduction associated with proton pump inhibitors // Pharmacotherapy. — 2012. — № 32. — Р. 67-79. — doi: 10.1002/PHAR.1007.
19. Lewis J.R., Barre D., Zhu K. et al. Long-term proton pump inhibitor therapy and falls and fractures in elderly women: a prospective cohort study // J. Bone Miner. Res. — 2014. — № 29(11). — Р. 2489-2497. — doi: 10.1002/jbmr.2279.
20. McCarthy D.M. Adverse effects of proton pump inhibitor drugs: clues and conclusions // Current Opinion in Gastroenterology. — 2010. — № 26. — Р. 624-631. — doi: 10.1097/MOG.0b013e32833ea9d9.
21. Moberg L.M.E., Nilsson P.M., Samsioe G., Borgfeldt C. Use of proton pump inhibitors (PPI) and history of earlier fracture are independent risk factors for fracture in postmenopausal women. The WHILA study // Maturitas. — 2014. — № 78. — Р. 310-315. — doi: 10.1016/j.maturitas.2014.05.019.
22. Ngamruengphong S., Leontiadis G., Radhi S. et al. Proton pump inhibitors and risk of fracture: a systematic review and meta-analysis of observational studies // Am. J. Gastroenterol. — 2011. — № 106. — Р. 1209-1218. — doi: 10.1038/ajg.2011.113.
23. O’Connell M.B., Madden D.M., Murray A.M. et al. Effects of proton pump inhibitors on calcium carbonate absorption in women: a randomized crossover trial // Am. J. Med. — 2005. — № 118. — Р. 778-781. — doi: 10.1016/j.amjmed.2005.02.007.
24. O’Neill L.W., Culpepper B.L., Galdo J.A. Long-term Consequences of Chronic Proton Pump Inhibitor Use // US Pharmacist. — 2013. — № 38(12). — Р. 38-42.
25. Prause M., Seeliger C., Unger M. et al. Pantoprazole decreases cell viability and function of human osteoclasts // Mediators Inflamm. — 2015. — 413097. — doi: 10.1155/2015/413097.
26. Prause M., Seeliger C., Unger M. et al. Pantoprazole increases cell viability and function of primary human osteoblasts in vitro // Injury. — 2014. — № 45. — Р. 1156-1164. — doi: 10.1016/j.injury.2014.05.005.
27. Prieto-Alhambra D., Pages-Castella A., Wallace G. et al. Predictors of fracture while on treatment with oral bisphosphonates: a population-based cohort study // J. Bone Miner. Res. — 2013. — № 29. — Р. 268-274. — doi: 10.1002/jbmr.2011.
28. Ranchon F., Vantard N., Gouraud A. et al. Suspicion of drug-drug interaction between high-dose methotrexate and proton pump inhibitors: a case report — should the practice be changed? // Chemotherapy. — 2011. — № 57. — Р. 225-229. — doi: 10.1159/000327372.
29. Recker R.R. Calcium absorption and achlorhydria // N. Engl. J. Med. — 1985. — № 313. — Р. 70-73. — PMID: 4000241.
30. Roux C., Goldstein J., Zhou X. et al. Vertebral fracture efficacy during risedronate therapy in patients using proton pump inhibitors // Osteoporos. Int. — 2012. — № 23. — Р. 277-284. — doi: 10.1007/s00198-011-1574-5.
31. Serfaty-Lacrosniere C., Wood R.J., Voytko D. et al. Hypochlorhydria from short-term omeprazole treatment does not inhibit intestinal absorption of calcium, phosphorus, magnesium or zinc from food in humans // J. Am. Coll. Nutr. — 1995. — № 14. — Р. 364-368. — PMID: 8568113.
32. Suzuki M., Suzuki H., Hibi T. Proton pump inhibitors and gastritis // J. Clin. Biochem. Nutr. — 2008. — № 42. — Р. 71-75. — doi: 10.3164/jcbn.2008012.
33. Targownik L., Leslie W., Davison K. et al. The relationship between proton pump inhibitor use and longitudinal change in bone mineral density: a population-based from the Canadian Multicentre Osteoporosis Study (CaMos) // Am. J. Gastroenterol. — 2012. — № 107. — Р. 1361-1369. — doi: 10.1038/ajg.2012.200.
34. Targownik L.E., Lix L.M., Leung S., Leslie W.D. Proton-pump inhibitor use is not associated with osteoporosis or accelerated bone mineral density loss // Gastroentero-
logy. — 2010. — № 138. — Р. 896-904. — doi: http://dx.doi.org/10.1053/j.gastro.2009.11.014.
35. Targownik L.E., Lix L.M., Metge C.J., Prior H.J. et al. Use of proton pump inhibitors and risk of osteoporotic fractures // CMAJ. — 2008. — № 179. — Р. 319-326. — doi: 10.1503/cmaj.071330.
36. US Food and Drug Administration FDA (2010) Possible fracture risk with high dose, long-term use of proton pump inhibitors. — http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/ucm213206.htm. Accessed 28 May 2010.
37. Van der Hoorn M.M.C., Tett S.E., de Vries O.J. et al. The effect of dose and type of proton pump inhibitor use on risk of fractures and osteoporosis treatment in older Australian women: a prospective cohort study // Bone. — 2015. — № 81. — Р. 1-23. — doi: 10.1016/j.bone.2015.08.024.
38. Vestergaard P., Rejnmark L., Mosekilde L. Proton pump inhibitors, histamine H2 receptor antagonists, and other antacid medications and the risk of fracture // Calcif. Tissue Int. — 2006. — № 79. — Р. 76-83. — doi: 10.1007/s00223-006-0021-7.
39. Yang Y.X., Lewis J.D., Epstein S., Metz D.C. et al. Long-term proton pump inhibitor therapy and the risk of hip fracture // JAMA. — 2006. — № 296. — Р. 2947-2953. — doi: 10.1001/jama.296.24.2947.
40. Yu E.W., Blackwell T., Ensrud K.E. et al. Acid-suppressive medications and risk of bone loss and fracture in older adults // Calcif. Tissue Int. — 2008. — № 83. — Р. 251-259. — doi: 10.1007/s00223-008-9170-1.

/89-97/91-1.jpg)
/89-97/92-1.jpg)
/89-97/93-1.jpg)