Статтю опубліковано на с. 46-51
Проблема ранньої діагностики, прогнозу перебігу розсіяного склерозу (РС) дотепер залишається надзвичайно актуальною в усьому світі [1, 7, 11].
Різні темпи прогресування захворювання й терміни досягнення вираженої інвалідизації зумовлюють інтерес до різних аспектів і особливостей активності демієлінізуючого процесу при РС [2, 4, 8, 10].
У проведеному протягом 20,6 року ретроспективному аналізі 2477 пацієнтів з РС із Великобританії та Канади [14, 15] досліджувався вплив рецидивів на різних етапах захворювання на його прогресування. У спостереженні за природним перебігом РС A. Scalfari et al. [13], у якому було проаналізовано 28 000 пацієнто-років, починаючи з 806 дебютів, наведено дані про неоднорідність взаємозв’язків рецидивів і довгострокової інвалідизації. Отже, завершені довготривалі дослідження вказували на необхідність подальшого визначення нових критеріїв прогресування захворювання [5, 12, 14]. Так званий клініко-радіологічний парадокс, тобто невідповідність картини магнітно-резонансної томографії (МРТ) клінічним проявам захворювання, на що вказували слабкі кореляційні взаємозв’язки між клінічними і МРТ-ознаками захворювання, обговорюється в літературі тривалий період часу [1, 3, 9–11, 16]. У роботі K. Lovblad et al. [9] надається велике значення ролі МРТ у діагностиці й моніторингу захворювання та проводиться узагальнення досягнень і невирішених проблем ери нейровізуалізації. Водночас дослідники вказують, що крім недоліків існуючих клінічних та МРТ-досліджень має значення присутність «німих» осередків, роль нейродегенеративного процесу в патогенезі захворювання, тому актуальним залишається визначення нових нейровізуалізаційних предикторів активності перебігу захворювання.
Фундаментальне нове 20-річне дослідження QueenSguare великої кількості пацієнтів (140 хворих) із клінічно ізольованим синдромом (КІС) показало, що кількість вогнищ на Т2-зважених зображеннях на момент КІС не тільки співвідноситься з наступним переходом у клінічно вірогідний розсіяний склероз, а й з ризиком втрати здатності ходити без підтримки через 20 років [6]. Дослідники вказують на те, що висновки щодо слабких кореляційних зв’язків нейровізуалізаційної картини стандартної МРТ і клінічних проявів захворювання були зроблені передчасно. МРТ-показники є важливими прогностичними факторами розвитку клінічних проявів РС. Об’єм ураження речовини головного мозку та його зміни корелюють з інвалідизацією через 20 років від початку захворювання.
Отже, багаторічні клінічні спостереження за клінічними, нейровізуалізаційними та імунопатологічними факторами активності демієлінізуючого процесу при РС вказують на те, що відповідні надійні критерії, згідно з якими пацієнти мають різну активність захворювання в різні відрізки часу від його початку, потребують подальшого вивчення.
Мета роботи: підвищити рівень прогностичної оцінки активності демієлінізуючого процесу у хворих на РС на підставі комплексного клініко-неврологічного і нейровізуалізаційного проспективного десятирічного дослідження.
Матеріали і методи
Обстежено 180 хворих (88 жінок і 92 чоловіки) з РС, які спостерігалися в Київському міському центрі розсіяного склерозу на базі міської клінічної лікарні № 4 протягом 2003–2014 рр. починаючи з перших клінічних ознак захворювання — клінічно ізольованого синдрому. У всіх хворих у подальшому розвинувся рецидивуючо-ремітуючий розсіяний склероз (РРРС). Загальний період спостереження за пацієнтами становив 10,25 ± 0,25 року. Весь термін спостереження за пацієнтами було поділено на декілька періодів, під час яких проводили аналіз результатів клініко-інструментального обстеження.
І період — КІС (2003–2004 рр.)
ІА період — 2005–2006 рр.
ІІ період — 2008–2009 рр.
ІІІ період — 2009–2010 рр.
ІV період — 2010–2011 рр.
V період — 2011–2012 рр.
VI період — завершення проспективного дослідження (2013–2014 рр.).
Вираженість неврологічних симптомів оцінювали за шкалою EDSS (Kurtzke J., 1983). Також визначали частоту клінічних загострень захворювання.
Магнітно-резонансні зображення головного мозку були отримані на магнітно-резонансному томографі GE, Signa Excite HD1.5т медичної клініки «Борис» за стандартним протоколом з використанням імпульсних послідовностей швидкого спін-ехо (FSE), спін-ехо (SE), Т2-FLAIR, а також Dual Echo — для зображень, зважених за Т2- і Т1-протонною щільністю. Оцінювали кількість гіперінтенсивних вогнищ на Т2-зважених зображеннях, у тому числі кількість вогнищ понад 3 мм, кількість Т-вогнищ, Gd+-вогнищ.
Статистичну обробку отриманих даних проводили з використанням програмного пакета Statistiсa 10.0 (StatSoft, Inc, США) і Microsoft® Excel 2010 (Microsoft Corporation, США). Для графічного зображення даних використовувався редактор Microsoft Graph (© Microsoft Corporation, версія 2010).
Результати дослідження
Провели визначення клінічних та нейровізуалізаційних проявів активності демієлінізуючого процесу при РС, для чого за періодами дослідження реєстрували частоту загострень, ступінь інвалідизації за шкалою EDSS і кількість МРТ-осередків (Т2-, в тому числі з розмірами понад 3 мм, Т1- та Gd+) і проводили аналіз взаємозв’язків між вказаними ознаками.
У першу чергу було зроблено аналіз динаміки частоти загострень і рівня інвалідизації за шкалою ЕDSS, оцінено їх взаємозв’язок з першими клінічними проявами захворювання та між собою в різні періоди захворювання.
/47.jpg)
У разі початку захворювання зі стовбурових розладів в обидва строки захворювання виявили статистично вірогідний прямий середній кореляційний зв’язок із частотою загострень (r = 0,521 (p < 0,01); r = 0,556 (p < 0,01)) та слабкий і середній зі ступенем EDSS (r = 0,223 (p < 0,05); r = 0,348 (p < 0,05)) відповідно. У випадку початку захворювання з пірамідних розладів прямий середній кореляційний зв’язок виявляли з частотою загострень через три роки від початку РС (r = 0,551; p < 0,01), а зі ступенем EDSS — через шість років (r = 0,567 (p < 0,01)). Початок захворювання з чутливих розладів мав слабкий, але статистично вірогідний кореляційний зв’язок з частотою загострень через три роки і через шість років від початку захворювання (r = 0,276 (p < 0,05); r = 0,346 (p < 0,05)), і був відсутній зв’язок з рівнем EDSS. Менші значення та закономірності спостерігалися в разі початку захворювання із зорових і мозочкових розладів, а в разі початку з когнітивних розладів вони були відсутні.
У подальшому спостерігалась тенденція до зменшення рівня кореляційних зв’язків виду ураження ФС при КІС з частотою загострень та збільшення рівня кореляцій з рівнем інвалідизації за шкалою ЕDSS.
Швидкість прогресування інвалідизації — один з важливих показників клінічної активності перебігу захворювання. Збереження в деяких пацієнтів протягом 10 років від його початку рівня інвалідизації до 3 балів за EDSS, так званого доброякісного м’якого РС (benign MS), визначає необхідність детального вивчення всіх факторів, що впливають на цей показник. Для оцінки ризику прогресування інвалідизації застосовували метод відношення шансів (ВШ).
Враховуючи відсутність кореляційних зв’язків між ступенем EDSS і частотою загострень у більшості періодів дослідження, провели подальший аналіз впливу частоти загострень, що реєстрували на початку захворювання, на швидкість досягнення рівня EDSS > 3 бали за періодами дослідження.
Як видно з рис. 1, через 9–10 років (V–VI період) від початку захворювання реєстрували вірогідно високий показник відношення шансів досягнення рівня EDSS > 3 бали (помірний рівень інвалідизації) залежно від частоти загострень на початковому етапі захворювання: ВШ = 3,11, 95% довірчий інтервал (ДІ) 1,16–8,32, p = 0,021 і ВШ = 3,68, 95% ДІ 1,28–10,61, p = 0,01 відповідно.
Моніторинг МРТ-активності демієлінізуючого процесу при РС починаючи з КІС за періодами дослідження виявив як наявність, так і відсутність кореляційних зв’язків з клінічними ознаками захворювання. Найбільшу значущість мали такі результати.
Визначали час розвитку третього загострення у пацієнтів з РС, коли діагноз був встановлений, а частота розвитку загострень на його початкових етапах може мати прогностичне значення. За методом Каплана — Майєра було встановлено, що на швидкість розвитку третього загострення, що є одним з показників активності перебігу РС, впродовж проспективного спостереження статистично вірогідно впливала наявність 9 і більше Т2-вогнищ, виявлених при КІС (р = 0,004) (рис. 2).
За 10 років спостереження у всіх пацієнтів, які мали менше 9 Т2-вогнищ з розмірами > 3 мм при КІС, розвинулося третє загострення, а при наявності 9 і більше Т2-вогнищ з розмірами > 3 мм при перших клінічних ознаках захворювання третє загострення розвивалося впродовж перших п’яти років захворювання (р = 0,0048).
При наявності 3 і більше Gd+-осередків у хворих із РРРС ризик виникнення загострень зростав більше ніж у 2 рази (F = 1,99, p = 0,0002), у той час як наявність даних осередків при КІС не впливала на швидкість розвитку третього загострення, як і зареєстрована кількість Т1-осередків у хворих з КІС і РС.
Враховуючи неоднозначність впливу загальної кількості Т2-вогнищ на швидкість виникнення третього загострення, ми оцінили вплив даного показника в пацієнтів з більш активним клінічним перебігом на розвиток шостого загострення. Виявили, що у хворих з РС за наявності понад 20 Т2-осередків збільшення швидкості виникнення шостого загострення було статистично вірогідним (F = 1,57, p = 0,0035).
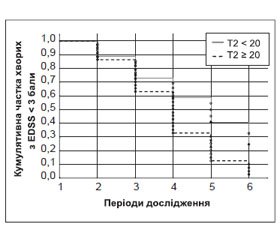
Оцінена за методом Каплана — Майєра швидкість прогресування інвалідизації із досягненням помірного і тяжкого ступеня інвалідизації за шкалою EDSS залежно від загальної кількості Т2-осередків (у групах Т2 ≥ 20 та Т2 < 20) у хворих з РС вказувала на те, що тільки через сім років від початку захворювання (ІV період) швидкість редукції частки пацієнтів з EDSS менше ніж 3 бали зростала майже в два рази (F = 5,3, p = 0,006), що підтверджувало значення строку захворювання в прогнозуванні активності перебігу. Так, у ІV періоді вона становила відповідно 32,7 та 58,9 % при кількості Т2-осередків ≥ 20 або < 20, у V періоді — 12,7 та 40,7 %, у VІ періоді — 2,5 та 24,5 % (рис. 3).
/49.jpg)
Також було доведено, що у випадках, коли при КІС спостерігалась перивентрикулярна та субтенторіальна локалізація осередків, швидкість прогресування інвалідизації до рівня EDSS > 3 бали вірогідно збільшувалась: ВШ = 2,25, 95% ДІ 1,0–4,9, р = 0,031 та ВШ = 1,9, 95% ДІ 1,1–3,5, р = 0,022. При локалізації осередків у мозолястому тілі ризик досягнення рівня EDSS3 бали, за нашими даними, був відсутній (табл. 2).
/49_2.jpg)
При аналізі впливу наявної на момент ІІ періоду дослідження МРТ-картини на швидкість прогресування інвалідизації виявили високий показник відношення шансів досягнення рівня EDSS > 3 бали через шість років від початку захворювання при реєстрації ≥ 9 Т2-осередків з розмірами > 3 мм — ВШ = 21,46, 95% ДІ 9,58–48,09 (рис. 4). Даний показник можна вважати одним з найвагомішим індикаторів досягнення рівня EDSS > 3 бали. Також при наявності у ІІ періоді 20 і більше Т2-осередків визначено високий показник відношення шансів формування інвалідизації за шкалою EDSS > 3 бали — ВШ = 3,62, 95% ДІ 1,88–6,96.
Обговорення результатів дослідження
Наявність кореляційного зв’язку стовбурової ФС як ініціального прояву РС з частотою загострень та ступенем інвалідизації за шкалою ЕDSS як через три, так і через шість років від початку захворювання вказувала на те, що ураження даної ФС має прогностичне значення для клінічної активності захворювання в перші шість років від його початку. Наявність кореляційного зв’язку з частотою загострень через три роки, а з рівнем ЕDSS — через шість років від початку захворювання в разі ураження при КІС пірамідної ФС вказувало на те, що клінічна активність захворювання в даному випадку спочатку проявлялася епізодами загострень, а в подальшому зростав ступінь інвалідизації за шкалою ЕDSS. Виявлений кореляційний зв’язок чутливої ФС лише з частотою загострень у вказані періоди захворювання і відсутність зв’язку з рівнем ЕDSS вказували на те, що в разі початку захворювання з розладів у даній ФС перебіг захворювання більш сприятливий.
Результати статистичного аналізу показали, що висока частота загострень (2 і більше на рік), зареєстрована в перші роки захворювання, не впливала на ризик досягнення рівня EDSS > 3 бали у тому ж періоді спостереження та найближчі два роки. Отримані нами результати довели, що частота загострень у перші шість років від початку захворювання вірогідно впливала на ризик досягнення інвалідизації > 3 бали лише через 9–10 років (V–VI періоди) спостереження. Доведено взаємозв’язок частоти загострень і прогресування інвалідизації, а саме прогностичне значення частоти загострень перших років захворювання зі збільшенням відношення шансів зростання рівня інвалідизації в довгостроковій перспективі.
За методом Каплана — Майєра доведено, що на швидкість розвитку ранніх загострень (третього) вірогідно впливала наявність ≥ 9 Т2-вогнищ, виявлених при КІС, в той час як загальна кількість Т2-осередків ≥ 20 може клінічно не проявлятися на початку захворювання (до третього загострення), а знаходити клінічний вихід у подальшому (при шостому загостренні) (F = 1,57, p = 0,0035). Отримані результати могли вказувати на те, що при утворенні нових Т2-осередків клінічні прояви захворювання можуть реєструватися при наступних атаках захворювання.
Доведено, що при збільшенні строку захворювання понад сім років загальна кількість Т2-осередків при РС вірогідно впливала на зростання ступеня інвалідизації, що підтверджувалося швидкістю редукції кількості пацієнтів, у яких рівень ЕDSS зростав у два рази в указані періоди дослідження.
Високий показник відношення шансів досягнення рівня EDSS > 3 бали протягом перших шести років від початку захворювання виявляли при реєстрації 9 і більше Т2-осередків з розмірами > 3 мм — ВШ = 21,46, 95% ДІ 9,58–48,09. Даний показник можна вважати одним з найвагоміших індикаторів досягнення рівня EDSS > 3 бали. Доведено значення в прогресуванні інвалідизації інфратенторіальної і перивентрикулярної локалізації осередків при КІС.
Отримані результати проведених досліджень мають велике практичне значення для сучасної неврології, у тому числі для українських неврологів, у зв’язку з тим, що визначення предикторів активності перебігу захворювання має значення для своєчасного призначення засобів патогенетичної терапії. Причому визначений ступінь активності захворювання дозволяє прийняти рішення про призначення лікарських засобів як першої, так і другої лінії терапії, що вже зареєстровані в Україні.
Висновки
1. Прогнозування активності перебігу РС повинно проводитися з урахуванням клінічних і нейровізуалізаційних ознак активності захворювання в різні періоди від його початку.
2. Вид ураження ФС при КІС має значення для прогнозування клінічної активності захворювання. Початок РС зі стовбурових і пірамідних розладів є найбільш несприятливим для його прогнозу.
3. Частота загострень перших років РС є вірогідним фактором досягнення помірного рівня інвалідизації за шкалою EDSS у довгостроковій перспективі — через 9–10 років від початку захворювання.
4. Ризик виникнення загострень захворювання збільшується при реєстрації дев’яти й більше Т2-осередків при КІС, при збільшенні загальної кількості Т2-осередків до 20 і більше у хворих з РС клінічні прояви загострень можуть реєструватися при наступних атаках захворювання.
5. Основними нейровізуалізаційними предикторами прогресування інвалідизації при РС є наявність 9 і більше Т2-осередків з розмірами понад 3 мм, інфратенторіальна та перивентрикулярна локалізація осередків при КІС, загальна кількість Т2-осередків. Причому наявність понад 20 Т2-осередків вірогідного значення набуває при збільшенні строку захворювання понад сім років.
Список литературы
1. Волошина Н.П., Гапонов И.К. Возможности магнитно-резонансной томографии в диагностике и прогнозе течения рассеянного склероза в зависимости от пола и возраста больных // Український вісник психоневрології. — 2010. — Т. 2, № 3 (64). — С. 19-23.
2. Ann Yeh E. Multiple sclerosis: predicting risk and delaying progression / Yeh E. Ann, Bianca Weinstock Guttman // Neurology. — 2010. — Vol. 9, № 1. — P. 7-9.
3. Bar-Zohar D. Magnetic resonance imaging metrics and their correlation with clinical outcomes in multiple sclerosis: a review of the literature and future perspectives / D. Bar-Zohar, F. Agosta, D. Goldstaub, M. Filippi // Mult. Scler. — 2008. — Vol. 14, № 6. — P. 719-727.
4. Correale J. Benign multiple sclerosis: a new definition of this entity is needed / J. Correale, I. Peirano, L. Romano // Mult. Scler. — 2012. — Vol. 18, № 2. — P. 210-218.
5. Koch M. The natural history of secondary progressive multiple sclerosis / M. Koch, E. Kingwell, P. Rieckmann, H. Tremlett // J. Neurol. Neurosurg. Psychiatry. — 2010. — Vol. 81. — P. 1039-1043.
6. Fisniku L.K. Disability and T2 MRI lesions: a 20-year follow-up of patients with relapse onset of multiple sclerosis / L.K. Fisniku, P.A. Brex, D.R. Altmann [et al.] // Brain. — 2008. — Vol. 131 (Pt 3). — P. 808-817.
7. Giesser B.S. Diagnosis of multiple sclerosis / B.S. Giesser // Neurol. Clin. — 2011. — Vol. 29, № 2. — P. 381-388.
8. Kister I. Disability in multiple sclerosis: A reference for patients and clinicians / I. Kister, E. Chamot, A.R. Salter, G.R. Cutter, T.E. Bacon, J. Herbert // Neurology. — 2013, Mar 12. — Vol. 80, № 11. — P. 1018-1824.
9. Lovblad K.O. MR imaging in Multiple Sclerosis: review and recommendation for current practice / K.O. Lovblad, N. Anzalone, A. Doflier [et al.] // AJNR Am. J. Neuroradiol. — 2010. — Vol. 31. — P. 983-989.
10. Menon S. Characterising aggressive multiple sclerosis / S. Menon, A. Shirani, H. Zhao [et al.] // J. Neurol. Neurosurg. Psychiatry. — 2013. — Vol. 84, № 11. — P. 1192-1198.
11. Niekerson Nickerson M. The multiple sclerosis experience: Patient-reported outcomes from the North American Research Committee on Multiple Sclerosis (NARCOMS) Registry / M. Nickerson, R.A. Marrie // BMC Neurology. — 2013. — Vol. 13. — P. 119.
12. Scalfari A. Early relapses, onset of progression, and late outcome in multiple sclerosis / A. Scalfari, A. Neuhaus, M. Daumer, G. Deluca, P. Muraro, G. Ebers // JAMA Neurol. — 2013. — Vol. 70, № 2. — P. 214-222.
13. Scalfari A. The natural history of multiple sclerosis, a geographically based study. Relapses and long-term disability / A. Scalfari, A. Neuhaus, A. Degenhardt [et al.] // Brain. — 2010. — Vol. 133 (Pt 7). — P. 1914-1929.
14. Tremlett H. UBC Neurologists. Impact of multiple sclerosis relapses on progression diminishes with time / H. Tremlett, M. Yousefi, V. Devonshire, P. Rieckmann, Y. Zhao // Neurology. — 2009. — Vol. 73, № 20. — P. 1616-1623.
15. Tremlett H. New perspectives in the natural history of multiple sclerosis / H. Tremlett, Y. Zhao, P. Rieckmann, M. Hutchinson // Neurology. — 2010. — Vol. 74, № 24. — P. 20042015.
16. Ziemsenn T., Tintore M.A. New Era in Multiple Sclerosis: New Consideration for Therapeutic Approaches. — Elsevier, 2010. — 94 p.
/48_2.jpg)
/49.jpg)

/47.jpg)
/48.jpg)
/49_2.jpg)
/50.jpg)