Журнал «Здоровье ребенка» 3 (71) 2016
Вернуться к номеру
Антиоксидантная система респираторного тракта Антиоксидантные эффекторы в надэпителиальном и экстрацеллюлярном пространстве (часть 1)
Авторы: Абатуров А.Е. - ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины», г. Днепр, Украина; Волосовец А.П. - Национальный медицинский университет им. А.А. Богомольца, г. Киев, Украина; Худяков А.Е. - ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины», г. Днепр, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
В огляді літератури викладені сучасні дані щодо антиоксидантної системи респіраторного тракту. Показана локалізація компонентів і функціонування ферментної ланки антиоксидантної системи в респіраторному тракті. Викладена характеристика протеїнового складу рідини бронхоальвеолярного лаважу. Представлено зміни вмісту різних протеїнів у рідині бронхоальвеолярного лаважу після впливу алергена у хворих на бронхіальну астму. Показано функції й локалізацію неферментних біоантиоксидантів бронхоальвеолярного секрету. Докладно розглянуті характеристика, індукція синтезу й фізіологічна роль у респіраторному тракті антиоксидантного ферменту бронхоальвеолярного секрету — екстрацелюлярної супероксиддисмутази.
В обзоре литературы изложены современные данные об антиоксидантной системе респираторного тракта. Показаны локализация компонентов и функционирование ферментного звена антиоксидантной системы в респираторном тракте. Дана характеристика протеинового состава жидкости бронхоальвеолярного лаважа. Представлено изменение содержания различных протеинов в жидкости бронхоальвеолярного лаважа после воздействия аллергеном у больных бронхиальной астмой. Показаны функции и локализация неферментных биоантиоксидантов бронхоальвеолярного секрета. Подробно рассмотрены характеристика, индукция синтеза и физиологическая роль в респираторном тракте антиоксидантного фермента бронхоальвеолярного секрета — экстрацеллюлярной супероксиддисмутазы.
The review of literature presents the current data about the antioxidant system of the respiratory tract. The localization of the components and functioning of the enzyme link of antioxidant defense in the respiratory tract are described. The protein content of the bronchoalveolar lavage is characterized. The changes in the content of various proteins in the bronchoalveolar lavage fluid after exposure to an allergen in patients with bronchial asthma are presented. There were shown the function and localization of non-enzymatic bioantioxidants of lung fluid. The characteristics, synthesis induction and physiological role in the respiratory tract of the antioxidant enzyme of lung fluid — extracellular superoxide dismutase were considered in detail.
антиоксидантна система, респіраторний тракт, антиоксидантні ефектори.
антиоксидантная система, респираторный тракт, антиоксидантные эффекторы.
antioxidant system, respiratory tract, antioxidant effectors.
Статья опубликована на с. 161-171
Введение
/162.jpg)
Антиоксидантные эффекторы в надэпителиальном и экстрацеллюлярном пространстве
Неферментные биоантиоксиданты бронхоальвеолярного секрета
Антиоксидантные ферменты бронхоальвеолярного секрета
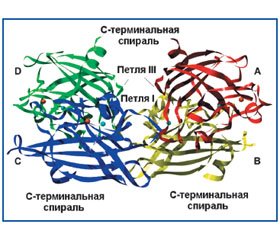
Экстрацеллюлярная супероксиддисмутаза
Краткая характеристика экстрацеллюлярной супероксиддисмутазы
Индукция синтеза экстрацеллюлярной супероксиддисмутазы и каталитический цикл
Физиологическая роль экстрацеллюлярной супероксиддисмутазы в респираторном тракте
1. Воскресенский О.Н. Биооксиданты — облигатные факторы питания / О.Н. Воскресенский, В.Н. Бобырев // Вопр. мед. химии. — 1992. — № 4. — С. 21.
2. Габитова Д.М. Антиоксидантная защитная система организма / Д.М. Габитова, В.О. Рыжикова, М.А. Рыжикова // Башкирский химический журнал. — 2006. — Т. 13, № 2. — С. 94.
3. Калинина Е.В. Участие тио-, перокси- и глутаредоксинов в клеточных редокс-зависимых процессах / Е.В. Калинина, Н.Н. Чернов, А.Н. Саприн // Успехи биологической химии. — 2008. — Т. 48. — С. 319-331.
4. Активные формы кислорода в живых системах / А. Магеррамов, И.А. Алиев, У.Ф. Аскерова и др. // Baki Universitetinin Xǝbǝrlǝri. — 2009. — Т. 4. — С. 41-52.
5. Analysis of glutathione: implication in redox and detoxification / A. Pastore, G. Federici, E. Bertini, F. Piemonte // Clin. Chim. Acta. — 2003. — Vol. 333. — P. 19-39. PMID: 12809732.
6. Altered expression of extracellular superoxide dismutase in mouse lung after bleomycin treatment / C.L. Fattman, C.T. Chu, S.M. Kulich et al. // Free Radic. Biol. Med. — 2001. — Vol. 31, № 10. — P. 1198-1207. PMID: 11705698.
7. Comhair S.A. Antioxidant responses to oxidant-mediated lung diseases / S.A. Comhair, S.C. Erzurum // Am. J. Physiol. Lung Cell. Mol. Physiol. — 2002. — Vol. 283, № 2. — P. L246-L255. PMID: 12114185.
8. Deplancke B. Redox control of the trans-sulfuration and glutathione biosynthesis pathways / B. Deplancke, H.R. Gaskins // Curr. Opin. Clin. Nutr. Metab. Care. — 2002. — Vol. 5. — P. 85-92. PMID: 11790955.
9. Depletion of glutathione and ascorbate in lung lining fluid by respirable fibres / D.M. Brown, P.H. Beswick, K.S. Bell, K. Donaldson // Ann. Occup. Hyg. — 2000. — Vol. 44. — P. 101-108. PMID: 10717261.
10. Differential proteomic analysis of bronchoalveolar lavage fluid in asthmatics following segmental antigen challenge/ J. Wu, M. Kobayashi, E.A. Sousa et al. // Mol. Cell. Proteomics. — 2005. — Vol. 4, № 9. — P. 1251-1264. PMID: 15951573.
11. Extracellular glutathione peroxidase induction in asthmatic lungs: evidence for redox regulation of expression in human airway epithelial cells / S.A. Comhair, P.R. Bhathena, C. Farver et al. // FASEB J. — 2001. — Vol. 15. — P. 70-78. PMID: 11149894.
12. Extracellular superoxide dismutase in macrophages augments bacterial killing by promoting phagocytosis / M.L. Manni, L.P. Tomai, C.A. Norris et al. // Am. J. Pathol. — 2011. — Vol. 178, № 6. — P. 2752-2759. doi: 10.1016/j.ajpath.2011.02.007.
13. Extracellular superoxide dismutase in pulmonary fibrosis / F. Gao, V.L. Kinnula, M. Myllärniemi, T.D. Oury // Antioxid. Redox. Signal. — 2008. — Vol. 10, № 2. — P. 343-354. PMID: 17999630.
14. Fattman C.L. Extracellular superoxide dismutase in biology and medicine / C.L. Fattman, L.M. Schaefer, T.D. Oury // Free Radic. Biol. Med. — 2003. — Vol. 35, № 3. — P. 236-256. PMID: 12885586.
15. Haddad J.J. O2-evoked regulation of HIF‑1α and NF-κB in perinatal lung epithelium requires glutathione biosynthesis / J.J. Haddad, S. Land // Am. J. Physiol. Lung Cell. Mol. Physiol. — 2000. — Vol. 278. — P. L492-L503. PMID: 10710521.
16. Haddad J.J. Thiol regulation of pro-inflammatory cytokines reveals a novel immunopharmacological potential of glutathione in the alveolar epithelium / J.J. Haddad, B. Safieh-Garabedian, N.E. Saadé, S.C. Land // J. Pharmacol. Exp. Therap. — 2001. — Vol. 296. — P. 996-1005. PMID: 11181934.
17. Hu S. Human body fluid proteome analysis / S. Hu, J.A. Loo, D.T. Wong // Proteomics. — 2006. — Vol. 6, № 23. — P. 6326-6353. PMID: 17083142.
18. Human bronchoalveolar lavage: biofluid analysis with special emphasis on sample preparation / A. Plymoth, C.G. Löfdahl, A. Ekberg-Jansson et al. / Proteomics. — 2003. — Vol. 3, № 6. — P. 962-972. PMID: 12833521.
19. Kinnula V.L. Focus on antioxidant enzymes and antioxidant strategies in smoking related airway diseases // Thorax. — 2005. — Vol. 60, № 8. — P. 693-700. PMID: 16061713.
20. Kinnula V.L. Superoxide dismutases in the lung and human lung diseases / V.L. Kinnula, J.D. Crapo // Am. J. Respir. Crit. Care Med. — 2003. — Vol. 167, № 12. — P. 1600-1619. PMID: 12796054.
21. Leroy B. Sample preparation of bronchoalveolar lavage fluid / B. Leroy, P. Falmagne, R. Wattiez // Methods Mol. Biol. — 2008. — Vol. 425. — P. 67-75. doi: 10.1007/978-1-60327-210-0_6.
22. Localization of extracellular superoxide dismutase in rat lung: neutrophils and macrophages as carriers of the enzyme / B. Loenders, E. Van Mechelen, S. Nicolaï et al. // Free Radic. Biol. Med. — 1998. — Vol. 24, № 7-8. — P. 1097-1106. PMID: 9626563.
23. Loss of extracellular superoxide dismutase leads to acute lung damage in the presence of ambient air: a potential mechanism underlying adult respiratory distress syndrome / M.C. Gongora, H.E. Lob, U. Landmesser et al. // Am. J. Pathol. — 2008. — Vol. 173, № 4. — P. 915-926. doi: 10.2353/ajpath.2008.080119. Epub 2008 Sep 11.
24. Marklund S.L. Human copper-containing superoxide dismutase of high molecular weight // Proc. Natl. Acad. Sci. USA. — 1982. — Vol. 79, № 24. — P. 7634-7638. PMID: 6961438.
25. Marklund S.L. Extracellular superoxide dismutase in human tissues and human cell lines // J. Clin. Invest. — 1984. — Vol. 74, № 4. — P. 1398-1403. PMID: 6541229.
26. Miao L. Regulation of superoxide dismutase genes: implications in disease / L. Miao, D.K. St Clair // Free Radic. Biol. Med. — 2009. — Vol. 47, № 4. — P. 344-356. doi: 10.1016/j.freeradbiomed.2009.05.018. Epub 2009 May 25.
27. NF-κB protects lung epithelium against hyperoxia-induced nonapoptotic cell death-oncosis / W.R. Franek, D.M. Morrow, H. Zhu et al. // Free Radic. Biol. Med. — 2004. — Vol. 37. — P. 1670-1679. PMID: 15477018.
28. Nozik-Grayck E. Extracellular superoxide dismutase / E. Nozik-Grayck, H.B. Suliman, C.A. Piantadosi // Int. J. Biochem. Cell. Biol. — 2005. — Vol. 37, № 12. — P. 2466-2471. PMID: 16087389.
29. Oxygen sensing and redox signaling: the role of thioredoxin in embryonic development and cardiac diseases / M. Kobayashi-Miura, K. Shioji, Y. Hoshino et al. // Am. J. Physiol. Heart. Circ. Physiol. — 2007. — Vol. 292, № 5. — P. H2040- H2050. PMID: 17293486.
30. Reddy S.P. The antioxidant response element and oxidative stress modifiers in airway diseases // Curr. Mol. Med. — 2008. — Vol. 8, № 5. — P. 376-383. PMID: 18691064.
31. Role of extracellular superoxide dismutasein hypertension / M.C. Gongora, Z. Qin, K. Laude et al. // Hypertension. — 2006. — Vol. 48. — P. 473-481. PMID: 16864745.
32. Skrzycki M. Zewnątrzkomórkowa dysmutaza ponadtlenkowa (EC-SOD) — budowa, właściwości i funkcje / M. Skrzycki, H. Czeczot // Postepy Hig. Med. Dosw. (Online). — 2004. — Vol. 58. — P. 301-311. PMID: 15280800
33. Superoxide dismutase 3, extracellular (SOD3) variants and lung function / K. Ganguly, M. Depner, C. Fattman et al. // Physiol. Genomics. — 2009. — Vol. 37, № 3. — P. 260-267. doi: 10.1152/physiolgenomics.90363.2008. Epub 2009 Mar 24.
34. The structure of human extracellular copper-zinc superoxide dismutase at 1.7 A resolution: insights into heparin and collagen bin-ding / S.V. Antonyuk, R.W. Strange, S.L. Marklund, S.S. Hasnain // J. Mol. Biol. — 2009. — Vol. 388, № 2. — P. 310-326. doi: 10.1016/j.jmb.2009.03.026. Epub 2009 Mar 14.
35. Wattiez R. Proteomics of bronchoalveolar lavage fluid / R. Wattiez, P. Falmagne // J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. — 2005. — Vol. 815, № 1-2. — P. 169-178. PMID: 15652807.

/162_2.jpg)
/163.jpg)
/163_2.jpg)
/164.jpg)
/165.jpg)
/166.jpg)
/167.jpg)
/168.jpg)
/169_2.jpg)
/169.jpg)