Резюме
Актуальность. Несмотря на успехи клинической микробиологии, этиотропная терапия тяжелых инфекций, в том числе пневмоний, на начальном этапе остается эмпирической, при этом ее адекватность играет ключевую роль в спасении жизни больного.
Цель работы — усовершенствование лечения тяжелых пневмоний, требующих интенсивной терапии, в детском возрасте.
Материалы и методы. Под наблюдением находилось 63 больных от 9 месяцев до 14 лет, получавших лечение в отделении анестезиологии и интенсивной терапии по поводу тяжелых внегоспитальных пневмоний. Первую группу составили 30 детей, в качестве стартовой терапии получавшие пиперациллин/тазобактам (Ауротаз-Р); во второй группе (n = 33) стартовая терапия проводилась цефалоспоринами третьего поколения или комбинацией их с аминогликозидами.
Результаты. Выбор препарата Ауротаз-Р в качестве стартового был связан с широким спектром его действия как на грамположительную, так и на грамотрицательную флору. По результатам микробиологического мониторинга чувствительность к пиперациллину/тазобактаму составила 95,5 %.
Средний период пребывания в отделении интенсивной терапии у детей первой группы составил 8,5 ± 2,3 дня. Случаев неэффективности назначенной эмпирической антибактериальной терапии у пациентов этой группы не было. В группе контроля средний период пребывания в отделении составил 14,0 ± 3,9 дня — достоверно дольше, чем у больных первой группы. Потребность в более длительном лечении объяснялась необходимостью смены антибиотика в 81,9 % случаев в связи с недостаточной клинической эффективностью.
Заключение. Широкий спектр действия, а также удобство дозирования в детском возрасте позволяют рассматривать Ауротаз-Р как препарат выбора для интенсивной терапии тяжелых пневмоний у детей, что подтверждается результатами микробиологического мониторинга и высокой клинической эффективностью по результатам данного исследования.
Актуальність. Незважаючи на успіхи клінічної мікробіо-логії, етіотропна терапія тяжких інфекцій, у тому числі пневмоній, на початковому етапі залишається емпіричною, при цьому її адекватність відіграє ключову роль у рятуванні життя хворого.
Мета роботи — удосконалення лікування тяжких пневмоній, що потребують інтенсивної терапії, в дитячому віці.
Матеріали та методи. Під наглядом перебувало 63 хворих від 9 місяців до 14 років, які отримували лікування у відділенні анестезіології та інтенсивної терапії з приводу тяжких позалікарняних пневмоній. Першу групу склали 30 дітей, які в якості стартової терапії одержували піперацилін/тазобактам (Ауротаз-Р); у другій групі (n = 33) стартова терапія проводилася цефалоспоринами третього покоління або комбінацією їх з аміноглікозидами.
Результати. Вибір препарату Ауротаз-Р в якості стартового був пов’язаний із широким спектром його дії як на грампозитивну, так і на грамнегативну флору. За результатами мікробіологічного моніторингу чутливість до піперациліну/тазобактаму становила 95,5 %.
Середній період перебування у відділенні інтенсивної терапії у дітей першої групи становив 8,5 ± 2,3 дня. Випадків неефективності призначеної емпіричної антибактеріальної терапії у пацієнтів цієї групи виявлено не було. У групі контролю середній період перебування у відділенні становив 14,0 ± 3,9 дня — достовірно довше, ніж у хворих першої групи. Потреба в більш тривалому лікуванні пояснювалася необхідністю зміни антибіотика у 81,9 % випадків у зв’язку з недостатньою клінічною ефективністю.
Висновок. Широкий спектр дії та зручність дозування в дитячому віці дозволяє розглядати Ауротаз-Р як препарат вибору для інтенсивної терапії тяжких пневмоній у дітей, що підтверджується даними мікробіологічного моніторингу та високою клінічною ефективністю за результатами даного дослідження.
Introduction. Despite the success of clinical microbiology, causal treatment of severe infections, including pneumonia, is empirical at the initial stage, and its adequacy is crucial for saving the patient’s life.
Objective of the study — to improve the treatment of severe pneumonia requiring intensive care in childhood.
Materials and Methods. We observed 63 patients aged 9 months to 14 years who were treated in the department of ane-sthesiology and intensive care for severe community-acquired pneumonia. The first group consisted of 30 children, who received piperacillin/tazobactam (Aurotaz-P) as initial therapy; in the second group (n = 33), the initial treatment was carried out using third-generation cephalosporins or their combination with aminoglycosides.
Results. The choice of Aurotaz-P as initial drug has been associated with a wide range of its impact on both Gram-positive and Gram-negative flora. According to the results of microbiological monitoring, the sensitivity to piperacillin/tazobactam was 95.5 %.
The average period of stay in the intensive care unit in the first group was 8.5 ± 2.3 days. In this group, there were no cases of empirical antibiotic therapy failure. In the control group, the average period of stay in the department was 14.0 ± 3.9 days — significantly longer than in patients of the first group. The need for more prolonged treatment was due to the need to change the antibiotic in 81.9 % of cases because of the lack of clinical efficacy.
Conclusions. A wide range of action, as well as the ease of dosing in childhood, allows us to consider Aurotaz-P as the drug of choice for intensive care of severe pneumonia in children, as evidenced by the results of microbiological monitoring and high clinical efficacy according to the results of this study.
Статья опубликована на с. 56-60
Введение
Несмотря на успехи в лечении и диагностике, достигнутые в последние годы, проблема терапии тяжелых инфекций остается актуальной. Это обусловлено возрастающей частотой затяжного течения и неблагоприятных исходов заболевания.
Несмотря на значительные успехи клинической микробиологии, этиотропная терапия пневмоний, по крайней мере на начальном этапе, остается эмпирической и, вероятно, будет таковой в обозримом будущем. Основным этиологическим фактором внебольничных пневмоний принято считать Streptococcus Pneumoniae [1, 3]. По данным литературных источников, этот возбудитель выявляется у 45–70 % больных [2]. Вторым по частоте возбудителем пневмонии у детей раннего возраста считают Haemophilus influenzae (около 10–15 % больных). При этом у них нередко выявляется сочетанная пневмококко-гемофильная этиология пневмонии. В конце прошлого века распространенными возбудителями пневмоний у детей первых месяцев жизни были стафилококки, но сейчас их как этиологический агент пневмонии идентифицируют гораздо реже. У 10–12 % больных детей пневмонию вызывают микоплазмы и хламидии [3].
Анализ данных литературы также свидетельствует, что в этиологии острых пневмоний бактерии в виде монокультур составляют до 45 %, в виде бактериальных ассоциаций — 26–37 %, ассоциаций с вирусами — 9–12 % и микоплазмой — от 7 до 10 %. При осложненных формах пневмонии летальность составляет 10–30 % [2]. Разумеется, адекватная эмпирическая антибактериальная терапия играет ключевую роль в спасении жизни больного.
Цель работы — усовершенствование лечения тяжелых пневмоний, требующих интенсивной терапии, в детском возрасте.
Материалы и методы
В течение 2013–2015 гг. под нашим наблюдением находилось 63 больных в возрасте от 9 месяцев до 14 лет, получавших лечение в отделении анестезиологии, интенсивной терапии и хрониодиализа Запорожской городской детской многопрофильной больницы № 5 по поводу тяжелых внегоспитальных пневмоний. Первую группу — группу исследования — составили 30 детей, в качестве стартовой терапии получавшие пиперациллин/тазобактам (Ауротаз-Р) в качестве монотерапии или в комбинации с гликопептидами (ванкомицин); вторую группу — группу сравнения — составили дети (n = 33) с тяжелыми внегоспитальными пневмониями, стартовая терапия которым проводилась цефалоспоринами третьего поколения или комбинацией цефалоспоринов третьего поколения (цефтриаксон, цефотаксим или цефтазидим) с аминогликозидами (амикацин).
Всем детям проводилось рентгенологическое исследование при поступлении и в динамике, микробиологическое исследование смывов дыхательных путей, плеврального экссудата и крови, определение лабораторных индексов интоксикации (Кальф-Калифа, Даштаянца, Любимовой) и уровня среднемолекулярных пептидов. Кроме того, в отделении в течение последних 6 лет производится микробиологический мониторинг преобладающей внегоспитальной и нозокомиальной микрофлоры, позволяющий получать эпидемиологические данные о распространенности и антибиотикорезистентности бактериальных возбудителей инфекций определенной локализации. Статистическая обработка данных производилась с помощью пакета программ Microsoft Еxcel и StatSoft 6.
Результаты
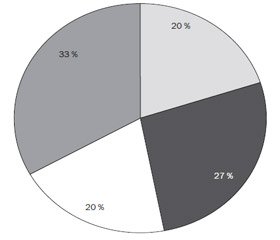
Обращает на себя внимание, что в течение последних двух лет (2014–2015 гг., n = 30) только у 6 пациентов (20 %) с тяжелыми пневмониями из дыхательных путей или пунктата плевральной полости при поступлении была выделена исключительно грамположительная флора (у половины из них — в виде ассоциаций); у 8 пациентов (27 %) определялась грамотрицательная флора и у 6 (20 %) — ассоциации грамположительных и грамотрицательных микроорганизмов. У 10 детей (33 %) микробиологическое исследование не выявило инфекционного агента (рис. 1). У 6 детей (20 %) уже при поступлении были выделены грибы рода Candida.
-vak/24-1.jpg)
Среди грамположительных микроорганизмов преобладал пневмококк, который был выделен у 33 % больных с положительными посевами, однако из них в 2/3 случаев — в ассоциациях с –грамотрицательной микрофлорой; на втором месте был золотистый стафилококк, выделенный у 4 пациентов (20 %) в ассоциациях с другой грамположительной либо грамотрицательной микрофлорой, а также грибами рода кандида. Среди грамотрицательных микроорганизмов превалировала гемофильная палочка, как в качестве монофлоры, так и в ассоциациях выделенная у 10 больных (50 % случаев положительных посевов), а также Moraxella catarrhalis, Klebsiella pneumoniae и — в 2 случаях (10 % положительных посевов) — Pseudomonas aeruginosa (рис. 2).
-vak/25-1.jpg)
Представляется интересным сравнение полученных результатов с аналогичным исследованием, проводившимся в 2010–2011 годах (n = 20). На первом месте в этиологической структуре был пневмококк (40 % случаев), на втором — золотистый стафилококк (30 %), а гемофильная палочка определялась только в 20 % случаев. Всего –грамотрицательная флора была выделена только у трети детей. Таким образом, у 60 % пациентов определялась грамположительная флора, у 20 % — грамотрицательная, и в 20 % случаев были выявлены ассоциации грамположительных и грамотрицательных микроорганизмов.
В настоящее время при тяжелых инфекциях, требующих интенсивной терапии, существует практика деэскалационного принципа антибиотикотерапии [4]. Его суть состоит в стартовом назначении антибактериальных препаратов максимально широкого спектра действия, с последующей сменой после идентификации возбудителя и определения его чувствительности по результатам микробиологического исследования. Если же инфекционный агент не выявлен, антибиотик наиболее широкого спектра действия должен назначаться в максимальной курсовой дозе (как правило, 10–14 дней). Эта практика применима и в случае тяжелых пневмоний, так как позволяет быстро добиться положительной динамики объема пневмонической инфильтрации, предупредить развитие легочных и внелегочных осложнений, таких как деструкция легочной ткани, респираторный дистресс-синдром взрослого типа, сепсис и другие. Кроме того, по нашему опыту, такой подход является оправданным с экономической точки зрения, так как позволяет значительно уменьшить вероятность назначения повторных курсов антибиотиков более широкого спектра действия, а также сократить сроки пребывания больного в отделении интенсивной терапии.
Обратила на себя внимание возможность использования в качестве стартового препарата защищенного пенициллина нового поколения пиперациллина/тазобактама (Ауротаз-Р) в связи с его широким спектром действия [4]. Такой спектр позволяет использовать Ауротаз-Р при тяжелых, требующих интенсивной терапии пневмониях смешанной этиологии у детей либо в качестве монотерапии, либо в комбинации с гликопептидом. Последняя используется при подозрении на наличие метициллинрезистентных стафилококков, которое, как правило, возникает, если ребенок до поступления в отделение интенсивной терапии получал антибактериальную терапию современными препаратами, либо в случаях, когда ребенок находился длительное время в отделении реанимации новорожденных.
Преимущество препарата Ауротаз-Р в педиатрической практике заключается также в том, что после разведения остаток можно использовать в течение 24 часов. Это дает возможность у детей раннего возраста использовать один флакон в сутки, добиваясь лучшего экономического эффекта.
Выбор препарата для стартовой антибактериальной терапии был продиктован также результатами микробиологического мониторинга. На рис. 3 представлена чувствительность микроорганизмов, выделяемых из верхних дыхательных путей, трахеи или плевральной полости детей с тяжелыми внегоспитальными пневмониями. По результатам анализа полученных данных выявлено, что на современном этапе высока чувствительность грамположительной флоры к гликопептидам и оксазолидинонам, однако ее невысокий удельный вес не позволяет уверенно использовать эти препараты в качестве монотерапии, так как грамотрицательные микроорганизмы к этим препаратам не чувствительны. По этой же причине нерационально в качестве стартового препарата использовать макролиды. Чувствительность к цефалоспоринам первого поколения, по нашим данным, не превышает 20 %, второго и третьего — до 80 %, четвертого — не более 70 %. Чувствительность к амоксициллину/клавуланату также оказалась ниже 80 %, к тикарциллину/клавуланату была нечувствительна половина микроорганизмов. Определена высокая (более 90 %) чувствительность внегоспитальной флоры к карбапенемам и современным аминогликозидам. Чувствительность к пиперациллину/тазобактаму (Ауротаз-Р) составила 95,5 % — в одном случае синегнойная палочка оказалась умеренно устойчива к данному препарату (рис. 3).
-vak/26-1.jpg)
Возвращаясь к исследуемой группе больных с тяжелыми пневмониями, следует отметить, что у 16 детей из группы исследования (53 %) при поступлении отмечалось повышение индексов интоксикации, что коррелировало с повышением уровня средних молекул и требовало проведения от одного до трех сеансов дискретного плазмафереза. Четверым больным (13 %) назначались внутривенные иммуноглобулины курсами по 3 суток. До 5–8-х суток терапии в отделении у всех пациентов такая тактика приводила к снижению индексов интоксикации до нормальных показателей. У троих детей потребовалась агрессивная хирургическая тактика в виде торакоскопии и удаления плотного фибринозного налета, образовавшегося вокруг очага поражения. У всех этих больных в посевах был выделен пневмококк — в качестве моноинфекции или в ассоциациях. На вторые-третьи сутки пребывания в отделении 23 детям (77 %) проводилась фибробронхоскопия с целью санации бронхиального дерева и улучшения дренирования пораженных участков легочной ткани [5]. Средний период пребывания в отделении интенсивной терапии у детей этой группы составил 8,5 ± 2,3 дня. Смена антибиотика потребовалась одному ребенку (3,3 %) в связи с окончанием 10-дневного курса лечения (замена на карбапенем), еще 4 пациентам (13,3 %) был назначен второй курс лечения в виде пероральных макролидов. Случаев неэффективности назначенной эмпирической антибактериальной терапии у пациентов этой группы выявлено не было.
В группе контроля повышение индексов интоксикации отмечалось при поступлении у 15 детей (45,5 %), что также требовало назначения 2–3 сеансов плазмафереза и внутривенного введения иммуноглобулина коротким курсом. Однако в этой группе детей у 4 (26,7 %) не произошло полной нормализации индексов интоксикации к моменту перевода из отделения интенсивной терапии (12–24-е сутки). Средний период пребывания в отделении в группе контроля составил 14,0 ± 3,9 дня — достоверно дольше, чем у больных первой группы. Отчасти необходимость в более длительном лечении в отделении интенсивной терапии объяснялась необходимостью смены антибиотика — 3-и — 4-е сутки: только у 4 из 33 больных (18,1 %) стартовая терапия (цефтриаксон либо цефтриаксон + амикацин) оказалась эффективной. В остальных 81,9 % случаев требовалась смена антибиотика в связи с недостаточной клинической эффективностью (продолжающаяся лихорадка, отсутствие положительной динамики респираторных нарушений, сохранение или нарастание воспалительных изменений в анализах крови).
Обсуждение результатов
Если сравнить полученные в последние годы данные с аналогичным исследованием пятилетней давности, прослеживается тенденция к возрастанию роли грамотрицательной флоры, а также бактериальных ассоциаций в этиологической структуре тяжелых внегоспитальных пневмоний у детей, что диктует необходимость пересмотра тактики стартовой антибактериальной терапии. Препарат Ауротаз-Р (пиперациллин/тазобактам) обладает широким спектром действия в отношении как грамположительных, так и грамотрицательных микроорганизмов. Такой спектр, а также удобство дозирования в детском возрасте позволяют рассматривать Ауротаз-Р как препарат выбора для интенсивной терапии тяжелых пневмоний у детей, что подтверждается результатами микробиологического мониторинга и высокой клинической эффективностью по результатам данного исследования.
Выводы
1. В настоящее время в этиологической структуре тяжелых внегоспитальных пневмоний преобладает грамотрицательная флора либо ассоциации грамположительных и грамотрицательных микроорганизмов, что следует учитывать при выборе препаратов для стартовой эмпирической терапии.
2. Пневмококковые пневмонии на современном этапе характеризуются частыми деструктивными изменениями в легких и обильными фибринозными наложениями в плевральной полости, что требует активной хирургической тактики.
3. Деэскалационный принцип назначения антибактериальной терапии при тяжелых пневмониях у детей в настоящее время оправдан и продиктован прежде всего благом каждого конкретного пациента.
4. Использование препарата Ауротаз-Р (пиперациллин/тазобактам) в качестве стартового антибактериального препарата при тяжелых пневмониях, требующих интенсивной терапии, у детей дает возможность улучшить результаты лечения, уменьшить количество курсов антибиотиков, а также длительность пребывания ребенка в отделении интенсивной терапии.
Список литературы
1. Брико Н.И. Распространенность и возможности профилактики пневмококковых инфекций в мире и России [Электронный ресурс] / Н.И. Брико // Бюллетень «Вакцинация». — 2009. — № 2. Режим доступа: http://www.privivka.ru/ru/expert/bulletin/archive/?id = 1&tid = 4.
2. Нудьга А.Н. Тяжелые пневмонии с фатальным исходом (анализ течения, особенности) [Электронный ресурс] / А.Н. Нудьга, Е.А Ковалева, В.А. Галинская с соавт. // Медицина неотложных состояний. — 2006. — № 5 (6). Режим доступа: http://www.mif-ua.com/archive/article_print/945.
3. Шабалов Н.П. Пневмонии у детей раннего возраста [Электронный ресурс] / Н.П. Шабалов // Лечащий врач. — 2003. — № 2. Режим доступа: http://www.lvrach.ru/2003/02/4530038.
4. Janowski A.B. Piperacillin-Tazobactam Usage at a Tertiary Pediatric Hospital: An Antimicrobial Stewardship Review [Электронный ресурс] / А.В. Janowski, M.G. Michaels, J.M. Martin, M.D. Green // J. Pediatric Infect. Dis. Soc. — 2015. Access mode: http://www.ncbi.nlm.nih.gov/pubmed/26407269#.
5. Zhang Y. Effects of bronchoalveolar lavage on refractory Mycoplasma pneumoniae pneumonia [Электронный ресурс] / Y. Zhang, Y. Chen, Z. Chen et al. // Respir. Care. — 2014. — V. 59, № 9. — P. 1433-1439. Режим доступа: http://www.ncbi.nlm.nih.gov/pubmed/24962224.
1. Briko N.I. (2009) Prevalence and opportunities of pneumococcus infections prophylactic on the World and in Russia. Butteten’ “Vaktsinatsiia”, (2). Available at: http://www.privivka.ru/ru/expert/bulletin/archive/? іd=1&tid=4.
2. Nudga A.N., Kovaleva E.A., Galinskaia V.A., Sidorenko O.A., Ponomarenko A.I. Hard pneumonias with fatal outcome (analysis of course, peculiarities). Meditsina neotlozhnykh sostoianii, 2006, (5(6)). Available at: http://www.mif-ua.com/archive/article_print/945.
3. Shabalov N.P. Pneumonias in young age children. Lechashchii vrach, 2003, (2). Available at: http://www.lvrach.ru/2003/02/4530038.
4. Janowski A. B. Piperacillin-Tazobactam Usage at a Tertiary Pediatric Hospital: An Antimicrobial Stewardship Review. J. Pediatric Infect. Dis. Soc., 2015. Access mode: http://www.ncbi.nlm.nih.gov/pubmed/26407269#.
5. Zhang Y., Chen Y., Chen Z., Zhou Y., Sheng Y., Xu D., Wang Y. (2014). Effects of bronchoalveolar lavage on refractory Mycoplasma pneumoniae pneumonia. Respir. Care, 59(9), 1433-1439. Available at: http://www.ncbi.nlm.nih.gov/pubmed/24962224.

-vak/24-1.jpg)
-vak/25-1.jpg)
-vak/26-1.jpg)