Международный эндокринологический журнал 4 (68) 2015
Вернуться к номеру
Стан статевої функції у чоловіків, хворих на цукровий діабет 2-го типу
Авторы: Лучицький В.Є. - ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Статева дисфункція розглядається як одне з найчастіших ускладнень цукрового діабету 2-го типу. Патологічним змінам в органах статевої системи у чоловіків, які страждають від цукрового діабету, властивий хронічний прогресуючий характер, причому ці зміни негативно впливають на перебіг діабету. Мета дослідження — вивчити стан статевої функції у чоловіків, які страждають від цукрового діабету 2-го типу. Матеріали і методи. Обстежено 205 чоловіків, хворих на цукровий діабет 2-го типу, зі скаргами на порушення еректильної функції (середній вік 48,0 ± 4,6 року). Оцінка порушень статевої функції проводилася згідно з даними анкетування пацієнтів за шкалою міжнародного індексу еректильної функції та квантифікаційною шкалою сексуальної формули чоловіка. Результати. Середній показник індексу еректильної функції становив 17,23 ± 2,08 бала vs 26,75 ± 0,79 бала у контрольній групі (р < 0,01). Показник задоволення статевим актом у пацієнтів із цукровим діабетом 2-го типу був знижений (9,34 ± 0,93) порівняно з контролем (16,18 ± 0,68; р < 0,01). Показники оргастичних відчуттів (6,48 ± 0,72 бала) і статевого потягу (9,44 ± 0,95 бала) в обстежених пацієнтів були нижчі, ніж у контрольній групі (9,23 ± 0,26 бала (р < 0,05) і 13,93 ± 0,56 бала (р < 0,01) відповідно). Найбільш висока частота еректильной дисфункції у чоловіків, хворих на цукровий діабет 2-го типу, припадає на вікову групу старше 40 років. У більшості хворих на цукровий діабет 2-го типу (62,4 %) спостерігається еректильна дисфункція помірного ступеня. Рівень загального тестостерону в обстежених чоловіків віком 41–50 років був знижений порівняно з контрольною групою (3,1 ± 0,47 нг/мл і 5,63 ± 0,9 нг/мл відповідно, р < 0,01), але перебував на нижній межі вікової норми. У більшості чоловіків, хворих на цукровий діабет 2-го типу, спостерігалося ураження декількох складових копулятивного циклу: трьох складових — у 55,3 % пацієнтів і двох складових — у 18,4 % хворих.
Половая дисфункция рассматривается как одно из наиболее частых осложнений сахарного диабета 2-го типа. Патологическим изменениям в органах половой системы у мужчин, страдающих сахарным диабетом, присущ хронический прогрессирующий характер, причем эти изменения негативно влияют на течение диабета. Цель исследования — изучить состояние половой функции у мужчин, страдающих сахарным диабетом 2-го типа. Методы. Обследовано 205 мужчин, больных сахарным диабетом 2-го типа, с жалобами на нарушения эректильной функции (средний возраст 48,0 ± 4,6 года). Оценка нарушений половой функции проводилась согласно данным анкетирования пациентов по шкале международного индекса эректильной функции и квантификационной шкале сексуальной формулы мужчин. Результаты. Средний показатель индекса эректильной функции составил 17,23 ± 2,08 балла vs 26,75 ± 0,79 балла в контрольной группе (р < 0,01). Показатель удовлетворения половым актом у пациентов с сахарным диабетом 2-го типа был снижен (9,34 ± 0,93) по сравнению с контролем (16,18 ± 0,68; р < 0,01). Показатели оргастических ощущений (6,48 ± 0,72 балла) и полового влечения (9,44 ± 0,95 балла) у обследованных пациентов были ниже, чем в контрольной группе (9,23 ± 0,26 балла (р < 0,05 ) и 13,93 ± 0,56 (р < 0,01) балла соответственно). Наиболее высокая частота эректильной дисфункции у мужчин, больных сахарным диабетом 2-го типа, приходится на возрастную группу старше 40 лет. У большинства больных с сахарным диабетом 2-го типа (62,4 %) наблюдается эректильная дисфункция умеренной степени. Уровень общего тестостерона у обследованных мужчин в возрасте 41–50 лет был снижен по сравнению с контрольной группой (3,1 ± 0,47 нг/мл и 5,63 ± 0,9 нг/мл
соответственно, р < 0,01), но находился на нижней границе возрастной нормы. У большинства мужчин, больных сахарным диабетом 2-го типа, наблюдалось поражение нескольких составляющих копулятивного цикла: трех составляющих — у 55,3 % пациентов и двух составляющих — у 18,4 % больных.
Sexual dysfunction is considered as one of the most common complications of type 2 diabetes mellitus. Pathological changes in organs of the reproductive system in men suffering from diabetes mellitus are characterized by chronic progressive nature, and these changes adversely affect the course of diabetes. The objective of the study — to examine the state of sexual function in men suffering from type 2 diabetes mellitus. Materials and methods. The study involved 205 men with type 2 diabetes mellitus with complaints about violations of erectile function (average age 48.0 ± 4.6 years). Sexual function disorders were assessed according to the data of questioning patients by international index of erectile function and male sexual formula quantification scale. Results. The average index of erectile function was 17.23 ± 2.08 points vs 26.75 ± 0.79 in the control group (p < 0.01). Index of sexual intercourse satisfaction in patients with type 2 diabetes mellitus was reduced (9.34 ± 0.93) compared with control one (16.18 ± 0.68; p < 0.01). Indicators of orgasmic sensations (6.48 ± 0.72 points) and sexual desire (9.44 ± 0.95 points) in the examined patients were lower than in the control group (9.23 ± 0.26 points (p < 0.05) and 13.93 ± 0.56 (p < 0.01) points, respectively). The highest incidence of erectile dysfunction in men with type 2 diabetes mellitus is in the age group over 40 years. The majority of patients with type 2 diabetes mellitus (62.4 %) had moderate erectile dysfunction. The level of total testosterone in men aged 41–50 years was reduced compared with the control group (3.10 ± 0.47 ng/ml
and 5.63 ± 0.90 ng/ml, respectively, p < 0.01), but it was at the lower limit of age norm. In most male patients with type 2 diabetes mellitus, there were disorders of several components of copulative cycle: 3 components — in 55.3 % of patients and 2 components — in 18.4 % of patients.
цукровий діабет 2-го типу, еректильна дисфункція, тестостерон.
сахарный диабет 2-го типа, эректильная дисфункция, тестостерон.
type 2 diabetes mellitus, erectile dysfunction, testosterone.
Статья опубликована на с. 76-84
У чоловіків до статевої дисфункції належать порушення ерекції, еякуляції, лібідо і оргазму. Найбільш поширеною формою статевих порушень у чоловіків є еректильна дисфункція (ЕД). ЕД — постійна або персистуюча нездатність досягти та/або підтримувати ерекцію, достатню для задоволення статевої активності [1]. Обстеження 1134 чоловіків, які мали статеву дисфункцію (ЕД — у 92,6 %, зниження лібідо — 36,8 %, передчасна еякуляція — 25,9 % і затримка еякуляції — 5,6 %), виявило, що 21,8 % із них хворіли на цукровий діабет 2–го типу (ЦД–2), а 29 % мали компоненти метаболічного синдрому (МС) [2]. За іншими даними (обстежено 1464 чоловіки з клінічним діагнозом «статева дисфункція») встановлено, що ЕД спостерігалася у 96,2 %, передчасна еякуляція — у 50,8 %, гіполібідемія — у 7,6 % [3]. Вважають, що ЕД є «порталом» чоловічого здоров’я, оскільки існує відповідність між причинами розвитку ЕД і причинами розвитку серцево–судинних захворювань (ССЗ) [4]. Тому ЕД може бути попереджувальним сигналом для ранньої інтервенції — адекватного й агресивного лікування у чоловіків будь–яких факторів ризику. За приблизними оцінками, наприкінці минулого століття кількість чоловіків, хворих на ЕД, становила близько 152 млн, і, беручи до уваги тенденції зростання, прогнозується зростання цього показника більше ніж удвічі до 2025 року. За даними Масачусетського дослідження старіння чоловіків (MMAS), серед чоловіків віком від 40 до 69 років (середній період спостереження — 8,8 року) поширеність ЕД становила 52 % [5]. Найчастішими причинами розвитку органічної ЕД, згідно з даними MMAS, є: артеріальна гіпертензія (АГ), ЦД–2 та ССЗ. Спостерігається тісний взаємозв’язок поширеності та темпів приросту ЕД із віком. У дослідженні MMAS щорічний ступінь поширеності ЕД зростає з кожною віковою декадою: 12,4; 29,8 і 46,4 випадку на 1000 чоловіків віком 40–49, 50–59 і 60–69 років відповідно. ЕД діагностується у 35–75 % чоловіків із ЦД–2, причому спостерігається кореляція тяжкості ЕД із тривалістю ЦД, глікемічним контролем, наявністю хронічних ускладнень ЦД [6, 7].
Згідно з даними міжнародної групи дослідників (Lewis R.W., 2010) [8], у хворих на ЦД–2 середня поширеність ЕД для різних вікових груп становить: до 40 років — 1–10 %, від 40 до 49 років — 2–9–15 %, від 50 до 59 років — 20–40 %, від 60 до 69 років — 40–50 % і у чоловіків, старших за 70 і 80 років, — від 50 до 100 % відповідно [9].
ЕД — часте захворювання, що супроводжує ЦД або є його ускладненням. За різними даними, поширеність ЕД при ЦД перебуває в межах від 25 до 90 % [10–12]. У Масачусетському дослідженні старіння чоловіків встановлено, що у чоловіків із ЦД імовірність розвитку ЕД була втричі вищою, ніж у їх ровесників без ЦД [13]. Існує думка, що ЕД може розглядатися як можливий провісник розвитку ЦД–2 та маркер прогресування судинних ускладнень ЦД. Згідно з даними того ж MMAS [14], ЕД розвивається у чоловіків на 10–15 років раніше від часу діагностування ЦД і асоціюється з нижчими показниками якості життя [15] і меншою ефективністю пероральної терапії, ніж ЕД у чоловіків без ЦД [16]. У мультинаціональному дослідженні ставлення чоловіків до життєвих подій та їх сексуальності було встановлено, що чоловіки з ЦД оцінювали свою ЕД як більш тяжку хворобу і таку, що сильніше впливає на загальне здоров’я, ніж чоловіки без ЦД [17].
ЦД — одне з найпоширеніших захворювань і належить до неінфекційних епідемій сучасності. ЦД посідає третю позицію після онкологічних і серцево–судинних захворювань, що є найчастішими причинами смерті та інвалідизації. ЦД–2 належить до одного з кластерів МС, причому деякі дослідники (Corona J. et al., 2006) [18] вважають, що ЕД трапляється частіше і є більш тяжкою у таких хворих, що обумовлено поєднаним впливом інших кластерів МС, у першу чергу АГ, вісцерального ожиріння, дисліпідемії [19]. Поширеність ЕД у чоловіків із МС становить 36,7–76,2 %, причому найбільш агресивними чинниками були інсулінорезистентність (ІР), гіперінсулінемія, ЦД–2 [20]. Результати Diabetes Report Card (2012) Американського центру з контролю і профілактики захворювань також вказують на різке зростання поширеності ЦД–2 в США за останні десятиліття: відзначено трикратне збільшення щорічного числа нових випадків ЦД у період із 1990 по 2010 р. порівняно з попереднім періодом. Поясненням цьому феномену є старіння популяції, гіподинамія та ожиріння [21]. Розвиток і прогресування хронічних ускладнень ЦД–2, особливо мікро– і макроангіопатій, полінейропатій, належать до ключових факторів, що призводять до розвитку статевої дисфункції. З позицій персоніфікованої гендерної медицини статева дисфункція розглядається як одне з найбільш частих ускладнень ЦД–2. Патологічним змінам в органах статевої системи у чоловіків, які страждають від ЦД, притаманний хронічний прогресуючий характер, причому ці зміни негативно впливають на перебіг ЦД.
Основними біохімічними проявами ЦД–2, що призводять до розвитку макро– і мікросудинних ускладнень, є ІР і хронічна гіперглікемія [22]. Гіперглікемія призводить до підвищеної глікації еластичних волокон, внаслідок чого відбувається недостатня релаксація кавернозних тіл статевого члена в процесі ерекції. Встановлено, що поганий глікемічний контроль асоційований із вищим ризиком розвитку ЕД [23–25]. Крім того, у хворих на ЦД–2 наявний синергізм ІР та пов’язаних з нею коморбідних станів: МС, ожиріння, АГ, атеросклерозу, автономної нейропатії, кожен з яких, що загальновизнано, є самостійним фактором ризику розвитку ЕД [26, 27]. Дослідники виділяють такі механізми розвитку ЕД у чоловіків із ЦД–2 [28, 29]:
— ендотеліальна дисфункція синусоїдальних ендотеліальних клітин, що призводить до зменшення продукції оксиду азоту та порушення вазодилатації [30];
— глікація еластичних волокон, що призводить до недостатньої релаксації кавернозних тіл статевого члена в процесі ерекції [31];
— недостатність нейрональної передачі від спинного мозку внаслідок діабетичної нейропатії і зменшення продукції нейрональної NO–синтази, що призводить до зменшення вивільнення NO гладкими м’язами кавернозних тіл [32, 33];
— андрогенодефіцит [34–37];
— прийом препаратів, що призводять до виникнення ЕД, зокрема антигіпертензивних ліків (діуретики, b–блокатори) [38, 39];
— макро– і мікросудинні порушення, спричинені ліпідними порушеннями та АГ, що призводять до розвитку атеросклеротичних змін у пенільних артеріях [40, 41].
У той же час лише незначний відсоток чоловіків, які страждають від ЕД, звертаються за допомогою до лікарів, і лише деякі з них отримують адекватне лікування. При ретроспективному дослідженні історій хвороб чоловіків із ЦД встановлено, що питання про стан еректильної функції ставили тільки 8 % лікарів, які проводили огляд пацієнтів [42].
Мета дослідження — вивчити стан статевої функції у чоловіків, які страждають від ЦД–2.
Матеріал і методи дослідження
Нами обстежено 205 чоловіків, хворих на ЦД–2, зі скаргами на порушення еректильної функції, які перебували на лікуванні в ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» (м. Київ). Середній вік обстежених пацієнтів становив 48,0 ± 4,6 року (27–68 років). Діагноз ЦД був встановлений лікарем–ендокринологом. Рівень глікованого гемоглобіну (HbA1c) на момент обстеження не перевищував 6,5 %, що, згідно з критеріями Міжнародної діабетичної федерації (IDF), є ознакою компенсації вуглеводного обміну у хворих на ЦД–2. У 160 обстежених пацієнтів (78 %) діагностовано ожиріння I–II ступеня (середній показник індексу маси тіла — 34,46 ± 1,06 кг/м2, окружності талії — 112,86 ± 2,38 см). У 129 хворих (62,9 %) в анамнезі діагностована АГ.
Оцінка порушень статевої функції проводилася з урахуванням віку пацієнтів та тривалості основного захворювання. Стан еректильної функції визначався за даними анкетування пацієнтів за шкалою міжнародного індексу еректильної функції (МІЕФ) [43, 44]. Анкета складається з 15 питань, відповіді на які дозволяють отримати оцінку пацієнтом стану свого лібідо, еректильної функції, оргазму, задоволеності від статевого акту та загальної задоволеності статевим життям.
Структурний аналіз статевої дисфункції в обстежених пацієнтів проведений з використанням квантифікаційної шкали сексуальної формули чоловіка (СФЧ) [45]. Квантифікаційна шкала СФЧ є надійним інструментом структурного аналізу сексуальних розладів. Метод дозволяє оцінити функціональний стан підсистем регуляції складових копулятивного циклу: нейрогуморальної, психічної, еректильної, еякуляторної, а також виявити стрижневий синдром статевого розладу. Три функціональні тріади характеризують стан попередньої нейрогуморальної готовності, стан психічної складової, а також результат їх інтегративної взаємодії, що проявляється статевою активністю.
Для порівняння отриманих результатів був використаний профіль СФЧ для гіпотетичного випадку середньої статистичної норми, визначений у нашій попередній роботі [46].
Дані про тривалість і тяжкість перебігу ЦД–2 взяті з карт стаціонарного або амбулаторного пацієнта.
Визначення рівнів загального тестостерону, лютеотропного гормону та естрадіолу в сироватці крові обстежених пацієнтів проводилося методом імуноферментного аналізу.
Контрольну групу становили 24 практично здорових чоловіки, без скарг на статеву дисфункцію, віком від 25 до 58 років.
Обробка даних проводилася з використанням стандартного пакета програмного забезпечення Exсel.
Результати та їх обговорення
Проведене обстеження пацієнтів показало зниження всіх інтегративних показників МІЕФ–15 (табл. 1). Так, середній показник індексу еректильної функції становив 17,23 ± 2,08 бала і був вірогідно нижчим, ніж у контрольній групі, — 26,75 ± 0,79 бала (р < 0,01) (табл. 1). Показник задоволення статевим актом у пацієнтів із ЦД–2 був знижений порівняно з контролем (9,34 ± 0,93 бала і 16,18 ± 0,68 бала відповідно; р < 0,01). Показники оргастичних відчуттів (6,48 ± 0,72 бала) і статевого потягу (9,44 ± 0,95 бала) в обстежених пацієнтів були нижчі, ніж у контрольній групі — 9,23 ± 0,26 бала (р < 0,05) і 13,93 ± 0,56 бала (р < 0,01) відповідно. Зниження цих показників закономірно призводить до незадоволеності статевим життям, що підтверджувалося вірогідним зниженням відповідного індексу у чоловіків із ЦД–2 (6,12 ± 0,75 бала) порівняно з контрольною групою (8,98 ± 0,91 бала; р < 0,05).
У чоловіків, хворих на ЦД, поширеність ЕД зростає з віком, як і поширеність діабету. За нашими даними, критичне зростання частоти ЕД у чоловіків, хворих на ЦД–2, припадає на вікову групу старше 40 років: у віковій групі 41–50 років поширеність ЕД була приблизно в 4 рази вище, ніж у чоловіків віком від 31 до 40 років (табл. 2).
Ці дані збігаються з результатами, отриманими в Cologne Male Survey (Braun M. et al., 2000), де було чітко показано значне зростання поширеності ЕД у чоловіків із ЦД віком понад 40 років порівняно з однолітками без ЦД. Тривалість основного захворювання також впливала на частоту порушень еректильної функції у чоловіків із ЦД–2. Аналіз показників еректильної функції у чоловіків із ЦД–2 залежно від тривалості ЦД показав, що погіршення її спостерігалося при тривалості основного захворювання 5–10 і понад 10 років. Дискутабельним є питання впливу компенсації метаболічних порушень, в першу чергу вуглеводного обміну, на стан еректильної функції у чоловіків із –ЦД–2. У той же час, за даними O. Yaman еt al., статистично вірогідне зниження рівнів глюкози натще і HbА1с в обстежених пацієнтів, які страждають від ЦД 1–го і 2–го типів, не призводило до покращення показників еректильної функції, хоча вважають, що при високих рівнях глюкози натще (≥ 180 мг/дл) і HbA1c (≥ 8,1 %) ризик розвитку будь–яких хронічних ускладнень ЦД більш високий, а показники ЕД корелюють із рівнями глікемічного контролю, периферичною нейропатією і HbA1c, що є незалежними предикторами розвитку ЕД. Підкреслюємо, що не отримано відповіді на питання: чи може поліпшення глікемічного контролю покращити еректильну функцію? Незважаючи на те, що регулювання глікемічного контролю є важливим для лікування ЦД, необхідно враховувати і корегувати інші фактори в лікуванні ЦД — підвищену глікацію кінцевих продуктів (AGEs) у крові та тканинах.
Визначення індексу еректильної функції в обстежених пацієнтів показало, що у більшості хворих на ЦД–2 (62,4 %) спостерігається ЕД помірного ступеня (середній індекс еректильної функції — 15,10 ± 0,68, n = 128) і тяжка ЕД — у 22,4 % хворих (середній індекс еректильної функції — 12,20 ± 0,44, n = 46). Ці дані можна пояснити тим, що тривалість ЦД–2 у переважної кількості обстежених чоловіків (73 %) становила понад 5 років, що є передумовою приєднання діабетичної нейропатії, мікро– і макроангіопатій, а також впливом андрогенодефіциту. На думку більшості авторів, саме ці фактори мають прямий вплив на ступінь вираженості ЕД у чоловіків із ЦД–2 [47–50]. АГ є найбільш поширеним фактором ризику розвитку ендотеліальної дисфункції у хворих на ЦД–2 [51, 52]. Підвищені рівні глюкози натще, ожиріння і АГ належать до основних факторів, що впливають на тяжкість ЕД у чоловіків, які страждають від ЦД–2 та метаболічного синдрому (МС) [53]. Беручи до уваги часту асоціацію ЦД–2 та АГ, вісцерального ожиріння, дисліпідемії, що об’єднують у термін «МС», припускають, що коморбідні стани, які поєднуються з ЦД–2, призводять до розвитку більш тяжких форм ЕД. Однак ЦД залишається провідним фактором ризику розвитку ЕД, оскільки превалювання ЦД становило 77,3 % серед пацієнтів з ЕД [54]. МС — один із найбільш істотних проявів поєднання судинних факторів ризику розвитку ЕД, оскільки всі його кластери відіграють важливу роль у патогенезі ЕД [20]. Однак автори вважають, що на більш пізніх стадіях ЦД–2 порушення вегетативної рівноваги — підвищення активності симпатичної нервової системи і зниження активності парасимпатичної нервової системи — призводить до порушення нервової регуляції кавернозних тіл, розвитку діабетичної нейропатії, що відіграють істотну роль у розвитку більш тяжких форм ЕД. Автори також спостерігали порушення соматичної іннервації статевого члена у 64,3 % пацієнтів. У 78 % чоловіків, які страждали від ЦД–2, відзначалися дегенеративні порушення іннервації статевого члена. З’ясування взаємозв’язку ураження нервової тканини з ендотеліальною дисфункцією і хронічним запаленням має значення для оптимізації підходів до ранньої діагностики, своєчасного лікування і, що особливо важливо, профілактики розвитку ЕД у чоловіків, які страждають від ЦД–2.
За даними літератури, роль тестостерону в патогенезі статевих розладів у чоловіків, хворих на ЦД–2, є встановленим фактом. Ведуться дискусії в площині первинності андрогенодефіциту у розвитку ЦД–2 та ЕД. З одного боку, ряд авторів стверджують, що андрогенодефіцит — ускладнення ЦД–2 і, як наслідок, може викликати або посилювати вираженість ЕД. У той же час деякі дослідники [20, 54] виявили вірогідне зниження концентрації тестостерону в крові у більшої частини пацієнтів із ЦД–2 та порушенням потенції, що підтверджується й результатами наших досліджень [7]. За даними інших авторів, у чоловіків, які страждають від ЦД–2 та ЕД, андрогенодефіцитний стан діагностують у 1/3 пацієнтів [18, 20, 55–57]. Рівень загального тестостерону в обстежених нами чоловіків із ЦД–2 та ЕД у групі 41–50–літніх був вірогідно знижений порівняно з контрольною групою (3,10 ± 0,47 нг/мл і 5,63 ± 0,90 нг/мл відповідно, р < 0,01), але перебував на нижній межі вікової норми (табл. 3).
У старших вікових групах обстежених чоловіків відзначалося вірогідне зниження середнього рівня тестостерону, середня концентрація якого в крові становила 2,70 ± 0,71 нг/мл в 51–60–річних і 2,90 ± 0,55 нг/мл — у чоловіків старше 60 років (табл. 3). У більшості пацієнтів рівні загального тестостерону в крові були нижче 3 нг/мл, що, за даними L. Gooren (2003), вказує на абсолютний гіпогонадизм.
Середній рівень естрадіолу в обстежених пацієнтів становив 0,17 ± 0,04 пмоль/л і не відрізнявся від аналогічного показника в контрольній групі — 0,14 ± 0,02 пмоль/л. Проте в групі пацієнтів із надмірною масою тіла відзначалася тенденція до підвищення рівня естрадіолу в крові — 0,24 ± 0,07 пмоль/л (р > 0,2).
Визначення коефіцієнта Т/Е2 як маркера субклінічного андрогенодефіциту показало його вірогідне зниження у чоловіків із ЦД–2 та ожирінням (63,00 ± 8,20 бала) порівняно з обстеженими пацієнтами без ожиріння (112,40 ± 8,16 бала) і контрольною групою (136,40 ± 11,30 бала). Отримані дані свідчать про наявність у чоловіків із ЦД–2 та ожирінням відносного андрогенодефіциту.
Середній рівень лютеїнізуючого гормону (ЛГ) в обстежених чоловіків становив 4,28 ± 0,36 мО/л і не відрізнявся від середнього показника в контрольній групі (4,2 ± 0,5 мО/л). Тривалість перебігу основного захворювання і рівень загального тестостерону в обстежених пацієнтів не мали суттєвого впливу на рівень ЛГ.
Таким чином, отримані дані підтверджують наявність андрогенодефіцитного стану у чоловіків, які страждають від ЦД–2 та ЕД. Результати досліджень свідчать про те, що при ЦД–2 розвивається змішаний гіпогонадизм, обумовлений поєднанням ураження центральної і периферичної ланок системи «гіпоталамус — гіпофіз — гонади». Проведені нами раніше дослідження чітко вказують на превалювання мікроангіопатій в яєчках у чоловіків із ЦД–2 [58]. Більше того, вважають, що гіпогонадизм передує розвитку ЦД–2 у чоловіків, про що свідчать результати епідеміологічних досліджень [59–62].
Експериментальні та клінічні дослідження підтверджують істотну роль тестостерону в регуляції еректильної відповіді на центральному та периферичному рівнях [63]. Слабкий ефект інгібіторів фосфодіестерази 5–го типу у хворих на ЦД–2 може бути обумовлений змінами еректильної тканини, низьким рівнем андрогенів у крові хворих на ЦД [64]. Андрогенозалежні біохімічні та молекулярні зміни в кавернозній тканині виявляються у більшості чоловіків із ЦД–2. Ці зміни є ендотелійзалежними і опосередкованими через нервові механізми порушення релаксації кавернозних тіл [65]. Відомо, що андрогенодефіцит у чоловіків із ЦД–2 порушує фізіологічний і біохімічний субстрати еректильної функції [66, 67]. Ці процеси є оборотними і нормалізуються при медикаментозній корекції андрогенодефіциту [68, 69]. Істотна роль у патогенезі порушення ендотеліальної функції у чоловіків із ЦД–2 належить макро– і мікроангіопатії, полінейропатії (з поєднаним ураженням соматичної та автономної нервових систем), порушенням синтезу і вивільнення нейротрансмітерів на цереброспінальному і периферичному рівнях (оксиду азоту, вазоінтестинального пептиду, ацетилхоліну) [70]. Саме нейро– й ангіопатії вважаються первинними патогенетичними факторами розвитку ЕД у чоловіків, які страждають від ЦД [71]. Судинні зміни є вираженими, оскільки при всебічному обстеженні чоловіків із ЦД і ЕД виявляють помірний і тяжкий ступінь кавернозної артеріальної недостатності у 87,2 %, а при поєднанні ЦД із АГ — у 100 % пацієнтів [72]. Важливим результатом ендотеліальної дисфункції є зниження продукції та/або дії оксиду азоту — провідного фактора вазодилатації пенільної мікроциркуляції, оскільки встановлено, що у діабетичних щурів відзначається виражене зниження активності пенільної синтази оксиду азоту з редукцією в тканини статевого члена nNOS. Ці та інші експериментальні дослідження у діабетичних щурів підтвердили, що при ЦД порушена нейрогенна та ендотелійопосередкована релаксація гладких м’язів кавернозних тіл поєднано з можливим залученням холестерину або кінцевих продуктів підвищеної глікації [73]. Допплерографічні дослідження підтвердили, що судинна ЕД є найбільш важливим етіологічним фактором, а також первинним чинником у 64 % діабетичних чоловіків, підтверджуючи теорію про те, що мікроангіопатії — найбільш істотна причина діабетичної ЕД [74]. Гіперглікемія призводить до метаболічних порушень, що впливають на фізіологічні механізми ерекції — підвищений рівень глюкози призводить до регіональних гемодинамічних змін і порушення ендотелійзалежної релаксації з підвищеним утворенням вільних радикалів та інактивацією оксиду азоту та ураження ендотелію [75]. Неврологічне тестування пацієнтів із ЦД показало, що 85 % чоловіків з ЕД мали деякі форми нейропатії, тоді як у хворих на ЦД без ЕД — тільки у 40 %, а у чоловіків без ЦД з ЕД — у 44 % [76], проте не були використані специфічні тести для оцінки нейропатії.
Відомо, що у формуванні сексуальних розладів суттєву роль відіграє статева конституція чоловіків. В єдиній статевій системі, завданням якої є забезпечення процесу розмноження і сексуального задоволення, що необхідно для збереження роду, виділяють чотири підсистеми, кожна з яких має своє завдання. Нейрогуморальна складова пов’язана з діяльністю глибоких структур мозку і всієї системи ендокринних залоз, забезпечує вираженість статевого потягу і відповідну збудливість всіх відділів нервової системи, що регулюють статеву діяльність. Психічна складова пов’язана з діяльністю кори головного мозку. Вона визначає спрямованість статевого потягу, полегшує виникнення ерекції до моменту інтроїтусу, відповідність статевої активності умовам конкретної ситуації і морально–етичним вимогам. Еректильна складова забезпечує механічну сторону статевого акту. Функція виконавчого органу (статевого члена) залежить від анатомічної будови, стану кровопостачання, ендокринного та нервового (спінальні, екстраспінальні структури) забезпечення. Еякуляторна складова забезпечує виділення запліднюючого чоловічого секрету — еякуляту. Вона заснована на інтеграції структурних елементів простати з апаратом центральної нервової системи. Кожна зі складових моделюється, спираючись на іншу, і може змінюватися при патологічних станах. Сукупність діагностичних алгоритмів структурного аналізу захворювань статевої системи у чоловіків завершує ідентифікацію клінічної форми розладів. Дані про превалювання тих чи інших складових копулятивного циклу при статевій дисфункції у чоловіків із ЦД нечисленні і суперечливі: деякі дослідники виділяють як стрижневий синдром еректильну складову [77], інші вказують на переважання нейрогуморального компонента [78].
Нами проведено структурний аналіз статевої дисфункції в обстежених пацієнтів із використанням квантифікаційної шкали СФЧ. Встановлено, що сумарний показник СФЧ був зниженим у пацієнтів із ЦД–2 — 21,6 бала (середній нормальний показник — 30,0 бала) [46]. Визначення стрижневого синдрому показало, що у чоловіків, хворих на ЦД–2, також частіше уражається нейрогуморальна складова, а далі в порядку зменшення — ерекційна, психічна і еякуляторна (табл. 4).
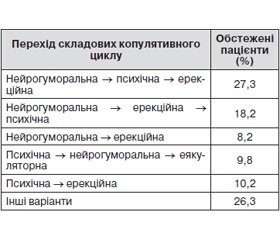
Вивчення динаміки розгортання синдромів ураження складових копулятивного циклу в часі свідчить, що при ЦД–2 частіше спостерігається перехід нейрогуморальної складової в психічну і еректильну (27,3 % обстежених) і нейрогуморальної складової в еректильну і психічну (18,2 % обстежених) (табл. 5).
Отже, у більшості хворих чоловіків із ЦД–2 спостерігалося ураження декількох складових копулятивного циклу: трьох складових — у 55,3 % пацієнтів і двох складових — у 18,4 % хворих. Вважається, що поєднання декількох компонентів значно посилює тяжкість копулятивної дисфункції.
Нами був проведений аналіз залежності наявності складових копулятивного циклу від віку. Використання квантифікаційної шкали СФЧ дозволяє визначити ступінь функціональної схоронності фізіологічних складових копулятивного циклу за числовими градієнтами, що характеризують ступінь вираженості тієї функції, яку вони відображають [45.]
В обстежених чоловіків із ЦД–2 спостерігалося чітке вікове зниження показників всіх компонентів їх копулятивного циклу (табл. 6).
Більш виражене зниження досліджуваних компонентів в осіб старших вікових груп можна пояснити приєднанням природного вік–асоційованого зниження статевої функції, тривалістю перебігу основного захворювання, а також впливом андрогенодефіциту. Останній безпосередньо впливає на нейрогуморальну і еректильну складові у хворих на ЦД–2.
Використання методу структурного аналізу статевих порушень у хворих на ЦД дає можливість виділити етіологічні причини та стримуючі фактори, виділити стрижневий синдром, розгортання та приєднання складових копулятивного циклу в динаміці. У чоловіків, хворих на ЦД–2, ураження нейрогуморальної складової спостерігається частіше. Подібні результати були отримані й іншими авторами [77, 78].
Розлади нейрогуморальної складової є комплексними і складними. У переважної більшості пацієнтів спостерігається ураження декількох складових копулятивного циклу, при цьому частіше відзначається приєднання психічної та еректильної складових. Ураження декількох складових копулятивного циклу призводить до розвитку більш тяжких сексуальних розладів. Наявність варіантів розгортання в часі ураження складових копулятивного циклу вказує на складність і багатофакторність статевих розладів у чоловіків, хворих на ЦД. Тому одна лише корекція метаболічних порушень ЦД–2 без урахування корекції інших складових копулятивного циклу не в змозі поліпшити показники еректильної функції. Про це свідчать і наші дані щодо відсутності вірогідних відмінностей між показниками ЕД у хворих на ЦД у стадії декомпенсації і компенсації. У цьому контексті слушним є твердження одного з піонерів дослідження порушень еректильної функції при ЦД [79], що компенсація метаболічних порушень при ЦД і статевих розладах необхідна для попередження метаболічних змін, розвитку таких ускладнень ЦД, як мікроангіо–, нейропатії, що відіграють істотну роль у розвитку порушень статевої функції. Сексуальна дисфункція у хворих на ЦД є результатом метаболічних і гемодинамічних змін, а також розвитку мікроангіопатій, нейропатії і гормональних порушень.
1. National Institutes of Health Consensus Development Panel On Impotence // JAMA. — 1993. — Vol. 270. — P. 83–90.
2. Corona G., Mannucci E., Petrone L. et al. NCEP — –ATPIII — Defined Metabolic Syndrome, Type 2 Diabetes Mellitus, and Prevalence of Hypogonadism in Male Patient With Sexual Dysfunction // J. Sex. Med. — 2007. — Vol. 4. — P. 1038–1045.
3. El–Sacca A. Assotiation of risk factors and medical comorbidities with male sexual dysfunction // J. Sex. Med. — 2007. — Vol. 4. — P. 1691–1700.
4. Shabsigh R., Arver S., Channer K.S. et al. The triad of erectile dysfunction, hypogonadism and the metabolic syndrome // Int. J. Clin. Pract. — 2008. — Vol. 62. — P. 791–798.
5. Johannes C.B., Araujo A.B., Feldman H.A. et al. Incidence of erectile dysfunction in men 40 to 69 years old: longitudinal results from the Massachusetts male aging study // J. Urol. — 2000. — Vol. 163, № 2. — P. 460–463.
6. Yaman O. et al. The effect of diabetes mellitus treatment and good glycemic control on the erectile function in men with diabetes mellitus–induced erectile dysfunction: A Pilot Study // J. Sex. Med. — 2006. — № 3. — P. 344–348.
7. Лучицький Є.В. Особливості розвитку еректильної дисфункції у чоловіків з цукровим діабетом 2–го типу // Андрология и сексуальная мед. — 2008. — № 1. — С. 64–68.
8. Lewis R.W. Epidemiology of sexual dysfunction in Asia compared to the rest of the world // Asian Journal of Andrology. — 2011. — Vol. 13. — P. 152–158.
9. Fugl–Meyer K.S., Corona G., Hayes R.D. et al. Definitions/Epidemiology/Risk Factors for Sexual Dysfunction // J. Sex. Med. — 2010. — Vol. 7. — P. 1598–1607.
10. Fedele D., Bortolotti A., Coscelli C. et al. Erectile dysfunction in type 1 and type 2 diabetics in Italy // Int. J. Epidemiol. — 2000. — Vol. 29. — P. 524–531.
11. Klein R., Klein B.E.K., Lee K.E. et al. Prevalence of self–reported erectile dysfunction in people with long–term IDDM // Diabetes Care. — 1996. — Vol. 19. — P. 135–141.
12. Malavige L.S., Levy J.C. Erectile dysfunction in diabetes mellitus // J. Sex. Med. — 2009. — Vol. 6. — P. 1232–1247.
13. Feldman H.A., Goldstein I., Hatzichristou D.G. et al. Impotence and its medical and psychosocial correlates: results of the Massachusetts male aging study // J. Urol. — 1994. — Vol. 151. — P. 54–61.
14. Johannes C.B., Araujo A.B., Feldman H.A. et al. Incidence of erectile dysfunction in men 40 to 69 years old: longitudinal results from the Massacusetts male aging study // J. Urol. — 2000. — Vol. 163. — P. 460–463.
15. Penson D.F., Latini D.M., Lubek D.P. et al. Do impotent men with diabetes have more severe erectile dysfunction and worse quality of life than the general population of impotent patients? Results from the Exploratory Comprehensive Evaluation of Erectile Dysfunction (ExCEED) Database // Diabetes Care. — 2003. — Vol. 26. — P. 1093–1099.
16. Goldstein I., Lue T.F., Padma–Nathan H. et al. Oral sildenafil in the treatment of erectile dysfunction: Sildenafil study group // N. Engl. J. Med. — 1998. — Vol. 338. — P. 1397–1404.
17. Eardley I., Fisher W., Rosen R.C. et al. The multinational men's attitudes to life events and sexuality study: the influence of diabetes on self–reported erectile function, attitudes and treatment seeking patterns in men with erectile dysfunction // Int. J. Clin. Pract. — 2007. — Vol. 61. — P. 1446–1453.
18. Corona G., Mannucci E., Petrone L. et al. Association of hypogonadism and type II diabetes in men attending an outpatient erectile dysfunction clinic // Int. J. Impot. Res. — 2006. — Vol. 18. — P. 190–197.
19. Jacson G. The Metabolic syndrome and erectile dysfunction: multiple vascular risk factors and hypogonadism // Eur. Urol. — 2006. — Vol. 50. — P. 426–427.
20. Гамидов С.И., Мамедов М.Н., Сотникова Е.М., Гусейнов М.М. Метаболический синдром и эректильная дисфункция // Тер. архив. — 2007. — Т. 10. — С. 21–25.
21. Geiss L.S., Cowie C.C. Type 2 diabetes and persons at high risk of diabetes. In: Narayan K.M., Williams D., Gregg E.W., Cowie C.C., eds. Diabetes and Public Health: From Data to Policy. — New York, NY: Oxford University Press, 2011. — 15–32.
22. Hidalgo–Tamola J., Chitaley K. Type 2 diabetes mellitus and erectile dysfunction // J. Sex. Med. — 2009. — Vol. 6. — P. 916–926.
23. Romeo J.H., Seftel A.D., Madhum Z.T., Aron D.C. Sexual function in men with diabetes type 2: association with glycemic control // J. Urol. — 2000. — Vol. 163. — P. 788–791.
24. De Angelis L., Marfella R., Siniscalchi M. et al. Erectile and endothelial dysfunction in type II diabetes: a possible link // Diabetologia. — 2001. — Vol. 44. — P. 1155–1160.
25. Кобяков С.К., Лучицький Є.В., Лучицький В.Є. Статеві порушення у чоловіків, хворих на цукровий діабет, та їх лікування // Сексологія та андрологія. — 2000. — № 5. — С. 44–46.
26. Seftel A.D., Sun P., Swindle R. The prevalence of hypertension, hyperlipidemia, diabetes mellitus and depression in men with erectile dysfunction // J. Urol. — 2004. — Vol. 171. — P. 2341–2345.
27. Esposito K., Giugliano F., Ciotola M. et al. Obesity and sexual dysfunction, male and female // Int. J. Impot. Res. — 2008. — Vol. 20. — P. 358–365.
28. Borges R., Temido P., Sousa L. et al. Metabolic syndrome and sexual (dys)function // J. Sex. Med. — 2009. — № 6. — P. 2958–2975.
29. Musicki B., Burnett A.L. Endothelial dysfunction in diabetic erectile dysfunction // Int. J. Impot. Res. — 2007. — № 19. — P. 1129–1138.
30. Moreland R.B. Pathophysiology of erectile dysfunction: the contributions of trabecular structure to function and the role of functional antagonism // Int. J. Impot. Res. — 2000. — № 12 (Suppl. 4). — Р. 39–46.
31. Wespes E., Goes P.M., Schiffmann S. et al. Computerized analysis of smooth muscle fibers in potent and impotent patients // J. Urol. — 1991. — № 146. — Р. 1015–1017.
32. Bivalacqua T.J., Usta M.F., Champion H.C. et al. Endothelial dysfunction in erectile dysfunction: role of the endothelium in erectile physiology and disease // J. Androl. — 2003. — № 24 (Suppl. 6). — Р. 17–37.
33. Bivalacqua T.J., Musicki B., Usta M.F. et al. Endothelial nitric oxide synthase gene therapy for erectile dysfunction // Curr. Pharm. Des. — 2005. — № 11. — Р. 4059–4067.
34. Traish A.M., Goldstein I., Kim N.N. Testosterone and erectile function: from basic research to a new clinical paradigm for managing men with androgen insufficiency and erectile dysfunction // Eur. Urol. — 2007. — № 52. — Р. 54–70.
35. Singh R., Artaza J.N., Taylor W.E. et al. Androgens stimulate myogenic differentiation and inhibit adipogenesis in C3H 10T1/2 pluripotent cells through an androgen receptor–mediated pathway // Endocrinology. — 2003. — Vol. 144. — Р. 5081–5088.
36. Hwang T.I., Chen H.E., Tsai T.F., Lin Y.C. Combined use of androgen and sildenafil for hypogonadal patients unresponsive to sildenafil alone // Int. J. Impot. Res. — 2006. — № 18. — Р. 400–404.
37. Akishita M., Hashimoto M., Ohike Y. et al. Low testosterone level is an independent determinant of endothelial dysfunction in men // Hypertens Res. — 2007. — № 30. — Р. 1029–1034.
38. Solomon H., Man J.W., Jackson G. Erectile dysfunction and the cardiovascular patient: endothelial dysfunction is the common denominator // Heart. — 2003. — Vol. 89. — Р. 251–253.
39. Watts G.F., Chew K.K., Stuckey B.G. The erectile–endothelial dysfunction nexus: new opportunities for cardiovascular risk prevention // Nat. Clin. Pract. Cardiovasc. Med. — 2007. — № 4. — Р. 263–273.
40. Wespes E., Raviv G., Vanegas J.P. et al. Corporeal veno–occlusive dysfunction: a distal arterial pathology? // J. Urol. — 1998. — Vol. 160. — P. 2054–2057.
41. Bivalacqua T.J., Usta M.F., Champion H.C. et al. Endothelial dysfunction in erectile dysfunction: role of the endothelium in erectile physiology and disease // J. Androl. — 2003. — № 24 (Suppl. 6). — Р. 17–37.
42. Hackett G. Impotence–the most neglected complication of diabetes // Diabetes Res. — 1995. — № 28. — P. 75–83.
43. Rosen R., Riley A., Wagner G. et al. The International Index of Erectile Function (IIEF): A multidimensional scale for assessment of erectile dysfunction // Urology. — 1997. — № 49. — P. 822–830.
44. Marumo K., Nagatsuma K., Murai M. Effect of aging and diseases on male sexual function assessed by the International Index of Erectile Function // Nippon Hinyokika Gakkai Zasshi. — 1999. — Vol. 90, № 12. — P. 911–919.
45. Общая сексопатология / Под ред. Г.С. Васильченко. — 2–е изд., перераб. и доп. — М.: Медицина, 2005. — 512 с.
46. Кобяков С.К., Лучицкий Е.В., Буглак М.И. Синдромологическая характеристика половых расстройств у мужчин, больных сахарным диабетом // Клиническая и экспериментальная патология. — 2002. — T. 1, № 1. — C. 38–41.
47. Roth A., Kalter–Leibovici O., Kerbis Y. et al. Prevalence and risk factors for erectile dysfunction in men with diabetes, hypertension, or both diseases: a community survey among 1,412 Israel men // Clin. Cardiol. — 2003. — Vol. 26, № 1. — P. 25–30.
48. Giuliano F.A., Leriche A, Jaudinot E.O. et al. Prevalence of erectile dysfunction among 7689 patients with diabetes or hypertension or both // Urology. — 2004. — Vol. 64. — P. 1196–1201.
49. Mulhall J., Teloken P., Brock G., Kim E. Obesity, Dyslipidemias and Erectile Dysfunction: A Report of a Subcomittee of the Sexual Medicine Societe of North Americ // J. Sex. Med. — 2006. — № 3. — P. 778–786.
50. Standard Practice in Sexual Medicine / Ed. by H. Porst, J. Buvat, ISSM Standard Committee. — Blackwell Publishing, 2006. — P. 31–115.
51. Selvin E., Burnett A.L., Platz E.A. Prevalence and Risk Factors for Erectile Dysfunction in the US // The American Journal of Medicine. — 2007. — Vol. 120. — P. 151–157.
52. Lewis R.W., Fugl–Meyer K.S., Bosch R. et al. Epidemio–logy/Risk Factors of Sexual Dysfunction // J. Sex. Med. — 2004. — Vol. 1. — P. 35–39.
53. Borges R., Temido P., Sousa L. et al. Metabolic Syndrome and Sexual (Dys)function // J. Sex. Med. — 2009. — № 6. — P. 2958–2975.
54. El–Sacca A. Assotiation of Risk Factors and Medical Comorbidities with Male Sexual Dysfunction // J. Sex. Med. — 2007. — № 4. — P. 1691–1700.
55. Лучицький В.Є. Андрогендефіцитний стан у чоловіків, хворих на цукровий діабет 2 типу // Ендокринологія. — 2012. — Т. 17, № 2. — C. 28–36.
56. Svatberg J. et al. Testosterone treatment in elderly men with subnormal testosterone levels improves body composition and BMD in the hip. // Int. J. Impot. Res. — 2008. — Vol. 20, № 4. — P. 378–387.
57. Dandona P., Dhindsa S. Update: Hypogonadotropic Hypogonadism in Type 2 Diabetes and Obesity // J. Clin. Endocrin. Metab. — 2011. — Vol. 96. — P. 2643–2651.
58. Лучицький В.Є. Дослідження стану тестикулярного кровотоку у чоловіків з цукровим діабетом 2 типу та пізнім гіпогонадизмом // Досягнення та перспективи експериментальної і клінічної ендокринології. Мат–ли наук.–практ. конф. — Харків, 2010. — C. 78–79.
59. Oh J.Y., Barrett–Connor E., Wedick N.M., Wingard D.L. Endogenous sex hormones and the development of type 2 diabetes in older men and women: the Rancho Bernardo study // Diabetes Care. — 2002. — Vol. 25. — Р. 55–60.
60. Haffner S.M., Shaten J., Stern M.P. et al. Low levels of sex hormone–binding globulin and testosterone predict the development of non–insulin–dependent diabetes mellitus in men. MRFIT Research Group. Multiple Risk Factor Intervention Trial // Am. J. Epidemiol. — 1996. — Vol. 143. — Р. 889–897.
61. Laaksonen D.E., Niskanen L., Punnonen K. et al. Testosterone and sex hormone–binding globulin predict the metabolic syndrome and diabetes in middle–aged men // Diabetes Care. — 2004. — Vol. 27. — Р. 1036–1041.
62. Tibblin G., Alderberth A., Linstedt G., Bjorntorp P. The pituitary–gonadal axis and health in elderly men: a study of men born in 1913 // Diabetes. — 1996. — Vol. 45. — P. 1605–1609.
63. Yassian A. The link between erectile dysfunction, metabolic syndrome and testosterone deficiency / A. Yassian, F. Saad // Abstract of 23 Annual EAU Congress. — Milan, 2008. — P. 899.
64. Traish A.M. Are androgens critical for penile erections in humans? / A.M. Traish, A.T. Guay // J. Sexual Medicine. — 2006. — Vol. 5. — P. 382–407.
65. Ghanem H. Etiology and Risk Factors of Erectile Dysfunction // Porst H., Buvat J., eds. Standard Practice in Sexual Medicine / H. Ghanem, H. Porst. — Blackwell Publishing, 2006. — P. 49–58.
66. Jackson G. The metabolic syndrome and erectile dysfunction:multiple vascular risk factors and hypogonadism / G. Jackson // Eur. Urol. — 2006. — Vol. 50. — P. 426–427.
67. Corona G. Psychobiologic correlates of the metabolic syndrome and associated sexual dysfunction / G. Corona, E. Mannucci, C. Schulman [et al.] // Eur. Urol. — 2006. — Vol. 50. — P. 595–604.
68. Kurbatov D. Testosterone improves erectile function in hypogonadal patients with venous leakage / D. Kurbatov, J. Kuznetsky, A. Traish // J. of Andrology. — 2008. — Vol. 29. — P. 630–637.
69. Aversa M. Androgens improve cavernous vasodilation and response to sildenafil in patients with erectile dysfunction // J. Clin. Endocrin. — 2003. — Vol. 58, № 3. — P. 632–638.
70. Saens de Tejada L. Empaired neurogenic and endeotelium–medialect relaxation of penile smooth muscule from diabetic men / L. Saens de Tejada, L. Goldstein, K. Gradroi [et al.] // J. Med. — 1989. — Vol. 320. — P. 1025–1030.
71. Buvat J., Gooren L.J.,Guay A.T. et al. Endocrine Aspects of Men Sexual Dysfunction. In Sexual. Medicine Sexual Dysfunctions in Men and Women / Ed. Lue T.F., Basson R., Rosen R. et al. — Chapter 11. — P. 347–382.
72. Wang C.J., Shen S.J., Wu C.C. et al. Penile blood flow study in diabetic impotence // Urol. Int. — 1993. — Vol. 50. — P. 209.
73. Saito I., Folsom A.R., Brancati F.L. et al. Nontraditional risk factors for coronary heart disease incidence among persons with diabetes: the Atherosclerosis Risk in Communities (ARIC) Study // Ann. Int. Med. — 2000. — Vol. 81. — P. 133.
74. Metro M.J., Broderick G.A. Diabetes and vascular impotence: does insulin dependence increase the relative severity // Int. J. Impot. Res. — 1999. — Vol. 11. — P. 1999.
75. Sobrevia L., Mann G.E. Dysfunction of the endothelial–nitric oxide signaling pathway in diabetes and hyperglycemia // Exp. Phisiol. — 1997. — Vol. 82. — P. 423.
76. Behelmans B., Meuleman E., Doesburg W. et al. Erectile dysfunction in diabetic men: the neurogical factor revisited // J. Urol. — 1994. — Vol. 151. — P. 1994.
77. Камалов К.Г. Состояние копулятивной и репродуктивной функции у мужчин, страдающих сахарным диабетом: Автореф. дис… канд. мед. наук. — М., 1988. — 24 с.
78. Акопян А.Э. Нейрососудистые расстройства в генезе нарушений сексуального здоровья у мужчин, страдающих сахарным диабетом, и их коррекция: Автореф. дис… канд. мед. наук. — Харьков, 1990. — 22 с.
79. Pereira da Silva G. Diabetes and sexual dysfunction // Andrologia. — 1993. — Vol. 1. — P. 5–16.

/78/78.jpg)
/79/79.jpg)
/81/81.jpg)
/81/81_2.jpg)