Международный эндокринологический журнал 4 (68) 2015
Вернуться к номеру
Комбинированная терапия антигипергликемическими пероральными препаратами (метформин, производные сульфонилмочевины) с инсулином в менеджменте больных сахарным диабетом 2-го типа (патогенетическая обоснованность и клиническая целесообразность)
Авторы: Горшунская М.Ю. - Харьковская медицинская академия последипломного образования
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Обзор посвящен обоснованию перспективности применения комбинированной терапии сахарного диабета 2-го типа пероральными антигипергликемическими препаратами с различным механизмом действия (метформин + производные сульфонилмочевины) и инсулином. Второй пероральный препарат целесообразно добавлять, когда средние дозы первого препарата не обеспечивают полной эффективности; при этом, поскольку дозы антигипергликемических неинсулиновых препаратов обычно не увеличивают до максимальных, побочные эффекты уменьшаются. Кроме того, сочетание гетерогенных антидиабетических эффектов в пределах и за пределами гликемического контроля, характерных для комбинации бигуанида (метформин), производного сульфонилмочевины (глимепирид) и инсулина, таких как снижение гипоадипонектинемии, дислипидемии, оксидативного стресса, воспаления, дисфункции сосудистых эндотелиальных клеток, устранение «гипергликемической памяти», сохранение феномена ишемического прекондиционирования, повышение выживаемости панкреатических β-клеток и др., предоставляет дополнительные преимущества в лечении сахарного диабета 2-го типа, а также в профилактике и терапии сердечно-сосудистых осложнений.
Огляд присвячено обґрунтуванню перспективності застосування комбінованої терапії цукрового діабету 2-го типу пероральними антигіперглікемічними препаратами з різним механізмом дії (метформін + похідні сульфонілсечовини) та інсуліном. Другий пероральний препарат доцільно додавати, коли середні дози першого препарату не забезпечують повної ефективності; при цьому, оскільки дози антигіперглікемічних неінсулінових препаратів зазвичай не збільшують до максимальних, побічні ефекти зменшуються. Крім того, поєднання гетерогенних антидіабетичних ефектів у межах та поза межами глікемічного контролю, характерних для комбінації бігуаніду (метформін), похідного сульфонілсечовини (глімепірид) та інсуліну, такі як зниження гіпоадипонектинемії, дисліпідемії, оксидативного стресу, запалення, дисфункції судинних ендотеліальних клітин, усунення «гіперглікемічної пам’яті», збереження феномена ішемічного прекондиціонування, підвищення виживання панкреатичних β-клітин та ін., надає додаткові переваги в лікуванні цукрового діабету 2-го типу, а також у профілактиці та терапії серцево-судинних ускладнень.
The review deals with the prospect substantiation for using combined therapy by oral antihyperglycemic drugs with different mechanisms of action (metformin + sulfonylureas) and insulin for type 2 diabetes mellitus. The second oral drug is advisable to add, when the average doses of the first drug do not provide full effectiveness, and, since the doses of non-insulin antihyperglycemic drugs are usually not increased to a maximum, the side effects are reduced. Also, a combination of heterogeneous antidiabetic effects within and beyond the glycemic control, which is characteristic of biguanide (metformin), sulfonylurea (glimepiride) and insulin combination, such as reduction of hypoadiponectinemia, dyslipidemia, oxidative stress, inflammation, vascular endothelial cell dysfunction, elimination of «hyperglycemic memory», preservation the phenomenon of ischemic preconditioning, increased pancreatic β-cell survival rate, etc., provides further advantages in the treatment of type 2 diabetes mellitus, as well as in the prevention and treatment of cardiovascular complications.
сахарный диабет 2-го типа, метформин, глимепирид, инсулин, комбинированная терапия.
цукровий діабет 2-го типу, метформін, глімепірид, інсулін, комбінована терапія.
type 2 diabetes mellitus, metformin, glimepiride, insulin, combined therapy.
Статья опубликована на с. 61-75
Сахарный диабет (СД) 2–го типа является прогрессирующим заболеванием [45]. Его патогенез носит комплексный характер: генетическая предрасположенность вместе с метаболическими нарушениями, ассоциированными с избыточным весом (увеличенный липолиз, дефект секреции и действия инсулина, увеличенная секреция глюкагона, повышенная эндогенная продукция глюкозы наряду с ее повышенной почечной реабсорбцией и уменьшенным поглощением в инсулинчувствительных тканях, нейротрансмиттерная дисфункция и сниженный эффект инкретинов) обусловливают нарушение глюкозного гомеостаза [13, 93]. Имеющиеся в настоящее время данные клинических и экспериментальных исследований формируют представление о том, что СД 2–го типа характеризуется сниженной массой b–клеток, которые не могут обеспечить компенсацию прогрессирующей инсулинорезистентности, что приводит к развитию манифестного СД 2–го типа [39, 44, 103]. Несмотря на антигипергликемическую терапию, функция панкреатических b–клеток продолжает прогрессивно уменьшаться, что четко продемонстрировано в UKPDS [54]. С другой стороны, накапливаются доказательства возможного замедления или даже обратного развития нарушения функции b–клеток, особенно на ранних стадиях заболевания, как модификацией образа жизни, так и фармакотерапией [2, 17, 41, 49, 64, 103, 112]. Вместе с тем, несмотря на определяющую роль b–клеток в развитии и прогрессировании СД 2–го типа [45], реальная врачебная практика фокусируется на инсулинорезистентности. Хотя следует отметить, что в последних рекомендациях по менеджменту гликемического контроля у больных СД 2–го типа акцентируется внимание на более агрессивном терапевтическом алгоритме, а именно на динамическом (каждые 3 месяца) изменении (дополнении) антигипергликемической терапии, включая раннюю инсулинотерапию, в случае недостижения целевых ориентиров [3, 30]. Так, поскольку длительная экспозиция даже умеренно повышенного уровня глюкозы ассоциирована с десенситизацией (потерей чувствительности) b–клеток, их повышенным апоптозом, задержкой первой фазы секреторного ответа b–клеток на пер–орально введенную глюкозу и ослаблением второй фазы выделения инсулина [43, 109, 111], то раннее достижение хорошего гликемического контроля является благоприятным для выживания b–клеток, в первую очередь за счет снижения глюко– и липотоксичности, а также формирования хорошей «гликемической памяти» [45, 64, 83, 106].
Существенная недостаточность b–клеток наблюдается уже на ранней стадии прогрессирования заболевания, а именно перед манифестацией, с последующим ускорением процесса [9, 13, 15, 19, 44].
Так, согласно UKPDS, секреторная функция b–клеток у впервые выявленных больных СД 2–го типа (время диагностирования гипергликемии натощак) была снижена на 50 % [25, 54]. Следует отметить, что в физиологических условиях компенсаторная способность b–клеток относительно инсулинорезистентности обеспечивает близкий к нормальному уровень глюкозы, уравновешивая изменения в инсулиновой чувствительности пропорциональным изменением секреторной функции b–клеток [6, 28, 36]. В классическом долгосрочном исследовании тучных инсулинорезистентных индейцев пима с нормальной толерантностью к глюкозе в исходном состоянии показано, что переход от нормогликемии к нарушенной толерантности к глюкозе (НТГ) и манифестному СД 2–го типа был связан с ограниченной способностью b–клеток компенсировать относительно постоянную инсулинорезистентность [93].
Прогрессирующая недостаточность b–клеток при СД 2–го типа обусловлена взаимодействием генетических и приобретенных факторов, а именно генов, включенных в кодирование белков глюкозного метаболизма, молекул инсулин–сигналинговых путей и транскрипционных факторов [84, 86], среди приобретенных факторов — глюко– и липотоксичность, увеличенное отложение островкового амилоидного полипептида, воспалительные цитокины [6, 17, 44, 111]. В совoкупности эти факторы обусловливают недостаточность массы и функции b–клеток для адекватного ответа на увеличенную потребность [45].
Следует отметить, что качественные дефекты выделения инсулина у больных СД 2–го типа характеризуются изменением ритма пульсирующей секреции и нарушением процессинга прекурсорного пептида проинсулина в полностью активный инсулин [53, 69, 70]. Tак, процессинг проинсулина (расщепление на инсулин и С–пептид), происходящий в секреторных гранулах у здоровых лиц, практически полный (примерно 2 % интактного или неполностью расщепленного проинсулина остается в гранулах) [37, 90]. У больных СД 2–го типа процесс превращения проинсулина в инсулин b–клетками подавлен, что увеличивает их соотношение в 4–5 раз [76]. Морфологические исследования панкреатической ткани (аутопсия) показали существенное снижение объема b–клеток у больных СД 2–го типа и у лиц с предиабетом за счет увеличенного апоптоза [9]. Вместе с тем верифицированное у пациентов с длительно существующим диабетом образование островков de novo аргументирует потенциал новых терапевтических подходов, угнетающих апоптоз или повышающих неогенез и репликацию b–клеток [9, 91], как и оптимизированных алгоритмов фармакологического менеджмента гликемического контроля, имеющих наибольшее распространение в реальной клинической практике (Унифицированный клинический протокол первичной и вторичной (специализированной) медицинской помощи. Сахарный диабет 2–го типа. Приказ МЗ Украины № 1118 от 21.12.2012; 3, 30). Хотя эта статья сфокусирована преимущественно на гликемическом менеджменте СД 2–го типа, крайне необходимо понимать, что данное заболевание представляет собой комплексное метаболическое состояние и что гликемический контроль — только одна грань надлежащего ведения СД 2–го типа. Следовательно, мультифакторный подход, направленный на контроль всех известных факторов риска развития кардиоваскулярной болезни и микроваскулярных осложнений, как и изменение образа жизни, является весьма важным [21, 89].
К настоящему времени имеются различные классы фармакологических препаратoв для гликемического менеджмента СД 2–го типа. Метформин является краеугольным камнем лечения СД 2–го типа, в целом он хорошо переносится, имеет немногочисленные побочные эффекты (главным образом со стороны желудочно–кишечного тракта, очень редко вызывает тяжелые гипогликемии и смертельно опасный лактоацидоз) [30, 63]. Производные сульфонилмочевины (СМ) представляют популярный класс пероральных антигипергликемических препаратов. В реальной жизни они остаются приемлемыми препаратами первой линии для комбинированного назначения с метформином пациентам, страдающим СД 2–го типа [1]. В консенсусном докладе экспертов журнала «Diabetes Care» сказано: «Идеальный антигипергликемический препарат удобен в применении, имеет низкую вероятность симптоматических побочных эффектов, которые могут препятствовать соблюдению режима терапии, безопасен, высокоэффективен, обладает невысокой стоимостью. Можно утверждать, что данным стандартам хорошо соответствуют современные СМ (но некоторые клинические потребности при назначении данных препаратов остаются неудовлетворенными)» [11]. Эффективность СМ ограничивается, как правило, несколькими годами (главным образом прямо пропорционально сохранению остаточной функции b–клеток), и их использование, особенно у больных с выраженной почечной недостаточностью, связано с тяжелыми гипогликемиями [31]. В клинических исследованиях применение данного класса препаратов не связывают с появлением сердечно–сосудистых осложнений [26, 34, 79]. В исследованиях in vitro глимепирид и глипизид, а in vivo — глимепирид не демонстрировали ингибирование защитного феномена ишемического прекондиционирования в отличие от глибенкламида [47, 59]. Целесообразно избегать назначения глибенкламида в дополнение к метформину у всех пациентов, поскольку и глимепирид, и глипизид обладают значительно лучшим профилем безопасности. Однако нет оснований прекращать назначение класса СМ в комбинированной терапии с метформином, так как при использовании данных препаратов у многих пациентов наблюдается улучшение контроля гликемии с минимальным риском побочных эффектов [1].
Вместе с тем необходимо подчеркнуть, что рекомендованное использование СМ не ниже второй генерации в последних консенсусах по антигипергликемической терапии СД 2–го типа основывается на существенно меньшей частоте гипогликемий по сравнению с применением производных СМ первой генерации [30]. Кроме того, ряд клинических исследований подтвердил нейтральный эффект такого производного СМ, как глимепирид, относительно веса и индекса массы тела у больных СД 2–го типа при длительном его применении по сравнению с другими инсулиновыми секретагогами [42, 92].
Новые классы инсулинстимулирующих препаратов, такие как агонисты глюкагоноподобного пептида–1 (ГПП–1), вводимые инъекционно, и пероральные ингибиторы дипептидилпептидазы–4 (ДПП–4) являются уникальными по механизму действия (подавление секреции глюкагона), а в связи с контролем аппетита агонисты ГПП–1 вызывают также снижение веса. Вместе с тем их долгосрочная безопасность остается предметом исследований [3, 30]. Это весьма значимый момент, поскольку верифицированное наличие долгосрочной безопасности является существенным для широкого использования антигипергликемических препаратов. В частности, для пиоглитазона (класс тиазолидиндионов), обладающего выраженным благоприятным специфическим действием (увеличение чувствительности к инсулину в мышцах и печени через активацию рецепторов РРАR–y, снижение НbА1с на 0,5–1,4 %), только с течением времени были верифицированы такие серьезные неблагоприятные эффекты, как оте–ки, сердечная недостаточность и риск переломов, особенно у женщин [52]. Производные СМ представляют собой антигипергликемические препараты с доказанной долгосрочной безопасностью, включая кардиоваскулярную [1]. Безопасность и переносимость глимепирида была оценена более чем у 5000 пациентов, и результаты свидетельствуют об отсутствии нарушений лабораторных показателей. Единственными побочными событиями, обнаруженными у < 2 % пациентов, получавших глимепирид, были проявления гипогликемии, головокружение, астения, головная боль, сыпь и тошнота [80]. Гастроинтестинальные побочные реакции (рвота, гастроинтестинальная боль, диарея) наблюдались менее чем у 1 % пациентов в плацебо–контролируемых исследованиях [80]. Анализ объединенных результатов свидетельствует о том, что частота всех побочных эффектов глимепирида такая же, как у других препаратов СМ, или даже меньшая [8]. Проспективный анализ большой группы пациентов относительно частоты тяжелых гипогликемий (необходимость внутривенного введения глюкозы или глюкагона) при лечении глимепиридом vs глибурид (глибенкламид) показал, что она была существенно ниже при терапии глимепиридом (0,86 эпизода/1000 пациенто–лет vs 5,6 эпизода/1000 пациенто–лет) [27]. Несомненным преимуществом глимепирида является уменьшенная частота гипогликемий во время физических упражнений. Реализация этого эффекта несомненно связана с отсутствием у глимепирида в отличие от других препаратов СМ, в частности глибенкламида, блокирующего действия на КАТФ–зависимые каналы панкреатических b–клеток, синтезирующих и секретирующих глюкагон [16], а также с зависимостью инсулин–сенсибилизирующего действия глимепирида от уровня глюкозы [58]. Следует подчеркнуть, что уменьшение частоты гипогликемий имеет существенное значение как для снижения фатальных кардиоваскулярных событий, так и для уменьшения риска деменции у пожилых больных СД 2–го типа [94]. Безопасность глимепирида определяется также отсутствием его повреждающего влияния на защитный феномен ишемического прекондиционирования [10, 47, 104]. Имеющиеся к настоящему времени доказательства позволяют говорить о полезности этого адаптивного феномена и правомерности его определения как золотого стандарта кардиопротекции [18]. Глимепирид, обладающий уникальным сочетанием инсулин–секретогенных (щадящая стимуляция) и инсулин–сенситайзерных свойств, при нейтральном эффекте на вес и низком риске гипогликемий может быть лучшим выбором у больных СД 2–го типа при наличии кардиоваскулярного риска по сравнению с другими препаратами СМ в связи с отсутствием повреждающего эффекта в отношении этого защитного феномена [47].
Необходимо отметить, что в первом анализе сравнительной эффективности новейших классов фармакотерапии СД 2–го типа (ингибиторы ДПП–4 и агонисты ГПП–1), как в качестве монотерапии, так и различных их комбинаций, акцентируется отсутствие достаточных доказательств в пользу окончательной поддержки одного препарата или конкретной комбинации препаратов с учетом долгосрочных клинических исходов (смертность, макро– и микроваскулярные осложнения СД) [5]. Следует подчеркнуть, что этот системный анализ включает 140 рандомизированных контролируемых исследований (RCT) и 26 обсервационных исследований head–to–head. Более того, случаев смерти было несколько меньше при использовании метформина, чем при лечении препаратами СМ, в обсервационных наблюдениях, но результаты рандомизированных и обсервационных исследований отличаются (низкий уровень доказательств), а кардиоваскулярная смертность была несколько ниже с метформином относительно СМ, но результаты остаются неопределенными (низкий уровень доказательств) [5]. Большинство обсервационных исследований и данные регистров являются противоречивыми и варьируют в зависимости от популяции и используемой для исследования методики [5].
Недавно опубликованный анализ результатов современных (тип head–to–head) долгосрочных (≥ 72 недель) рандомизированных контролированных исследований, сопоставлявших влияние СМ на кардиоваскулярные исходы, показал отсутствие сообщений об увеличении частоты кардиоваскулярных событий при использовании СМ [77]. Вместе с тем авторы отмечают ограниченность имеющихся данных и, что наиболее важно, отсутствие адекватной формальной силы (мощности) в исследованиях head–to–head кардиоваскулярных исходов, предназначенных для оценки кардиоваскулярной безопасности.
Производные СМ остаются одним из наиболее широко используемых у больных СД 2–го типа классов препаратов для менеджмента гликемического контроля с уменьшающейся со временем эффективностью, как терапия второй линии, добавленная к метформину, а в некоторых случаях и как терапия первой линии (прежде всего альтернатива для пациентов, которые не могут принимать метформин) [23, 29, 77]. СМ, а именно глибурид (известный в Европе как глибенкламид), гликлазид, глипизид или глимепирид, часто рекомендуются как предпочтительная терапия второй линии из–за их хорошо установленной эффективности и низкой стоимости [30, 77].
Принимая во внимание доказанные множественные патогенетические механизмы СД 2–го типа, обоснованным представляется использование многочисленных препаратов с взаимодополняющим характером действия для контроля гликемии и, если возможно, сохранения массы панкреатических b–клеток до момента достижения критического уровня [3, 30, 31, 45, 64].
Рекомендованная комбинация препаратов зависит от стадии болезни и степени дисфункции b–клеток. Комбинация метформина с СМ является наиболее используемой пероральной комбинацией в реальной жизни и широко представлена в современном алгоритме антигипергликемической терапии больных СД 2–го типа [3, 30] (рис. 1).
Мета–анализ сравнительной эффективности формулирует представление о том, что в целом каждый новый класс неинсулиновых препаратов, добавленный к первоначальной терапии метформином, снижает НbA1c на 0,9–1,1 % [5]. При этом стоимость препаратов различная, а именно: низкая — бигуаниды, производные СМ второй генерации (глибурид/глибенкламид, глипизид, гликлазид, глимепирид), тиазолидиндионы; высокая — ингибиторы ДПП–4, агонисты рецепторов ГПП–1, ингибиторы натрий–глюкозного котранспортера 2–го типа; варьирующая — инсулин [3].
Согласно последним рекомендациям ADA и EASD [30], если целевой уровень НbA1c у больных с впервые диагностированным СД 2–го типа не достигается приблизительно спустя 3 месяца монотерапии максимально переносимыми дозами метформина, то рассматривается комбинация последнего и одной из шести терапевтических опций: производные СМ, тиазолидиндионы, ингибиторы ДПП–4, ингибиторы натрий–глюкозного котранспортера 2–го типа, агонисты рецепторов ГПП–1 или базальный инсулин (двойная терапия). Выбор препарата основывается на предпочтениях пациента, а также на различных характеристиках больного, болезни и препарата с целью снижения уровня глюкозы крови с минимизацией побочных эффектов, особенно гипогликемий.
Для всех пациентов рассматривается иницииро–вание терапии двойной комбинацией фармпрепаратов при НbA1c ≥ 9 % для быстрого достижения целевого уровня. Инсулин имеет преимущества по эффективности в ситуации, когда другие препараты ею не обладают, и должен рассматриваться как часть любого комбинированного режима, если доказана тяжелая гипергликемия, особенно при наличии симптомов или любого катаболического проявления (потеря веса, кетоз). Инициирование использования комбинации инъекционных инсулинов рассматривается, когда концентрация глюкозы крови ≥ 16,7–19,4 ммоль/л и/или НbA1c ≥ 10–12 %. После устранения глюкотоксичности режим фармакотерапии может упрощаться [3].
Возрастающее признание того, что у пациентов с метаболическим риском и манифестным СД 2–го типа недостаточность b–клеток наблюдается намного раньше и выражена тяжелее, чем полагали [45], обосновывает необходимость регулярного гликемического скрининга в группах риска, так же как и быстрого и агрессивного вмешательства, обеспечивающего противодействие кумулятивным повреждающим эффектам хронической гипергликемии на функцию b–клеток [13, 78]. Заслуживает большего внимания концепция относительно b–клеток как ключевого первичного двигателя в развитии болезни и ее прогрессирования [45]. Это согласуется с патогенетическим определением СД 2–го типа, представленным в последних рекомендациях ADA (январь 2015): «Сахарный диабет 2–го типа — следствие прогрессирующего инсулин–секреторного дефекта на фоне инсулинорезистентности» [3].
Рутинная необходимость комбинированной терапии, включающей пероральные антигипергликемические препараты + инсулин, была четко подтверждена исследователями в UKPDS [88]. Анализ результатов 9–летней монотерапии различными препаратами впервые диагностированных больных СД 2–го типа показал, что уровни глюкозы крови натощак были ниже 7,8 ммоль/л только у 18 % пациентов, применяющих метформин, у 24 %, использующих СМ, и у 42 % — на инсулинотерапии. Независимо от препарата, назначенного в качестве первоначальной терапии, верифицировано прогрессивное ухудшение гликемического контроля, обусловленное главным образом постепенным снижением продукции эндогенного инсулина. В этом же исследовании было показано, что раннее добавление базального инсулина к СМ (комбинированный режим) по сравнению с монотерапией инсулином в течение шести лет обеспечивало достижение более низкой медианы НbA1c (6,6 vs 7,1 %) с меньшим количеством гипогликемий (1,6 vs 3,2 % ежегодно) [97]. На основании вышеизложенного был сделан вывод о том, что большинство пациентов нуждается в комбинированной терапии для достижения гликемических целей с течением времени [88].
Фармакологическая рациональность комбинированной терапии — это повышение отношения желательных эффектов к нежелательным [75]. С другой стороны, в UKPDS было обнаружено, что интенсивный гликемический контроль с момента диагностирования СД был связан со значительным уменьшением риска коронарных событий в дополнение к широко известному снижению риска микрососудистых осложнений [26].
Следовательно, незамедлительный тщательный гликемический контроль имеет большое значение при СД 2–го типа. Это отражено в ряде последних рекомендаций, рассматривающих целесообразность раннего добавления базальной инсулинотерапии (НПХ, гларгин, детемир, деглюдек) больным, не достигшим целевых уровней НbA1c [3, 29, 30]. Назначение третьего перорального препарата (особенно если уровень НbA1c близок к целевому), так называемая тройная терапия, также рассматривается, но этот режим в большинстве случаев не имеет существенных преимуществ перед инициацией или интенсификацией инсулинотерапии (он не более эффективен в понижении гликемии, но требует больших финансовых затрат) [81]. Следует подчеркнуть, что, несмотря на значительное увеличение имеющихся в распоряжении пероральных антигипергликемических препаратов (ПОАГП), производные СМ, метформин и их комбинации все еще являются наиболее часто назначаемым классом ПОАГП. Поэтому многие клинические исследования посвящены изучению эффективности различных инсулинов, включая инсулин гларгин, как дополнительной терапии к различным комбинированным режимам ПОАГП.
В реальной жизни значительное количество больных СД 2–го типа не могут достичь жесткого гликемического контроля, несмотря на комбинированную терапию большими дозами инсулина с несульфаниламидными препаратами в течение длительного времени. Большинство врачей продолжают сопротивляться увеличению доз инсулина или проведению интенсивной инсулинотерапии в связи с побочными эффектами, обусловленными инсулином, а именно гипогликемиями и прибавкой веса. Комбинация инсулина с производными СМ второй генерации, такими как глибенкламид и гликлазид, значимо улучшает гликемический контроль с отчетливым уменьшением дозы инсулина [32, 82, 85]. Ряд исследователей поддерживает целесообразность добавления глимепирида к инсулинотерапии больных СД 2–го типа, плохо компенсированных инсулином, поскольку улучшение гликемического контроля было ассоциировано со снижением дозы вводимого инсулина [66]. Глимепирид — новейшее производное СМ второй генерации, которое иногда классифицируется как представитель третьей генерации из–за бóльших замещений в химической структуре, чем у других производных СМ второй генерации [4], и доказанного сочетания инсулин–секретогенного действия с первичным снижением инсулинорезистентности [105, 109]. Бóльшая эффективность комбинации «СМ + инсулин» связана с тем, что производные СМ обеспечивают более высокие уровни инсулина в портальной циркуляции по сравнению с подкожно введенным инсулином и, таким образом, меньшее выделение глюкозы печенью и, следовательно, более низкую глюкозу плазмы натощак. Преимущественное улучшение гликемии натощак по сравнению с постпрандиальной концентрацией глюкозы было отмечено при добавлении глибенкламида к инсулину (однократное в сутки введение инсулина средней продолжительности действия) еще в исследовании S. Stenman и соавт. (1988) при проведении теста толерантности с едой [85]. Это согласуется с результатами H. Yokoyma и соавт. (2011), полученными у больных СД 2–го типа, находящимися на комбинированной терапии «глимепирид + метформин + базис–болюсная инсулинотерапия» [101]. Снижение только концентрации тощаковой гликемии, но не постпрандиальной во время перорального теста толерантности к глюкозе при добавлении глибурида к инсулину было верифицировано в исследовании [82]. Следует отметить, что прогрессирующая природа СД 2–го типа требует со временем более сложных и гибких режимов инсулинотерапии (базальный инсулин как единственный обычно характерен для первоначальных инсулиновых режимов).
И хотя, согласно современным рекомендациям по антигипергликемической терапии больных СД 2–го типа [3, 30], использование неинсулиновых препаратов может быть продолжено, как правило, прием СМ, ингибиторов ДПП–4 и агонистов рецепторов ГПП–1 прекращается тотчас, как только назначаются более сложные, чем базальный инсулин, режимы инсулинотерапии. Вместе с тем приведенные выше данные свидетельствуют о возможных благоприятных эффектах таких сложных режимов инсулинотерапии с некоторыми ПОАГП в случае сохранения остаточной функции b–клеток.
Заслуживает внимания еще один благоприятный (финансовый) аспект комбинированной терапии «СМ + инсулин». Поскольку доза инсулина уменьшается примерно на 30 % или более добавлением СМ при повышении терапевтической эффективности фармакологической комбинации [97, 100], то суммарная стоимость препаратов из расчета на одного пациента в год составила, например, 1522 американских доллара (глимепирид 6 мг + инсулин 40 Ед, включая 20 Ед базального и 20 Ед болюсного) по сравнению с 1616 американскими долларами при соответствующей дозе инсулина 56 Ед (базального 28 Ед и 28 Ед болюсного без глимепирида) [101].
Бóльшая терапевтическая эффективность может быть достигнута комбинацией двух или более препаратов с различным механизмом действия [75]. Другой препарат целесообразно добавлять, когда средние дозы первого препарата не обеспечивают получения больших преимуществ в эффективности и стоимости. При этом, поскольку дозы антигипергликемических неинсулиновых препаратов обычно не увеличивают до максимальных, побочные эффекты уменьшаются. То же самое относится и к инсулину. Способность пероральных препаратов уменьшать риск вызванных инсулином гипогликемий при достигаемом уровне гликемического контроля зависит главным образом от растущих эффектов эндогенного инсулина. В физиологических условиях повышение глюкозы в плазме уменьшается за счет соответствующего увеличения эндогенной секреции инсулина, а снижение уровня глюкозы ведет к уменьшению секреции гормона [7]. При ухудшении эндогенной секреции инсулина этот механизм балансирования нарушается, что ведет к возрастающим колебаниям уровня глюкозы. Следует подчеркнуть, что, несмотря на ухудшенную секрецию инсулина у всех больных с СД 2–го типа, полное ее отсутствие наблюдается нечасто. Следовательно, пероральные препараты могут улучшать гликемическое равновесие путем потенцирования секреции инсулина или действия остаточного эндогенного инсулина. Это вызывает особый интерес, поскольку достижение идеального гликемического контроля экзогенным инсулином сопряжено во многих случаях с ведущей проблемой интенсивной терапии — гипогликемией. Анализ результатов ряда исследований по изучению эффектов комбинирования СМ и метформина с инсулином, проведенный H. Yki–Järvinen (2001), показал, что конечная доза инсулина была меньше на 32 %, когда сохранялась терапия метформином, на 42 % — на фоне приема СМ и на 62 % — при режиме добавления инсулина к обоим пероральным препaратам. Значительное уменьшение дозы вводимого инсулина на фоне продолжающегося приема СМ, подобное эффектам метформина и тиазолидиндионов [62, 100], ведет к уменьшению риска индуцируемых экзогенным инсулином гипогликемий [72, 75, 100] и свидетельствует о терапевтическом потенциале СМ, реализуемом через повышение стабилизирующих эффектов остаточного эндогенного инсулина у больных СД 2–го типа. Даже если эквивалентный контроль мог бы быть достигнут путем оптимальных инсулиновых режимов и высокого качества вводимого инсулина, повышение секреции инсулина добавлением СМ с меньшими дозами вводимого инсулина является более физиологичным при сохранении остаточной функции β–клеток, поскольку, как было упомянуто выше, эндогенный инсулин, в противоположность подкожно введенному экзогенному инсулину, сначала проходит через портальную вену и печень. Следует подчеркнуть, что до последнего времени оставался нерешенным вопрос об использовании производных СМ у пациентов, которые стартовали с инсулинотерапии и/или продолжают на ней находиться. По результатам ряда ранних мета–анализов и оригинальных исследований целесообразность использования СМ в комбинации с инсулином представлялась спорной [12, 46, 71, 99]. В условиях хронической экспозиции (in vitro) было показано, что производные СМ (глибенкламид, толбутамид) или глиниды (натеглинид) могут повреждать β–клетки путем избыточной сверхстимуляции секреции инсулина и ускорять их апоптотическую гибель [87]. Тем не менее большинство экспертов продолжают использовать производные СМ с началом инсулинотерапии. В ряде сообщений поддерживается целесообразность комбинированной терапии «СМ + инсулин» в связи с достижением лучшего гликемического контроля по сравнению с использованием одного инсулина [24, 32, 65, 74, 75, 97]. Однако во всех этих исследованиях использованы старые препараты СМ, такие как глибенкламид (или глибурид) [12, 26, 65, 99], глипизид, хлорпропамид [24, 97] в комбинации с ультраленте, НПХ или комбинированным инсулином [12, 24, 74, 97, 100], при этом достигнутый гликемический контроль не был достаточным (НbA1c > 8,0 %). Убедительные доказательства перспективности фармакологической комбинации «СМ + инсулин», обеспечивающей оптимизацию терапии (поддержание близкой к нормальной гликемии и возможное предупреждение/ослабление микроваскулярных и макроваскулярных осложнений), связано с разработкой нового производного СМ глимепирида и беспикового аналога базального инсулина (гларгина). Показано, что у больных СД 2–го типа (n = 99), не компенсированных комбинированной терапией субмаксимальными дозами ПОАГП (глимепирид + метформин, соответственно амарил 4 мг/день и глюкофаж 1500 мг/день), 24–недельная комбинированная терапия, дополненная инсулином (метформин + глимепирид + инсулин гларгин), приводила к более выраженному улучшению гликемического контроля по сравнению с комбинированной терапией «метформин или СМ + инсулин гларгин» [68]. Уровни НbA1c (m ± стандартное отклонение) в группах снизились с 8,7 ± 0,95 % до 7,3 ± 0,6 %, с 8,5 ± 0,9 % до 7,7 ± 0,8 % и с 8,4 ± 1,0 % до 7,7 ± ± 1,3 % соответственно (p = 0,02), а среднее снижение составило –1,41 (–1,67; –1,16), –0,75 (–1,14; –0,36) и –0,7 (–1,15; –1,16), суммарный уровень p = 0,02).
Следует отметить, что в этом исследовании средние изменения НbA1c по отношению к базальному уровню в группах «инсулин гларгин + метформин» и «инсулин гларгин + глимепирид» были подобны. Не наблюдалось увеличения риска прироста веса и гипогликемий в группе «метформин + глимепирид + инсулин гларгин» по сравнению с верифицированным у тех, кто получал инсулин гларгин + только один ПОАГП (глимепирид или метформин).
Авторы предполагают, что комбинированная терапия «метформин + глимепирид + инсулин гларгин» ведет к уменьшению дозы инсулина, необходимой для достижения гликемического контроля, по сравнению с другими режимами комбинированной терапии без увеличения риска. Так, на протяжении 24–недельного периода терапии дозы инсулина (m ± стандартное отклонение) увеличились с 12,2 ± ± 2,7 Ед до 29,5 ± 13,3 Ед в группе «инсулин гларгин + метформин», с 11,8 ± 2,0 до 27,2 ± 14,2 Ед в группе «инсулин гларгин + глимепирид» и с 12,5 ± ± 2,5 до 20,1 ± 10,3 Ед в группе «инсулин гларгин + + глимепирид + метформин».
Таким образом, результаты исследования Ch.–Y. Park и соавт. (2014) показали оптимальную пероральную комбинацию антигипергликемических препаратов в добавление к инсулину гларгин у больных с неконтролированным СД 2–го типа, несмотря на субмаксимальные дозы ПОАГП (СМ + метформин), которые наиболее часто применяются в реальной практике у пациентов с неконтролированным СД 2–го типа [68]. Следует также подчеркнуть, что больше больных достигало уровня НbA1c ≤ 7,5 % в группе «инсулин гларгин + глимепирид + метформин», чем в группе «инсулин гларгин + метформин». С учетом длительного наличия СД у этих пациентов (в среднем 12 лет), колебаний возраста от 18 лет до 80 лет, а также рекомендуемой индивидуализации целевых уровней гликемического контроля [29] эти результаты с практической точки зрения свидетельствуют о перспективности такой тройной комбинированной терапии. Ее эффективность обусловлена направленностью на основные патогенетические звенья СД 2–го типа (недостаточная функция b–клеток, включая десенсибилизацию инсулинового ответа на физиологические и фармакологические стимулы, вызванные глюко– и липотоксичностью, и мультифакторную природу инсулинорезистентности) [109]. С учетом двойного механизма антидиабетического действия глимепирида (щадящая стимуляция секреции инсулина в сочетании с инсулин–сенситайзерными свойствами) [105, 109, 110], наиболее выраженный гликемический контроль, достигнутый тройной комбинацией у больных с длительностью СД 11,7 ± 5,0 года (m ± стандартное отклонение), является косвенным свидетельством сохранения остаточной функции панкреатических b–клеток. Прямые доказательства этого, как и обоснованности применения глимепирида в сочетании с метформином и базис–болюсной инсулинотерапией у длительно болеющих пациентов с СД 2–го типа (до 17 лет), были получены в элегантном исследовании H. Yokoyama и соавт. (2011) [101].
Это открытое перекрестное исследование проведено с двумя режимами лечения, а именно с прекращением и продолжением приема глимепирида у 25 пациентов со средней длительностью СД 17 ± 11 лет (m ± стандартное отклонение) и пятилетней инсулинотерапией, комбинированной с метформином + глимепирид, обеспечивающей относительно хороший гликемический контроль (НbA1c < 8,0 %) (три инъекции болюсного инсулина, одна инъекция инсулина гларгин утром, 6 мг глимепирида перед завтраком и метформин 750 мг). При вхождении в исследование и в конце каждого трехмесячного режима лечения определялись базальная гликемия и С–пептид во время пищевого теста толерантности.
Показано, что к концу трехмесячного периода в режиме прекращения применения глимепирида во время теста толерантности к еде значимо увеличивалась гликемия на 0–й, 30–й, 60–й мин, в то время как уровень С–пептида в сыворотке значимо уменьшался через 60 и 120 мин. Уровни НbA1c в режиме прекращения применения глимепирида значимо повышались (с 6,6 ± 0,6 % в базальном состоянии до 7,7 ± 0,8 % к концу трехмесячного периода), и повышенное содержание НbA1c коррелировало с уменьшением площади под кривой С–пептида, стимулированного едой (r = –0,61, р < 0,0001). Полученные результаты свидетельствуют об эффективности продолжающегося длительного приема глимепирида, частично благодаря повышению секреции инсулина у пациентов с СД 2–го типа с большой продолжительностью диабета и базально–прандиальной инсулинотерапией [101]. Подобное сохранение терапевтической эффективности глимепирида, добавленного к комбинированной терапии «инсулин + метформин», отмечено у пациентов, болеющих СД 2–го типа более 10 лет (медиана длительности диабета 16 лет, колебания от 10 до 30 лет), с медианой ИМТ 30 кг/м2 (25–37) [65]. В отсутствие изменений НbA1c в группе больных с плацебо добавление глимепирида уменьшало содержание НbA1c на 0,6 % (р < 0,001), при этом доза инсулина была уменьшена у 23 из 43 больных (медиана уменьшения составила 29 %, колебания от 2 до 100) и не наблюдалось тяжелых гипогликемий. Отмечено значимое увеличение как тощакового, так и постпрандиального отношения С–пептид/глюкоза (р < 0,001) глимепиридом, а в пошаговом множественном регрессионном анализе возможных предикторных факторов ответа более выраженное уменьшение НbА1с было ассоци–ировано с величиной отношения С–пептид/глюкоза. Больший возраст больных был связан с меньшим ответом у 29 пациентов из 43 (67 %), верифицированых как респондеры (снижение НbA1c ≥ 0,5 % или уменьшение дозы инсулина ≥ 20 %). Таким образом, полученные результаты свидетельствуют о том, что даже при длительно существующем диабете добавление глимепирида к комбинированной терапии «инсулин + метформин» может быть эффективным для снижения НbA1c и уменьшения потребности в экзогенном инсулине [65]. Метаанализ 45 клинических исследований показал, что пациенты, не достигающие хорошего гликемического контроля на комбинированной пероральной терапии, нуждаются в инсулине [4]. Pезультаты ряда клинических исследований свидетельствуют о том, что комбинация инсулина и глимепирида также способна уменьшать потребность в инсулине при обеспечении хорошего гликемического контроля [22, 73, 74]. Так, в 24–недельном исследовании больных СД 2–го типа с ожирением, неадекватно контролированных максимальными дозами СМ в базальном состоянии, добавление инсулина к глимепириду при условии титрования дозы инсулина до достижения гликемии натощак 100–120 мг% обеспечивало подобный уровень тощаковой гликемии и НbA1c по сравнению с достигнутым в группе больных только на инсулинотерапии, но при этом в группе на комбинированной терапии уменьшалась доза вводимого инсулина (48 Ед/день vs 78 Ед/день) [73]. Кроме того, уровень гликемии натощак понижался быстрее (уже через 2 и 4 недели) на комбинированной терапии. В другом исследовании, охватившем 695 плохо контролированных больных СД 2–го типа, была изучена эффективность и безопасность комбинации глимепирида с НПХ или гларгином [20]. Наибольшая терапевтическая эффективность (снижение НbA1c) обнаружена в группе больных, получавших утром инсулин гларгин в добавление к глимепириду (3 мг/сутки), по сравнению с НПХ инсулином (р = 0,001) или инсулином гларгин, вводимыми перед сном (р = 0,008). При этом риск ночных гипогликемий был ниже на фоне глимепирида в комбинации с утренним или вечерним введением инсулина гларгин vs комбинации «глимепирид + НПХ инсулин» на ночь.
Следует подчеркнуть, что благоприятный глюкозо–понижающий эффект глимепирида, добавленного к инсулинотерапии, может реализоваться не только за счет повышения функциональной активности b–клеток [48]. Так, у больных СД 2–го типа (n = 46) с длительным течением последнего, плохо контролированных большими дозами инсулина (более 40 Ед/сут–ки) и не получавших СМ или инсулинсенситайзеры в течение 6 мес. до начала исследования, добавление глимепирида (группа А, n = 29) или увеличение суточной дозы инсулина (группа Б, n = 27) на протяжении 24 недель для достижения гликемического контроля (гликемия натощак 7,0 ммоль/л, двухчасовая постпрандиальная глюкоза < 10 ммоль/л) приводило к большему улучшению гликемического конт–роля в группе А, ассоциированному со значительно меньшей суточной дозой вводимого инсулина и повышением уровня адипонектина высокого молекулярного веса (ВМВ–адипонектина) в отсутствие значимых изменений С–пептида в обеих группах.
Принимая во внимание то, что ВМВ–адипонектин является главной активной формой гормона и играет существенную роль в повышении чувствительности к инсулину и защите от диабета [51, 107], логично рассматривать его прямое участие в улучшении гликемического контроля в исследовании Ch. Li и соавт. (2014). Это подтверждается обнаруженной авторами отрицательной корреляцией между НbA1c и сывороточными уровнями ВМВ–адипонектина, согласуется с сообщениями об ингибировании инсулином in vitro [35] и in vivo [102] экспрессии и секреции адипонектина, а также позволяет думать, что уменьшение доз инсулина в группе больных, леченных глимепиридом, на 53 % (с 68,6 ± 14,6 Ед/сутки до 32,3 ± 14,9 Ед/сутки) по сравнению с увеличением на 29 % (с 66,8 ± 13,9 Ед/сутки до 86,2 ± 18,9 Ед/сут–ки) в группе Б (без глимепирида) может приводить к повышению концентрации ВМВ–адипонектина в циркуляции [48]. Следует добавить, что глимепирид оказывает прямое действие на увеличение экспрессии гена адипонектина в адипоцитах [38], но инсулин–сенситайзерные свойства глимепирида не исчерпываются этим механизмом [109]. Существенно, что в отсутствие тяжелых гипогликемий в обеих группах гипогликемические эпизоды верифицированы значимо реже в группе А, чем в группе Б (р < 0,05). Более того, 67 % пациентов в группе Б, леченных возрастающими дозами инсулина, имели хотя бы один эпизод гипогликемии, в то время как в группе А (добавление глимепирида к инсулину) гипогликемии отмечены только у 28 % лиц. Следует заметить, что 75 % пациентов с плохим гликемическим контролем в базальном состоянии имели абдоминальное ожирение по критериям Китайской диабетической ассоциации (объем талии у мужчин 90 см, у женщин 85 см) и находились на больших дозах инсулина, а длительность диабета составила 15,6 ± 5,7 года и 15,4 ± 6,2 года соответственно в группах А и Б. Заслуживает внимания и отсутствие значительного увеличения веса у пациентов на комбинированной терапии инсулином и глимепиридом, добавленным к инсулину (группа А), что может быть связано со значительным уменьшением дозы вводимого инсулина. Напротив, в группе Б наблюдалось небольшое, но значимое повышение веса к концу 24–недельной терапии возрастающими дозами инсулина (с 67,2 ± ± 15,9 кг до 69,8 ± 16,5 кг, р < 0,05, m ± стандартное отклонение). С учетом доказанной корреляции ожирения с диабетогенными, атерогенными, тромботическими и провоспалительными метаболическими нарушениями, что повышает риск атеросклеротической кардиоваскулярной болезни [40], даже небольшая прибавка веса может быть опасной, так как связана с повышенной смертностью и такими осложнениями, как гиперлипидемия, гипертензия и ишемическая болезнь сердца. Напротив, отсутствие динамики веса, верифицированное в группе А, является преимуществом, обусловленным добавлением глимепирида к инсулинотерапии, о котором было более подробно упомянуто выше.
Хотя многие препараты СМ успешно применяются в комбинации с инсулином, только глимепирид одобрен Управлением по контролю за продуктами питания и лекарственными средствами США (US Food and Drug Administration) для комбинированной терапии [4].
Преимущества глимепирида по сравнению с другими препаратами СМ для оптимизации комбинированной терапии с метформином и инсулином включают следующее:
— глимепирид щадяще стимулирует секрецию инсулина с воспроизведением физиологического биоритма (повышает прежде всего первую фазу секреции гормона);
— глимепирид сохраняет физиологический ответ на физическую нагрузку, включая снижение секреции инсулина (глюкозозависимый эффект СМ и отсутствие стимуляции секреции глюкагона) [105];
— глимепирид повышает синтез и секрецию адипонектина — единственного гормона жировой ткани с доказанным антиатерогенным действием;
— глимепирид обладает прямым (за пределами гликемического контроля) снижающим инсулинорезистентность действием за счет 1) инсулин–миметического эффекта (через нерастворимые детергентами богатые гликолипидами «мостики» путем активации гликозилфосфатидилинозитолфосфолипазы С); 2) инсулин–сенситайзерных эффектов (через повышение адипонектина, снижение ФНО–a, оксидативного стресса и др.) [109, 110].
Более того, глимепирид не блокирует благоприятный (защитный) эффект миокардиального ишемического прекондиционирования в отличие от глибурида и глипизида [57]. Следует подчеркнуть, что глимепирид — единственное производное CM с клинически доказанной способностью сохранять защитный феномен ишемического прекондиционирования [47, 105].
Глимепирид расширяет спектр реабилитирующего влияния на патофизиологические составляющие инсулинорезистентности, а также потенцирует благоприятные эффекты метформина (в частности, через адипонектин, который является активатором аденозинмонофосфат–активируемой протеинкиназы — ключевого фермента в реализации снижающего инсулинорезистентность действия метформина). С этим связано достижение оптимизированной терапевтической эффективности пероральной фармкомбинации при снижении побочного действия (уменьшение дозы глимепирида, метформина) [109].
Кроме того, заслуживает внимания исследование K.M. Pantalone и соавт. (2010) большой когорты больных СД 2–го типа, представившее клинические доказательства увеличения риска смерти глибуридом или глипизидом по сравнению с глимепиридом при наличии в базальном состоянии документированной кардиоваскулярной болезни [67]. Следует отметить, что кардиозащитный потенциал глимепирида включает верифицированные к настоящему времени in vivo и in vitro благоприятные эффекты на факторы риска атеросклеропатий (ускоренного атерогенеза) у больных СД 2–го типа за пределами гликемического контроля: снижение гипоадипонектинемии, дислипидемии, оксидативного стресса, а также дисфунк–ции сосудистых эндотелиальных клеток [33, 42, 61, 98, 105, 107].
Так, in vitro глимепирид (но не глибенкламид) вызывал продукцию NO эндотелиальными клетками пупочной вены человека (HUVEC) путем повышения активности эндотелиальной NO–синтазы, угнетал активацию провоспалительного транскрипционного фактора NF–kВ, вызванную ФНО–a, в частности, способствовал значительному ингибированию индуцированного обработкой ФНО–a увеличения содержания ДНК–активирующей субъединицы NF–kВ — белка р65 в ядерных экстрактах HUVEC [33]. Стоит отметить, что среди инициаторов специфических диабетических осложнений, синтезируемых под активирующим влиянием NF–kB, важное место занимают различные факторы роста, и в первую очередь эндотелиальный фактор роста сосудов (vascular endothelial growth factor, VEGF). Это специфический для эндотелиальных клеток митоген, обеспечивающий регуляцию ангиогенеза. В то же время VEGF идентифицирован как ключевой фактор пролиферативной диабетической ретинопатии и потенциальный медиатор непролиферативной ретинопатии [95], он также задействован в развитии нефропатии [56] и нейропатии у пациентов с СД [14]. Помимо активации синтеза факторов роста, NF–kВ регулирует целый ряд провоспалительных компонентов, активно участвующих в развитии сосудистой патологии, в первую очередь атеросклероза. Таким образом, повышенная активность NF–kВ, обусловленная оксидативным стрессом в условиях гипергликемии, гиперлипидемии и хронического воспаления, в значительной мере ответственна за развитие и прогрессирование кардиоваскулярной дисфункции, наблюдаемой при СД, поскольку приводит к усиленной трансактивации ключевых генов, вовлеченных в данный патологический процесс.
Необходимо подчеркнуть, что обнаруженное у больных СД 2–го типа самостоятельное положительное (реабилитирующее) влияние глимепирида за рамками улучшения гликемического контроля свидетельствует о его уникальных свойствах, направленных на коррекцию нарушений регуляции кардиоваскулярной системы при СД 2–го типа. В подтверждение этого в исследовании K. Koshiba и соавт. (2006) уровень гликемического контроля, достигаемый терапией глимепиридом или глибенкламидом, был одинаков, однако снижение риска развития атеросклероза и его клинической выраженности отмечено только при использовании глимепирида [42]. Более того, обнаруженный благоприятный эффект 24–недельной терапии глимепиридом на антиоксидантные и антивоспалительные параметры, как и ангиогенные свойства препарата, был верифицирован в отсутствие корреляции со снижением уровня глюкозы или уровня HbA1c [61]. В дополнение отметим, что при одинаковом улучшении гликемического контроля 12–недельной терапией глимепиридом или глибенкламидом больных СД 2–го типа (n = 565) только глимепирид вызвал значимое улучшение липидного метаболизма (снижение уровней триглицеридов, общего холестерина, холестерина ЛПНП и повышение холестерина ЛПВП), улучшил баланс в фибринолитической системе (повышение активности тканевого активатора плазминогена и снижение активности ингибитора активатора плазминогена типа 1), т.е. снизил тромбообразование [98].
Следует обратить внимание на формирование современной концепции о существенном значении благоприятных эффектов, включая факторы кардио–васкулярного риска, за пределами гликемического контроля при выборе перспективных антидиабетических пероральных препаратов как для монотерапии, так и для комбинации с инсулином [98].
Терапевтическая оптимальность пероральной фармакологической комбинации «метформин + глимепирид», как и «метформин + глимепирид + инсулин», базируется также на уникальной способности метформина устранять феномен «гипергликемической памяти» (метаболического наследия) за счет повышения экспрессии и активности ключевого игрока — сиртуина–1, с одной стороны, и патогенетически обоснованном соответствии реабилитирующих эффектов такого сочетания спонтанной эволюции СД 2–го типа, с другой стороны [108, 109].
Следует также отметить, что в настоящее время ведутся активные поиски и апробация широкого спектра пероральных сахароснижающих фармакологических средств, способных влиять на процессы неогенеза и апоптоза панкреатических b–клеток при СД, однако до сих пор не получено достоверных клинических сведений об их эффективности [55, 103, 111]. В таких условиях инсулинотерапия является реальной стратегией комплексного терапевтического влияния при СД как 1–го, так и 2–го типа. Протективная возможность инсулинотерапии относительно апоптотической гибели b–клеток при СД связана: а) с иммуномодулирующими свойствами инсулина (антивоспалительный эффект, в частности снижение индуктора апоптоза ФНО–a); б) способностью обеспечивать «покой» b–клеткам, что приводит к уменьшению экспрессии аутоантигенов, тормозит накопление проинсулина, снижает феномен десенситизации к инсулиновым секретагогам и в целом продлевает способность к эндогенной секреции инсулина; в) антиапоптотическим действием инсулина в отношении панкреатических b–клеток за счет его подобных фактору роста свойств; г) оптимизацией метаболического контроля (снижение глюко– и липотоксичности, а именно индукторов апоптоза — гипер– и гипогликемии, повышенного уровня свободных жирных кислот, как и вызываемой гипергликемией продукции b–клетками интерлейкина–1b— ключевого медиатора их ухудшенной функции и деструкции).
Таким образом, комбинирование ПОАГП «метформин + глимепирид» с инсулином (традиционно или преимущественно базальным) обеспечивает максимальное соответствие специфических эффектов фармкомбинации детерминирующим патогенетическим факторам СД 2–го типа и ассоциированных ангиопатий с учетом спонтанной эволюции заболевания.
1. Abrahamson M.J. Should sulfonylureas remain an acceptable first–line add–on to metformin therapy in patients with type 2 diabetes? Yes, they continue to serve us well! // Diabetes Care. — 2015. — Vol. 38. — P. 160–169.
2. Ackermann R.T., Finch E.A., Brizendine E. et al. Translating the diabetes prevention program into the community. The DEPLOY Pilot Study // Am. J. Prev. Med. — 2008. — Vol. 35. — P. 357–363.
3. American Diabetes Association. Standards of Medical Care in Diabetes — 2015 // Diabetes Care. — 2015. — Vol. 38, Suppl. 1. — P. S41–48.
4. Basit A., Riaz M., Fawwad A. Glimipiride: evidence–based facts, trends, and observations // Vasc. Health Risk Manag. — 2012. — Vol. 8. — P. 463–472.
5. Bennett W.L., Maruthur N.M., Singh S. et al. Comparative effectiveness and safety of medications for type 2 diabetes: an update including new drugs and 2–drug combinations // Ann. Intern. Med. — 2011. — Vol. 154. — P. 602–613.
6. Bergman R.N. Lilly lecture 1989. Toward physiological understanding of glucose tolerance. Minimal–model approach // Diabetes. — 1989. — Vol. 38. — P. 1512–1527.
7. Boon H., Blaak E.F., Saris W.H.M. et al. Substrate source utilization in long–term diagnosed type 2 diabetes patients at rest, and during exercise and subsequent recovery // Diabetologia. — 2007. — Vol. 50. — P. 103–112.
8. Briscoe V.J., Griffith M.L., Davis S.N. The role of glimepiride in the treatment of type 2 diabetes mellitus // Expert Opin. Drug Metab. Toxicol. — 2010. — Vol. 6. — P. 225–235.
9. Butler A.E., Janson J., Bonner–Weir S. et al. β–Cell deficit and increased β–cell apoptosis in humans with type 2 diabetes // Diabetes. — 2003. — Vol. 52. — P. 102–110.
10. Caulfield M.T., O’Brien K.D. Cardiovascular safety of oral antidiabetic agents: the insulin secretagogues // Clin. Diabetes. — 2002. — Vol. 20. — P. 81–84.
11. Cefalu W.T., Buse J.B., Del Prato S. et al. Beyond metformin: safety considerations in the decision–making process for selecting a second medication for type 2 diabetes management. Reflections from a Diabetes Care Editor's Expert Forum // Diabetes Care. — 2014. — Vol. 37. — P. 2647–2659.
12. Chow C.C., Tsang L.W., Sorensen J.P., Cockram C.S. Comparison of insulin with or without continuation of oral hypoglycemic agents in the treatments of secondary in NIDDM patients // Diabetes Care. — 1995. — Vol. 18. — P. 307–314.
13. Defronzo R.A. Banting lecture. From the triumvirate to the ominous octet: a new paradigm for the treatment of type 2 diabetes mellitus // Diabetes. — 2009. — Vol. 58. — P. 773–795.
14. Deguchi T., Hashiguchi T., Horinouchi S. et al. Serum VEGF increases in diabetic polyneuropathy, particularly in the neurologically active symptomatic stage // Diabet. Med. — 2009. — Vol. 26, № 3. — P. 247–252.
15. Del Prato S., Bianchi C., Marchetti P. B–cell function and antidiabetic pharmacotherapy // Diabetes Metab. Res. Rev. — 2007. — Vol. 23. — P. 518–527.
16. Diedenhofen A., Rosenkranz B., Robkamp R. Scientific monograph Amaryl® 3rd revised edition // Aventis Pharma. — 2000. — 1–114.
17. Donath M.Y., Halban P.A. Decreased β–cell mass in diabetes: significance, mechanisms and therapeutic implications // Diabetologia. — 2004. — Vol. 47. — P. 581–589.
18. Ferdinandy P., Schulz R., Baxter G.F. Interaction of cardiovascular risk factors with myocardial ischemia/reperfusion injury, preconditioning, and postconditioning // Pharmacol. Rev. — 2007. — Vol. 59. — P. 418–458.
19. Festa A., Williams K., Hanley A.J., Haffner S.M. β–сell dysfunction in subjects with impaired glucose tolerance and early type 2 diabetes: comparison of surrogate markers with first–phase insulin secretion from an intravenous glucose tolerance test // Diabetes. — 2008. — Vol. 57. — P. 1638–1644.
20. Fritsche A., Schweitzer M.A., Häring H.U. Glimepiride combined with morning insulin glargine, bedtime neutral protamine hagedorn insulin, or bedtime insulin glargine in patients with type 2 diabetes. A randomized, controlled trial // Ann. Intern. Med. — 2003. — Vol. 138. — P. 952–959.
21. Gaede P., Lund–Andersen H., Parving H.H., Pedersen O. Effect of multifactorial intervention on mortality in type 2 diabetes // N. Engl. J. Med. — 2008. — Vol. 358. — P. 580–589.
22. Garber A.J. Benefits of combination therapy of insulin and oral hypoglycemic agents // Arch. Intern. Med. — 2003. — Vol. 163. — P. 1781–1782.
23. Garber A.J., Abrahamson M.J., Barzilay J.I. et al. American Association of Clinical Endocrinologists’ comprehensive diabetes management algorithm 2013 consensus statement — executive summary // Endocr. Pract. — 2013. — Vol. 19. — P. 536–557.
24. Holman R.R., Steemson J., Turner R.C. Sulphonylurea failure in type 2 diabetes: treatment with a basal insulin supplement // Diabet. Med. — 1987. — Vol. 4. — P. 457–462.
25. Holman R.R. Assessing the potential for –glucosidase inhibitors in prediabetic states // Diabetes Res. Clin. Pract. — 1998. — Vol. 40. — P. S21–S25.
26. Holman R.R., Paul S.K., Bethel M.A. et al. 10–year follow–up of intensive glucose control in type 2 diabetes // N. Engl. J. Med. — 2008. — Vol. 359. — P. 1577–1589.
27. Holstein A., Plaschke A., Egberts E.H. Lower incidence of severe hypoglycaemia in patients with type 2 diabetes treated with glimepiride versus glibenclamide // Diabetes Metab. Res. Rev. — 2001. — Vol. 17. — P. 467–473.
28. Hu F.B., Manson J.E., Stampfer M.J. et al. Diet, lifestyle, and the risk of type 2 diabetes mellitus in women // N. Engl. J. Med. — 2001. — Vol. 345 — P. 790–797.
29. Inzucchi S.E., Bergenstal R.M., Buse J.B. et al. Ma–nagement of hyperglycemia in type 2 diabetes: A patient–centered approach: position statement of the american diabetes association (ADA) and the European Association for the Study of Diabetes (EASD) // Diabetes Care. — 2012. — Vol. 35 — P. 1364–1379.
30. Inzucci S.E., Bergenstal R.M., Buse I.B. et al. Management of hyperglycemia in type 2 diabetes, 2015: a patient–centered approach: update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes // Diabetes Care. — 2015. — Vol. 38. — P. 140–149.
31. Ismail–Beigi F. Pathogenesis and glycemic management of type 2 diabetes mellitus: a psychological approach // Arch. Iran. Med. — 2012. — Vol. 15, № 4. — P. 239–246.
32. Johnson J.L., Wolf S.L., Kabadi U.M. Efficacy of insulin and sulfonylurea combination therapy in type II diabetes. A meta–analysis of the randomized placebo–controlled trials // Arch. Intern. Med. — 1996. — Vol. 156. — P. 259–264.
33. Jojima T., Suzuki K., Hirama N. et al. Glimepiride upregulates eNOS activity and inhibits cytokine–induced NF–kappaB activation through a phosphoinoside 3–kinase–Akt–dependent pathway // Diabetes Obes. Metab. — 2009. — Vol. 11. — P. 143–149.
34. Jollis J.G., Simpson R.J. Jr., Cascio W.E. et al. Relation between sulfonylurea therapy, complications, and outcome for elderly patients with acute myocardial infarction // Am. Heart J. — 1999. — Vol. 138. — P. S376–S380.
35. Kadowaki T., Yamauchi T., Kubota N. et al. Adiponectin and adiponectin receptors in insulin resistance, diabetes, and the metabolic syndrome // J. Clin. Invest. — 2006. — Vol. 116. — P. 1784–1792.
36. Kahn S.E., Prigeon R.L., McCulloch D.K. et al. Quantification of the relationship between insulin sensitivity and β–cell function in human subjects. Evidence for a hyperbolic function // Diabetes. — 1993. — Vol. 42. — P. 1663–1672.
37. Kahn S.E., Halban P.A. Release of incompletely processed proinsulin is the cause of the disproportionate proinsulinemia of NIDDM // Diabetes. — 1997. — Vol. 46. — P. 1725–1732.
38. Kanda Y., Matsuda M., Tawaramoto K. et al. Effects of sulfonylurea drugs on adiponectin production from 3 T3–L1 adipocytes: implication of different mechanism from pioglitazone // Diabetes Res. Clin. Pract. — 2008. — Vol. 81. — P. 13–18.
39. Karaca M., Magnan C., Kargar C. Functional pancreatic –cell mass: involvement in type 2 diabetes and therapeutic intervention // Diabetes Metab. — 2009. — Vol. 35. — P. 77–84.
40. Kishida K., Funahashi T., Shimomura I. Clinical importance of assessment of type 2 diabetes mellitus with visceral obesity. A Japanese perspective // Curr. Diabetes Rev. — 2012. — Vol. 8. — P. 84–91.
41. Knowler W.C., Connor E.B, Fowler S.E. et al. Diabetes Prevention Program Research Group Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin // N. Engl. J. Med. — 2002. — Vol. 346 — P. 393–403.
42. Koshiba K., Nomura M., Nakaya Y., Ito S. Efficacy of glimepiride on insulin resistance, adipocytokines, and atherosclerosis // J. Med. Invest. — 2006. — Vol. 53 — P. 87–94.
43. Leahy J.L., Bonner–Weir S., Weir G.C. Cell dysfunction induced by chronic hyperglycemia. Current ideas on mechanism of impaired glucose–induced insulin secretion // Diabetes Care. — 1992. — Vol. 15. — P. 442–455.
44. Leahy J.L. Pathogenesis of type 2 diabetes mellitus // Arch. Med. Res. — 2005. — Vol. 36 — P. 197–209.
45. Leahy J.L., Hirsch I.B., Peterson K.A., Schneider D. Targeting –cell function early in the course of therapy for type 2 diabetes mellitus // J. Clin. Endocrinol. Metab. — 2010. — Vol. 95. — P. 4206–4216.
46. Lebovitz H.E., Pasmantier R. Combination insulin–sulfonylurea therapy // Diabetes Care. — 1990. — Vol. 13. — P. 667–675.
47. Lee T.M., Chou T.F. Impairment of myocardial protection in type 2 diabetic patients // J. Clin. Endocrinol. Metab. — 2003. — Vol. 88. — P. 531–537.
48. Li Ch.–J., Zhang J.–Y., Yu De–M., Zhang Q.–M. Adding glimepiride to current insulin therapy increases high–molecular weight adiponectin levels to improve glycemic control in poorly controlled type 2 diabetes // Diabetol. Metab. Syndr. – 2014. — Vol. 6. — P. 41–42.
49. Li G., Zhang P., Wang J. et al. The long–term effect of lifestyle interventions to prevent diabetes in the China Da Qing Diabetes Prevention Study: a 20–year follow–up study // Lancet. — 2008. — Vol. 371, № 9626. — P. 1783–1789.
50. Lindström J., Ilanne–Parikka P., Peltonen M. et al. Sustained reduction in the incidence of type 2 diabetes by lifestyle intervention: follow–up of the Finnish Diabetes Prevention Study // Lancet. — 2006. — Vol. 368. — P. 1673–1679.
51. Liu M., Liu F. Regulation of adiponectin multimerization, signaling and function // J. Clin. Invest. — 2006. — Vol. 116. — P. 1784–1792.
52. Loke Y.K., Kwok C.S., Singh S. Comparative cardiovascular effects of thiazolidinediones: systematic review and meta–analysis of observation studies // BMJ. — 2011. — Vol. 342. — P. d1309.
53. Matthews D.R. Oscillatory insulin secretion: a variable phenotypic marker // Diabet. Med. — 1996. — Vol. 13 — P. S53–S58.
54. Matthews D.R., Cull C.A., Stratton I.M. et al. UKPDS 26: Sulphonylurea failure in non–insulin–dependent diabetic patients over six years. UK Prospective Diabetes Study (UKPDS) Group // Diabet. Med. — 1998. — Vol. 15. — P. 297–303.
55. Meier J.J. Beta cell mass in diabetes: a realistic therapeutic target? // Diabetologia. — 2008. — Vol. 51. — P. 703–713.
56. Mironidou–Tzouveleki M., Tsartsalis S., Tomos C. Vascular endothelial growth factor (VEGF) in the pathogenesis of diabetic nephropathy of type 1 diabetes mellitus // Curr. Drug. Targets. — 2011. — Vol. 12, № 1. — P. 107–114.
57. Mocanu M.M., Maddock H.L., Baxter G.F. et al. Glimepiride, a novel sulfonylurea, does not abolish myocardial protection afforded by either ischemic preconditioning or diazoxide // Circulation — 2001. — Vol. 103 — P. 3111–3116.
58. Muller G., Wied S. The sulfonylurea drug, glimepiride, stimulates glucose transport, glucose transporter translocation, and dephosphorylation in insulin–resistant rat adipocytes in vitro // Diabetes. — 1993. — Vol. 42. — P. 1852–1867.
59. Murry C.E., Jennings R.B., Reimer K.A. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium // Circulation. — 1986. — Vol. 74. — P. 1124–1136.
60. Nagayama D., Saiki A., Endo K. et al. Improvement of cardio–ankle vascular index by glimepiride in type 2 diabetic patients // Int. J. Clin. Pract. — 2010. — Vol. 64, № 13. — P. 1796–801.
61. Nakamura I., Oyama J., Komoda H. et al. Possible effects of glimepiride beyond glycemic control in patients with type 2 diabetes: a preliminary report // Cardiovasc. Diabetol. — 2014. — Vol. 13, Art. 15. — P. 1–8.
62. Natali A., Ferrannini E. Effects of metformin and thiazolidinediones on suppression of hepatic glucose production and stimulation of glucose uptake in type 2 diabetes: a systematic review // Diabetologia. — 2006. — Vol. 49. — P. 434–441.
63. Nathan D.M., Buse J.B., Davidson M.B. et al. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy a consensus statement of the American Diabetes association and the European Association for the Study of Diabetes // Diabetes Care. — 2009. — Vol. 32. — P. 193–203.
64. Nyalakonda K., Sharma T., Ismail–Beigi F. Preservation of beta–cell function in type 2 diabetes // Endocr. Practice. — 2010. — Vol. 16. — P. 1038–1055.
65. Nybäck–Nakell A., Adamson U., Lins P.E., Landstedt–Hallin L. Glycaemic responsiveness to long–term insulin plus sulphonylurea therapy as assessed by sulphonylurea withdrawal // Diabet. Med. — 2007. — Vol. 24. — P. 1424–1429.
66. Ose H., Fukui M., Kitagawa Y. et al. Efficacy of glimepiride in patients with poorly controlled insulin–treated type 2 diabetes mellitus // Endocr. J. — 2005. — Vol. 52. — P. 563–569.
67. Pantalone K.M., Kattan M.W., Yu C. et al. The risk of overall mortality in patients with type 2 diabetes receiving glipizide, glyburide, or glimepiride monotherapy: a retrospective analysis // Diabetes Care. — 2010. — Vol. 33. — P. 1224–1229.
68. Park Ch.–Y., Kang J.G., Chon S. et al. Comparison between the therapeutic effect of metformin, glimepiride and their combination as an add–on treatment to insulin glargine in uncontrolled patients with type 2 diabetes // Plos One. — 2014. — Vol. 9. — Р. 1–7.
69. Polonsky K.S., Sturis J., Van Cauter E. Temporal profiles and clinical significance of pulsatile insulin secretion // Horm. Res. — 1998. — Vol. 49. — P. 178–184.
70. Pørksen N. The in vivo regulation of pulsatile insulin secretion // Diabetologia. — 2002. — Vol. 45. — P. 3–20.
71. Pugh J.A., Wagner M.L., Sawyer J. et al. Is combination of sulfonylurea and insulin therapy useful in NIDDM patients? A metaanalysis // Diabetes Care. — 1992. — Vol. 15 — P. 953–959.
72. Riddle M.C., Hart J., Bingham P. et al. Combined therapy for obese type 2 diabetes: suppertime mixed insulin with daytime sulfonylurea // Am. J. Med. Sci. — 1992. — Vol. 303. — P. 151–156.
73. Riddle M.C. Combined therapy with a sulfonurea plus evening insulin: safe, reliable, and becoming routine // Horn. Metab. Res. — 1996. — Vol. 28 — P. 430–433.
74. Riddle M.C., Schneider J. The glimepiride combination group beginning insulin treatment of obese patients with evening 70/30 insulin plus glimepiride versus insulin alone // Diabetes Care. — 1998. — Vol. 21 — P. 1052–1057.
75. Riddle M.C. Combined therapy with a insulin plus oral agents. Is there any advantage? An argument in favor // Diabetes Care. — 2008. — Vol. 31. — P. S125–S130.
76. Røder M.E., Porte Jr.D., Schwartz R.S., Kahn S.E. Disproportionately elevated proinsulin levels reflect the degree of impaired B–cell secretory capacity in patients with noninsulin–dependent diabetes mellitus // J. Clin. Endocrinol. Metab. — 1998. — Vol. 83. — P. 604–608.
77. Rosenstock J., Marx N., Kahn S.E. et al. Cardiovascular outcome trials in type 2 diabetes and the sulphonylurea controversy: Rationale for the active–comparator CAROLINA trial // Diabet. Vasc. Dis. Res. — 2013. — Vol. 10. — P. 289–301.
78. Rosenzweig J.L., Ferrannini E., Grundy S.M. et al. Primary prevention of cardiovascular disease and type 2 diabetes in patients at metabolic risk: an Endocrine Society Clinical Practice Guideline // J. Clin. Endocrinol. Metab. — 2008. — Vol. 93. — P. 3671–3689.
79. Rutter M.K., Nesto R.W. The BARI 2D Study: a randomised trial of therapies for type 2 diabetes and coronary artery disease // Diab. Vasc. Dis. Res. — 2010. — Vol. 7, № 1. — P. 69–72.
80. Sanofi–Aventis Canada, Inc. Product Monograph (Amaryl, glimepiride). — 2009.
81. Schwartz S., Sievers R., Strange P. et al. Insulin 70/30 mix plus metformin versus triple oral therapy in the treatment of type 2 diabetes after failure of two oral drugs: efficacy, safety, and cost analysis // Diabetes Care. — 2003. — Vol. 26. — P. 2238–2243.
82. Shade D.S., Mitchell W.J., Griego G. Addition of sulfonylurea to insulin treatment in poorly controlled type II diabetes. A double–blind, randomized clinical trial // JAMA. — 1987. — Vol. 257. — P. 2441–2445.
83. Siebel A.L., Fernandez A.Z., El–Osta A. Glycemic memory associated epigenetic changes // Biochem. Pharmacol. — 2010. — Vol. 80. — P. 1853–1859.
84. Sladek R., Rocheleau G., Rung J. et al. A genome–wide association study identifies novel risk loci for type 2 diabetes // Nature. — 2007. — Vol. 445. — P. 881–885.
85. Stenman S., Groop P.H., Saloranta C. et al. Effects of the combination of insulin and glibenclamide in type 2 (non–insulin–dependent) diabetic patients with secondary failure to oral hypoglycaemic agents // Diabetologia. — 1988. — Vol. 31. — P. 206–213.
86. Tabara Y., Osawa H., Kawamoto R. et al. Replication study of candidate genes associated with type 2 diabetes based on genome–wide screening // Diabetes — 2009. — Vol. 58. — P. 493–498.
87. Takahashi A., Nagashima K., Hamasaki A. et al. Sulfonylurea and glinide reduce insulin content, functional expression of K (ATP) channels, and accelerate apoptotic beta–cell death in the chronic phase // Diabetes Res. Clin. Pract. — 2007. — Vol. 77. — P. 77343–77350.
88. Turner R.C., Cull C.A., Frighi V., Holman R.R., UK Prospective Diabetes Study (UKPDS) Group. Glycemic control with diet, sulfonylurea metformin or insulin in patients with type 2 diabetes mellitus: progressive requirement for multiple therapies (UKPDS 49) // JAMA. — 1999. — Vol. 281, № 21. — P. 2005–2012.
89. Unik J.L., Beavers D., Jakicic J.M. et al. Effectiveness of lifestyle interventions for individuals with severe obesity and type 2 diabetes: Results from the Look AHEAD trial // Diabetes Care. — 2011. — Vol. 34. — P. 2152–2157.
90. Ward W.K., LaCava E.C., Paquette T.L. et al. Disproportionate elevation of immunoreactive proinsulin in type 2 (non–insulin–dependent) diabetes mellitus and in experimental insulin resistance // Diabetologia. — 1987. — Vol. 30. — P. 698–702.
91. Weir G.C., Laybutt D.R., Kaneto H. et al. β–сell adaptation and decompensation during the progression of diabetes // Diabetes. — 2001. — Vol. 50, Suppl. 1. — P. S154–S159.
92. Weitgasser R., Lechleitner M., Luger A., Klingler A. Effects of glimepiride on HbA(1c) and body weight in type 2 diabetes: results of a 1/5–year follow up study // Diabetes Res. Clin. Pract. — 2003. — 61. — 13–19.
93. Weyer C., Bogardus C., Mott D. M. et al. The natural history of insulin secretory dysfunction and insulin resistance in the pathogenesis of type 2 diabetes mellitus // J. Clin. Invest. — 1999. — Vol. 104. — P. 787–794.
94. Whitmer R.A., Karter A.J., Yaffe K. et al. Hypoglycemic episodes and risk of dementia in older patients with type 2 diabetes mellitus // JAMA. — 2009. — Vol. 301. — P. 1565–1572.
95. Wirostko B., Wong T.Y., Simó R. Vascular endothelial growth factor and diabetic complications // Prog. Retin. Eye Res. — 2008. — Vol. 27, № 6. — P. 608–621.
96. Wolffenbuttel B.H., Sels J.P., Rondas–Colbers G.J. et al. Comparison of different insulin regiments in elderly patients with NIDDM // Diabetes Care. — 1996. — Vol. 19. — P. 1326–1332.
97. Wright A., Burden A.C.F., Paisey R.B. et al. Sulfonylurea inadequately. Efficacy of addition of insulin over 6 years in patients with type 2 diabetes in the UK Prospective Diabetes Study (UKPDS 57) // Diabetes Care. — 2002. — Vol. 25. — P. 330–336.
98. Xu D., Zhao S.–P., Huang Q.–X. et al. Effects of glimepiride on metabolic parameters and cardiovascular risk factors in patience with newly diagnosed type 2 diabetes mellitus // Diabet. Res. Clin. Pract. — 2010. — Vol. 88. — P. 71–75.
99. Yki–Järvinen H., Ryysy L., Nikkilä K. et al. Comparison of bedtime insulin regiments in patients with type diabetes mellitus. A randomized, controlled trial // Ann. Intern. Med. — 1999. — Vol. 130. — P. 389–396.
100. Yki–Järvinen H. Combination therapies with insulin in type 2 diabetes // Diabetes Care. — 2001. — Vol. 24. — P. 758–767.
101. Yokoyama H., Sone H., Yamada D. et al. Contribution of glimepiride to basal–prandial insulin therapy in patients with type 2 diabetes // Diabet. Res. Clin. Pract. — 2011. — Vol. 91. — P. 148–153.
102. Yu J.G., Javorschi S., Hevener A.L. et al. The effect of thiazolidinediones on plasma adiponectin levels in normal, obese, and type 2 diabetic subjects // Diabetes. — 2002. — Vol. 51. — P. 2968–2974.
103. Маньковский Б.Н. Функция β–клеток и возможные механизмы ее сохранения при лечении больных СД 2–го типа // Здоров’я України. Медична газета. — 2006. — № 8 (141). — C. 1–3.
104. Полторак В.В., Горбенко Н.І., Горшунська М.Ю. Блокада К–АТФ–каналів препаратами сульфонілсечовини та кардіоваскулярна безпека у хворих на цукровий діабет 2–го типу // Український медичний часопис. — 2002. — № 6 (32). — С. 65–78.
105. Полторак В.В., Кравчун Н.А., Горшунская М.Ю., Красова Н.С. Глимепирид (Амарил®) в терапии больных сахарным диабетом 2–го типа (патофизиологическое обоснование и клиническая реализация) // Международный эндокринологический журнал. — 2014. — № 1. — С. 77–89.
106. Полторак В.В., Красова Н.С., Горшунская М.Ю. Гликемическая память как патогенетическое основание для формирования алгоритма современной антидиабетической терапии // Міжнародний ендокринологічний журнал. — 2014. — № 3. — С. 15–21.
107. Полторак В.В., Красова Н.С., Горшунська М.Ю. Адипонектин та цукровий діабет 2–го типу (патогенетичні аспекти як підґрунтя для оптимізації антидіабетичної фармакотерапії) // Міжнародний ендокринологічний журнал. — 2014. — № 5. — С. 95–104.
108. Полторак В.В., Красова Н.С., Горшунская М.Ю. Сиртуины как перспективная мишень для профилактики и терапии сахарного диабета // Пробл. ендокрин. патології. — 2014. — № 3. — С. 97–104.
109. Полторак В.В., Красова Н.С., Горшунская М.Ю. Комбинированная терапия «метформин + глимепирид» у больных сахарным диабетом 2–го типа (молекулярные механизмы оптимизации реабилитирующего действия) // Мiжнародний ендокринологiчний журнал. — 2015. — № 1. — P. 87–97.
110. Полторак В.В., Горшунская М.Ю., Жердева Н.Н., Красова Н.С. Амарил® М СР: новая форма выпуска, новые возможности для пациентов // Укр. мед. часопис. — 2015. — № 105. — С. 30–34.
111. Полторак В.В., Красова Н.С., Горшунская М.Ю. Апоптоз панкреатических бета–клеток как новая мишень для инсулинотерапии больных сахарным диабетом 1–го и 2–го типа // Пробл. ендокрин. патології. — 2015. — № 1. — С. 90–102.
112. Тронько М.Д., Полторак В.В., Соколова Л.К. Дослі–дження ORIGIN (передумови, результати) // Міжнародний ендокринологічний журнал. — 2013. — № 1 (49). — С. 15–22.
1. Abrahamson MJ. Should sulfonylureas remain an acceptable first-line add-on to metformin therapy in patients with type 2 diabetes? Yes, they continue to serve us well! Diabetes Care 2015;38:160-169. doi: 10.2337/dc14-1945.
2. Ackermann RT, Finch EA, Brizendine E, Zhou H, Marrero DG. Translating the diabetes prevention program into the community. The DEPLOY Pilot study. Am J Prev Med 2008;35:357-363. doi:10.1016/j.amepre.2008.06.035.
3. American Diabetes Association. Standards of Medical Care in Diabetes — 2015. Diabetes Care 2015;38(Suppl 1):S41-48. doi: 10.2337/dc15-S010.
4. Basit A, Riaz M, Fawwad A. Glimipiride: evidence-based facts, trends, and observations. Vasc Health Risk Manag 2012;8:463-472. doi:10.2147/HIV.S33194.
5. Bennett WL, Maruthur NM, Singh S, Segal JB, Wilson LM, Chatterjee R, Marinopoulos SS, Puhan MA, Ranasinghe P, Block L, Nicholson WK, Hutfless S, Bass EB, Bolen S. Comparative effectiveness and safety of medications for type 2 diabetes: an update including new drugs and 2-drug combinations. Ann Intern Med 2011;154:602-613. doi:10.7326/0003-4819-154-9-201105030-00336.
6. Bergman RN. Lilly lecture 1989. Toward physiological understanding of glucose tolerance. Minimal-model approach. Diabetes 1989;38:1512-1527. doi:10.2337/diabetes.38.12.1512.
7. Boon H, Blaak EF, Saris WHM, Keizer HA, Wagenmakers AJM, van Loon LJC. Substrate source utilization in long-term diagnosed type 2 diabetes patients at rest, and during exercise and subsequent recovery. Diabetologia 2007;50:103-112. doi: 10.1007/s00125-006-0482-2.
8. Briscoe VJ, Griffith ML, Davis SN. The role of glimepiride in the treatment of type 2 diabetes mellitus. Expert Opin Drug Metab Toxicol 2010;6:225-235. doi: 10.1517/17425250903512955.
9. Butler AE, Janson J, Bonner-Weir S, Ritzel R, Rizza RA, Butler PC. β-Cell deficit and increased β-cell apoptosis in humans with type 2 diabetes. Diabetes 2003;52:102-110. doi:10.2337/diabetes.52.1.102.
10. Caulfield MT, O’Brien KD. Cardiovascular safety of oral antidiabetic agents: the insulin secretagogues. Clin Diabetes 2002;20:81-84. doi: 10.2337/diaclin.20.2.81
11. Cefalu WT, Buse JB, Del Prato S, Home PD, LeRoith D, Nauck MA, Raz I, Rosenstock J, Riddle MC. Beyond metformin: safety considerations in the decision-making process for selecting a second medication for type 2 diabetes management. Reflections from a Diabetes Care Editor's Expert Forum. Diabetes Care 2014;37:2647-2659. doi: 10.2337/dc14-1395.
12. Chow CC, Tsang LW, Sorensen JP, Cockram CS. Comparison of insulin with or without continuation of oral hypoglycemic agents in the treatments of secondary in NIDDM patients. Diabetes Care 1995;18:307-314. doi:10.2337/diacare.18.3.307.
13. Defronzo RA. Banting lecture. From the triumvirate to the ominous octet: a new paradigm for the treatment of type 2 diabetes mellitus. Diabetes 2009;58:773-795. doi:10.1016/j.diabres.2010.10.007.
14. Deguchi T, Hashiguchi T, Horinouchi S, Uto T, Oku H, Kimura K, Makisumi K, Arimura K. Serum VEGF increases in diabetic polyneuropathy, particularly in the neurologically active symptomatic stage. Diabet Med 2009;26(3):247-252. doi: 10.1111/j.1464-5491.2009.02680.x.
15. Del Prato S, Bianchi C, Marchetti P. B-cell function and antidiabetic pharmacotherapy. Diabetes Metab Res Rev 2007;23:518-527. doi:10.2337/db09-9028.
16. Diedenhofen A, Rosenkranz B, Robkamp R. Scientific monograph Amaryl® 3rd revised edition. Aventis Pharma 2000:1-114.
17. Donath MY, Halban PA. Decreased β-cell mass in diabetes: significance, mechanisms and therapeutic implications. Diabetologia 2004;47:581-589. doi:10.1007/s00125-004-1336-4.
18. Ferdinandy P, Schulz R, Baxter GF. Interaction of cardiovascular risk factors with myocardial ischemia/reperfusion injury, preconditioning, and postconditioning. Pharmacol Rev 2007;59:418-458. doi: 10.1124/pr.107.06002
19. Festa A, Williams K, Hanley AJ, Haffner SM. β-Cell dysfunction in subjects with impaired glucose tolerance and early type 2 diabetes: comparison of surrogate markers with first-phase insulin secretion from an intravenous glucose tolerance test. Diabetes 2008;57:1638-1644. doi:10.2337/db07-0954.
20. Fritsche A, Schweitzer MA, Häring HU. Glimepiride combined with morning insulin glargine, bedtime neutral protamine hagedorn insulin, or bedtime insulin glargine in patients with type 2 diabetes. A randomized, controlled trial. Ann Intern Med 2003;138:952-959. doi:10.7326/0003-4819-138-12-200306170-00006.
21. Gaede P, Lund-Andersen H, Parving HH, Pedersen O. Effect of multifactorial intervention on mortality in type 2 diabetes. N Engl J Med 2008;358:580-589. doi: 10.1056/NEJMoa0706245.
22. Garber AJ. Benefits of combination therapy of insulin and oral hypoglycemic agents. Arhc Intern Med 2003;163:1781-1782. doi:10.1001/archinte.163.15.1781.
23. Garber AJ, Abrahamson MJ, Barzilay JI Blonde L, Bloomgarden ZT, Bush MA, Dagogo-Jack S, Davidson MB, Einhorn D, Garvey WT,Grunberger G, Handelsman Y, Hirsch IB, Jellinger PS, McGill JB, Mechanick JI, Rosenblit PD, Umpierrez GE, Davidson MH. American Association of Clinical Endocrinologists' comprehensive diabetes management algorithm 2013 consensus statement — executive summary. Endocr Pract 2013;19(Suppl.):536-557. doi: 10.4158/EP13176.CS.
24. Holman RR, Steemson J, Turner RC. Sulphonylurea failure in type 2 diabetes: treatment with a basal insulin supplement. Diabet Med 1987;4:457-462. doi: 10.1111/j.1464-5491.1987.tb00909.x
25. Holman RR. Assessing the potential for α-glucosidase inhibitors in prediabetic states. Diabetes Res Clin Pract 1998;40(Suppl): S21-S25. PMID: 9740498
26. Holman RR, Paul SK, Bethel MA, Neil HA, Matthews DR. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008;359:1577-1589. doi:10.1056/NEJMoa0806470.
27. Holstein A, Plaschke A, Egberts EH. Lower incidence of severe hypoglycaemia in patients with type 2 diabetes treated with glimepiride versus glibenclamide. Diabetes Metab Res Rev 2001;17:467-473. doi: 10.1002/dmrr.235
28. Hu FB, Manson JE, Stampfer MJ, Colditz G, Liu S, Solomon CG, Willett WC. Diet, lifestyle, and the risk of type 2 diabetes mellitus in women. N Engl J Med 2001;345:790-797. doi:10.1056/NEJMoa010492.
29. Inzucchi SE, Bergenstal RM, Buse JB, Diamant M, Ferrannini E. et al. Management of hyperglycemia in type 2 diabetes: A patient-centered approach: position statement of the american diabetes association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2012;35:1364-1379. doi:10.2337/dc12-0413.
30. Inzucchi SE, Bergenstal RM, Buse JB, Diamant M, Ferrannini E, Nauck M, Peters AL, Tsapas A, Wender R, Matthews DR. Management of hyperglycemia in type 2 diabetes, 2015: a patient-centered approach: update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2015;38:140-149. doi: 10.2337/dc14-2441.
31. Ismail-Beigi F. Pathogenesis and glycemic management of type 2 diabetes mellitus: a psychological approach. Arch Iran Med. 2012;15(4):239-246. doi: 012154/AIM.0014.
32. Johnson JL, Wolf SL, Kabadi UM. Efficacy of insulin and sulfonylurea combination therapy in type II diabetes. A meta-analysis of the randomized placebo-controlled trials. Arch Intern Med. 1996;156:259-264. doi:10.1001/archinte.1996.00440030049007.
33. Jojima T, Suzuki K, Hirama N, Uchida K, Hattori Y. Glimepiride upregulates eNOS activity and inhibits cytokine-induced NF-kappaB activation through a phosphoinoside 3-kinase-Akt-dependent pathway. Diabetes Obes Metab 2009; 11:143-149. doi:10.1111/j.1463-1326.2008.00923.x.
34. Jollis JG, Simpson RJ Jr, Cascio WE, Chowdhury MK, Crouse JR 3rd, Smith SC Jr. Relation between sulfonylurea therapy, complications, and outcome for elderly patients with acute myocardial infarction. Am Heart J 1999;138:S376-S380. PMID: 10539800.
35. Kadowaki T, Yamauchi T, Kubota N, Hara K, Ueki K, Tobe K. Adiponectin and adiponectin receptors in insulin resistance, diabetes, and the metabolic syndrome. J Clin Invest 2006; 116:1784-1792. doi:10.1172/JCI29126.
36. Kahn SE, Prigeon RL, McCulloch DK, Boyko EJ, Bergman RN, Schwartz MW, Neifing JL, Ward WK, Beard JC, Palmer JP. Quantification of the relationship between insulin sensitivity and β-cell function in human subjects. Evidence for a hyperbolic function. Diabetes 1993;42:1663-1672. doi:10.2337/diab.42.11.1663.
37. Kahn SE, Halban PA. Release of incompletely processed proinsulin is the cause of the disproportionate proinsulinemia of NIDDM. Diabetes 1997; 46:1725-1732. doi:10.2337/diab.46.11.1725.
38. Kanda Y, Matsuda M, Tawaramoto K, Kawasaki F, Hashiramoto M, Matsuki M, Kaku K. Effects of sulfonylurea drugs on adiponectin production from 3T3-L1 adipocytes: implication of different mechanism from pioglitazone. Diabetes Res Clin Pract 2008; 81:13-18. doi:10.1016/j.diabres.2008.01.031.
39. Karaca M, Magnan C, Kargar C. Functional pancreatic β-cell mass: involvement in type 2 diabetes and therapeutic intervention. Diabetes Metab 2009;35:77-84. doi: 10.1016/j.diabet.2008.09.007.
40. Kishida K, Funahashi T, Shimomura I. Clinical importance of assessment of type 2 diabetes mellitus with visceral obesity. A Japanese perspective. Curr Diabetes Rev 2012;8:84-91. doi: 10.2174/157339912799424546.
41. Knowler WC., Connor E B, Fowler S E., Hamman R F., Lachin J M., Walker E A., Nathan D M; Diabetes Prevention Program Research Group. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med 2002;346:393-403. doi: 10.1056/NEJMoa012512.
42. Koshiba K, Nomura M, Nakaya Y, Ito S. Efficacy of glimepiride on insulin resistance, adipocytokines, and atherosclerosis. J Med Invest 2006;53:87-94. doi:10.2152/jmi.53.87
43. Leahy JL, Bonner-Weir S, Weir GC. β-Cell dysfunction induced by chronic hyperglycemia. Current ideas on mechanism of impaired glucose-induced insulin secretion. Diabetes Care 1992;15:442-455. doi:10.2337/diacare.15.3.442
44. Leahy JL. Pathogenesis of type 2 diabetes mellitus. Arch Med Res 2005;36:197-209. doi:10.1016/j.arcmed.2005.01.003.
45. Leahy JL, Hirsh IB, Peterson KA, Schneider D. Targeting b-cell function early in the course of therapy for type 2 diabetes mellitus J Clin Endocrinol Metab 2010;95:4206-4216. doi: 10.1210/jc/2010-0668.
46. Lebovitz HE, Pasmantier R. Combination insulin-sulfonylurea therapy. Diabetes Care 1990;13:667-675. doi:10.2337/diacare.13.6.667
47. Lee TM, Chou TF. Impairment of myocardial protection in type 2 diabetic patients. J Clin Endocrinol Metab 2003;88:531-537. doi: 10.1210/jc.2002-020904.
48. Li Ch-J, Zhang J-Y, Yu De-M, Zhang Q-M. Adding glimepiride to current insulin therapy increases high-molecular weight adiponectin levels to improve glycemic control in poorly controlled type 2 diabetes. Diabetol Metab Syndr 2014;6:41. doi:10.1186/1758-5996-6-41.
49. Li G, Zhang P, Wang J, Gregg EW, Yang W, Gong Q, Li H, Li H, Jiang Y, An Y, Shuai Y, Zhang B, Zhang J, Thompson TJ, Gerzoff RB, Roglic G, Hu Y, Bennett PH. The long-term effect of lifestyle interventions to prevent diabetes in the China Da Qing Diabetes Prevention Study: a 20-year follow-up study. Lancet 2008; 371(9626):1783-1789. doi: 10.1016/S0140-6736(08)60766-7.
50. Lindström J, Ilanne-Parikka P, Peltonen M, Aunola S, Eriksson JG, Hemiö K, Hämäläinen H, Härkönen P, Keinänen-Kiukaanniemi S, Laakso M, Louheranta A, Mannelin M, Paturi M, Sundvall J, Valle TT, Uusitupa M, Tuomilehto J; Finnish Diabetes Prevention Study Group. Sustained reduction in the incidence of type 2 diabetes by lifestyle intervention: follow-up of the Finnish Diabetes Prevention Study. Lancet 2006; 368 (9548):1673-1679. doi:10.1016/S0140-6736(06)69701-8
51. Liu M, Liu F. Regulation of adiponectin multimerization, signaling and function. Best Pract Res Clin Endocrinol Metab. 2014;28(1):25-31. doi: 10.1016/j.beem.2013.06.003.
52. Loke YK, Kwok CS, Singh S. Comparative cardiovascular effects of thiazolidinediones: systematic review and meta-analysis of observation studies BMJ 2011;342:d1309. doi: 10.1136/bmj.d1309
53. Matthews DR. Oscillatory insulin secretion: a variable phenotypic marker. Diabet Med 1996;13:S53-S58. PMID: 8894483
54. Matthews DR, Cull CA, Stratton IM, Holman RR, Turner RC. UKPDS 26: Sulphonylurea failure in non-insulin-dependent diabetic patients over six years. UK Prospective Diabetes Study (UKPDS) Group. Diabetic Med 1998;15:297-303. doi:10.1002/(SICI)1096-9136(199804)15:4 < 297::AID-DIA572 > 3.0.CO;2-W
55. Meier JJ. Beta cell mass in diabetes: a realistic therapeutic target? Diabetologia 2008;51:703-713. doi: 10.1007/s00125-008-0936-9.
56. Mironidou-Tzouveleki M, Tsartsalis S, Tomos C. Vascular endothelial growth factor (VEGF) in the pathogenesis of diabetic nephropathy of type 1 diabetes mellitus. Curr Drug Targets. 2011;12(1):107-114. doi: 10.2174/138945011793591581.
57. Mocanu MM, Maddock HL, Baxter GF, Lawrence CL, Standen NB, Yellon DM. Glimepiride, a novel sulfonylurea, does not abolish myocardial protection afforded by either ischemic preconditioning or diazoxide. Circulation 2001;103:3111-3116. doi:10.1161/01.CIR.103.25.3111.
58. Muller G, Wied S. The sulfonylurea drug, glimepiride, stimulates glucose transport, glucose transporter translocation, and dephosphorylation in insulin-resistant rat adipocytes in vitro. Diabetes 1993;42:1852-1867. doi:10.2337/diab.42.12.1852
59. Murry CE, Jennings RB, Reimer KA. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation 1986;74:1124-1136. doi: 10.1161/01.CIR.74.5.1124.
60. Nagayama D, Saiki A, Endo K, Yamaguchi T, Ban N, Kawana H, Ohira M, Oyama T, Miyashita Y, Shirai K. Improvement of cardio-ankle vascular index by glimepiride in type 2 diabetic patients. Int J Clin Pract 2010;64(13):1796-801. doi: 10.1111/j.1742-1241.2010.02399.x.
61. Nakamura I, Oyama J, Komoda H, Shiraki A, Sakamoto Y, Taguchi I, Hiwatashi A, Komatsu A, Takeuchi M, Yamagishi S, Inoue T, Node K. Possible effects of glimepiride beyond glycemic control in patients with type 2 diabetes: a preliminary report. Cardiovasc Diabetol 2014;13:15. doi:10.1186/1475-2840-13-15.
62. Natali A, Ferrannini E. Effects of metformin and thiazolidinediones on suppression of hepatic glucose production and stimulation of glucose uptake in type 2 diabetes: a systematic review. Diabetologia 2006;49:434-441. doi: 10.1007/s00125-006-0141-7.
63. Nathan DM, Buse JB, Davidson MB, Ferrannini E, Holman RR, Sherwin R, Zinman B. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy a consensus statement of the American Diabetes association and the European Association for the Study of Diabetes. Diabetes Care 2009;32:193-203. doi: 10.2337/dc08-9025.
64. Nyalakonda K, Sharma T, Ismail-Beigi F. Preservation of beta-cell function in type 2 diabetes. Endocr Practice 2010;16:1038-1055. doi: 10.4158/EP10112.RA.
65. Nybäck-Nakell A, Adamson U, Lins PE, Landstedt-Hallin L. Glycaemic responsiveness to long-term insulin plus sulphonylurea therapy as assessed by sulphonylurea withdrawal. Diabet Med 2007;24:1424-1429. doi:10.1111/j.1464-5491.2007.02286.x.
66. Ose H, Fukui M, Kitagawa Y, Hirata C, Ichio N, Kadono M, Mogami S, Onishi M, Ichida Y, Nakajima T, Hasegawa G, Yoshikawa T, Nakamura N. Efficacy of glimepiride in patients with poorly controlled insulin-treated type 2 diabetes mellitus. Endocr J 2005;52:563-569. doi: 10.1507/endocrj.52.563
67. Pantalone KM, Kattan MW, Yu C, Wells BJ, Arrigain S, Jain A, Atreja A, Zimmerman RS. The risk of overall mortality in patients with type 2 diabetes receiving glipizide, glyburide, or glimepiride monotherapy: a retrospective analysis. Diabetes Care 2010;33:1224-1229. doi:10.2337/dc10-0017.
68. Park Ch.-Y, Kang JG, Chon S, Noh J, Oh SJ, Lee Ch B, Park SW. Comparison between the therapeutic effect of metformin, glimepiride and their combination as an add-on treatment to insulin glargine in uncontrolled patients with type 2 diabetes Plos ONE 2014;9:1-7. doi:10.1371//journal.pone.0087799.
69. Polonsky KS, Sturis J, Van Cauter E. Temporal profiles and clinical significance of pulsatile insulin secretion. Horm Res 1998;49:178-184. doi:10.1159/000023168)
70. Pørksen N. The in vivo regulation of pulsatile insulin secretion. Diabetologia 2002;45:3-20. doi:10.1007/s125-002-8240-x.
71. Pugh JA, Wagner ML, Sawyer J, Ramirez G, Tuley M, Friedberg SJ. Is combination of sulfonylurea and insulin therapy useful in NIDDM patients? A metaanalysis. Diabetes Care 1992;15:953-959. doi:10.2337/diacare.15.8.953
72. Riddle MC, Hart J, Bingham P, Garrison C, McDaniel P. Combined therapy for obese type 2 diabetes: suppertime mixed insulin with daytime sulfonylurea. Am J Med Sci 1992;303:151-156. ISSN: 1538-2990.
73. Riddle MC. Combined therapy with a sulfonylurea plus evening insulin: safe, reliable, and becoming routine. Horn Metab Res 1996;28:430-433. doi:10.1055/s-2007-979832.
74. Riddle MC, Schneider J. The glimepiride combination group beginning insulin treatment of obese patients with evening 70/30 insulin plus glimepiride versus insulin alone. Diabetes Care 1998;21:1052-1057. doi:10.2337/diacare.21.7.1052.
75. Riddle MC, Combined therapy with an insulin plus oral agents. Is there any advantage? An argument in favor. Diabetes Care 2008;31:S125-S130. doi: 10.2337/dc08-s231.
76. Røder ME, Porte JrD, Schwartz RS, Kahn SE. Disproportionately elevated proinsulin levels reflect the degree of impaired B-cell secretory capacity in patients with noninsulin-dependent diabetes mellitus. J Clin Endocrinol Metab 1998;83:604-608. doi:10.1210/jcem.83.2.4544.
77. Rosenstock J., Marx N., Kahn S. E., Zinman B., Kastelein J.J., Lachin J. M., Bluhmki E., Patel S., Johansen O-E., Woerle H-J. Cardiovascular outcome trials in type 2 diabetes and the sulphonylurea controversy: Rationale for the active-comparator CAROLINA trial. Diabet Vasc Dis Res 2013;10:289-301. doi: 10.1177/1479164112475102.
78. Rosenzweig JL, Ferrannini E, Grundy SM, Haffner SM, Heine RJ, Horton ES, Kawamori R. Primary prevention of cardiovascular disease and type 2 diabetes in patients at metabolic risk: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2008;93:3671-3689. doi: 10.1210/jc.2008-0222.
79. Rutter MK, Nesto RW. The BARI 2D Study: a randomised trial of therapies for type 2 diabetes and coronary artery disease. Diab Vasc Dis Res. 2010;7(1):69-72. doi: 10.1177/1479164109354145.
80. Sanofi-Aventis Canada, Inc. Product Monograph (Amaryl, glimepiride). — 2009.
81. Schwartz S, Sievers R, Strange P, Lyness WH, Hollander P. Insulin 70/30 mix plus metformin versus triple oral therapy in the treatment of type 2 diabetes after failure of two oral drugs: efficacy, safety, and cost analysis. Diabetes Care 2003;26:2238-2243. doi:10.2337/diacare.26.8.2238.
82. Sсhade DS, Mitchell WJ, Griego G. Addition of sulfonylurea to insulin treatment in poorly controlled type II diabetes. A double-blind, randomized clinical trial. JAMA 1987;257:2441-2445. doi:10.1001/jama.1987.03390180059023.
83. Siebel AL, Fernandez AZ, El-Osta A. Glycemic memory associated epigenetic changes. Biochem. Pharmacol. 2010;80:1853-1859. doi: 10.1016/j.bcp.2010.06.005.
84. Sladek R, Rocheleau G, Rung J, Dina C, Shen L, Serre D, Boutin P, Vincent D, Belisle A, Hadjadj S, Balkau B, Heude B, Charpentier G, Hudson TJ, Montpetit A, Pshezhetsky AV, Prentki M, Posner BI, Balding DJ, Meyre D, Polychronakos C, Froguel P. A genome-wide association study identifies novel risk loci for type 2 diabetes. Nature 2007;445:881-885. doi:10.1038/nature05616.
85. Stenman S, Groop PH, Saloranta C, Tötterman KJ, Fyhrqvist F, Groop L. Effects of the combination of insulin and glibenclamide in type 2 (non-insulin-dependent) diabetic patients with secondary failure to oral hypoglycaemic agents. Diabetologia 1988;31:206-213. doi:10.1007/BF00290586
86. Tabara Y, Osawa H, Kawamoto R, Onuma H, Shimizu I, Miki T, Kohara K, Makino H. Replication study of candidate genes associated with type 2 diabetes based on genome-wide screening. Diabetes 2009;58:493-498. doi:10.2337/db07-1785
87. Takahashi A. Nagashima K, Hamasaki A, Kuwamura N, Kawasaki Y, Ikeda H. et al. Sulfonylurea and glinide reduce insulin content, functional expression of K (ATP) channels, and accelerate apoptotic beta-cell death in the chronic phase. Diabetes Res Clin Pract 2007;77:343-350. doi:10.2337/db07-1785.
88. Turner RC, Cull CA, Frighi V, Holman RR, UK Prospective Diabetes Study (UKPDS) Group. Glycemic control with diet, sulfonylurea, metformin or insulin in patients with type 2 diabetes mellitus: progressive requirement for multiple therapies (UKPDS 49). JAMA 1999;281(21):2005-2012. doi: 10.1001/jama.281.21.2005.
89. Unik JL, Beavers D, Jakicic JM, Kitabhci AE, Knowler WC, Wadden TA, Wing RR, Look AHEAD Research Group. Effectiveness of lifestyle interventions for individuals with severe obesity and type 2 diabetes: Results from the Look AHEAD trial. Diabetes Care. 2011;34:2152-2157. doi: 10.2337/dc11-0874
90. Ward WK, LaCava EC, Paquette TL, Beard JC, Wallum BJ, Porte JrD. Disproportionate elevation of immunoreactive proinsulin in type 2 (non-insulin-dependent) diabetes mellitus and in experimental insulin resistance. Diabetologia 1987;30:698-702. doi: 10.1007/BF00296991.
91. Weir GC, Laybutt DR, Kaneto H, Bonner-Weir S, Sharma A. β-Cell adaptation and decompensation during the progression of diabetes. Diabetes 2001;50 (Suppl 1):S154 -S159. doi:10.2337/diabetes.50.2007.S154.
92. Weitgasser R, Lechleitner M, Luger A, Klingler A. Effects of glimepiride on HbA(1c) and body weight in type 2 diabetes: results of a 1/5-year follow up study. Diabetes Res Clin Pract 2003;61:13-19. doi: 10.1016/S0168-8227(02)00254-1.
93. Weyer C, Bogardus C, Mott DM, Pratley RE. The natural history of insulin secretory dysfunction and insulin resistance in the pathogenesis of type 2 diabetes mellitus. J Clin Invest 1999;104:787-794. doi:10.1172/JCI7231.
94. Whitmer RA, Karter AJ, Yaffe K, Quesenberry CP, Selby JV. Hypoglycemic episodes and risk of dementia in older patients with type 2 diabetes mellitus. JAMA 2009;301:1565-1572. doi:10.1001/jama.2009.460
95. Wirostko B, Wong TY, Simó R. Vascular endothelial growth factor and diabetic complications. Prog. Retin. Eye Res. 2008;27(6):608-621. doi: 10.1016/j.preteyeres.2008.09.002.
96. Wolffenbuttel BH, Sels JP, Rondas-Colbers GJ, Menheere PP, Kruseman CAN. Comparison of different insulin regiments in elderly patients with NIDDM. Diabetes Care 1996;19:1326-1332. doi:10.2337/diacare.19.12.1326.
97. Wright A, Burden ACF, Paisey RB, Cull CA, Holman RR. Sulfonylurea inadequatecy. Efficacy of addition of insulin over 6 years in patients with type 2 diabetes in the UK Prospective Diabetes Study (UKPDS 57). Diabetes Care 2002; 25:330-336. doi:10.2337/diacare.25.2.330
98. Xu D, Zhao S-P, Huang Q-x, Wei D, Liu Y-h, Liu L, Xiao-mei Xie et al, Effects of glimepiride on metabolic parameters and cardiovascular risk factors in patience with newly diagnosed type 2 diabetes mellitus. Diabetes research and clinical practice 2010;88:71-75. doi:10.1016/j.diabres.2009.12.010.
99. Yki-Järvinen H, Ryysy L, Nikkilä K, Tulokas T, Vanamo R, Heikkilä M. Comparison of bedtime insulin regiments in patients with type diabetes mellitus. A randomized, controlled trial. Ann Intern Med 1999;130:389-396. doi:10.7326/0003-4819-130-5-199903020-00002
100. Yki-Järvinen H. Combination therapies with insulin in type 2 diabetes. Diabetes Care 2001;24:758-767. doi:10.2337/diacare.24.4.758.
101. Yokoyama H, Sone H, Yamada D, Honjo J, Haneda M. Contribution of glimepiride to basal-prandial insulin therapy in patients with type 2 diabetes. Diabetes research and clinical practice 2011;91:148-153. doi:10.1016/j.diabres.2010.10.007.
102. Yu JG, Javorschi S, Hevener AL, Kruszynska YT, Norman RA, Sinha M, Olefsky JM. The effect of thiazolidinediones on plasma adiponectin levels in normal, obese, and type 2 diabetic subjects. Diabetes 2002;51:2968-2974. doi:10.2337/diabetes.51.10.2968.
103. Man'kovskiy B. N. Funktsiya β-kletok y vozmozhnye mekhanyzmy ee sokhraneniya pry lecheniy bol'nykh SD 2 typa. Zdorov'ya Ukrayiny. Medychna hazeta 2006;(141): 1-3.
104. Poltorak VV, Gorbenko NI, Gorshunska MY. Blokada K-ATF-kanaliv preparatamy sul'fonilsechovyny ta kardiovaskulyarna bezpeka u khvorykh na tsukrovyy diabet 2 typu. Ukrayins'kyy medychnyy chasopys 2002;(32): 65-78.
105. Poltorak VV, Kravchun NS, Gorshunska MY, Krasova NS. Hlymepyryd (Amaryl) v terapyy bol'nykh sakharnym dyabetom 2 typa (patofyzyolohycheskoe obosnovanye y klynycheskaya realyzatsyya. Mizhnarodnyy endokrynolohichnyy zhurnal 2014;(1):77-89.
106. Poltorak VV, Krasova NS, Gorshunska MY. Hlykemycheskaya pamyat' kak patohenetycheskoe osnovanye dlya formyrovanyya alhorytma sovremennoy antydyabetycheskoy terapyy. Mizhnarodnyy endokrynolohichnyy zhurnal 2014;(3):15-21.
107. Poltorak VV, Krasova NS, Gorshunska MY. Adyponektyn ta tsukrovyy diabet 2 typu (patohenetychni aspekty yak pidhruntya dlya optymizatsiyi antydiabetychnoyi farmakoterapiyi). Mizhnarodnyy endokrynolohichnyy zhurnal 2014;(5):95-104.
108. Poltorak VV, Krasova NS, Gorshunska MY. Sirtuiny kak perspektivnaja mishen' dlja profilaktiki i terapii saharnogo diabeta. Probl. Endokr. Patologii 2014(3):97-104.
109. Poltorak VV, Krasova NS, Gorshunska MY. Kombynyrovannaya terapyya «metformyn + hlymepyryd» u bol'nykh sakharnym dyabetom 2-ho typa (molekulyarnye mekhanyzmy optymyzatsyy reabylytyruyushcheho deystvyya). Mizhnarodnyy endokrynolohichnyy zhurnal 2015;(1):87-97.
110. Poltorak VV, Gorshunska MY, Zherdeva NN, Krasova NS. Amaryl® M SR: novaya forma vypuska, novye vozmozhnosty dlya patsyentov. Ukrayins'kyy medychnyy chasopys 2015;105:30-34.
111. Poltorak VV, Krasova NS, Gorshunska MY. Apoptoz pankreatycheskykh beta-kletok kak novaya myshen' dlya ynsulynoterapyy bol'nykh sakharnym dyabetom 1 y 2 typa. Probl. Endokr. Patologii 2015(1):90-102.
112. Tron'ko MD, Poltorak VV, Sokolova LK. Doslidzhennya ORIGIN (peredumovy, rezul'taty). Mizhnarodnyy endokrynolohichnyy zhurnal 2013;(49):15-22.

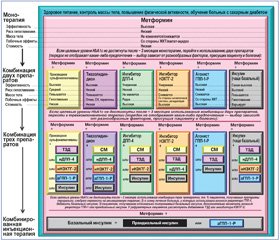
/65/65.jpg)