Международный эндокринологический журнал 4 (68) 2015
Вернуться к номеру
Вплив лікування метформіном на вміст деяких гормонів жирової тканини та медіаторів генералізованого неспецифічного запалення в пацієнтів з уперше виявленим цукровим діабетом 2-го типу
Авторы: Урбанович А.М. - Львівський національний медичний університет ім. Данила Галицького
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Метою дослідження було вивчення впливу препарату метформін на рівень деяких гормонів жирової тканини та медіаторів генералізованого неспецифічного запалення при цукровому діабеті 2-го типу. Обстежено 38 пацієнтів з уперше виявленим цукровим діабетом 2-го типу перед початком і після 12 місяців цукрознижувальної монотерапії Глюкофажем. Отримані результати свідчать, що нормалізація показників вуглеводного обміну, зниження маси тіла пацієнтів на тлі проведеного лікування спричинено не лише прямим впливом метформіну на поліпшення поглинання глюкози периферичними тканинами, а і його здатністю модулювати секрецію адипоцитокінів.
Целью исследования было изучение влияния препарата метформин на уровень некоторых гормонов жировой ткани и медиаторов генерализованного неспецифического воспаления при сахарном диабете 2-го типа. Обследовано 38 пациентов с впервые выявленным сахарным диабетом 2-го типа до и после 12 месяцев сахароснижающей монотерапии Глюкофажем. Полученные результаты свидетельствуют, что нормализация показателей углеводного обмена, снижение массы тела пациентов на фоне проводимого лечения вызваны не только прямым влиянием метформина на улучшение поглощения глюкозы периферическими тканями, а и его способностью модулировать секрецию адипоцитокинов.
The aim of the study was to investigate the influence of the drug metformin on the levels of adipose tissue hormones and generalized nonspecific mediators of inflammation in type 2 diabetes. 38 patients with newly diagnosed type 2 diabetes were followed up before and after 12 months of hypoglycemic monotherapy with glucophage. The results indicate that the normalization of carbohydrate metabolism indices and decreased body weight of patients in the presence of the therapy is due not only to direct effects of metformin in improving glucose uptake by peripheral tissues, but by the ability of the drug to modulate adipocytokine secretion.
цукровий діабет 2-го типу, лептин, резистин, ІЛ-2, ІЛ-6, TNF-α.
сахарный диабет 2-го типа, лептин, резистин, ИЛ-2, ИЛ-6, TNF-α.
type 2 diabetes mellitus, leptin, resistin, IL-2, IL-6, TNF-α.
Статья опубликована на с. 34-38
Цукровий діабет (ЦД) 2–го типу — це гетерогенне захворювання, на тлі якого високою є частота розвитку серцево–судинних ускладнень, що часто спричинюють ранню інвалідизацію та високу летальність цієї категорії пацієнтів. Недостатня компенсація вуглеводного обміну, хронічна гіперглікемія — одна з головних причин розвитку цих ускладнень.
Останніми роками уявлення про патогенез ЦД 2–го типу дещо змінилися. Велику кількість досліджень присвячено вивченню ролі гормонів жирової тканини та медіаторів генералізованого неспецифічного запалення в розвитку як ЦД 2–го типу, так і серцево–судинних ускладнень цієї патології.
Резистин належить до класу багатих цистеїном білків — резистиноподібних молекул, виробляється адипоцитами та макрофагами. Резистин пригнічує інсулін–опосередкований захват глюкози тканинами–мішенями (є антагоністом інсуліну). Наявні сьогодні дані дозволяють припустити, що резистин відіграє певну роль у розвитку ожиріння та гомеостазі глюкози через регулювання метаболізму глюкози та має прозапальні властивості. Але роль резистину в людському організмі остаточно не вивчена [1].
Лептин — гормон жирової тканини, що модулює концентрацію прозапальних і протизапальних цитокінів, оскільки активує такі клітини, як макрофаги, нейтрофільні гранулоцити, Т–лімфоцити. Згідно з результатами досліджень, лептин пов’язаний із синтезом та активацією таких маркерів генералізованого неспецифічного запалення, як фактор некрозу пухлини a (TNF–a), інтерлейкін (ІЛ) 6, ІЛ–12, ІЛ–10, С–реактивний білок (СРБ). Встановлено прямий кореляційний зв’язок між рівнями TNF–a, СРБ, ІЛ–6 і лептином у здорових осіб. Лептин, TNF–a, ІЛ–6, ІЛ–2 та інші цитокіни безпосередньо пов’язані між собою, і регулюються вони тими ж механізмами — через PPAR–y(peroxisome proliferator–activated receptor y активовані рецептори. Ймовірно, лептин прямо або опосередковано через імунну систему може змінювати активацію та синтез цитокінів, що роблять внесок у виникнення та прогресування ЦД 2–го типу та серцево–судинної патології [2–5].
Вважається, більшою мірою теоретично, що деякі цукрознижувальні препарати можуть справляти вплив на концентрацію гормонів жирової тканини та медіаторів неспецифічного запалення. Натомість наявні дані є суперечливими, що обумовлює необхідність подальших досліджень [6–8].
Метформін рекомендовано ADA і EASD, Уніфікованим клінічним протоколом первинної та вторинної (спеціалізованої) медичної допомоги «Цукровий діабет 2–го типу» (2012 р.) як препарат першої лінії медикаментозної терапії у хворих із вперше діагностованим ЦД 2–го типу, звичайно, за відсутності протипоказань. Він використовується для лікування ЦД 2–го типу понад 50 років, але визначення механізму його дії і сьогодні залишається метою інтенсивних експериментальних, клінічних і фармакологічних досліджень, переглядається його значущість у лікуванні ЦД 2–го типу. Відомо, що він справляє захисну дію на ендотелій судин, чим пояснюють потенційну серцево–судинну перевагу цього препарату [9–11].
Метою роботи було дослідження впливу препарату метформін (Глюкофаж) на рівень деяких гормонів жирової тканини та медіаторів генералізованого неспецифічного запалення, зокрема лептину та резистину, TNF–a, ІЛ–2, ІЛ–6 у пацієнтів з уперше виявленим ЦД 2–го типу.
Матеріали та методи
Обстежено 38 пацієнтів з уперше виявленим ЦД 2–го типу, які звернулися по консультативну допомогу на кафедру ендокринології Львівського національного медичного університету ім. Данила Галицького. Усім пацієнтам проведено клініко–лабораторне обстеження, визначено рівні глікозильованого інсуліну (HbA1c), інсуліну, С–пептиду, лептину, резистину, TNF–a, ІЛ–2, ІЛ–6 перед початком і через 12 місяців терапії. Ці пацієнти після обстеження та підтвердження діагнозу за відсутності протипоказань і непереносимості препарату –приймали метформін (Глюкофаж) протягом 12 місяців у добовій дозі від 1000 до 2500 мг. Інших цукрознижувальних препаратів цим пацієнтам не призначали. Діагноз ЦД 2–го типу визначали згідно з рекомендаціями експертів ВООЗ.
Взяття крові для аналізу здійснювали натще, після 12 годин голодування. Рівень резистину в крові визначали імуноферментним методом (ELISA) за допомогою набору реактивів фірми Bio Vendor (Німеччина), рівні інсуліну, С–пептиду, лептину в крові — імуноферментним методом (ELISA) за допомогою наборів реактивів фірми DRG (Німеччина), рівні TNF–a, ІЛ–2 та ІЛ–6 — імуноферментним методом (ELISA) за допомогою наборів реактивів фірми Diaclone (Франція), рівень HbA1c — методом катіонообмінної хроматографії високого тиску за допомогою автоматичного аналізатора Biorad D–10 у клінічній лабораторії Львівського обласного ендокринологічного диспансеру.
Пацієнтам проводили добовий моніторинг артеріального тиску (АТ) за допомогою електронного автоматичного вимірювача артеріального тиску ВАТ 41–2, аналіз результатів виконували за допомогою програми «АРИАДА» (з автоматичним розрахунком стандартних показників).
Отримані результати наведено у вигляді середнього арифметичного значення ± стандартне відхилення від середнього значення. Статистичну обробку результатів здійснювали за допомогою параметричних методів тесту Стьюдента. Критерієм вірогідності відмінностей або зв’язків між групами даних визнавали коефіцієнт статистичної значущості р < 0,05.
Під час клінічного дослідження дотримувались передбачених у таких випадках заходів безпеки для здоров’я пацієнта, захисту його прав, людської гідності та морально–етичних норм відповідно до принципів Гельсінської декларації прав людини, Конвенції Ради Європи про права людини та біомедицини, відповідних законів України.
Результати та їх обговорення
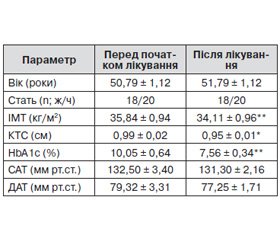
Зміни параметрів обстежених пацієнтів наведено в табл. 1.
/35/35.jpg)
Виявлено вірогідне зменшення індексу маси тіла (ІМТ) (35,84 ± 0,94 vs. 34,11 ± 0,96, р = 0,0039) та коефіцієнта талія/стегно (КТС) (0,90 ± 0,02 vs. 0,95 ± ± 0,01, р = 0,021). Терапія метформіном супроводжувалася зниженням маси тіла за рахунок зменшення кількості жирової тканини. Крім того, можна припустити, що зменшення маси тіла в цих пацієнтів досягалося також завдяки зниженню рівня лептину в процесі лікування метформіном, що статистично підтверджено в даному дослідженні.
Підтверджено високу цукрознижувальну ефективність препарату: рівень HbA1c після 12 місяців лікування Глюкофажем знизився практично на 2,5 %. Можна припустити, що нормалізація показників компенсації вуглеводневого обміну на тлі приймання метформіну відбувається не лише внаслідок прямого впливу на поліпшення поглинання глюкози периферичними тканинами, а й за рахунок змін вмісту деяких гормонів жирової тканини та маркерів неспецифічного запалення, зокрема лептину та резистину, TNF–a, що встановлено в цьому дослідженні.
Є відомості, що терапія метформіном призводить до зниження АТ [9, 12, 13]. У даному дослідженні виявлено тенденцію до зниження як систолічного АТ (САТ), так і діастолічного (ДАТ), але ці зміни виявились статистично невірогідними.
У групі пацієнтів після лікування метформіном виявлено вірогідне зменшення рівнів лептину та резистину; збільшення рівня TNF–a. Результати наведено в табл. 2.
Вміст інсуліну та С–пептиду після лікування дещо зменшився, але ці зміни виявились невірогідними. Метформін не справляє безпосереднього впливу на секрецію інсуліну, у присутності інсуліну він посилює периферичну утилізацію глюкози, зменшує глюконеогенез, посилює утилізацію глюкози кишечником.
Також не виявлено вірогідних змін у вмісті ІЛ–2 та ІЛ–6.
За даними деяких досліджень, метформін знижує резистентність до лептину, зменшує концентрацію лептину в крові в пацієнтів як з ожирінням [14], так і з нормальною масою тіла [15]. Основною функцією лептину є зниження апетиту, що досягається впливом на нейропептид Y, що секретується гіпоталамусом. Лептин також перешкоджає накопиченню ліпідів у периферичних тканинах. Відомо, що лептин впливає на розвиток інсулінорезистентності, знижуючи гіперпродукцію глюкози печінкою та підвищуючи елімінацію глюкози м’язами. Секреція лептину та інсуліну тісно взаємозв’язана. Інсулін стимулює секрецію лептину, а лептин, у свою чергу, знижує секрецію інсуліну [16]. Так, за даними досліджень, метформін безпосередньо знижує секрецію лептину, стимулюючи p44/p42 білок, що активується мітогеном, на рівні адипоцита [17]. Отже, зниження рівня лептину на тлі терапії метформіном може свідчити про зменшення лептинорезистентності, ліпотоксичності, гіперінсулінемії, сприяти нормалізації маси тіла.
/36/36.jpg)
Результати даного дослідження показують, що лікування метформіном також спричиняє зменшення концентрації резистину. Дані про вплив метформіну на адипоцитокіни та маркери неспецифічного запалення є суперечливими [7, 18–21]. Наявні сьогодні дослідження доводять, що резистин відіграє як пряму роль у розвитку ожиріння та гомеостазі глюкози, регулюючи метаболізм глюкози, так і вторинну, шляхом модуляції запального процесу. С. Sheng і співавт. стверджують, що в організмі людини резистин спричиняє резистентність до інсуліну в гепатоцитах, блокуючи два сигнальні шляхи передачі інсуліну, а приймання метформіну нівелює цей ефект резистину [22]. Деякі інші автори також виявили підвищену резистентність до інсуліну у відповідь на резистин і позитивну кореляцію між рівнями резистину, інсуліну та глюкози [1, 7, 23]. Є припущення, що резистин діє як прозапальний агент, і, можливо, в організмі людини ця дія більш виражена, ніж вплив на резистентність до інсуліну [24, 25]. Також є повідомлення, що рекомбінантний резистин активує в організмі людини ендотеліальні клітини за рахунок збільшення вмісту ендотеліну–1, молекул адгезії та хемокінів, а також індукує продукцію СРБ адипоцитами та вивільнення IL–6 і TNF–a з адипоцитів та одноядерних клітин периферичної крові [26–28].
Механізм, відповідальний за вплив метформіну на рівень резистину, не вивчено. М. Zurawska–Klis зі –співавт. у своєму дослідженні не знайшли кореляції між зниженням рівня резистину та рівнем HbA1c [29]. Дані деяких інших досліджень теж показують, що вплив метформіну на резистин не залежить від його цукрознижувальних властиво–стей [7].
Рівень TNF–a вірогідно збільшився після 12 місяців терапії метформіном. Ще 1993 року було вперше опубліковано дані про те, що TNF–a продукується жировими клітинами, бере участь в енергетичному обміні та знижує масу тіла [30]. Ймовірно, зниження ІМТ за 12 місяців приймання Глюкофажу у пацієнтів із вперше виявленим ЦД 2–го типу частково спричинено і підвищенням вмісту TNF–a.
Висновки
1. Проведене дослідження підтверджує виражену антигіперглікемічну дію Глюкофажу.
2. За 12 місяців терапії Глюкофажем в пацієнтів із уперше виявленим ЦД 2–го типу з’ясувалося вірогідне зниження рівня лептину та резистину, і це свідчить, що метформін може мати додаткові протизапальні властивості, які сприяють зниженню лептинорезистентності, ліпотоксичності та гіперінсулінемії. Виявлено регуляторні ефекти метформіну щодо регуляції секреції адипоцитокінів та адипокін–опосередкованого впливу на зниження маси тіла пацієнтів.
3. Щоб остаточно прояснити ці додаткові ефекти метформіну (модуляція цитокінів), необхідно проведення додаткових поглиблених досліджень із більшою кількістю пацієнтів.
1. Gomez–Ambrosi J., Frohbeck G. Evidence for the involvement of resistin in inflammation and cardiovascular disease // Diabetes Rev. — 2005. — 1. — 227–234.
2. Su S.C., Pei D., Hsieh C.H. Circulating proinflammatory cytokines and adiponectin in young men with type 2 diabetes // Acta Diabetol. — 2011. — 48, № 2. — 113–119.
3. Shoelson S.E., Lee J., Goldfine A.B. Inflammation and insulin resistance // J. Clin. Invest. — 2006. — 116. — 1793–1801.
4. Tilg H., Moschen A.R. Inflammatory mechanisms in the regulation of insulin resistance // Mol. Med. — 2008. — 14, № 3–4. — 222–231.
5. Fantuzzi G., Mazzone T. Adipose tissue and atherosclerosis: Exploring the connection // Arterioscler. Thromb. Vasc. Biol. — 2007. — 27. — 996–903.
6. Nakano K., Hasegawa G., Fukui M. et al. Effect of pioglitazone on various parameters of insulin resistance including lipoprotein subclass according to particle size by a gel–permeation high–performance liquid chromatography in newly diagnosed patients with type 2 diabetes // Endocr. J. — 2010. — 57. — 423–430.
7. Jung H.S., Youn B.S., Cho Y.M. et al. The effects of rosiglitazone and metformin on the plasma concentrations of resistin in patients with type 2 diabetes mellitus // Metabolism. — 2005. — 54. — 314–420.
8. Pradhan A.D., Everett B.M., Cook N.R. et al. Effects of initiating insulin and metformin on glycemic control and inflammatory biomarkers among patients with type 2 diabetes: the LANCET randomized trial // JAMA. — 2009. — 302. — 1186–1194.
9. Cicero A.F., Tartagni E., Ertek S. Metformin and its clinical use: new insights for an old drug in clinical practice // Arch. Med. Sci. — 2012. — 8. — 907–917.
10. Inzucchi S.E. Oral antihyperglycemic therapy for type 2 diabetes — scientific review // Journal of the American Medical Association. — 2002. — 287. — 360–372.
11. UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood–glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34) // Lancet. — 1998. — 352. — 854–86.
12. Sundaresan P., Lykos D., Daher A. et al. Comparative effects of glibenclamide and metformin on ambulatory blood pressure and cardiovascular reactivity in NIDDM // Diabetes Care. — 1997. — 20. — 692–697.
13. Wulffel M.G., Kooy A., de Zeeuw D. et al. The effect of metformin on blood pressure, plasma cholesterol and triglycerides in type 2 diabetes mellitus: a systematic review // J. Intern. Med. — 2004. — 256. — 1–14.
14. Glueck C.J., Fontaine R.N., Wang P. et al. Metformin reduces weight, centropedal obesity, insulin, leptin, and low–density lipoprotein cholesterol in non–diabetic, morbidly obese subjects with body mass index greater than 30 // Metabolism. — 2001. — 50. — 856–861.
15. Fruehwald–Schultes B., Oltmanns K.M., Toschek B. et al. Shortterm treatment with metformin decreases serum leptin concentration without affecting body weight and body fat content in normal–weight healthy men // Metabolism. — 2002. — 51. — 531–536.
16. Урбанович А.М. Рівень лептину в крові хворих на цукровий діабет із різною тривалістю захворювання // Проблеми ендокринної патології. — 2013. — № 4. — 25–30.
17. Klein J., Westphal S., Kraus D. et al. Metformin inhibits leptin secretion via a mitogen–activated protein kinase signalling pathway in brown adipocytes // J. Endocrinology. — 2004. — 183. — 299–307.
18. Derosa G., Maffioli P., Salvadeo S.A. et al. Effects of sitagliptin or metformin added to pioglitazone monotherapy in poorly controlled type 2 diabetes mellitus patients // Metabolism. — 2010. — 59. — 887–895.
19. Kadoglou N.P., Kapelouzou A., Tsanikidis H. et al. Effects of rosiglitazone/metformin fixed–dose combination therapy and metformin monotherapy on serum vaspin, adiponectin and IL–6 levels in drug–nave patients with type 2 diabetes // Exp. Clin. Endocrinol. Diabetes. — 2011. — 119. — 63–68.
20. Adamia N., Virsaladze D., Charkviani N. et al. Effect of metformin therapy on plasma adiponectin and leptin levels in obese and insulin resistant postmenopausal females with type 2 diabetes // Georgian Med. News. — 2007. — 145. — 52–55.
21. Caballero A.E., Delgado A., Aguilar–Salinas C.A. et al. The differential effects of metformin on markers of endothelial activation and inflammation in subjects with impaired glucose tolerance: a placebo–controlled, randomized clinical trial // J. Clin. Endocrinol. Metab. — 2004. — 89. — 3943–3948.
22. Sheng C.H., Di J., Jin Y. et al. Resistin is expressed in human hepatocytes and induces insulin resistance // Endocrine. — 2008. — 33. — 135–143.
23. Rajala M.W., Qi Y., Patel H.R. et al. Regulation of resistin expression and circulating levels in obesity, diabetes, and fasting // Diabetes. — 2004. — 53. — 1671–1679.
24. Calabro P., Golia E., Maddaloni V. et al. Adipose tissue–mediated inflammation: the missing link between obesity and cardiovascular disease? // Intern. Emerg. Med. — 2009. — 4. — 25–34.
25. Karbowska A., Boratynska M., Klinger M. Resistin: a pathogenic factor or a biomarker of metabolic disorders and inflammation? // Postepy Hig. Med. Dosw. — 2009. — 63. — 485–491.
26. Verma S., Li S.H., Wang C.H. et al. Resistin promotes endothelial cell activation: further evidence of adipokine–endothelial interaction // Circulation. — 2003. — 108. — 736–740.
27. Calabro P., Chang D.W., Willerson J.T., Yeh E.T. Release of C–reactive protein in response to inflammatory cytokines by human adipocytes: linking obesity to vascular inflammation // J. Am. Coll. Cardiol. — 2005. — 46. — 1112–1113.
28. Nagaev I., Bokarewa M., Tarkowski A., Smith U. Human resistin is a systemic immune–derived proinflammatory cytokine targeting both leukocytes and adipocytes // PLoS One. — 2006. — 1. — e31.
29. Zurawska–Klis M., Kosmalski M., Andrzejczak D., Drzewoski J. Metformin lowers resistin, while insulin decreases C–reactive protein and elevates adiponectin concentrations in patients with type 2 diabetes mellitus // Diabetologia Doswiadczalna i Kliniczna. — 2011. — 11, № 1. — 8–13.
30. Hotamisligil G.S., Shargill N.S., Spiegelman B.M. Adipose expression of tumor necrosis factor: direct role in obesity — linked insulin resistance // Science. — 1993. — 259. — 87–91.