Международный эндокринологический журнал 4 (68) 2015
Вернуться к номеру
Порушення вуглеводного обміну та компоненти метаболічного синдрому в пацієнток із гіпертонічною хворобою на тлі фізіологічної та постхірургічної менопаузи
Авторы: Ілюшина Г.Я., Мітченко О.І., Романов В.Ю. - ДУ «ННЦ «Інститут кардіології ім. М.Д. Стражеска» НАМН України, м. Київ
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Мета — порівняння характеристик вуглеводного обміну, наявності інших компонентів метаболічного синдрому (МС) на тлі фізіологічної та постхірургічної менопаузи, а також оцінка можливого впливу замісної гормональної терапії (ЗГТ), призначеної для запобігання посткастраційним клімактеричним симптомам у жінок із гіпертонічною хворобою (ГХ) відповідних клінічних груп. Матеріал та методи. Обстежені 112 жінок із ГХ II ст. 1–2-го ступеня, середній вік яких становив 46,14 ± 1,60 року: I група — 37 хворих (середній вік — 45,70 ± 1,45 року) із ГХ II ст. і постхірургічною менопаузою в репродуктивному віці без ЗГТ; II група — 37 хворих (середній вік — 44,90 ± 1,82 року) із ГХ II ст. і постхірургічною менопаузою, яким призначалася комбінована ЗГТ; ІІІ група — 38 хворих (середній вік — 47,83 ± 1,70 року) із ГХ II ст. на тлі фізіологічної менопаузи без ЗГТ. Виявлення МС проводилося відповідно до Консенсусу Міжнародної діабетичної федерації (2009 р.). Результати. У жінок репродуктивного віку з постхірургічною менопаузою на тлі маніфестної гіпоестрогенемії без ЗГТ формуються порушення вуглеводного обміну, що проявляються вірогідним (р < 0,01) зростанням рівнів глюкози натще, у глікемічному профілі, характеристик інсулінорезистентності (ІР) за індексом НОМА та глікованого гемоглобіну, що асоціюється з мінімальним відсотком виявленої нормоглікемії (37,8 %), найбільшим відсотком ІР (89,2 %) і ЦД (29,7 %) на відміну від значно вищих показників нормоглікемії на тлі прийому ЗГТ (83,7 %) та ранньої фізіологічної менопаузи (63,1 %), нижчих відсотків ІР (70,3 та 65,8 %) і ЦД (2,7 та 0 %) у двох останніх групах хворих. Призначення ЗГТ жінкам репродуктивного віку з постхірургічною менопаузою оптимізує вуглеводний і ліпідний обмін, що проявляється майже вдвічі меншим числом випадків (45,9 проти 81,1 %) реєстрації МС та вірогідно (р < 0,01) меншою кількістю виявлених компонентів МС. Висновки. У жінок як із постхірургічною, так і з ранньою фізіологічною менопаузою на тлі гіпоестрогенемії присутні значні порушення вуглеводного обміну у вигляді гіперглікемії, ІР, ЦД, що асоціюються з кластером кардіометаболічних симптомів, які формують менопаузальний МС. Усі вищезгадані зрушення максимально маніфестують у хворих із пост-хірургічною менопаузою без ЗГТ, призначення якої в другій групі дозволило запобігти гіпоестрогенемії та уповільнити перебіг продіабетогенних змін вуглеводного обміну.
Цель — сравнение характеристик углеводного обмена, наличия компонентов метаболического синдрома (МС) на фоне физиологической и постхирургической менопаузы, а также оценка возможного влияния заместительной гормональной терапии (ЗГТ), назначенной для предупреждения посткастрационных климактерических симптомов у женщин с гипертонической болезнью (ГБ) соответствующих клинических групп. Материал и методы. Обследовано 112 женщин с ГБ II ст. 1–2-й степени, средний возраст которых составил 46,14 ± 1,60 года: I группа — 37 больных (средний возраст — 45,70 ± 1,45 года) с ГБ II ст. и постхирургической менопаузой в репродуктивном возрасте без ЗГТ; II группа — 37 больных (средний возраст — 44,90 ± 1,82 года) с ГБ II ст. и постхирургической менопаузой, которым назначалась комбинированная ЗГТ; ІІІ группа — 38 больных (средний возраст — 47,83 ± 1,70 года) с ГБ II ст. на фоне физиологической менопаузы без ЗГТ. Верификация МС проводилась в соответствии с Консенсусом Международной диабетической федерации (2009 г.). Результаты. У женщин репродуктивного возраста с постхирургической менопаузой на фоне манифестной гипоэстрогенемии без ЗГТ формируются нарушения углеводного обмена в виде достоверного (р < 0,01) роста уровня глюкозы натощак, в гликемическом профиле, характеристик инсулинорезистентности (ИР) по данным индекса НОМА и гликированного гемоглобина, что ассоциируется с минимальным процентом нормогликемии (37,8 %), наибольшим процентом ИР (89,2 %) и сахарного диабета (СД) (29,7 %) в отличие от более высоких показателей нормогликемии на фоне приема ЗГТ (83,7 %) и ранней физиологической менопаузы (63,1 %), более низких процентов ИР (70,3 и 65,8 %), СД (2,7 и 0 %) в двух последних группах. Назначение ЗГТ женщинам репродуктивного возраста с постхирургической менопаузой оптимизирует углеводный и липидный обмен, что проявляется почти вдвое меньшим числом случаев (45,9 против 81,1 %) регистрации МС и достоверно (р < 0,01) меньшим количеством выявленных компонентов МС. Выводы. У женщин как с постхирургической, так и с ранней физиологической менопаузой на фоне гипоэстрогенемии присутствуют нарушения углеводного обмена в виде гипергликемии, ИP, СД, которые ассоциируются с кластером кардиометаболических компонентов, формирующих менопаузальный МС. Максимальная манифестация метаболических изменений наблюдалась у больных с постхирургической менопаузой без ЗГТ, назначение которой во второй группе позволило предотвратить гипоэстрогенемию и уменьшить продиабетогенные нарушения.
The objective — to compare the characteristics of carbohydrate metabolism, and the presence of other components of metabolic syndrome (MS) associated with physiological and postsurgical menopause, as well as the assessment of possible impact of hormone replacement therapy (HRT) intended to prevent postcastration climacteric symptoms in women with essential hypertension (EH) from relevant clinical groups. Material and methods. 112 women with EH degree II, whose average age was 46.14 ± 1.60 years, were examined: I group — 37 patients (average age 45.70 ± 1.45 years) with EH degree II and postsurgical menopause in reproductive age without HRT; II group — 37 patients (average age 44.90 ± 1.82 years) with EH degree II and postsurgical menopause, who received combined HRT; III group — 38 patients (average age 47.83 ± 1.70 years) with EH degree II on the background of physiological menopause without HRT. MS has been detected in accordance with the International Diabetes Federation Consensus (2009). Results. Women of childbearing age with postsurgical menopause on the background of symptomatic hypoestrogenism without HRT have carbohydrate metabolism disorders manifested in significant (p < 0.01) higher levels of fasting glucose, in glycemic profile, characteristics of insulin resistance (IR) by HOMA index and glycated hemoglobin, associated with the minimum percentage of normoglycemia (37.8 %), the highest levels of IR (89.2 %) and diabetes mellitus (DM) (29.7 %) as against significantly higher level of normoglycemia in patients receiving HRT (83.7 %) and with early physiological menopause (63.1 %), lower levels of IR (70.3 and 65.8 %) and DM (2.7 and 0 %) in the last two groups of patients. Administration of HRT to the women of reproductive age with postsurgical menopause optimizes carbohydrate and lipid metabolism, manifested in almost twice smaller detection rate (45.9 vs. 81.1 %) of MS and significantly (p < 0.01) lower number of revealed components of MS. Conclusions. Women with both postsurgical and early physiological menopause following hypoestrogenism have significant disorders of carbohydrate metabolism as hyperglycemia, IR, DM associated with various cardiometabolic symptoms that form menopausal MS. All the above changes most manifest in patients with postsurgical menopause without HRT, administration of which in the second group enabled to prevent hypoestrogenism and to slow the course of prediabetogenic changes in carbohydrate metabolism.
вуглеводний обмін, інсулінорезистентність, менопауза, замісна гормональна терапія.
углеводный обмен, инсулинорезистентность, менопауза, заместительная гормональная терапия.
carbohydrate metabolism, insulin resistance, menopause, hormone replacement therapy.
Статья опубликована на с. 28-33
На сучасному етапі встановлено тісний зв’язок між порушеннями вуглеводного обміну та серцево–судинними захворюваннями (ССЗ). Як показали епідеміологічні дослідження, при порушенні толерантності до глюкози (ПТГ) частота розвитку ішемічної хвороби серця зростає вдвічі, а смертність від ССЗ в 1,5 раза вища, ніж у хворих без гіперглікемії, а за наявності кластеру симптомів у вигляді метаболічного синдрому ризик розвитку коронарної хвороби серця та інсульту в 3 рази вищий, ніж без нього [2, 4]. Маніфестація цукрового діабету (ЦД) сприяє подальшому погіршенню серцево–судинного прогнозу, збільшуючи смертність від ССЗ у 2–3 рази в чоловіків та в 4–6 раз у жінок [3].
За результатами проведених епідеміологічних досліджень встановлено, що під час менопаузи збільшується поширеність порушень вуглеводного обміну і власне ЦД в жіночій популяції [1]. Крім цього, на підставі даних Фремінгемського дослідження та великого наглядового дослідження здоров’я медсестер (Nurses Health Study) констатовано тісний зв’язок між порушеннями вуглеводного обміну та ССЗ: у жінок із ЦД ризик розвитку серецево–судинних ускладнень у період пери– і постменопаузи зростає в 3–7 разів порівняно зі здоровими жінками того ж віку [9]. Слід зазначити, що середньопопуляційний вік настання менопаузи в Україні становить 48,9 ± 0,3 року, тоді як у Європі менопауза настає майже на 3 роки пізніше, в середньому у віці 51,3 року. Відповідно до класифікації менопаузи настання її до 45 років має назву ранньої менопаузи. Пост–менопауза в жінок часто супроводжується збільшенням маси тіла та/або показників окружності талії (ОТ). Відомо, що жіночі статеві гормони контролюють обмін жирів і вуглеводів в організмі, прискорюючи розщеплення жирів і пригнічуючи синтез антиатерогенних ліпідних фракцій, що сприяє розвитку атеросклерозу. Поступове зниження рівня естрогену в перименопаузі обумовлює схильність до збільшення жирової тканини організму, що компенсаторно приймає на себе естрогенпродукуючу функцію замість яєчників у цей віковий період, та активується позагонадний синтез естрогенів: естрону з андростендіону та естрадіолу з тестостерону. Проте при значному надлишку жирової тканини цей координований процес може порушуватися. Важливо і те, що ожиріння в перименопаузі характеризується значним переважанням кількості жирової тканини над м’язовою. До того ж вісцеральне ожиріння також безпосередньо пов’язане зі станом інсулінорезистентності (ІР). Вісцеральна жирова тканина безпосередньо впливає на печінку і є метаболічно більш активною, ніж підшкірна жирова тканина. Формування відносної гіперандрогенії в жінок у цей віковий період може саме по собі сприяти розвитку ІР, а вона, зі свого боку, може призвести до гіперандрогенії за рахунок продукції андрогенів тека–клітинами яєчників і зниження вироблення секс–стероїд–глобуліну печінкою на тлі гіпер–інсулінемії [5].
За умов ІР відбуваються зниження надходження глюкози в інсулінозалежні тканини (м’язову, жирову) та підвищення продукції глюкози печінкою, сприяючи розвитку гіперглікемії. При адекватній здатності b–клітин компенсувати підвищення рівня глюкози надлишковою продукцією інсуліну зберігається стан нормоглікемії. Однак згодом, при наростанні вираженості ІР, відбувається виснаження інсулінсекреторної здатності b–клітин і вони перестають компенсувати навантаження глюкозою. Спочатку це проявляється розвитком гіперглікемії в постпрандіальний період, що діагностується як ПТГ за допомогою перорального глюкозотолерантного тесту, подальша маніфестація захворювання призводить до формування ЦД.
Збільшення маси тіла в клімактеричному періоді призводить до формування менопаузального метаболічного синдрому, основними проявами якого є абдомінальне ожиріння, дисліпідемія та порушення вуглеводного обміну [8]. Крім того, вазодилатація, що стимулюється інсуліном у нормі, порушується при ІР, підтверджуючи позитивний зв’язок між гіперінсулінемією та артеріальною гіпертензією (АГ). Таким чином, постменопауза є інсулінорезистентним станом, а клімактеричний період асоціюється зі значним підвищенням ризику розвитку ішемічної хвороби серця та інших макроангіопатій, сприяючи зниженню тривалості життя жінки [7, 14, 15].
Хірургічна, тобто передчасна, менопауза пов’язана з більш високим ризиком судинних змін порівняно з фізіологічною менопаузою [11, 12]. Останніми роками значно почастішали захворювання серцево–судинної системи в жінок, які перенесли тотальну оваріектомію в репродуктивному стані, порівняно зі здоровими жінками аналогічного віку [17]. Це пояснюється насамперед реакцією тканин, що мають рецептори до жіночих гормонів, на виражену гіпоестрогенію, що раптово розвинулася за умов відсутності фізіологічної адаптації організму до нових умов. Формування хірургічної менопаузи, для якої характерно різке зниження рівня статевих гормонів, що відіграють істотну роль у регуляції судинного тонусу, може сприяти розвитку АГ і визначати особливості її формування. На сьогодні існують поодинокі дослідження, що свідчать про можливий позитивний вплив на рівень АТ замісної гормональної терапії (ЗГТ), яка призначається з метою поліпшення перебігу постхірургічного клімактеричного синдрому. Категоричні застереження проти застосування ЗГТ у лікуванні серцево–судинної патології в жінок у менопаузі, що сформувалися після результатів досліджень WHI та HERS, поступово розвіюються, змінюючись на виважений розгляд позитивного впливу ЗГТ у заходах первинної профілактики в межах «терапевтичного вікна», а саме в жінок у перименопаузі віком до 50–55 років. Останні підсумки досліджень із даної проблеми викладені в міждисциплінарних документах, зокрема у виданому у 2013 р. Глобальному консенсусі щодо гормональної терапії в менопаузі [16] та у Практичній настанові щодо ведення менопаузи (2014) [13], які є позицією Міжнародного товариства з менопаузи та погоджені зі світовими товариствами та асоціаціями. Проте конкретні розробки, що стосуються кардіологічної оцінки перспектив застосування ЗГТ у первинній профілактиці серцево–судинного ризику у пацієнток репродуктивного віку після гістероваріектомії, поодинокі [6] і часом є суперечливими, що послужило підґрунтям для проведеного дослідження.
Метою роботи було порівняння характеристик вуглеводного обміну, а також наявності інших компонентів метаболічного синдрому на тлі фізіологічної та постхірургічної менопаузи, а також оцінка можливого впливу ЗГТ, призначеної для запобігання посткастраційним клімактеричним симтомам у жінок із гіпертонічною хворобою відповідних клінічних груп.
Матеріали та методи дослідження
На базі відділення дисліпідемій ДУ «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України проведено обстеження 112 жінок із гіпертонічною хворобою II стадії 1–2–го ступеня, середній вік яких становив 46,14 ± 1,60 року, з яких сформовано 3 групи обстеження. До першої групи увійшло 37 пацієнток (середній вік — 45,70 ± 1,45 року) із гіпертонічною хворобою II стадії та постхірургічною менопаузою, сформованою після оперативного втручання в репродуктивному віці, яким не призначалася ЗГТ у післяопераційному періоді. До другої групи увійшло також 37 жінок (середній вік — 44,90 ± 1,82 року) із гіпертонічною хворобою II стадії та постхірургічною менопаузою, яким для усунення посткастраційних клімактеричних симптомів призначалася низькодозова комбінована ЗГТ із використанням препарату фемостон (1/5) або фемостон конті, що містить 1 мг естрадіолу та 5 мг дідрогестерону, виробництва компанії ABBOT, США. Третю групу становили 38 жінок (середній вік — 47,83 ± 1,70 року) із гіпертонічною хворобою II стадії на тлі фізіологічної менопаузи, ЗГТ їм не призначалась. Строк менопаузи в усіх групах становив від 2 до 5 років. Анамнез АГ переважно збігався зі строком менопаузи.
У всіх хворих проведений аналіз антропометричних даних (зріст, вага, індекс маси тіла (ІМТ)), визначено наявність абдомінального ожиріння (ОТ, окружність стегон (ОС), їх співвідношення), а також глікемічний статус (рівень глюкози натще, інсуліну натще, чутливість до інсуліну за індексом НОМА аналіз глікемічного профілю). ІР діагностували при індексі НОМА > 2,77.
Дослідження ліпідного обміну включало визначення вмісту загального холестерину, тригліцеридів, холестерину ліпопротеїнів низької (ХС ЛПНЩ) та високої щільності (ХС ЛПВЩ). Рівні загального холестерину, тригліцеридів, ХС ЛПВЩ визначалися в сироватці венозної крові ферментативним методом на автоматичному аналізаторі фірми BioSystem, Іспанія, в ммоль/л. Фракції ХС ЛПНЩ розраховували за формулою Friedwald.
Крім того, у групах обстежених проаналізована наявність критеріїв метаболічного синдрому відповідно до Консенсусу Міжнародної діабетичної федерації (2009 р.).
Усім пацієнтам призначалася стандартна антигіпертензивна терапія згідно з рекомендаціями 2013 року Європейського товариства з вивчення гіпертензії (ESH)/Європейського товариства кардіологів (ESC) та рекомендаціями Української асоціації кардіологів (2008) з переглядом клінічної настанови у 2012 р.
Статистичну обробку отриманих результатів проведено стандартними методами варіаційної статистики з використанням пакета статистичних програм Statistica 6.0. Результати наведені як M ± m, де М — середнє значення показника, m — стандартна помилка. Вірогідність відмінностей між показниками, що вивчаються, визначалася за допомогою двовибіркового критерію Стьюдента.
Результати та їх обговорення
Антропометричні характеристики всіх хворих наведені в табл. 1. Проаналізовано дані росту, маси тіла, ІМТ, ОТ, ОС та їх співвідношення (ОТ/ОС). Як видно з наведених даних, усі обстежені хворі мали ознаки надлишкової маси тіла, а середні показники в групах відповідали ожирінню I ступеня. Відповідно до показників ОТ у всіх обстежених виявлені ознаки абдомінального типу ожиріння [10] як за європейськими (2012), так і за американськими критеріями (2013). Проте показники як ОТ, так і ОС у першій групі були вірогідно (p < 0,01) більшими за такі в третій групі, що свідчило про переважання ознак абдомінального ожиріння у хворих із постхірургічною менопаузою без ЗГТ. Відповідні показники другої групи мали проміжне значення.
За результатами аналізу характеристик вуглеводного обміну (табл. 2) установлено, що середні величини глюкози в першій групі були вірогідно вищими (р < 0,01), ніж у другій та третій групах, і свідчили про наявність підвищення глікемії натще у хворих із постхірургічною менопаузою без ЗГТ. У цій же групі зареєстровано максимальне зростання гіперінсулінемії натще серед усіх проаналізованих груп хворих, проте різниця була невірогідною. Аналіз ІР за розрахунком індексу НОМА не лише підтвердив вірогідне переважання характеристик першої групи порівняно з двома іншими групами (р < 0,01), але й відтворив наявність ІР (НОМА > 2,77) за обчисленням середніх величин у всіх групах обстеження, як у хворих із постхірургічною менопаузою, так і у хворих із ранньою фізіологічною менопаузою. За результатами аналізу глікованого гемоглобіну (HbA1c) установлено, що його середні параметри в першій групі хворих із постхірургічною менопаузою без ЗГТ не тільки були вірогідно (р < 0,01) найбільшими серед обстежених груп, але й свідчили про наявність ЦД у пацієнток цієї групи, оскільки середні величини були більшими, ніж порогове значення для встановлення діагнозу ЦД, — 6,6 ± 0,2 %. Підтвердження вірогідно найбільш глибоких серед груп порівняння зрушень вуглеводного обміну в першій групі отримано за результатами аналізу глюкози крові в глікемічному профілі обстежених хворих (р < 0,01).
Подальший аналіз виявлених порушень у групах (табл. 3) підтвердив наявність безпосередньої діабетогенної дії постхірургічної менопаузи, особливо без оптимізації вуглеводного обміну замісною терапією, що містить естроген. Так, для першої групи встановлено найнижчий відсоток нормоглікемії серед обстежених груп — 37,8 проти 63,1 % випадків нормоглікемії у хворих з ранньою фізіологічною менопаузою та більше ніж удвічі більшим її відсотком (83,7 %) у хворих із постхірургічною менопаузою на ЗГТ у другій групі. Гіперінсулінемія, що визначалася за концентрацією інсуліну в крові > 11,0 мкОД/мл, була характерною для всіх обстежених і спостерігалась у більшості хворих усіх груп, однак найчастіше зареєстрована також у першій групі — 91,9 проти 81,1 та 78,9 % у другій та третій групах відповідно. ІР також була характерною рисою майже всіх обстежених хворих — 89,1; 70,3 та 65,8 % у першій, другій та третій групах відповідно. Маніфестний ЦД діагностовано в максимального числа (в 11 хворих із 37) пацієнток першої групи з постхірургічною менопаузою без ЗГТ, що становило 29,7 %, та лише в однієї пацієнтки (2,7 %) в другій групі на тлі ЗГТ. Серед пацієнток із ранньою фізіологічною менопаузою хворих із ЦД не виявлено. Дещо інші дані були після аналізу ПТГ у групах: найчастіше ПТГ (32,4 %) виявлено в першій групі, проте найнижчий відсоток (13,5 %) було зареєстровано в другій групі, що могло бути наслідком антидіабетичної дії ЗГТ, що приймали ці пацієнтки. Характеристики третьої групи щодо виявленої ПТГ зайняли проміжне місце.
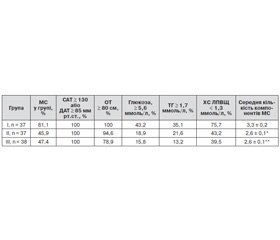
Насамкінець було проведено аналіз виявлення компонентів кластеру факторів ризику — метаболічного синдрому серед обстежених хворих (табл. 4). Відповідно до умов включення хворих в обстеження АГ діагностовано в 100 % пацієнтів усіх груп. Абдомінальне ожиріння за критеріями Європейського товариства кардіологів (2012) виявлено в 100 % хворих першої групи та в 94,6 і в 78,9 % у другій та третій групах відповідно. Усі інші компоненти метаболічного синдрому, такі як гіперглікемія, гіпертригліцеридемія та низький рівень ХС ЛПВЩ, найчастіше зареєстровані в першій групі з постхірургічною менопаузою без ЗГТ, а мінімальні показники — у третій групі на тлі фізіологічної ранньої менопаузи. Характеристики другої групи зайняли проміжне місце. Логічним завершенням аналізу було отримання результатів щодо обчислення відсотка метаболічного синдрому в групах, що діагностували за критеріями Консенсусу 2009 р. (наявність не менше ніж 3 із 5 критеріїв метаболічного синдрому у хворого). За отриманими даними, максимальний відсоток виявлення метаболічного синдрому був в першій групі (81,1 %), що майже вдвічі переважало результати виявлення метаболічного синдрому був в другій (45,9 %) та третій групі (47,4 %). Це також було підтверджено вірогідним (р < 0,01) переважанням середньої кількості виявлених компонентів метаболічного синдрому в першій групі порівняно з характеристиками другої та третьої груп (табл. 4).
Таким чином, можна дійти висновку, що у всіх обстежених пацієнток із гіпертонічною хворобою як із постхірургічною менопаузою, так і з ранньою фізіологічною менопаузою на тлі гіпоестрогенемії присутні значні порушення вуглеводного обміну у вигляді гіперглікемії, ІР та ЦД, що асоціюються з компонентами кластеру кардіометаболічних симптомів із формуванням менопаузального метаболічного синдрому. Усі вищезгадані зрушення максимально маніфестують у хворих із постхірургічною менопаузою без компенсаторного впливу ЗГТ, яка в другій групі з постхірургічною менопаузою дозволила запобігти естрогенодефіциту та уповільнити перебіг продіабетогенних змін вуглеводного обміну.
Висновки
1. Установлено, що в жінок репродуктивного віку з гіпертонічною хворобою та постхірургічною менопаузою на тлі маніфестної гіпоестрогенемії, не компенсованої ЗГТ, формуються порушення вуглеводного обміну, що проявляються вірогідним (р < 0,01) зростанням рівнів глюкози натще і в глікемічному профілі, інсулінорезистентності за індексом НОМА та глікованого гемоглобіну порівняно з аналогічними хворими на ЗГТ або з ранньою фізіологічною менопаузою.
2. Визначено, що з усіх обстежених груп в жінок репродуктивного віку з гіпертонічною хворобою та постхірургічною менопаузою без ЗГТ найрідше виявлялася нормоглікемія (37,8 %) та найчастіше відзначалися інсулінорезистентність (89,2 %) і цукровий діабет (29,7 %) на відміну від значно вищих показників нормоглікемії в аналогічних хворих на тлі прийому ЗГТ (83,7 %) та ранньої фізіологічної менопаузи (63,1 %) і відповідно меншої кількості випадків інсулінорезистентності — 70,3 та 65,8 % і цукрового діабету — 2,7 та 0 % у двох останніх групах хворих відповідно.
3. Призначення ЗГТ у жінок репродуктивного віку з гіпертонічною хворобою та постхірургічною менопаузою оптимізує вуглеводний та ліпідний обмін, що проявляється в майже вдвічі меншому відсотку (45,9 проти 81,1 %) реєстрації кластеру метаболічного синдрому та вірогідно (р < 0,01) меншій середній кількості виявлених компонентів метаболічного син–дрому.
1. Коваленко В.М. Серцево–судиннi захворювання у жiнок: пiдводна частина айсбергу // Нова медицина. — 2005. — № 4(21). — С. 12–13.
2. Методичні рекомендації Робочої групи з проблем метаболічного синдрому, цукрового діабету, предіабету та серцево–судинних захворювань Асоціації кардіологів України і асоціації ендокринологів України. — К., 2014. — 38 с.
3. Маньковский Б.Н. Артериальная гипертензия у больных сахарным диабетом 2 типа — особенности течения и терапии / Б.Н. Маньковский // Діабет. Ожиріння. Метаболічний синдром. — 2013. — № 4. — С. 55–59.
4. Оганов Р.Г. Современные представления о метаболическом синдроме: понятие, эпидемиология, риск развития сердечно–сосудистых осложнений и сахарного диабета // Международный эндокринологический журнал. — 2008. — № 6. — С. 36–42.
5. Мітченко О.І. Менопаузальний метаболічний синдром // Нова медицина. — 2005. — № 4(21). — С. 18–23.
6. Андреева Е.Н. Эффективность использования низких доз дроспиренона и 17 бета–эстрадиола у женщин в постменопаузе (обзор литературы) / Е.Н. Андреева // Гинекология. — 2015. — № 1. — С. 34–40.
7. Сметник В.П., Шестакова И.Г. Современные представления о менопаузальном метаболическом синдроме // Consilium medicum. — 2003 — Т. 5, № 9. — С. 23–29.
8. Юренева С.В., Ильина Л.М., Сметник В.П. Старение репродуктивной системы женщин: от теории к клинической практике. Часть I. Эндокринные и клинические характеристики стадий репродуктивного старения женщин // Акушерство и гинекология. — 2014. — № 3. — С. 21–27.
9. AHA Scientific Statement. Evidence–Based Guidelines for Cardiovascular Disease Prevention in Women // Circulation. — 2004. — 109. — Р. 672–693.
10. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012). The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts) // Eur. Heart J. — 2012. — Vol. 33. — P. 1635–1701.
11. Ingelsson К.E., Lundholm C., Johansson A.L., Altman D. Hysterectomy and risk of cardiovascular disease: a population–based cohort study // Eur. Heart J. — 2011. — Р. 745–750.
12. Jacoby L., Grady D., Wactawski–Wende J. Oophorectomy vs ovarian conservation with hysterectomy: cardiovascular disease, hip fracture, and cancer in the Women's Health Initiative Observational Study // Arch. Intern. Med. — 2011. — Р.760–768.
13. Jane F.M., Davis S.R. A Practitioner’s Toolkit for Managing the Menopause // Climacteric. — 2014. — Vol. 17. — P. 564–579.
14. Kallen A.N., Pal L. Cardiovascular disease and ovarian function // Curr. Opin. Obstet. Gynecol. — 2011. — Vol. 23(4). — P. 258–267.
15. Mosca L., Benjamin E.J., Berra K. et al. Effectiveness–based guidelines for the prevention of cardiovascular disease in women — 2011 update: a guideline from the american heart association // Circulation. — 2011. — Vol. 123(11). — P. 1243–1262.
16. Villiers T.J., Gass M.I., Haines C.J. et al. Global Consensus Statement on Menopausal Hormone Therapy // Climacteric. — 2013. — Vol. 16. — P. 203–204.
17. Wellons M., Ouyang P., Schreiner P.J. Early menopause predicts future coronary heart disease and stroke: the Multi–Ethnic Study of Atherosclerosis // Menopause. — 2012. — Vol. 19(10). — P. 1081–1087.
1. Kovalenko V.M. Sertsevo-sudynni zakhvoryuvannya u zhinok: pidvodna chastyna aysberhu // Nova medytsyna. – 2005. – № 4 (21). – S. 12-13.
2. Metodychni rekomendatsiyi Robochoyi hrupy z problem metabolichnoho syndromu, tsukrovoho diabetu, prediabetu ta sertsevo-sudynnykh zakhvoryuvan Asotsiatsiyi kardiolohiv Ukrayiny i asotsiatsiyi endokrynolohiv Ukrayiny. Kyiv 2014. – 38 s.
3. Man'kovskyy B. N. Arteryal'naya hypertenzyya u bol'nykh sakharnym dyabetom 2 typa - osobennosty techenyya y terapyy / B.N. Man'kovskyy. // Diabet. Ozhyrinnya. Metabolichnyy syndrom – 2013. – N 4.– S.55-59.
4. Ohanov R.H. Sovremenniye predstavlenyya o metabolycheskom syndrome: ponyatye, epydemyolohyya, rysk razvytyya serdechno-sosudystykh oslozhnenyy y sakharnoho dyabeta // Mezhdunarodnyy endokrynolohycheskyy zhurnal 2008. – N 6. – S. 36-42.
5. Mitchenko O.I. Menopauzal'nyy metabolichnyy syndrom // Nova medytsyna. – 2005. – № 4 (21). – S. 18-23.
6. Andreeva E. N. Effektyvnost' yspol'zovanyya nyzkykh doz drospyrenona y 17beta-эstradyola u zhenshchyn v postmenopauze (obzor lyteratury)/E. N. Andreeva // Hynekolohyya. –2015. - № 1. - S.34-40
7. Smetnyk V.P., Shestakova Y.H. Sovremennye predstavlenyya o menopauzal'nom metabolycheskom syndrome // Consilium medicum. – 2003 – V. 5, № 9. – P. 23-29.
8. Yureneva S. V., Yl'yna L. M. Smetnyk V. P. Starenye reproduktyvnoy systemy zhenshchyn: ot teoryy k klynycheskoy praktyke. Chast' I. Endokrynnye i klynycheskye kharakterystyky stadyy reproduktyvnoho starenyya zhenshchyn // Akusherstvo y hynekolohyya. – 2014. - № 3. - S. 21-27.
9. AHA Scientific Statement. Evidence-Based Guidelines for Cardiovascular Disease Prevention in Women. // Circulation. – 2004. – 109. – Р. 672-693.
10. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012). The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts) // Eur. Heart J. – 2012. – Vol. 33.– P. 1635-1701.
11. Ingelsson К.E., Lundholm C., Johansson A.L., Altman D. Hysterectomy and risk of cardiovascular disease: a population-based cohort study // Eur Heart J. – 2011. – Р. 745-750.
12. Jacoby L., Grady D., Wactawski-Wende J. Oophorectomy vs ovarian conservation with hysterectomy: cardiovascular disease, hip fracture, and cancer in the Women's Health Initiative Observational Study // Arch Intern Med. – 2011. – Р.760-768.
13. Jane F.M., Davis S.R. A Practitioner’s Toolkit for Managing the Menopause. // Climacteric. – 2014. – Vol. 17. – P.564-579.
14. Kallen A.N., Pal L. Cardiovascular disease and ovarian function. // Curr Opin Obstet Gynecol. – 2011.– Vol. 23 (4).– P. 258-267.
15. Mosca L., Benjamin E.J., Berra K. et al. Effectiveness-based guidelines for the prevention of cardiovascular disease in women – 2011 update: a guideline from the american heart association. // Circulation. – 2011. – Vol.123(11). – P. 1243-1262.
16. Villiers T.J., Gass M.I., Haines C.J. et al. Global Consensus Statement on Menopausal Hormone Therapy. // Climacteric. – 2013. – Vol.16. – P. 203-204.
17. Wellons M., Ouyang P., Schreiner P.J. Early menopause predicts future coronary heart disease and stroke: the Multi-Ethnic Study of Atherosclerosis // Menopause. – 2012.– Vol. 19 (10). – P. 1081-1087.

/30/30.jpg)
/31/31.jpg)