Журнал «Медицина неотложных состояний» 1 (64) 2015
Вернуться к номеру
Гостра ниркова недостатність при тяжких отруєннях метадоном
Авторы: Недашківський С.М. — Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ; Кучма А.Б., Струк В.Ф., Богомол А.Г. — Київська міська клінічна лікарня швидкої медичної допомоги
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
У статті наведені результати ретроспективного дослідження пацієнтів із гострим отруєнням метадоном, які були госпіталізовані у 2012–2014 рр. Розглянуті ускладнення: синдром позиційного стиснення тканин та зумовлена цим синдромом гостра ниркова недостатність.
В статье представлены результаты ретроспективного исследования пациентов с острым отравлением метадоном, которые были госпитализированы в 2012–2014 гг. Рассмотрены осложнения: синдром позиционного сдавления тканей и обусловленная этим синдромом острая почечная недостаточность.
The article presents the results of a retrospective study in patients with acute poisoning with methadone who were hospitalized in 2012–2014. Complications were considered: compartment syndrome in tissues and acute renal failure caused by this syndrome.
метадон, синдром позиційного стиснення, гостра ниркова недостатність, гемодіаліз.
метадон, синдром позиционного сдавления, острая почечная недостаточность, гемодиализ.
methadone, compartment syndrome, acute renal failure, hemodialysis.
Статья опубликована на с. 106-110
Вступ
Проаналізувавши структуру нозології по Київському міському центру лікування гострих отруєнь (КМЦЛГО), що функціонує на базі Київської міської клінічної лікарні швидкої медичної допомоги, ми хочемо звернути увагу на стрімке зростання за останні неповні 3 роки (2012, 2013 р., 9 місяців 2014 р.) кількості хворих з отруєнням метадоном. Щорічно до КМЦЛГО госпіталізується від 1800 до 2200 пацієнтів. Близько 95 % цієї кількості становлять хворі з екзогенними інтоксикаціями. Вагому частку становлять пацієнти, госпіталізовані внаслідок отруєння алкоголем, сурогатами алкоголю і наркотичними середниками, у тому числі і метадоном. Так, за 2012 р. з отруєннями алкоголем надійшло 275 пацієнтів, сурогатами алкоголю — 76, трамадолом — 33, метадоном — 44, іншими наркотичними засобами — 68. За 2013 р.: з отруєннями алкоголем — 391, сурогатами алкоголю — 109, трамадолом — 22, метадоном — 39, іншими наркотичними засобами — 185. За 9 місяців 2014 р.: з отруєннями алкоголем — 157, сурогатами алкоголю — 131, з отруєнням та передозуванням трамадолом — 17, метадоном — 139, іншими наркотичними засобами — 289. У групі отруєних іншими наркотичними засобами були госпіталізовані хворі з передозуванням і отруєнням середниками, виготовленими з макової соломки, амфетамінами, метамфетамінами тощо. Перші пацієнти з гострим отруєнням метадоном стали надходити до КМЦЛГО майже 10 років тому. Так, протягом 2005 р. госпіталізовано 5 пацієнтів, у 2006 р. — 8, за 2007 р. — 14 хворих. Значне зростання передозувань метадоном пов’язано з тим, що цей синтетичний наркотик виробляється нелегально і не залежить від сезонних коливань, як самовиготовлені середники з макової соломки. Крім того, час його ефективної дії значно довший. На відміну від інших як природних, так і синтетичних препаратів групи опію період напіврозпаду метадону в середньому становить близько 36 год. Тому наркозалежні після введення певної дози препарату, що призводить до непритомного стану, набагато довший час можуть знаходитися у вимушеному положенні. Тривале перебування у незручному положенні, особливо «сидячи на сходинках», «лежачи на твердій долівці» [2, 11], призводить до ускладнення отруєння — розвитку синдрому позиційного стиснення (СПС), на тлі якого при несприятливій ситуації розвивається гостра ниркова недостатність (ГНН). Це ускладнення зумовлює тяжкість стану пацієнтів і тривалість перебування їх у відділенні інтенсивної терапії (ВІТ).
Матеріали і методи
На базі КМЦЛГО у відділеннях інтенсивної терапії та екстракорпоральної детоксикації (ЕД) і відділенні токсикології (ВТ) проведено ретроспективне дослідження групи пацієнтів з отруєнням метадоном і випадків ускладнення даного отруєння (СПС, ГНН) за 2012, 2013 рр., 9 місяців 2014 р.
За цей період було досліджено 299 госпіталізованих пацієнтів. Діагноз встановлювався на ґрунті основних клінічних ознак отруєння, анамнезу (якщо пацієнт був притомний). При відсутності свідомості використовувалася інформація співробітників бригади швидкої медичної допомоги, рідних. Верифікація токсикантів проводилася у токсикологічній лабораторії. Досліджувалися вихідні та динамічні клінічні і біохімічні показники, електроліти, кислотно-основний стан. У 24 хворих визначався рівень креатинкінази (КК). При ураженні кінцівок (СПС) проводилося динамічне замірювання об’єму кінцівки у зоні стиснення. При необхідності долучалося ультразвукове дослідження (УЗД) прохідності судин ураженої кінцівки, УЗД органів черевної порожнини, заочеревинного простору. З моменту госпіталізації визначався погодинний діурез, час, що минув від дії фактора стиснення. Всіх досліджуваних розділили на три групи. До групи 1 (n = 235) увійшли пацієнти без СПС. До групи 2 (n = 28) — пацієнти з СПС із збереженим діурезом та хворі з транзиторною ГНН, яким вдалося обійтися без процедури гемодіалізу. До групи 3 (n = 36) — пацієнти з СПС, ускладненим ГНН. Було прийнято вважати олігурією погодинний діурез менше 50 мл/год. Отримані результати аналізували з використанням стандартних загальноприйнятих методів статистичної обробки.
Результати та їх обговорення
У всіх групах пацієнти не мали суттєвого розділу щодо гендерних відмінностей, віку, комбінації метадону з алкоголем. Із 299 обстежених було 38 (12,7 %) жінок і 261 чоловік (87,3 %). У процесі лікування померло 3: 1 хворий — з групи 1 і 2 хворі — з групи 3. Причиною смертей став синдром поліорганної дисфункції. У 50 потерпілих окрім метадону у біосередовищах були виявлені інші речовини. Серед них у 43 — алкоголь: з концентрацією у крові від 0,5 до 1,5 ‰ — 33; більше 1,5 до 2,5 ‰ — 9; більше 2,5 ‰ — 1.
Крім того, досліджений 1 пацієнт із мікстовим отруєнням: метадон, дельтатетрагідроканабіноїди, бензодіазепіни (переважала клініка отруєння метадоном). Хворий увійшов до групи 2. У 2 хворих окрім метадону виявлений морфін (група 3), у ще 4 (також група 3) — інші опіати (трамадол, кодеїн). Вік хворих становив 29,2 ± 4,8 року: від 18 (1) до 45 (2).
Хірургічні втручання запроваджувалися у хворих із вираженими місцевими ускладненнями в зоні дії фактора стиснення (некректомії, ПХО).
З табл. 1 видно, що більшість хворих з отруєнням метадоном пролікувалася з видужанням, уникаючи розвитку ГНН (переважно пацієнти групи 1), хоча більшість з них у перші години госпіталізації перебували на штучній вентиляції легень. Найбільш тяжкі хворі були в групі 3. Кількість сеансів гемодіалізу в одного пацієнта коливалася від 1 до 11. Відповідно перебування у ВІТ та ЕД становило від 3 до 35 днів.
Від своєчасності виявлення ознак СПС та розпочатого адекватного лікування у багатьох випадках залежить розвиток або уникнення розвитку ГНН, що видно у хворих групи 2. Дослідження КК проводилося у 20 хворих даної групи (решта 4 — у хворих групи 3). Отримані дані свідчать, що значне зростання цього ферменту в межах близько 5,000 U/l і більше служить надійним предиктором розвитку гострої ниркової дисфункції.
ГНН є значною проблемою у ВІТ. Р.Е. Marik (2010) наводить дані, що від 10 до 40 % хворих із СПС страждають від ГНН. Причому смертність пацієнтів, у яких розвинулася ГНН, досягає 7–80 %. Близько 20 % хворих помирають при тяжкому перебігу СПС із ГНН, що розвинулася, натомість при ускладненні тяжкого перебігу СПС із ГНН синдромом поліорганної дисфункції ця цифра значно більше.
Тому доволі важливими є зусилля, направлені на запобігання розвитку ГНН. Існуюча думка, що діуретики, зокрема фуросемід, що призначається на початкових стадіях ниркової недостатності, може покращити стан хворого, не підтвердилася [4, 7]. Проведені дослідження, у тому числі і метааналіз, показали, що застосування фуросеміду у таких випадках не пов’язано із покращенням стану хворих, натомість може погіршити їх стан. Жодна фармакологічна інтервенція не продемонструвала покращення стану хворих з анурією. Але для запобігання цьому стану слід належним чином підтримувати необхідний внутрішньосудинний об’єм рідини, серцевий викид, середній артеріальний тиск (АТ) та оксигенацію. Пацієнтам, у яких існує високий ризик розвитку ГНН, слід уникати призначення медикаментів, що мають нефротоксичний ефект. До таких слід віднести передусім високоосмолярні контрастні речовини, антибіотики, що мають нефротоксичний ефект (аміноглікозиди, ванкоміцин, амфотерицин В, циклоспорин), нестероїдні протизапальні засоби, осмодіуретики, високі дози салуретиків тощо.
Слід пам’ятати, що ГНН, яка зумовлена пошкодженням ниркових канальців, є оборотним процесом. Отже, наявність олігоанурії, анурії регламентується часом, необхідним для поновлення епітелію ниркових канальців. Але для того, щоб зменшити тяжкість ураження нирок, інших органів та систем у разі розвинення ГНН, слід спиратися на критерії, що ініціюють початок замісної терапії. До них відноситься гіперкаліємія (К > 6,5 ммоль/л), прогресуючий ацидоз з рН < 7,20, гіпергідратація з клінічними явищами перевантаження малого кола кровообігу, наявність випоту у перикарді, уремічна симптоматика, що проявляється нудотою, блюванням, поведінковими порушеннями.
Наразі дослідники провідних світових центрів не дійшли єдиної думки щодо ефективності різних режимів проведення гемодіалізу. Порівнювали проведення гемодіалізу у гемодинамічно стабільних груп (6 сеансів проти 3 за тиждень) і у гемодинамічно нестабільних груп (зі швидкістю ультрафільтрації 35 мл/кг/год проти 20 мл/кг/год). Але результати дослідження не показали видимої різниці як у кінцевому результаті, так і у тривалості лікування [9, 10, 12].
/108/108.jpg)
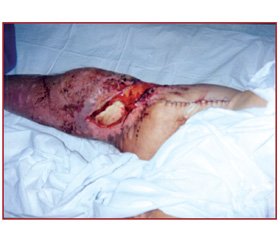
В основі розвитку СПС лежить порушення структурної цілісності та/або загибель міоцитів поперечно-смугастих м’язів, на які вплинув чинник компресії. Цей синдром характеризується порушенням структури м’язів, їх некрозом, потраплянням внутрішньоклітинних компонентів дезінтегрованих міоцитів до судинного русла та позаклітинної рідини. Клінічні прояви при СПС варіюють від безсимптомного перебігу з реєстрацією лише збільшення креатинкінази до життєзагрожуючих станів, що супроводжуються вкрай високими показниками КК, електролітним дисбалансом, розвитком ГНН та синдрому дисемінованого внутрішньосудинного згортання. Окрім безпосереднього стискання тканин вагою власного тіла та твердих поверхонь і предметів, на яких розташовані потерпілі, до дезінтеграції міофібрил долучаються й екзотоксичні середники, вжиті напередодні, які суттєво знижують резистентність клітинних мембран міоцитів до чинників, що зумовлюють власне саме стиснення [3]. Вихід міоглобіну, що потрапляє до судинного русла, зумовлює його потрапляння до ниркових канальців, перетворення у солянокислий гематин, який, блокуючи процесс фільтрації у нирках, спричиняє ГНН внаслідок розвитку міоглобінурійного нефрозу. Найбільш чутливий лабораторний показник порушення цілісності м’язів — креатинкіназа. Рівень КК більше за 5,000 U/l характеризує серйозне пошкодження м’язів за умови відсутності інфаркту міокарда та інфаркту мозку [5].
Пошкодження м’язового масиву призводить до переходу позаклітинних іонів кальцію інтрацелюлярно. Відтак внаслідок наявності надлишку Са2+ відбувається патологічна взаємодія актину і міозину. В результаті активуються внутрішньоклітинні протеази. Їх контакт з міофібрилами забезпечує дезінтеграцію і некроз м’язових структур. Масивний витік іонів Са2+ у позаклітинний простір реалізує каскадну реакцію вторинного ураження клітинних мембран епітелію капілярів і переміщення рідини позаклітинно. Внаслідок значної деструкції міоцитів велика кількість іонів калію, фосфатів, міоглобіну, КК, уратів потрапляє до циркуляторного русла. Міоглобін при клубочковій фільтрації випадає в осад, тим самим блокуючи і пошкоджуючи ниркові канальці.
Механізм ГНН при СПС. Передбачається, що відповідальними за розвиток ГНН при СПС є 2 основних чинники: 1) гіповолемія/дегідратація; 2) ацидурія [5].
Наразі доведено 3 основних механізми токсичного впливу білків гему: вазоконстрикція судин нирок з обмеженням ниркового кровообігу, обтурація ниркових канальців та безпосередня цитотоксичність, зумовлена впливом білків гему. За відсутності значної гіповолемії та ацидурії токсичність білків гему мінімальна. В інших випадках до чинників ушкодження долучається активація цитокінового каскаду. Обтурація ниркових канальців відбувається в результаті взаємодії протеїну Tamm-Horsfall з міоглобіном і збільшується при низьких значеннях рН.
До класичної тріади клінічних проявів, характерних для СПС, відносяться: а) біль у м’язах; б) слабкість в уражених м’язах; в) коричневе, темно-коричневе, чорне забарвлення сечі.
Найбільш часто внаслідок стиснення ушкоджуються м’язи сідниць, стегон, гомілок, поперек, бокові поверхні тулуба. Але у практиці ми зустрічали і стиснення у ділянці підборіддя, задньої поверхні шиї, верхніх кінцівок тощо. При пальпації таких дільниць виявляється їх щільність навіть тоді, коли зовні шкірні покриви не змінені, але частіше на шкірі у зоні стиснення виявляються ціаноз, садна, ділянки некрозу. Досить часто — бліде забарвлення шкіри, що відрізняється за кольором від оточуючих ділянок, набряклість, припухлість. Циркулярний біль у кінцівці, відчуття болю у глибині м’язів кінцівки можуть свідчити про наявність тромбозу глибоких вен. Біль при ураженні м’язів поперека може хибно розцінюватися як ниркова колька. У той же час біль у глибині м’язів при задіянні бокової поверхні тулуба зліва помилково може розцінюватися як ангінальний біль. Близько 50 % потерпілих взагалі можуть не скаржитися на м’язовий біль або м’язову слабкість. У цій ситуації об’єктивною ознакою ураження слід вважати зменшення кількості сечі та зміну її кольору на темно-коричневий аж до чорного.
Небезпечна гіперкаліємія виникає при масивному розпаді м’язових волокон. З нею пов’язані порушення серцевого ритму, що можуть стати причиною навіть зупинки серцевої діяльності. Порушення з боку печінки відмічаються у 25 % потерпілих і пов’язані із прямим пошкоджуючим ефектом на гепатоцити протеаз, що потрапили до кровотоку внаслідок порушення цілісності міоцитів. ГНН розвивається дещо пізніше, у період від 12–72 год після дії травматичного чинника.
Хоча збір анамнезу та фізикальний огляд відіграють суттєву роль, іноді для раннього встановлення діагнозу необхідне лабораторне обстеження. Найбільш чутливим індикатором розпаду міоцитів є зміна рівня КК. Нормальний рівень цього ферменту становить 45–260 U/l. Динаміка змін КК при СПС наступна. Підйом рівня починається через близько 12 год з моменту початку дії стиснення; пікові значення реєструються у період від 1 до 3 діб і зменшуються в період у 3–5 діб. Піковий рівень КК може служити предиктором розвитку ГНН (5,000 U/l). До інших характерних лабораторних показників відноситься збільшення рівня креатиніну, сечовини, електролітів (калію, фосфору), гіпокальціємія; збільшення рівня ензимів: лактатдегідрогенази, альдолази, амінотрансфераз і карбоангідрази ІІІ.
Перші дії після огляду потерпілого і визначення попереднього діагнозу направлені на стабілізацію стану хворих, включаючи намагання зберегти функцію нирок і запобігти розвитку ГНН. Ретроспективний аналіз показав, що проведення агресивної рідинної ресусцитації із використанням переважно сольових розчинів дозволяє звести до мінімуму розвиток гострого пошкодження нирок. Чим більше часу витрачається на відшкодування дефіциту рідини, тим більша вірогідність розвитку ГНН [8]. Дослідження показали, що форсований діурез, розпочатий до 6 годин з моменту госпіталізації пацієнта, значно зменшував кількість випадків розвитку ниркової дисфункції. Використання діуретиків виправдане лише після відшкодування дефіциту рідини. Існують свідчення, що манітол мінімізує обтурацію ниркових канальців фрагментами гему і сприяє зменшенню кількості вільних радикалів, тим самим зменшуючи вторинне ураження клітин. Фуросемід або інші петольові діуретики можуть використовуватися при збереженому діурезі в намаганні запобігти переходу олігуричної стадії ГНН в анурію.
Використання гідрокарбонату натрію як засобу залуження плазми направлене на мінімізацію ушкодження ниркових канальців при СПС. Залуження плазми сприяє тому, що рівень міоглобіну утримується підвішеним і при хорошій швидкості руху сечі по системі канальців вільно залишає їх просвіт. У кислому середовищі міоглобін випадає в осад у вигляді гелю з подальшою обтурацією просвіту ниркових канальців. З метою корекції метаболічного ацидозу і запобігання ГНН в/в вводять 200–300 мл 4% розчину натрію гідрокарбонату, далі — 100 мл на кожні 2 л рідини, що вводиться. Якщо постраждалі спроможні ковтати, натрій гідрокарбонат призначають всередину кожні 2–4 години. Після введення 200–300 мл соди можна розпочати введення 500 мл 0,9% розчину натрію хлориду, 500 мл 5% розчину глюкози з інсуліном. Лише після цього розпочинають введення колоїдних розчинів. Обов’язковими є контроль діурезу і стимуляція останнього невеликими дозами лазиксу (20–40 мг). З метою зменшення плазмовтрати і відновлення об’єму циркулюючої крові адекватною швидкістю внутрішньовенної інфузії вважається 300–400 мл/год [1].
Якщо зберігається гіпотензія, незважаючи на корекцію гіповолемії інфузійною терапією, то застосовують краплинне введення мезатону або норадреналіну, намагаючись підтримувати АТ на рівні 100–110 мм рт.ст. Для покращення функції міокарда та стабілізації клітинних мембран рекомендують уведення глюкокортикоїдів.
Гемодіаліз при СПС. Незважаючи на оптимальне лікування, у певної частини пацієнтів усе ж таки розвивається ГНН, що досить часто супроводжується гіперкаліємією і вираженим ацидозом. Таким чином, ці хворі потребують замісної терапії з використанням гемодіалізу, що дозволяє провести необхідну корекцію. На початку можуть знадобитися щоденні процедури гемодіалізу або безперервної гемофільтрації, які дозволяють зменшувати азотемію, гіперкаліємію, видаляти продукти розпаду міоцитів, водорозчинні медіатори запалення тощо. У цій ситуації зменшення рівня калію до безпечних величин розглядається як пріоритетне, усуваючи небезпеку раптової зупинки серця. В той же час проведення плазмаферезу з метою видалення надлишку міоглобіну не показало якихось переваг. В окремих випадках у пацієнтів з СПС, обтяженим ГНН, може реєструватися гіперкальціємія (20–30 %). У цих випадках до лікування долучають препарати калію, за винятком ситуації, при якій гіперкальціємія поєднана із гіперкаліємією.
Висновки
1. Усі пацієнти в непритомному стані з передозуванням наркотичних речовин, насамперед метадону, повинні оглядатися на предмет наявності синдрому позиційного стиснення для ранньої профілактики ГНН.
2. Зменшення кількості сечі, зміна її кольору на темний, збільшення рівня КК > 5,000 U/l слід розглядати як предиктор гострого ушкодження нирок.
3. Енергійна рідинна ресусцитація є найбільш ефективним методом профілактики і зменшення випадків гострої дисфункції нирок при синдромі позиційного стиснення.
1. Васильєв Г.О., Васильєв А.Г., Недашківський С.М. Синдром травматичного здавлювання/роздавлювання (краш-синдром) // Медицина неотложных состояний. — 2013. — № 7(54). — С. 15-21.
2. Миронов Л.Л. Рабдомиолиз // Медицина неотложных состояний. — 2006. — № 6(7).
3. Новикова Р.И., Шраменко Е.К., Кузнецова И.В. Синдром длительного сдавления / В.И. Черний, Р.И. Новикова // Интенсивная терапия при неотложных состояниях. — К.: Здоров’я, 2004. — Т. ІІІ. — С. 243-257.
4. Ho K.M., Sheridan D.J. Meta-analysis of furosemide to prevent or treat acute renal failure // BMJ. — 2006. — № 333. — 420.
5. Knochel J.P. Mechanisms of rabdomyolysis // Curr. Opin. Rheumatol. — 1993. — № 5. — Р. 725-731.
6. Marik P.E. Handbook of evidans-based critical care. — Second edition. — Norfolk, VA,USA, 2010. — Р. 460-476.
7. Metha R.L., Pascual M.T., Soroko S. at al. Diuretics, mortality, and non-recovery of renal function in acute renal failure // JAMA. — 2002. — № 288. — Р. 2547-2553.
8. Odeh M. The role of reperfusion-induced injury in the pathogenesis of the crush syndrome // N. Engl. J. Med. — 1991. — № 324. — Р. 1417-1422.
9. Pannu N., Klarenbach S., Wiebe N. et al. Renal replacement therapy in patient with acute renal failure: a systematic rewiew // JAMA. — 2008. — № 299. — Р. 793-805.
10. Palevsky P.M., Zhang J.H., O’Connor T.Z. et al. Intensity of renal support in critically ill patients with acute kidney injury // N. Engl. J. Med. — 2008. — № 359. — Р. 7-20.
11. Recommendations for the management of crush victims in mass disasters. Official Publication of the European Renal Association-European Dialysis and Transplant Association. April 2012.
12. Ronco C., Bellomo R., Homel P. et al. Effect of different doses in continuous veno-venous haemofiltration on outcomes of acute renal failure: a prospective randomized trial // Lancet. — 2000. — № 356. — Р. 26-30.

/107/107.jpg)