Журнал «Медицина неотложных состояний» 7 (62) 2014
Вернуться к номеру
Успішний досвід застосування ксенону в комплексі інтенсивного лікування алкогольних розладів
Авторы: Стрєпетова О.В. - Національний медичний університет імені О.О. Богомольця, кафедра анестезіології та інтенсивної терапії Клініка ТОВ «Борис», м. Київ
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
У дослідженні проведено порівняльний аналіз результатів лікування 137 хворих з алкогольними розладами, 60 із яких проходили курс інгаляційної терапії ксеноном. У дослідженні показана повна безпека методу ксенонової терапії, зменшилися дози седативних препаратів, що застосовуються під час лікування, виявлена менша кількість ускладнень (алкогольний абстинентний синдром, алкогольний делірій), швидше відновлювалася свідомість після алкогольної коми.
В исследовании проведен сравнительный анализ результатов лечения 137 больных с алкогольными расстройствами, 60 из которых проходили курс ингаляционной терапии ксеноном. В исследовании показана полная безопасность метода ксеноновой терапии, уменьшились дозы седативных препаратов, применяемых во время лечения, выявлено меньшее количество осложнений (алкогольный абстинентный синдром, алкогольный делирий), быстрее восстановливалось сознание после алкогольной комы.
The study presents a comparative analysis of treatment outcomes in 137 patients with alcohol use disorders, 60 of whom were receiving xenon inhalation therapy. The study shows the complete safety of xenon therapy method, reduction of doses of sedative drugs being used during treatment, fewer complications (alcohol withdrawal syndrome, delirium tremens), more rapid recovery of consciousness after alcoholic coma.
ксенон, алкогольний абстинентний синдром, когнітивні порушення, алкогольна інтоксикація, інгаляційна терапія ксеноном.
ксенон, алкогольный абстинентный синдром, когнитивные дисфункции, алкогольная интоксикация, ингаляционная терапия ксеноном.
xenon, alcohol withdrawal syndrome, cognitive impairment, alcoholic intoxication, xenon inhalation therapy.
Статья опубликована на с. 88-94
Актуальність теми
Відомо, що зловживання алкоголем призводить до формування залежності, підвищує ризик розвитку тяжких захворювань, у тому числі цирозу печінки, деяких видів раку, сприяє травматизму та психологічному і фізичному насильству. За даними ВООЗ, у Європі спостерігається найвищий у світі рівень вживання алкоголю на душу населення, причому деякі країни мають особливо високі рівні, у тому числі Україна [1, 2]. За даними фахівців, у середньому кожна людина віком 15 років і старше щороку випиває 6,2 л чистого спирту. Але насправді алкоголь вживає менше половини населення (38,3 %), тобто люди, залежні від алкоголю, споживають близько 17 л спирту. Існує висока відсоткова частка випадків смерті, пов’язаних з алкоголем: серед чоловіків — 7,6 %, серед жінок — 4 %. Останніми роками спостерігається стійке зростання жіночого алкоголізму. Встановлено, що близько 16 % населення епізодично вживають алкоголь у великих кількостях — так званий запийний алкоголізм, який найбільше шкодить здоров’ю, призводячи до поступових інволютивних та дегенеративних змін ЦНС [3, 4]. Більшість цих хворих мають низькі рівні доходів, не мають доступу до якісної медичної допомоги та реабілітації, що призводить до фатальних наслідків і стосується не тільки окремих хворих, є соціальною проблемою.
Ситуація в Україні повторює світову офіційну статистику. Кількість людей, які постійно вживають алкоголь, перевищує 700 тис. У 2013 р. Україна займала перше місце у світі за дитячим алкоголізмом. 57 % українських дітей віком до 13 років уже спробували алкоголь! Та найгіршим є те, що в Україні набирає обертів алкоголізм серед вагітних жінок, що спричинює розвиток широкого спектра фетальних розладів [2, 5–7]. Незважаючи на масштаби захворюваності, офіційна інформація про кількість пацієнтів у лікувальних установах, у тому числі приватних, які надають наркологічну допомогу, та кількість самостійно практикуючих лікарів-наркологів є недоступною. Залишається невідомою також чисельність хворих з ускладненнями внаслідок зловживання алкоголем, які лікуються у стаціонарах країни з інших приводів. Це ускладнює вирішення проблеми профілактики, лікування та реабілітації хворих на алкоголізм.
Церебральні порушення при алкогольних розладах (АР) займають основне місце у структурі ускладнень та причин інвалідизації і смертності. Серед хворих, які госпіталізуються до відділень інтенсивної терапії з екзогенними отруєннями і проявами гострих енцефалопатій, алкоголь є найбільш частою причиною, а лікування гострих алкогольних психозів — однією з найбільш поширених проблем анестезіологів, які чергують у стаціонарах [8, 9]. Все це спонукає до пошуку шляхів покращення результатів інтенсивного лікування цієї категорії хворих і визначає актуальність питання розробки методів спеціалізованої медичної допомоги та анестезіологічного забезпечення.
Інтенсивне лікування алкогольної інтоксикації (АІ) ґрунтується на знанні патогенетичних ланцюгів захворювання, в основі яких лежить гіпоксичне ураження, що супроводжується глибинними порушеннями метаболізму (енергетичного, жирового, білкового), нейромедіаторних взаємодій, регуляції рецепторного апарату клітин та їх ферментних систем. У комплексі інтенсивного лікування алкогольних розладів — гострої алкогольної інтоксикації, тяжких проявів хронічного алкоголізму та при алкогольних психозах — на першому етапі застосовуються засоби детоксикації та седації, церебропротекції та корекції метаболізму [10, 11]. Серед седативних препаратів найпоширенішими є бензодіазепіни (сибазон, гідазепам) та анестетики (тіопентал натрію, пропофол, ГОМК), що у досить великих дозах можуть спричинювати ускладнення — пригнічення дихання та серцево-судинної системи, посилення інтоксикації тощо [12, 13]. Тому актуальною є розробка нових ефективних методів із застосуванням препаратів, які відповідають необхідним критеріям — наявності седативного ефекту без залучення захисних рефлексів, підвищенню судомного порогу, зниженню вегетативної гіперактивності, антипсихотичній дії тощо.
В останні роки у зв’язку з поширенням на вітчизняному фармацевтичному ринку сучасних інгаляційних анестетиків та високотехнологічної апаратури з’явилась можливість їх використання в комплексі седативної терапії при алкогольних розладах. Одним із найбільш перспективних серед цієї групи є медичний газ ксенон. Обґрунтування вибору цього анестетика з властивостями «ідеального» зумовлено його біологічною дією. Ксенон застосовується не лише як анестетик із седативною та аналгетичною дією, але і як засіб, що знижує активність апоптозу нервових клітин і є універсальним церебропротектором та стабілізатором клітинних мембран [14, 15]. За даними фахівців, застосування ксенону значно покращує прогноз захворювання при різноманітних гострих енцефалопатіях, у тому числі алкогольних, знижує кількість ускладнень, наприклад проявів синдрому Корсакова, ефективно відновлює когнітивні функції в пацієнтів із церебрально-дисциркуляторним і пароксизмальним механізмами формування гострої патології [16, 17]. Динамічний контроль за клінічними й біохімічними показниками на фоні терапії ксеноном підтвердив, що інгаляційний спосіб введення ксенону в організм пацієнтів із проявами гострої енцефалопатії гарантує повну безпеку, швидку дію та добру керованість фармакологічним ефектом. Експериментальний доказ підтвердження пригнічення ксеноном активності NMDA-рецепторів при гіперметаболічному синдромі дозволяє використовувати його як нейропротектор при гіпоксичних станах центральної та периферичної нервової системи, що теж часто спостерігається при АР [18]. Як антагоніст NMDA-рецепторів, гіперактивація яких запускає основні прояви абстинентного стану, ксенон дозволяє на патогенетичному рівні зменшити прояв вегетативних порушень, пригнітити больовий синдром, нормалізувати сон, а також знизити до мінімуму фармакологічне навантаження за рахунок анксіолітичного, протисудомного, нейропротективного, антидепресивного ефектів, тому вже є повідомлення про успішне застосування ксенону як засобу патогенетичної терапії при алкогольній абстиненції [14, 17, 18]. Згідно з цими даними, навіть при одноразових ксенонових інгаляціях спостерігається виражена редукція соматоневрологічної симптоматики (минали явища гіпергідрозу, стабілізувалася гемодинаміка, зникала тахікардія). Відзначається, що при застосуванні ксенону значно покращуються когнітивні функції у хворих на алкоголізм і наркоманію: збільшується темп мислення, концентрація уваги, зникають конфабуляції, з’являється критичне ставлення до власного стану, хворі активізуються, проявляють інтерес до життя, у них підвищується обсяг використовуваної лексики, у тому числі професійної [19].
Таким чином, враховуючи основні положення про патогенез гострої алкогольної інтоксикації та абстинентного синдрому, наявний досвід успішного практичного застосування ксенону в анестезіології, можливо припустити високу ефективність його використання при даній патології. Включення ксенону в комплекс інтенсивної терапії АР може поліпшити результати лікування пацієнтів, зменшити летальність та інвалідизацію, особливо людей працездатного віку.
Метою дослідження стало покращення інтенсивного лікування хворих з АР шляхом застосування інгаляцій ксенону.
Матеріали та методи
Дослідження проводилось на базі відділення інтенсивної терапії (ВІТ) клініки ТОВ «Борис». До досліджуваної групи входило 137 хворих із діагнозом АІ середнього та тяжкого ступенів, неускладненої або ускладненої абстинентним синдромом, алкогольним делірієм (АД), алкогольною комою. Методи дослідження включали клінічне обстеження, лабораторну діагностику, вивчення ступеня седації за шкалою RASS із подальшим визначенням наявності або відсутності делірію за шкалою CAM-ICU, інструментальні методи (оцінка біспектрального індексу), застосування психометричних шкал (оцінка ступеня когнітивних порушень за шкалою MMSЕ та тестів пам’яті Векслера), статистичні методи (первинну базу для аналізу сформовано з використанням обчислювальних програм MS Excel та Statistica). Статистична обробка проводилась із використанням ліцензійного пакета статистичного аналізу Stata 12 [20].
Обстежені хворі розподілені на групи: контрольну — 70 хворих, яким проводилось стандартне лікування, та основну — 67 пацієнтів, яким додавався метод інгаляційної терапії ксеноном. Стандартна терапія АІ включала детоксикацію (інфузія кристалоїдних та колоїдних розчинів залежно від тяжкості стану та наявності супутньої патології, введення ентеросорбентів — дуфалак 30–90 мл/добу, ентеросгель 45 г/добу), седацію — проводилась постійна інфузія комбінацій седативних засобів, гіпнотиків та загальних анестетиків (дексдор 0,4–0,7 мкг/кг/год, пропофол 100–200 мг/год, натрію тіопентал 50–200 мг/год, натрію оксибутират 2–4 г/добу); введення бензодіазепінів (діазепам 20–60 мг/добу, гідазепам 50–100 мг/добу); анксіолітиків (атаракс 75–100 мг/добу); при необхідності — нейролептиків (труксал 50–75 мг/добу, галоперидол 10–15 мг/добу, аміназин до 25 мг/добу) та симптоматичну корекцію залежно від загального стану. В основній групі хворих, окрім базової терапії, проводилися лікувальні ксенонові інгаляції за модифікованою методикою раз на добу (іноді загальний стан вимагав додаткового застосування ксенону). Методика лікувальної інгаляції ксеноном включала етапи: одягання маски (що подекуди потребувало додаткової седації пропофолом); денітрогенізації — –10-хв інгаляція 100% О2 з метою виведення з дихального контуру СО2; насичення ксеноном до концентрації на видиху 25–30 об.% із подальшим переведенням хворого на спонтанне дихання по замкненому контуру; підтримка концентрації впродовж 10–15 хв; виведення ксенону з дихального контуру (інгаляція O2 протягом 2–3 хв) та переведення на дихання через напіввідкритий контур.
Під час перебування хворих у ВІТ проводили моніторинг показників артеріального тиску (АТ), частоти серцевих скорочень (ЧСС), частоти дихання (ЧДР), сатурації кисню (SpO2), концентрації вуглекислого газу в кінці видиху (ЕtCO2). Під час інгаляцій ксенону вимірювали концентрації кисню та ксенону в дихальному контурі, а на етапі насичення лікувальним газом досліджували гази артеріальної крові та кислотно-основний стан (КОС). У 10 хворих обох груп із метою визначення газового складу крові, що відтікає від головного мозку, брали проби з луковиці яремної вени (SjO2). Упродовж лікувальних наркозів для визначення глибини седації проводили BIS-моніторинг. При надходженні у ВІТ та впродовж 6 діб інтенсивного лікування проводили оцінку стану свідомості за шкалою коми Глазго (ШКГ), оцінку ступеня седації за RASS, наявності делірію за CAM-ICU, оцінку короткочасної та оперативної пам’яті, здатності до концентрації уваги, розуміння зверненої мови, сприйняття мови на слух і в письмовому вигляді, праксису за шкалою MMSE та мнемограму за Векслером.
Результати та їх обговорення
Клінічні дослідження та показники моніторингу при надходженні у стаціонар у більшості хворих визначали гіпертензію і тахікардію, лише при алкогольній комі виявляли тенденцію до гіпотензії та брадикардії. У таких пацієнтів спостерігали також ознаки вентиляційної дихальної недостатності, що вимагало корекції — швидкої вентиляції легень (ШВЛ). Основною причиною гемодинамічної недостатності була відносна гіповолемія, яку корегували адекватною інфузійною терапією. У разі відсутності ефекту застосовували вазопресори та кардіотоніки. Треба зазначити, що у хворих із застосуванням інгаляційної терапії підтримка вазопресорами та кардіотоніками тривала 4,32 ± 0,18 год, а в контрольній групі — значно довше, 6,41 ± 0,42 год (р = 0,003), що може бути зумовлено позитивною кардіотропною дією ксенону. За наявності гіпертензії гіпотензивну терапію в досліджуваних групах проводили за допомогою призначення та a-блокаторів (урапідил, метопролол). Особливо виділяли дію дексмедетомідину (дексдору) — селективного агоніста α2-адренорецепторів з клонідиноподібною дією, який забезпечував гіпотензивний ефект і зниження ЧСС та був відносно безпечним в умовах відновленого об’єму циркулюючого кровообігу. У більшості пацієнтів гіпертензія розцінювалася як вторинна, тому при корекції та забезпеченні необхідної седації даний симптом нівелювався. У випадках, коли гіпертензія була супутньою патологією, призначалася постійна антигіпертензивна терапія. Тахікардія найчастіше спостерігалася на фоні виражених електролітних порушень (гіпокаліємія), вона піддавалась медикаментозній корекції. У хворих основної групи максимальна ЧСС, при якій розпочинали інгаляцію ксеноном, становила 126,9 ± 2,6. Після введення ксенону в дихальний контур у динаміці спостерігалось зниження цього показника до рівня 60–70. У таких хворих не було потреби в додатковій корекції серцевого ритму кардіотропними засобами.
Тахіпное, що спостерігали в більшості випадків у хворих з АІ, було зумовлено такими факторами: метаболічним ацидозом, що компенсувався за рахунок підвищення ЧДР, підвищеним рівнем ажитації (RASS +3/+2 бали), задишкою, пов’язаною з проявами серцево-судинної недостатності. Дані хворих обох досліджуваних груп були порівнянними на 1-шу добу спостереження. Згодом на 2-гу та 3-тю добу загальний стан пацієнтів покращувався. У хворих основної групи показники SpO2 та ЧДР наближалися до референтних значень норми — у випадках, коли не було супутньої легеневої патології, зокрема хронічного бронхіту курця або запальних змін легень. У хворих, які перебували на ШВЛ, вентиляція швидше відновлювалася в основній групі — це підтверджували строки здійснення екстубації (у середньому на 1 добу раніше, ніж у хворих контрольної групи).
При дослідженні кисневого статусу хворих та газометрії виявлено, що при надходженні в стаціонар у всіх хворих була тенденція до ацидозу, гіперкапнія, помірне зниження напруги кисню, зменшення сатурації кисню, метаболічні зсуви ВЕ (basis exces), HCO2. При порівнянні показників обох груп хворих встановлено, що в основній групі у динаміці після проведення лікувальних інгаляцій ксеноном спостерігалось істотне і швидке зниження СО2 — при аналізі даних на 1-шу і 2-гу добу лікування, при р < 0,0003, що означало порівнянність даних, із формуванням стійкої динаміки до стабілізації в періоді перебування у ВІТ. Швидке зниження СО2 спостерігалося при проведенні інгаляцій ксеноном за рахунок корекції вентиляції, а також зменшенні потреби хворого в постійному введенні седативних засобів, що здебільшого впливають на пригнічення дихання.
При порівнянні показника рО2 в динаміці спостерігалося підвищення показника парціального тиску в обох групах дослідження, це більш чітко виявилося у хворих основної групи — підвищення рО2 було вже на 2-гу добу лікування і становило 95,2 ± 2,8 мм рт.ст., при р < 0,0001. У хворих контрольної групи даний показник становив 86,4 ± 2,9 мм рт.ст., при р < 0,0001. У хворих основної групи це пояснюється більш керованою седацією, що мала менший вплив на показники дихання завдяки регуляції ксеноновою терапією.
При порівнянні показників КОС виявлена чітка тенденція до ліквідації його порушень у хворих основної групи вже на 1-шу добу після застосування ксенону (рис. 1).
З рис. 1 видно, що рівень лактату в таргетному діапазоні 1,0–1,4 ммоль/л досягається після лікувальних інгаляцій ксеноном, що також підтверджує ефективну корекцію метаболічного ацидозу.
При дослідженні показника контролю церебральної гіпоксемії — SjО2 (рис. 2) — з 1-ї доби лікування позитивна динаміка спостерігалася в обох групах хворих. Проте збільшення даного показника, тобто ознаки ліквідації гіпоксії головного мозку, фіксувалося на 1-шу добу в основній групі, а саме після проведення ксенонової інгаляції. У середньому на 1-шу добу показники становили 65,4 ± 2,5 % в основній та 66,6 ± 3,1 % — у контрольній групі, при р = 0,534. Вже на 1-шу добу зміни були такими: 75,8 ± 1,9 % в основній та 70,6 ± 1,6 % — у контрольній, при р < 0,0003. На 6-ту добу лікування у хворих основної групи SjO2 дорівнювала 78,4 ± 1,4 %, а у хворих контрольної — 74,9 ± 2,3 %, при р < 0,0001. Більш швидкі зміни показників основної групи ми пояснювали позитивним впливом ксенону на церебральний кисневий метаболізм.
Наведені дані підтверджують, що застосування ксенону впливає не тільки на загальний стан газометрії, ліквідуючи гіпоксемію, але й безпосередньо на показники церебрального газообміну, швидко ліквідуючи гіпоксемічний стан.
При дослідженні когнітивних функцій пацієнтів досліджуваних груп на початку лікування визначали такий ступінь свідомості за ШКГ: 93 % хворих з АІ середнього ступеня були з ясною свідомістю (15 балів), 7 % — у стані оглушення чи сопору (9–14 балів); при АІ тяжкого ступеня тільки третина пацієнтів була в ясній свідомості — 31 %, більша частина хворих — 58 % — у стані сопору і 11 % — у стані коми, у яких за ШКГ було менше 9 балів.
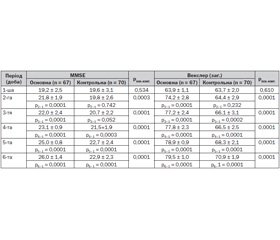
Наступним кроком було визначення наявності делірію у хворих, які були доступними для контакту. Обстежено 130 пацієнтів за шкалою CAM-ICU. У 22 із них, а це були хворі з порушеннями свідомості за ШКГ при надходженні, встановлено АД, у 108 ознак делірію не спостерігалося. Хворі, у яких за шкалою CAM-ICU АД визначено не було, проходили подальшу оцінку ступеня порушень когнітивних функцій за шкалою MMSE для оцінки короткочасної й оперативної пам’яті, здатності до концентрації уваги, розуміння зверненої мови, сприйняття мови на слух і в письмовому вигляді, праксису та тестів пам’яті Векслера. На 1-шу добу за шкалою MMSE були виявлені такі відхилення: у середньому оцінка становила 23,3 ± 2,5 бала, однак у зв’язку з неоднорідністю групи вірогідна різниця між хворими з тяжким і середнім ступенем АІ виявлена не була (р > 0,1). У хворих основної групи оцінка поступово збільшувалася, істотні зміни спостерігалися вже на 3-тю добу. У хворих контрольної групи зміни спостерігались лише з 4-ї та 5-ї доби.
При проведенні оцінки ступеня зниження пам’яті за тестами Векслера виявлено таке. При оцінці тесту Векслера І (знання хворим суспільних та особистих даних) уже на 1-шу добу показник істотно не відрізнявся від норми. Найбільший приріст у хворих основної групи спостерігався на 2-гу добу При зменшенні даного показника, що клінічно відповідало розвитку АД, хворі виключалися з аналізу. Після специфічної корекції, в тому числі і лікувальними інгаляціями ксеноном, ближче до 5–6-ї доби, спостерігалися покращення та стійкий приріст показника у хворих основної групи. У контрольній групі також спостерігалася динаміка до стабілізації даного показника, проте значно повільніше. При вивченні показників тесту Векслера ІІ — поточний час та орієнтування — виявлено, що на 2-гу добу було виражене покращення, проте на 3-тю й 4-ту добу спостерігався виражений спад показників, що корелювало з клінічними ознаками в основній групі. Зниження даного показника корелювало з початковими проявами АД, отже, обумовлювало необхідність профілактичних дій. На 5-ту добу у хворих, яким проводили інгаляції ксеноном, спостерігався виражений приріст, який також був і в контрольній групі, з меншим ступенем змін показників. Та вже на 6-ту добу спостерігали відновлення показника у хворих основної групи. За даними тесту Векслера ІІІ — психічний контроль — порівняно з початковими значеннями, покращення було вже на 2-гу добу, а в контрольній групі — на 3-тю — 4-ту. На 5-ту добу спостерігався пік приросту даного показника у групи хворих, які проходили лікувальні ксенонові інгаляції, після чого фіксувалася тенденція до помірного зменшення, та з 6-ї доби — нормалізація даного показника. У групі контролю стабілізація показника спостерігалася тільки на 7-му добу лікування. При оцінці логічної пам’яті за субтестом Векслера ІV, у хворих основної групи спостерігалася тенденція до помірного покращення впродовж 1-ї доби, коли була проведена перша лікувальна інгаляція ксеноном, тоді як у контрольній групі хворих ознаки приросту починалися на 3-тю добу спостереження. З 2-ї по 5-ту добу у хворих основної групи спостерігалася стабілізація на відносно низькому рівні (18–19 балів), що практично збігалося з даними аналізу показників контрольної групи. Однак до 6–7-ї доби спостерігалася тенденція до приросту та стабілізація на нормальному рівні в обох групах дослідження. При визначенні показників відтворення цифр у прямому і зворотному порядку для дослідження інтелекту (субтест Векслера V) простежувалася тенденція до приросту показника з 1-ї доби, проте динаміка була незначною в основній групі дослідження і практично відсутня в контрольній. З 3-ї доби визначалися суттєві позитивні зміни та приріст у групі хворих, які отримували інгаляційну терапію ксеноном, і дещо менші — у контрольній групі. У динаміці оцінки тесту Векслера VІ оцінювалися показники, що відображають спроможність хворого до візуальної репродукції. Пік приросту показника спостерігався на 3-тю добу в основній групі і на 4-ту — у контрольній, після чого спостерігалася тенденція до зниження бальної оцінки, стабілізація на рівні нормальних величин — на 6-ту добу лікування в основній групі, в контрольній групі — на 7-му. За даними субтесту VІІ вивчалась асоціативна пам’ять. У хворих основної групи спостерігалося покращення даного показника на 2-гу добу спостереження, а у хворих контрольної динаміка приросту — на 4-ту. Після цього спостерігалася помірна тенденція до зниження даного показника в обох групах, що була більш вираженою в контрольній. Стабілізація показників субтесту VІІ у хворих основної групи спостерігалася на 4-ту добу лікування, у хворих контрольної групи — на 6-ту. За загальним тестом Векслера на 1-шу добу спостерігався виражений дефіцит за даною когнітивною функцією (пам’ять) в обох групах. Проте за період лікування фіксувався стабільний приріст за даним показником, що був більш вираженим та швидким у хворих основної групи (табл. 1).
При дослідженні даних за шкалами порушення когнітивних функцій після інгаляційної терапії ксеноном виявлено вірогідну різницю між показниками основної та контрольної груп хворих. Покращення показників упродовж періоду лікування у хворих, яким було застосовано ксенонотерапію, спостерігали в середньому на 1 добу раніше.
При лікуванні хворих обох груп були виділені пацієнти з тяжкими ускладненнями АІ — АД, енцефалопатією, алкогольною комою: в основній групі — 30, у контрольній — 22. Прояви АД спостерігалися впродовж перших 2–3 діб перебування у ВІТ: в основній групі — через 38,9 ± 5,5 год після останнього вживання алкоголю, у контрольній — через 48,7 ± 4,5 год, р < 0,05. Перші клінічні ознаки делірію, що визначали за шкалою RASS (+3–4 бали), а також позитивний тест CAM-ICU, який проводили в обох групах дослідження, у 1-й спостерігався значно раніше, клінічні прояви мали більш згладжений характер, у контрольній — делірій мав гіперактивну форму. В основній групі частота даного ускладнення була меншою порівняно з контрольною групою — 14,7 і 21,0 % відповідно, р < 0,005. Клінічно у хворих основної групи визначалися дезорієнтація та збудження. Такі самі симптоми, що супроводжувалися порушеннями гемодинаміки, гіпертермією, судомами та іншими ускладненнями делірію, спостерігалися у хворих контрольної групи. Лікувальні інгаляції ксеноном проводилися щоденно, а за потреби — двічі на добу, що дозволяло оптимізувати у даних пацієнтів режими седації та запобігти ускладненням із боку ЦНС. Призначення ксенонотерапії не виключало застосування бензодіазепінів, гіпнотиків та нейролептиків, проте істотно знижувало дози та строки застосування. На початку седативної терапії використовували пропофол та тіопентал натрію болюсно з подальшим переведенням у режим постійної інфузії. При використанні цих засобів достатньо часто спостерігалися ускладнення з боку дихальної системи — порушення ритму дихання та апное, що вимагало проведення ШВЛ, розвиток гострих запальних процесів у бронхах та легенях. Оптимізацію седативної терапії проводили дексмедетомідином у дозі 0,6–1,5 мкг/кг/год за відсутності проявів гіпотензії та брадикардії. В обох групах неможливо було уникнути застосування нейролептиків. Використовували галоперидол (22,1 ± 4,5 мг/добу) та аміназин (50,55 ± 1,25 мг/добу) при першому введенні. Поступово дози знижувалися: в основній групі на 3-тю — 4-ту добу, у контрольній — на 5–6-ту, можливим було припинення лікування даними засобами. Нейролептичний синдром як ускладнення лікування в основній групі розвинувся тільки в 1 хворого з 30, у контрольній — у 7 з 22. При інтенсивній терапії намагалися уникнути введення нейролептиків, проте хворим 2-ї групи доводилося застосовувати дані засоби на 2-гу — 3-тю добу лікування через посилення клінічних симптомів. Хворим 1-ї групи нейролептики не призначали. До схеми лікування в основній групі були включені такі засоби: інгаляційна терапія ксеноном одноразово на добу, анксіолітики (атаракс 75 мг/добу), антидепресанти (тразодон до 600 мг/добу), таблетовані та ін’єкційні бензодіазепіни (гідазепам — до 100 мг/добу, сибазон — 60 мг/добу). Така схема була необхідною лише на 1-шу — 2-гу добу лікування. Поступово дози препаратів знижували й на 7-му добу залишали підтримуючу дозу тразодону — 75 мг та атаракс — 50 мг. У хворих контрольної групи була необхідність у застосуванні нейролептиків у невеликих дозах: труксал (хлорпротиксен — антипсихотичний засіб, блокує серотонінові 5-HT2-рецептори, α1-адренорецептори, а також гістамінові H1-рецептори) у дозі 25–50 мг. Всім хворим проводили терапію вітамінами групи В із метою патогенетичного лікування алкогольної енцефалопатії, в основі якої лежить дефіцит вітамінів даної групи.
Хворі, які перебували у стані алкогольної коми, також потрапляли на лікування у ВІТ. В основній групі спостерігали 4 хворих із клінічними ознаками коми: 2 з АІ тяжкого ступеня, 2 — з тяжкою інтоксикацією змішаного генезу. У контрольній також було 4 пацієнти. Ступінь порушення свідомості оцінювали за ШКГ, проводився BIS-моніторинг. Клінічні прояви свідчили про вкрай тяжкий стан пацієнтів — порушення дихання та гемодинаміки. З метою корекції дихальних розладів, хворих переводили на ШВЛ. При оцінці BIS-індексу при надходженні спостерігалося, що в середньому показник становив 19,75 ± 1,25, що відповідало грубим церебральним пошкодженням. При поступовому відновленні свідомості з’являлися спроби самостійного дихання хворого та асинхронна робота з респіратором. Гемодинамічна недостатність та неможливість повного переведення на самостійне дихання утруднювали седацію. При застосуванні ксенонотерапії полегшувалася седація, вплив на дихання був мінімальним, переведення на самостійне дихання — на одну добу раніше, ніж у хворих контрольної групи. При застосуванні ксенонотерапії випадок розвитку гострої енцефалопатії спостерігався тільки в 1 хворого. Лікування хворих основної групи тривало 4,1 ± 0,7 доби, контрольної — 6,7 ± 2,1 і потребувало подальшого спостереження.
Отже, інгаляційна терапія ксеноном може успішно застосовуватися у хворих на АІ різного ступеня тяжкості незалежно від наявності ускладнень, оскільки справляє ефекти нейропротекції, корекції гіпоксії та метаболічного ацидозу, покращення когнітивної сфери, стабілізації загального стану хворого (позитивний вплив на гемодинаміку та дихання), скорочує строки перебування хворих на інтенсивному лікуванні та має виражений ефект профілактики ускладнень.
Висновки
1. Розроблено та впроваджено методику низькопотокової інгаляції на основі ксенону, що характеризується високим ступенем безпеки та ефективності та може успішно застосовуватись у комплексі інтенсивної терапії АР.
2. Ксенонові інгаляції забезпечують координовану регуляцію гемодинаміки та дихання, що підтверджено параметрами неінвазивного моніторингу: показників систолічного АТ, ЧСС, ЧДР, сатурації кисню, ЕtСО2 під час проведення маніпуляцій. Позитивний вплив на кисневий статус головного мозку та безпека також підтверджуються вірогідним збільшенням показника кисневого статусу мозку (SjO) при проведенні лікувальних ксенонових інгаляцій.
3. У перебігу лікувальних інгаляцій ксеноном у хворих з АІ середнього та тяжкого ступенів спостерігали особливості — погане сприйняття 1-го етапу маніпуляції (встановлення лицевої маски), що потребувало корекції загальними анестетиками в малих дозах та не спричиняло випадків гіпоксемії та гіперкапнії; моніторинг рівня седації шляхом вимірювання BIS-індексу виявляв розкид показника виключно в безпечних межах з повною кореляцією з клінічними ознаками. Після закінчення інгаляції практично у всіх хворих спостерігались позитивні відчуття з легким ейфоричним ефектом, швидким відновленням когнітивних функцій та в цілому — оптимізацією реабілітаційного періоду.
4. При вивченні клініко-лабораторних показників хворих з АР зменшення клінічних ознак захворювання та його ускладнень у групі з лікуванням ксеноном виявлено раніше (на 2-гу — 3-тю добу) порівняно з контрольною групою хворих (на 4–5-ту). За лабораторними даними також виявлялось більш раннє відновлення в основній групі за показниками: рCO2, який на 2-гу — 3-тю добу становив 34,3 ± 2,2, у контрольній — 39,3 ± 2,3 (р = 0,0001), рО2 — на 2-й добі спостереження — 95,2 ± 2,8 (р2–1 = 0,0001), у контрольній — на 4-ту добу — 94,5 ± 2,5 (р4–1 = 0,0001), а також КОС — корекція ацидозу та нормалізація рівня лактату вже на 1-шу добу перебування у ВІТ порівняно з контрольною — на 3-тю добу.
5. Вивчення впливу ксенону при алкогольній комі показало, що рівень свідомості, який при надходженні за клінікою та показниками BIS-індексу (x = 19,7), шкалою RASS (4 бали) відповідав глибокій комі, після кожного сеансу інгаляційної терапії ксеноном помірно збільшувався і вже на 2-гу — 3-тю добу становив x = 95,0 ± 2,5 та RASS 0–1 бал, що розцінювали як ясну свідомість. При розвитку делірію у хворих основної групи спостерігали більш швидкий початок клінічних проявів (дезорієнтація, психомоторне збудження), що минали через 38,9 ± 5,5 год, а в контрольній групі прояви делірію спостерігали упродовж 48,7 ± 4,5 год (р = 0,021). Термін перебування хворих на АД у ВІТ, які проходили ксенонову терапію, становив 6,1 ± 0,7 доби порівняно з контрольною групою — 8,7 ± 2,1 доби (р = 0,018).
6. При вивченні впливу методу лікувальних інгаляцій ксеноном на швидкість відновлення когнітивних функцій у хворих з АР виявлено вірогідне покращення за показниками шкал MMSE з 2-ї доби — спостерігали статистичне збільшення показника з 21,8 ± 1,9 до 26,0 ± 1,4 (р6–1 = 0,0001), значний приріст відзначали з початку 3-ї доби. Порівняльна оцінка тестів пам’яті Векслера в основній та контрольній групах виявляла статистично значимий приріст в основній групі з 2-ї доби спостереження (р < 0,0001). Різниця між показниками під час інтенсивного лікування була статистично значимою впродовж 2–6-ї діб за рахунок більш швидкого відновлення у хворих основної групи, що свідчило про більш швидку корекцію когнітивних порушень у хворих з АР, яким проводилась інгаляційна терапія ксеноном.
1. Глобальная стратегия сокращения вредного употребления алкоголя. [Електронний ресурс] / Доклад ВОЗ 15.03.2013. Режим доступу: apps.who.int/gb/ebwha/pdf_files/WHA66/A66_27-ru.pdf. — Назва з екрана.
2. Зеркало недели. Украина. Украина заняла третье место по потреблению водки в мире, 18 июня 2013 г. // Режим доступу: http://podrobnosti.ua/society/2013/06/18/912020.html. — Назва з екрана.
3. Меркулова О.Ю., Ефремова Т.П. [и др.]. Хронический алкоголизм — социальная и медицинская проблема современности [Текст] / О.Ю. Меркулова, Т.П. Ефремова, [и др.] // Медицина транспорту України. — 2011. — № 3. — С. 111-114.
4. Мосолов С.Н., Малинин Д.Е., Цукарзи Э.Э. Острые алкогольные психозы [Текст] / C.Н. Мосолов, Д.Е. Малинин, Э.Э. Цукарзи // Медицинский вестник. — 2007. — № 41(426). — С. 2-5.
5. Вієвський А.М., Жданова М.П. [та ін.]. Зріз наркотичної ситуації в Україні (дані 2010 року) [Текст] / А.М. Вієвський, М.П. Жданова [та ін.] // Український медичний та моніторинговий центр з алкоголю і наркотиків МОЗ України. — Київ, 2011. — 22 с.
6. Полищук Н. Страшнее голода, чумы и войны / Н. Полищук // Зеркало недели. — 25.03.2006. — № 11.
7. Гармаш Д. Статистика смертности и травматизма в Украине в 2007–2008 годах (для учета в страховых тарифах) [Текст] / Д. Гармаш // Страхование жизни. — К., 2009. — С. 26-34.
8. Звєрєв В.В., Черемський А.П. Патогенез та інтенсивна терапія алкогольного делірію [Текст] / В.В. Звєрєв, А.П. Черемський // Медицина неотложных состояний. — 2007. — Т. 4, № 11. — С. 14-18.
9. Руководство по анестезиологии. [Текст] / Под ред. Ф.С. Глумчера, А.И. Трещинского. — К.: Медицина, 2008. — 607 с.
10. Тархан А.У. Нейропсихологическая диагностика минимальной мозговой дефицитарности у больных с алкогольной зависимостью [Текст] / А.У. Тархан. — СПб., 2008. — 60 с.
11. Лужников Е.А. Медицинская токсикология: национальное руководство [Текст] / Е.А. Лужников. — М.: ГЭОТАР-Медиа, 2012. — 928 с.
12. Сиволап Ю.П. Алкогольная болезнь мозга: патогенез, клинические формы, современные подходы к лечению [Текст] / Ю.П. Сиволап // Психиатрия и психофармакология. — 2008. — № 2. — С. 49-53.
13. Фаршатов Р.С., Кильдебекова Р.Н., Савлуков А.И. Некоторые биохимические параметры крови у больных острой алкогольной интоксикацией и их связь с выраженностью гипоксии [Текст] / Р.С. Фаршатов, Р.Н. Кильдебекова, А.И. Савлуков // Фундаментальные исследования. — 2009. — № 8. — С. 61-62.
14. Буров Н.Е. Представления о механизме анестезиологических и лечебных свойств ксенона [Текст] / Н.Е. Буров // Ксенон и инертные газы в отечественной медицине / ГВКГ им. Н.Н. Бурденко. — 2010. — С. 39-54.
15. Ma D., Wilhelm S. [et al.]. Neuroprotective and neurotoxic properties of the «inert» gas, xenon [Text] / D. Ma, S. Wilhelm [et al.] // British Journal of Anaesthesia. — 2002. — № 5. — Р. 739-746.
16. Шамов С.А., Давлетов Л.А., [и др.]. Применение ксенона в комплексном лечении психических и соматоневрологических расстройств при острой энцефалопатии у пациентов с зависимостью от психоактивных веществ / С.А. Шамов, Л.А. Давлетов [и др.] // Наркология. — 2007. — № 1. — С. 38-44.
17. Наумов С.А., Хлусов И.А. Рецепторные и адаптационные эффекты ксенона / С.А. Наумов, И.А. Хлусов // Материалы научно-практической конференции «Ксенон и ксеноносберегающие технологии в медицине — 2005», 15–16 декабря 2005 г., Москва. — С. 46-58.
18. Baumert J.H., Hecker K.E., Hein M. Effects of xenon anaesthesia on the circulatory response to hypoventilation // Br. J. Anaesth. — 2005. — № 95. — Р. 166-171.
19. Корнетов Н.А., Шписман М.Н. [и др.]. Применение лечебного ксенонового наркоза в комплексной терапии абстинентного синдрома при опиатной наркомании. Пособие для врачей [Текст]. — 2002. — 28 с.
20. Халафян А.А. Statistica 6. Статистический анализ данных / А.А. Халафян. — М.: Бином-Пресс, 2007 — 508 с.

/91/91.jpg)
/92/92.jpg)