Журнал "Гастроэнтерология" 4 (54) 2014
Вернуться к номеру
Ефективність комбінованого гепатопротектора Форслів у лікуванні хронічних дифузних захворювань печінки
Авторы: Степанов Ю.М., Бреславець Ю.С., Зав’ялова І.Ю. - ДУ «Інститут гастроентерології НАМН України», м. Дніпропетровськ; Косинська С.В. - Державний заклад «Дніпропетровська медична академія МОЗ України»; Ягмур В.Б., Заіченко Н.Г., Гладун В.М., Попок Д.В., Плещенко М.Л., Меланич С.Л. - ДУ «Інститут гастроентерології НАМН України», м. Дніпропетровськ; Мосинцева О.В. - Обласна клінічна лікарня ім. І.І. Мечникова, м. Дніпропетровськ; Слаква І.І., Бородина Л.В. - Медико-санітарна частина № 6, м. Дніпропетровськ; Полешко В.Ю. - Дорожна лікарня, м. Дніпропетровськ;
Степанова Ж.В. - Поліклініка ПАТ «Інтерпайп НТЗ»
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
У статті наведені результати дослідження сироваткового рівня аланінамінотрансферази у хворих на хронічні дифузні захворювання печінки на фоні застосування комплексного гепатопротектора Форслів. За результатами дослідження встановлено вірогідне зниження даного показника у всіх обстежених, що засвідчує ефективність вищезазначеного гепатопротектора.
В статье представлены результаты исследования сывороточного уровня аланинаминотрансферазы у больных хроническими диффузными заболеваниями печени на фоне применения комплексного гепатопротектора Форслив. Согласно результатам исследования установлено достоверное снижение данного показателя у всех обследованных, что подтверждает эффективность вышеуказанного гепатопротектора.
The article presents the results of a study of serum alanine aminotransferase levels in patients with chronic diffuse liver diseases on the background of combined hepatoprotector Forceliv application. According to the findings, a significant decrease of this indicator in all examined patients has been found, that confirms the efficiency of the above mentioned hepatoprotector.
хронічні дифузні захворювання печінки, аланінамінотрансфераза, гепатопротектор, Форслів.
хронические диффузные заболевания печени, аланинаминотрансфераза, гепатопротектор, Форслив.
chronic diffuse liver disease, alanine aminotransferase, hepatoprotector, Forceliv.
Статья опубликована на с. 63-69
Незважаючи на прогрес, досягнутий у вивченні хронічних дифузних захворювань печінки (ХДЗП), проблема діагностики та лікування цієї патології залишається повністю не вирішеною. Це зумовлено декількома причинами: значною поширеністю ХДЗП, їх невпинним зростанням, великою економічною шкодою, якої вони завдають. Так, на вірусні гепатити В, С та алкоголь припадає більше ніж 80 % причин виникнення ХДЗП [1, 2]. За даними Європейського представництва Всесвітньої організації охорони здоров’я (ВООЗ), у 43 країнах регіону рівень смертності від хронічних захворювань печінки є високим (понад 25 випадків смертей на 100 000 населення), у середньому у Європейському регіоні — 17. За останні 10 років у 5 країнах Європи рівень смертності збільшився більше ніж на 50 %. За прогнозами американських епідеміологів, якщо темпи зростання ожиріння та діабету збільшуватимуться протягом ще 20 років, поширеність захворювань печінки в США збільшиться на 45 % до 2030 року [3, 4].
Причини виникнення ХДЗП різні, однак кінцевий результат зазначеної групи захворювань єдиний — формування цирозу печінки. Відомо, що внаслідок дії негативних факторів, у т.ч. токсинів, вірусів гепатиту В, С, активуються зірчасті клітини (ЗК), що є основними фіброгенними клітинами печінки, які утворюють позаклітинний матрикс в ураженому органі. У стані спокою в зірчастих клітинах знаходяться краплі жиру, що містять вітамін А, у них сконцентровано основний запас ретинолу. У разі хронічної дії уражаючих факторів ЗК проліферують, втрачаючи краплі жиру, що містять ретинол, з’являється специфічний білок гладеньких м’язів (альфа-актин). У процесі диференціації у міофібробластоподібні клітини ЗК набувають скоротливої функції, протизапальних та фіброгенетичних властивостей. Також збільшується кількість рецепторів до цитокінів, що стимулюють проліферацію та фіброгенез. Крім того, різко знижується біоенергетичний режим хімічних перетворень у гепатоцитах. Порушується здатність синтезувати альбумін, фактори згортання крові, різні вітаміни. Погіршується використання глюкози, амінокислот для синтезу білка, складних білкових комплексів, біологічно активних сполук. Сповільнюються процеси переамінування та дезамінування. Виникають труднощі в екскреції кон’югованого білірубіну, естерифікації холестерину та глюкуронізації багатьох сполук. Усе це спричиняє порушення детоксикуючої функції печінки [5, 6].
До недавнього часу вважалось, що фіброз печінки — це необоротний процес, який представлений деградацією печінкової паренхіми та заміщенням її збагаченою колагеном тканиною. На сучасному етапі більшість науковців розглядають фіброз як результат повторних уражувально-відновних процесів гепатоцитів, а заміщення сполучною тканиною — як репаративний процес у відповідь на хронічне запалення.
Відомо, що ефективність лікування пацієнтів із захворюваннями печінки залежить від двох складових. По-перше, усунення етіологічних факторів — ефективне лікування вірусних гепатитів, відмова від алкоголю, зменшення токсичних впливів ліків та факторів зовнішнього середовища, корекція стану імунної системи, кишечника, раціональне повноцінне харчування, нормалізація маси тіла. По-друге, використання препаратів, що є важливими посередниками корекції метаболічних порушень, підвищення стану антиоксидантної системи, покращення енергетичних процесів у гепатоцитах. Під час вибору гепатопротектора слід враховувати не тільки особливості перебігу та стадію захворювання печінки, але й наявність супутньої патології та особливості дії конкретного препарату.
У комплексній терапії ХДЗП патогенетично обґрунтовано призначення засобів, що належать до групи гепатопротекторів, здатних захищати та стабілізувати мембрани гепатоцитів і, таким чином, зменшувати підвищену проникність цих клітин. Біохімічний механізм безпосередньої захисної дії гепатопротекторних засобів є інтегральним та включає мембраностабілізуючий, антиоксидантний, протизапальний, анаболічний, жовчогінний, імуномодулюючий та інші ефекти [8].
Надати визначення гепатопротекторам як окремій терапевтичній групі достатньо складно. Перш за все це пов’язано з відсутністю єдиного механізму дії, що обумовлює різнорідність даної групи. Серед великої кількості існуючих визначень терміна «гепатопротектор» нашу увагу привернуло визначення професора І.Б. Михайлова (2005): «Гепатопротектори — це лікарські засоби з превалюючим впливом на печінкові клітини. Їх дія спрямована на корекцію гомеостазу в печінкових клітинах, підвищення протидії органа до дії патогенних чинників, нормалізацію активності та стимуляцію репаративно-регенеративних процесів у печінці» [9].
Як зазначалось вище, група гепатопротекторів гетерогенна та включає сполуки різних хімічних груп із різноспрямованим впливом на метаболічні процеси. Як відомо, гепатопротектори не мають єдиної класифікації. На думку О.А. Мубаракшиної (2008), залежно від хімічної структури та походження препарату виділяють декілька груп гепатопротекторів:
1) препарати рослинного походження;
2) препарати тваринного походження;
3) препарати, що містять есенціальні фосфоліпіди;
4) амінокислоти та їх похідні;
5) вітамінно-антиоксидантні комплекси та вітаміноподібні речовини;
6) препарати різних груп (урсодезоксихолева кислота, тіоктова кислота).
Однак такий підхід до класифікації має певні недоліки. Зокрема, лікувальні засоби однієї класифікаційної групи можуть терапевтично впливати на різні ланки патогенезу різноманітних захворювань та за різними механізмами дії. Саме тому вважається більш перспективним розподіл гепатопротекторів на групи за основним механізмом дії.
На сучасному етапі виділяють такі механізми дії гепатопротекторів: посилення знешкоджуючої функції гепатоцитів за рахунок збільшення глутатіону, таурину, сульфатів та підвищення активності ферментів, що беруть участь в окисненні; гальмування реакцій перекисного окиснення ліпідів (ПОЛ), зв’язування продуктів ПОЛ (перекису водню, вільних іонів О++ і Н+ та ін.) та репарація структур клітинних мембран; протизапальна дія; блокування фіброгенезу за рахунок протидії некрозу гепатоцитів; стимуляція активності колагеназ у печінці та блокування ферментів, що беруть участь у синтезі компонентів сполучної тканини. На думку багатьох науковців, ідеальний гепатопротектор повинен відповідати таким вимогам: хороша всмоктуваність; обов’язкове «проходження» через печінку; здатність зв’язуватися з уражаючими сполуками; протизапальна дія; призупинення фіброгенезу; стимуляція регенеративних процесів; відсутність токсичності [12]. На жаль, жоден існуючий препарат не має всіх цих властивостей одразу.
Застосування комбінованих гепатопротекторів має безперечні переваги, оскільки до їх складу входить кілька компонентів, кожен із яких справляє свою дію, а разом вони потенціюють впливи один одного, що призводить до комплексного та більш суттєвого ефекту порівняно із застосуванням монокомпонентного засобу. Крім того, при використанні саме комплексних препаратів відзначається покращення взаємодії в системі «пацієнт — лікар» та підвищення прихильності хворого до терапії.
Нашу увагу привернув новий комбінований гепатопротектор Форслів (компанії «Базкід Фарма»). Терапевтична ефективність засобу зумовлена фізіологічно активними речовинами метаболічної дії, що входять до його складу (адеметіонін — 150 мг, аргінін — 90 мг та тіоктова кислота — 70 мг), які містяться в кислотостійкій капсулі. Всі складові мають натуральне походження та високий ступінь очищення (постачальник сировини — компанія EUSA Colors (Франція)).
Адеметіонін — природна речовина, що ендогенно синтезується з метіоніну та аденозину. Адеметіонін бере участь принаймні в трьох типах життєво важливих біохімічних реакцій: трансметилюванні, транссульфуванні та синтезі поліамінів. Реакції трансметилювання є важливим етапом синтезу фосфоліпідів (у першу чергу фосфатидилхоліну), що забезпечують текучість мембран та їх поляризацію, яка відіграє помітну роль у синтезі жовчі. Порушення транссульфування призводить до дефіциту глутатіону — найважливішого клітинного антиоксиданту. У свою чергу, недолік глутатіону знижує стійкість гепатоцитів до шкідливої дії вільних радикалів. Крім цього, адеметіонін служить попередником інших тіолових сполук, таких як цистеїн, таурин, коензим А. Нарешті, третя група реакцій, у якій бере участь адеметіонін, — синтез поліамінів — має безпосереднє відношення до процесів проліферації гепатоцитів і регенерації печінки [8, 13]. Експериментальні та клінічні дані свідчать про антиоксидантну та детоксикуючу дію адеметіоніну, а також про прискорення під його впливом регенерації печінкової тканини й уповільнення розвитку фіброзу. На тлі застосування адеметіоніну у хворих на алкогольний цироз зафіксовано підвищення початково знижених концентрацій глутатіону, цистеїну й таурину в сироватці і тканинах печінки, що свідчить про нормалізацію метаболічних процесів. Відомо, що основний токсичний продукт метаболізму етанолу ацетальдегід блокує систему відновлення глутатіону, що обумовлює пошкодження гепатоцитів продуктами ПОЛ. Адеметіонін, будучи донором сульфгідрильної групи, сприяє ліквідації дефіциту глутатіону [14, 15].
Найбільш переконливі клінічні результати застосування адеметіоніну отримані при алкогольній хворобі печінки. Крім вірогідного зниження рівня сироваткового білірубіну, трансаміназ і γ-глутамілтранспептидази, є попередні дані про статистично значуще підвищення виживання хворих на алкогольний цироз. Інша галузь застосування адеметіоніну — холестатичні захворювання печінки, при яких вдається досягти значного зменшення свербежу та зниження ферментів холестазу. Є відомості про виражений позитивний ефект адеметіоніну при лікарському холестазі, у тому числі обумовленому застосуванням α-інтерферону [16]. Крім гепатопротекторних властивостей, адеметіоніну притаманний антидепресивний ефект, що є також дуже важливим у хворих на ХДЗП, однак механізм його залишається неясним. Антидепресивна активність виявляється поступово, починаючи з кінця першого тижня лікування. Ця властивість є важливим доповненням до комплексу лікувальних ефектів адеметіоніну. Зокрема, він сприяє подоланню алкогольної залежності [17].
Наступним компонентом, який увійшов до складу Форсліву, є унікальна за своїми біохімічними властивостями амінокислота — аргінін. У гепатоцитах велика кількість аргініну постійно утворюється в циклі сечовини, проте він одразу ж розщеплюється аргіназою. Таким чином, для того, щоб у печінці відбувався сумарний синтез цієї амінокислоти, цикл сечовини повинен поповнюватись за рахунок інших метаболітів, таких як орнітин. У нормі аміак включається в орнітиновий цикл сечовиноутворення, кінцевим продуктом якого є сечовина. Аміак, що не включився в цикл сечовини, захоплюється невеликою популяцією перивенозних гепатоцитів, у яких із різних аміно- та кетокислот (глутамат, аспартат, альфа-кетоглутарат та ін.) та аміаку під впливом глутаматсинтетази утворюється глутамін. Ці два шляхи утилізації аміаку запобігають надходженню його в загальний кровообіг [8]. Під час алкогольної інтоксикації аргінін стимулює утилізацію алкоголю в монооксигеназній системі печінки, запобігає пригніченню ключового ферменту утилізації етанолу — алкогольдегідрогенази та прискорює інактивацію та виведення токсичних продуктів метаболізму етанолу завдяки збільшенню утворення та окиснення янтарної кислоти. Клінічний досвід засвідчує, що неможливо назвати один специфічний засіб для лікування токсичних уражень печінки. Кожен з існуючих гепатопротекторів впливає на окремі ланки багатомірного патологічного процесу. Застосовують препарати, дія яких спрямована на послаблення токсичного впливу саме аміаку, або препарати, дія яких спрямована на підсилення метаболізму та утилізацію аміаку. Здійснення останнього також можливе декількома механізмами на шляху синтезу цитруліну, а саме: стимуляцією карбомоїлфосфатсинтетази (першого ферменту циклу сечовини), орнітином на етапі синтезу аргінінсукцинату або на етапі синтезу глутаміну. Для підвищення потужності цієї реакції необхідне додаткове надходження субстрату — глутамінової кислоти. Аргінін (L-аргініну L-глутамат) унаслідок субстратної індукції активує глутамінсинтетазну реакцію та зв’язує аміак у нетоксичний глутамін. Глутамін із кров’ю надходить у нирки і є основним постачальником NH4 для процесу амоніогенезу. Завдяки підвищенню амоніогенезу з організму виводиться надлишок Н+ іонів та нормалізується кислотно-лужний стан крові. Водночас аргінін стимулює знешкодження аміаку в циклі синтезу сечовини. Результати зарубіжних досліджень також засвідчують ефективність амінокислоти аргініну при гіперамоніємії. Також аргінін, як і глютамінова кислота, бере безпосередню участь у знешкодженні аміаку в орнітиновому циклі. Більшість препаратів, що відомі за кордоном та сприяють утилізації аміаку, містять аргінін, синтез якого може блокуватися при захворюваннях печінки та інших органів. У зв’язку з цим аргінін є обов’язковим компонентом інфузійних розчинів для парентерального харчування [12]. В останній час виявлено, що аргінін також є ендогенним джерелом оксиду азоту (NO), який відіграє роль між- та внутрішньо-клітинного вторинного посередника та регулює різні функції організму. Відомо, що під впливом аргініну зменшується ПОЛ та реалізується захисна дія при гіпероксії. Він викликає структурні зміни мембран, знижує в’язкість зон білково-ліпідного контакту та підвищує активність мембранозв’язаного ферменту мікросомальної системи печінки — цитохрому Р450; активуючи глутаматдекарбоксилазу, підтримує цим рівень гамма-аміномасляної кислоти, який є одним із тестових покажчиків ступеня гіпероксії. Фармакологічні ефекти аргініну включають як пряму дію на активність деяких ферментів (Na, К-АТФази, каталази, ацетилглутаматсинтетази), гормонів (соматотропного, інсуліну), так і вплив на метаболізм продуктів перетворення аргініну в аргіназній реакції — сечовини та орнітину [18]. Таким чином, аргінін корегує порушений при отруєннях обмін внутрішньоклітинних регуляторів, покращує енергозабезпечення гепатоцитів і стабілізує їх клітинні мембрани, нормалізує обмін білків, вуглеводів і жирів та проявляє антиоксидантні, антигіпероксичні і гіпоамоніємічні властивості.
Третім, не менш важливим компонентом гепатопротектора Форслів є тіоктова кислота. Корисні властивості тіоктової кислоти, яку ще називають ліпоєвою, почали досліджувати ще в середині XX століття. Свою назву ця речовина отримала за аналогічні хімічні та фізичні характеристики з речовинами, що не розчиняються у воді, але є розчинними в органічних сполуках — ліпоїдах. Тіоктова кислота утворюється як синтетичним шляхом, так і в природних умовах — в організмі людини і тварини, а також у рослинах. У сучасній медицині тіоктова кислота застосовується для лікування багатьох захворювань, і насамперед використовується при патології печінки. Тіоктова кислота має антиоксидантні властивості, завдяки чому сприяє зв’язуванню вільних радикалів. Крім того, застосування цієї активної речовини сприяє зниженню рівня глюкози в клітинах крові та збільшенню глікогену в печінці. Тіоктова кислота здатна покращувати роботу печінки, справляти гепатопротекторну, гіпохолестеринемічну, гіполіпідемічну та гіпоглікемічну дію на клітини печінки, а також знижує вплив несприятливих зовнішніх факторів (токсинів). Крім того, вона знижує рівень аміаку у кров’яних клітинах, чим сприяє усуненню симптомів печінкової енцефалопатії та церебральних ознак у пацієнтів із гіперамоніємією, портокавальним анастомозом уже через 2–5 днів лікування [19].
Наведена характеристика комбінованого гепатопротектора Форслів демонструє широкий спектр біологічних ефектів (антихолестатичний, антидепресивний, антиоксидантний, мембраностабілізуючий, цитопротекторний, детоксикуючий, протизапальний, антигіпоксичний, ліпотропний, регуляція вуглеводного обміну), що у комплексі забезпечують ефективну патогенетичну дію при ХДЗП. Таким чином, за умови наявності адекватного етіотропного лікування захворювання печінки ми маємо перспективи повного одужання.
Мета дослідження
1. Вивчити ефективність комплексного гепатопротектора Форслів у хворих на ХДЗП.
2. Порівняти ефективність рекомендованої добової дози (2 капсули на добу) та двократної дози (4 капсули на добу).
3. Розглянути ефективність гепатопротектора Форслів залежно від характеру ураження печінки та етіології ХДЗП.
Матеріали та методи дослідження
Для досягнення мети обстежено 97 пацієнтів із різними за етіологією захворюваннями печінки. Так, в більшості хворих діагностований хронічний вірусний гепатит С та стеатогепатит.
Всі пацієнти були розділені на дві групи:
— I група — 57 хворих (58,8 %, з них 30 чоловіків та 27 жінок), які як лікування отримували Форслів 2 капсули на добу (рекомендована добова доза).
— II групу становили 40 пацієнтів (41,2 %, з них 22 чоловіки та 18 жінок), які з терапевтичною метою отримували гепатопротектор Форслів 4 капсули на добу (двократна доза). Тривалість лікування становила 1 місяць (табл. 1).
Як уже зазначалось, амінокислоти здатні впливати на різні органи та системи, чим обумовлений широкий спектр їх застосування в медицині. Однак саме за рахунок комплексної дії декількох амінокислот одночасно потенційно можливе виникнення негативних ефектів у хворих. Тому насамперед хотілось відмітити, що гепатопротектор Форслів у рамках нашого дослідження продемонстрував гарну переносимість. Так, під час лікування не зафіксовано жодної побічної дії серед хворих обох груп. Цей факт вказує на високий профіль безпеки, що, напевно, пов’язаний із високою якістю сировини, з якої вироблений Форслів.
Для оцінки ефективності гепатопротектора Форслів ми вивчали рівень сироваткового ферменту аланінамінотрансферази (АЛТ) як одного з основних маркерів цитолітичного синдрому. Визначали рівень АЛТ до та після проведеного курсового прийому Форслів. Як видно з рис. 1, середній показник АЛТ серед усіх обстежених до та після терапії із застосуванням комбінованого гепатопротектора Форслів значно зменшився та становив (104,61 ± 6,87) Од/л і (65,10 ± 4,27) Од/л відповідно (р < 0,001).
/67/67.jpg)
Важливо зазначити, що за результатами біохімічного аналізу крові значущої різниці ефективності застосування гепатопротектора Форслів залежно від дози (2 або 4 капсули на добу) нами не отримано. Так, у хворих обох груп показник АЛТ зменшився практично в 1,6 раза (табл. 2). Даний висновок підкреслює економічну складову прийому Форслів та його якість.
Крім того, за результатами біохімічного дослідження, ефективність застосування гепатопротектора Форслів не залежала від характеру ураження печінки. Так, у хворих на цироз печінки рівень сироваткової АЛТ зменшився з (102,49 ± 10,19) Од/л до (83,55 ± 9,84) Од/д (р = 0,004) після застосування Форслів (рис. 2).
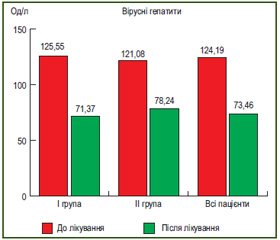
У пацієнтів зі стеатогепатитом показник АЛТ становив (69,39 ± 4,47) Од/д та (39,90 ± 3,70) Од/л (р < 0,001) до та після лікування, а у пацієнтів із вірусними гепатитами В і С аналогічний показник зменшився з (124,19 ± 12,87) Од/л до (73,46 ± 7,23) Од/д (р < 0,001) відповідно (рис. 3, 4.)
/68/68.jpg)
Висновки
Таким чином, аналіз результатів свідчить про ефективність застосування комбінованого амінокислотного гепатопротектора Форслів у хворих на ХДЗП. Терапевтичний ефект є достатнім у рекомендованій дозі (2 капсули на добу) та порівнянним із двократним дозуванням (4 капсули на добу). Ефективність підтверджено вірогідним зменшенням сироваткового рівня АЛТ. Так, в обох групах показник АЛТ зменшився практично в 1,6 раза, що підтверджує здатність зменшувати цитолітичний синдром, відповідно нормалізувати функціональний стан печінки.
Також визначено, що ступінь ефективності зазначеного гепатопротектора не залежить від характеру ураження печінки. У хворих на цироз печінки показник АЛТ сироватки крові зменшився в 1,7 раза; у пацієнтів зі стеатогепатитом — в 1,73, а у хворих на вірусні гепатити В і С цей показник зменшився в 1,76 раза.
Таким чином, Форслів має оптимальне співвідношення переваг та відповідає цілям патогенетичного лікування — відновленню мембрани гепатоцитів і, як наслідок, зменшенню цитолізу.
1. Adipocytokines in insulin resistance and non-alcoholic fatty liver disease: the two sides of the same coin / S.A. Polyzos, J. Kountouras, C. Zavos [et al.] // Med. Hypotheses. — 2010. — № 74(6). — Р. 1089–1090.
2. Пирогова И.Ю. Скрининговое обследование больных диффузными заболеваниями печени / И.Ю. Пирогова // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2010. — № 3. — С. 46–54.
3. A randomized study of extended treatment with peginterferon alpha-2b plus ribavirin based on time to HCV RNA negative-status in patients with genotype 1b chronic hepatitis C / T. Ide, T. Hino, K. Ogata [et al.] // Gastroenterol. — 2009. — № 104 (1). — Р. 70–75.
4. Aging of hepatitis C virus (HCV)-infected persons in the United States: a multiple cohort model of HCV prevalence and disease progression / G.L Davis, M.G. Alter, H. El-Serag [et al.] // Gastroenterology. — 2010. — № 138(2). — Р. 513–521.
5. Cеверов М.В. Обратим ли цирроз печени? / М.В. Северов // Клиническая гепатология. — 2006. — № 3. — С. 3–8.
6. Wynn T.A. Cellular and molecular mechanisms of fibrosis / T.A. Wynn // Journal of Pathology. — 2008. — № 2. — P. 199–210.
7. Determinants of long-term outcome in severe alcoholic hepatitis / J.R. Potts, S. Goubet, M.A. Heneghan [et al.] // Aliment. Pharmacol. Therapy. — 2013. — № 6. — Р. 584–595.
8. Наглядная биохимия / Под ред. Я. Кольмана, К. Рема. — М., 2009. — 469 с.
9. Основы фармакотерапии детей и взрослых: руководство для врачей / Под ред. И.Б. Михайлова. — Санкт-Петербург, 2005 — С. 35–39.
10. Рациональная фармакотерапия в гепатологии: Руководство для практикующих врачей / Под ред. В.Т. Ивашкина, А.О. Буеверова. — М.: Литтерра, 2009. — 296 с.
11. Мубаракшина О.А. Гепатопротекторы: сравнительная характеристика и аспекты клинического использования / О.А. Мубаракшина // Медицинский вестник. — 2008. — № 34. — С. 9–17.
12. Гепатопротекторы / Под ред. С.В. Оковитого, Н.Н. Безбородкина, С.Г. Улейчика [и др.]. — М.: ГЭОТАР-медиа, 2010. — C. 28–36.
13. Mato J.M. Role of S-adenosyl-L-methionine in liver health and injury / J.M. Mato, S.C. Lu // Hepatology. — 2007. — 45(5). — P. 1306–12.
14. Cohen S.M. The administration of methionine to schizophrenic patients: a review of ten studies / S.M. Cohen, A. Nichols, R. Wyatt [et al.] // Biol. Psychiat. — 1974. — № 8. — P. 209–25.
15. Polyunsaturated fatty acid and S-adenosylmethionine supplementation in predementia syndromes and Alzheimer’s disease: a review / F. Panza, V. Frisardi, C. Capurso [et al.] // Scientific World Journal. — 2009. — Vol. 9. — P. 373–389.
16. Carpenter D.J. S-adenosyl methionine as «natural» alternatives to conventional antidepressants in the of the suicidality boxed warning: what is the evidence for clinically relevant benefit? / D.J. Carpenter // Altern. Med. Rev. — 2011. — Vol. 16, № 1. — P. 17–39.
17. Double-blind, placebo-controlled pharmacodynamic studies with a nutraceutical and a pharmaceutical dose of ademetionine (SAMe) in elderly subjects, utilizing EEG mapping and psychometry / O. Arnold, B. Saletu, P. Anderer [et al.] // Eur. Neuropsychopharmacol. — 2005. — 15(5). — P. 533–543.
18. Wu G. Arginine metabolism: nitric oxide and beyond / G. Wu, S.M. Morris // Biochem. J. — 1998. — № 336. — Р. 17–32.
19. Protective effects of R-alpha-lipoic acid and acetyl-L-carnitine in MIN6 and isolated rat islet cells chronically exposed to oleic acid / W. Shen, K. Liu, C. Tian [et al.] // J. Cell Biochem. — 2008. — № 104 (4). — Р. 32–43.

/66/66.jpg)
/67/67_2.jpg)
/67/67_3.jpg)