Журнал «Травма» Том 15, №4, 2014
Вернуться к номеру
Особенности антиоксидантной защиты при термической травме
Авторы: Федорова А.А., Борзенко Б.Г., Гнилорыбов А.М. - Институт неотложной и восстановительной хирургии им. В.К. Гусака НАМН Украины; Донецкий национальный медицинский университет им. М. Горького
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
NО-доноры успешно применяются при лечении разной патологии для расширения сосудов и кардиопротекции. Но инфузии раствора L-аргинина в больших объемах могут стимулировать окислительный стресс. Мы исследовали суммарную концентрацию нитратов/нитритов в крови, содержание медь-зависимых антиоксидантов и субстрата для связывания NО — восстановленного глутатиона у тяжелообожженных, которые при лечении ожоговго шока получали L-аргинин. Нами было выявлено, что на 3-и сутки лечения по окончании ожоговго шока у 15 % пострадавших наблюдалось более значительное, чем у остальных, увеличение концентрации NOx (в 1,5 раза), отсутствие возрастания активности супероксиддисмутазы, низкий уровень восстановленного глутатиона (в 2 раза ниже контрольного) и достоверное снижение в 1,6 раза по сравнению с другими и в 2,5 раза по сравнению с контролем содержания церулоплазмина. Значит, можно говорить о значительном угнетении антиоксидантной защиты клеток при одновременном увеличении продукции оксида азота после инфузии L-аргинина у этих пациентов. Летальность в этой группе составила 100 %. Таким образом, наши данные свидетельствуют о необходимости исследования вышеперечисленных показателей при индивидуальной оценке эффективности использования NO-доноров для лечения тяжелообожженных.
NО-донори успішно застосовуються при лікуванні різної патології для розширення судин та кардіопротекції. Але інфузії розчину L-аргініну у великих об’ємах можуть стимулювати окислювальний стрес. Ми досліджували сумарну концентрацію нітратів/нітритів у крові, уміст мідь-залежних антиоксидантів та субстрату для зв’язування NО — відновленого глутатіону у тяжкообпечених, які при лікуванні опікового шоку отримували L-аргінін. Нами було виявлено, що на 3-тю добу лікування після закінчення опікового шоку у 15 % постраждалих спостерігалось значніше, ніж у решти, збільшення концентрації NOx (в 1,5 раза), відсутність зростання активності супероксиддисмутази, низький рівень відновленого глутатіону (у 2 рази нижче за контроль) і вірогідне зниження в 1,6 раза порівняно з іншими та у 2,5 раза порівняно з контролем умісту церулоплазміну. Отже, можна говорити про значне пригнічення антиоксидантного захисту клітин при одночасному збільшенні продукції оксиду азоту після інфузії L-аргініну у цих пацієнтів. Летальність в цій групі становила 100 %. Таким чином, наші дані свідчать про необхідність дослідження вищеперелічених показників при індивідуальній оцінці ефективності використання NO-донорів для лікування тяжкообпечених.
NO-donors are being successfully used for treatment of various pathologies as vasodilators and cardioprotective drugs. But infusion of great volumes of L-arginine solution can stimulate oxidative stress. We have studied total concentration of nitrates/nitrites in the blood, content of copper-dependent antioxidants and NO-binding — reduced glutathione substrate in patients with severe burns, who received L-arginine during the treatment for burn shock. We have detected that on the 3rd day of treatment after the end of burn shock, 15 % of victims reported more significant, than in other patients, NOx concentration (by 1.5 times), no increase in superoxide dismutase activity, low level of reduced glutathione (2-fold lower than the control one) and a significant decrease, by 1.6 times in comparison with other patients, and 2.5-fold compared with the controls, of ceruloplasmin content. Hence, we can talk about a significant inhibition of cell antioxidant protection while increasing nitric oxide production after infusion of L-arginine in these patients. Mortality in this group was 100 %. Thus, our data suggest the need to study the above-mentioned indicators with individual assessment of the effectiveness of using NO-donors for the treatment of patients with severe burns.
антиоксиданты, ожоги, NO-доноры.
антиоксиданти, опіки, NO-донори.
antioxidants, burns, NO-donors.
Статья опубликована на с. 129-132
Введение
В течение нескольких часов после получения термической травмы в организме пострадавшего развивается 1-я стадия ожоговой болезни (ОБ) — ожоговый шок (ОШ). Тяжелая гиповолемия, централизация кровообращения и микроциркуляторные расстройства приводят к выраженным гипоксическим изменениям в тканях [1]. В ответ на гипоксию должно происходить адаптационное усиление продукции оксида азота (NO) уже в 1-е сутки ОШ, поскольку NO обладает антитромбогенным и сосудорасширяющим действием [2]. Поэтому для стимуляции NO-синтаз обожженным назначаются инфузии раствора L-аргинина (тивортин), который является субстратом для NO-синтаз и донором NO [3].
На 3-и сутки периферическое кровообращение восстанавливается и ожоговый шок переходит в стадию острой ожоговой токсемии (ООТ) [4], при которой кислородное снабжение тканей лишь частично нормализуется.
Вследствие гипоксии при ОШ происходит избыточная генерация активных форм кислорода (АФК), в частности супероксидного анион-радикала [4]. О2– взаимодействует с оксидом азота с большой скоростью, в результате образуется пероксинитрит (ПН). При этом NO утрачивает свою физиологическую активность, тогда как ПН обладает радикальными свойствами и инициирует развитие нитрозативного стресса [5]. В норме большая часть супероксидного анион-радикала инактивируется медь-зависимой супероксиддисмутазой (СОД). При неадекватном функционировании антиоксидантной (АО) системы избыток АФК и ПН приводит к развитию окислительного и нитрозативного стрессов [5]. Известно, что значительные объемы инфузии L-аргинина могут углублять окислительный стресс [6].
SH-группы восстановленного глутатиона (GSH) связывают как оксид азота, так и ПН, в результате чего образуются S-нитрозоглутатионы, которые рассматриваются современными исследователями как легкодоступные депо NO [5, 7]. Кроме того, S-нитрозоглутатионы являются посредниками в реакциях транснитрозилирования белков и ферментов и таким образом регулируют в норме их активность [5, 7].
Регенерация оксида азота из S-нитрозотиолов происходит при участии ионов меди [7]. Ионы меди присутствуют во внутренних средах организма только в связанном виде, в первую очередь в составе антиоксидантного фермента церулоплазмина (ЦП). Ранее было обнаружено, что снижение или возрастание концентрации ЦП в плазме крови оказывает прямо пропорциональное действие на уровень нитритов в крови в норме [8]. Также он осуществляет доставку ионов меди к медь-зависимым ферментам.
Целью нашей работы было оценить активность антиоксидантной защиты у пострадавших с ожогами, которые получали NO-донор — раствор L-аргинина.
Материалы и методы
Было обследовано 60 обожженных в возрасте от 18 до 56 лет в 1-е сутки после травмы до начала лечения и на 3-и сутки лечения при выходе из шока на стадии острой ожоговой токсемии. Все они поступили в Донецкий ожоговый центр в 2008–2012 гг. в результате шахтных травм при взрыве метано-угольной смеси. Пострадавшие с комбинированными травмами в данное исследование не вошли.
Модифицированный индекс тяжести поражения [4] у всех больных превышал 90 ед., то есть это были пациенты с крайне тяжелыми ожогами. Все обожженные получали инфузионную противошоковую терапию, в том числе и раствор L-аргинина (тивортин) в объеме, соответствующем степени тяжести ОШ. При анализе результатов биохимического обследования пострадавших была выявлена группа больных с наиболее выраженными метаболическими нарушениями. На основании этих данных обследованные были разделены на две группы: 1-я — 51 пациент, 2-я — 9 пациентов с крайне выраженными дисметаболическими изменениями. Также было обследовано 17 условно здоровых доноров (группа контроля).
Для получения гемолизата эритроцитов набирали 4 мл крови из вены с добавлением 60 мкл 7,5% ЭДТА, после чего центрифугировали ее 10 минут при 3000 об/мин. Плазму отбирали для определения в ней церулоплазмина, из оставшейся клеточной суспензии отбирали 0,4 мл для последующей 3-кратной отмывки физраствором, после чего разводили отмытые эритроциты в 4 раза дистиллированной водой и замораживали.
Для определения концентрации GSH в эритроцитах к 0,6 мл разведенного в 4 раза дистиллированной водой гемолизата добавляли 0,2 мл 20% сульфосалициловой кислоты, центрифугировали 10 минут при 3000 об/мин. Смешивали 0,2 мл супернатанта с 2,55 мл 0,1-М трис•HCl буфера рН 8,5, содержащего 0,01% ЭДТА, и 0,025 мл 4% раствора 5,5 -дитиобис-2-нитробензойной кислоты в метаноле, измеряли поглощение при y = 412 нм на КФК-3-01 (Россия), затем рассчитывали концентрацию GSH по калибровочному графику [9].
Для определения активности СОД в стеклянной пробирке 0,1 мл отмытых эритроцитов растворяли в 0,9 мл 5-мМ трис•НСl рН 7,4 для получения гемолизата, добавляли 0,25 мл этанола и 0,15 мл хлороформа, затем замораживали. После размораживания центрифугат разводили в 2,5 раза 5-мМ К-фосфатным буфером с 0,0001-М ЭДТА рН 7,8.
Через 30 с после добавления 0,2 мл 2,25•10-3 М раствора адреналина в инкубационную смесь (0,25 мл К-фосфатного буфера + 0,25 мл разведенного центрифугата + 0,35 мл 0,15-М Na-карбонатного буфера pH 10,2 с ЭДТА 3•10-4 М) в кювете 1 см на спектрофотометре измеряли кинетику окисления адреналина при y = 480 нм через каждые 30 с в течение 2,5 минуты против холостой пробы (в инкубационной смеси вместо центрифугата и раствора адреналина — дистиллированная вода), после чего рассчитывается Ео за минуту.
С учетом разведения активность СОД А = 13•Т, где Т — торможение, Т = Е/Еа; Е = Еа – Ео, где Еа — изменение экстинкции автоокисления адреналина (в инкубационной смеси вместо центрифугата — дистиллированная вода) за 1 мин [10].
Суммарную концентрацию нитратов/нитритов (NOх) определяли спектрофотометрически по реакции с реактивом Грисса. 0,25 мл сыворотки крови разводили дистиллированной водой в 6 раз, добавляли 0,5 мл 15% уксусной кислоты, после чего встряхивали пробу в течение 1 мин с 30 мг смеси порошка металлического цинка с MnSO4 в соотношении 1 : 100 для восстановления нитратов в нитриты, потом добавляли 0,25 мл реактива Грисса и измеряли поглощение при y = 538 нм на спектрофотометре Genesys 10UV. Расчет производился по калибровочному графику, построенному на основании раствора 10-мкМ NaNO3 [11].
В основе метода определения содержания ЦП лежит инкубация в течение 1 часа при 37 °С 0,05 мл плазмы крови с 4 мл 0,4-М ацетатного буфера рН 5,5 и 0,5 мл 1% водного раствора п-фенилендиамина. Под действием церулоплазмина в пробе образуются окрашенные продукты. Реакцию останавливали добавлением 1 мл 1% NaF, после чего охлаж–дали в холодильнике 30 минут. Измеряли поглощение при y = 540 нм на КФК-3-01 против холостой пробы, которая содержала 0,05 мл дистиллированной воды вместо плазмы, и 1% NaF туда добавлялся перед началом инкубации. Для расчета содержания ЦП значение экстинкции умножали на фактор 875 [12].
Для статистической обработки результатов использовали программу Statistica. Результаты выражали в виде: среднее ± стандартная ошибка среднего. Достоверность отличий между группами оценивали по t-критерию Стьюдента, достоверными считались отличия при условии p < 0,05.
Результаты и обсуждение
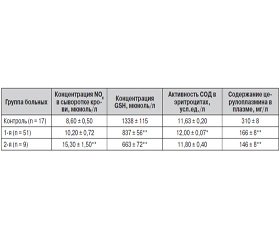
В 1-е сутки после получения травмы уровень NOх достоверно возрастал почти в два раза по сравнению с контролем только во 2-й группе (табл. 1). Следовательно, наши данные свидетельствовали о недостаточной активации NО-синтаз у больных 1-й группы сразу после получения ожога. Это подтверждает данные литературы [2, 13] о противоположном действии гипоксии на экспрессию гена эндотелиальной NO-синтазы в зависимости от продолжительности кислородной недостаточности и типа эндотелиоцитов. В случае с пострадавшими от ожогов уместнее говорить о зависимости повышения уровня NOх от тяжести и глубины травмы. При глубоких ожогах происходит поражение не только клеток кожи, но и клеток сосудов, в том числе и легочных. Таким образом, наши результаты подтверждают целесообразность назначения инфузий L-аргинина пациентам 1-й группы. Во 2-й группе необходимость использования доноров NO при исходно повышенной концентрации нитратов/нитритов не кажется такой очевидной.
Важную диагностическую информацию можно получить при исследовании показателей АО-системы, которые тесно взаимосвязаны с метаболизмом оксида азота.
Так, в норме СОД является основным фактором, предупреждающим образование цитотоксического ПН. Необходимо отметить, что в 1-е сутки после травмы достоверное возрастание активности СОД наблюдалось только в 1-й группе. Во 2-й группе важный фермент защиты против АФК проявлял активность на уровне контрольной группы.
Церулоплазмин транспортирует медь ко всем ферментам, содержащим этот металл в активном центре, в том числе и к СОД. Однако у обследованных нами пострадавших содержание ЦП было снижено в 2 раза в 1-й группе и в 2,5 раза — во 2-й. Такое резкое снижение уровня основного переносчика меди может отрицательно сказываться на функционировании СОД как медь-зависимого энзима. Соответственно, в данных условиях вероятность образования ПН при взаимодействии О2– и NO увеличивается.
В клетках присутствует природная ловушка для ПН — восстановленный глутатион. Изменение концентрации восстановленного глутатиона в эритроцитах также достоверно различалось. У пациентов 1-й группы наблюдалось снижение его содержания только в 1,6 раза, тогда как во 2-й группе уровень GSH снижался в 2 раза. То есть у обожженных этой группы уже в 1-е сутки после травмы регистрировалось истощение субстратов для связывания NО и пероксинитрита на фоне значительно возросшей концентрации NОх.
Итак, уже на стадии ОШ у больных с крайне тяжелыми ожогами прослеживалось две тенденции. У большей части пострадавших (1-я группа) не происходило достоверное возрастание NОх, зато увеличивалась активность СОД, при этом содержание GSH умеренно снижалось и резко снижался уровень церулоплазмина в плазме. То есть АО-система эффективно функционировала уже на 1-й линии защиты против свободных радикалов. У 15 % обожженных (2-я группа) была совсем иная картина: суммарная концентрация NОх резко возрастала на фоне явного истощения АО-ресурсов клеток.
На 3-и сутки лечения NО-донорами по окончании шока на стадии ООТ различия в активности АО-системы у пострадавших сохранялись (табл. 2).
Об активации NО-синтаз после инфузионной терапии с использованием L-аргинина свидетельствовала достоверно возросшая концентрация NОх у всех обожженных. Однако пул GSH достоверно (р < 0,05) снижался в 1,5 раза по сравнению с исходным уровнем на стадии ОШ у больных 1-й группы и оставался очень низким во 2-й группе. Таким образом, наблюдался очевидный дисбаланс в концентрации субстратов для синтеза физиологически активных депо оксида азота — S-нитрозоглутатионов на этой стадии у всех пострадавших.
Наиболее выраженные изменения сохранялись в медь-зависимом звене АО-защиты. Так, у пациентов 1-й группы активность СОД оставалась на том же повышенном уровне, при этом содержание церулоплазмина достоверно (р < 0,05) увеличивалось в 1,2 раза по сравнению со значениями этого показателя на стадии ОШ в этой группе.
У больных 2-й группы, наоборот, углублялись тенденции к снижению эффективности АО-защиты. СОД не возрастала, а уровень церулоплазмина был снижен уже в 2,5 раза. Возможно, такое низкое содержание переносчика меди у этих пациентов и обусловливало неэффективность 1-й линии инактивации АФК.
По тяжести травмы больные 1-й и 2-й групп принципиально не отличались, лечение им назначалось по одному и тому же принципу, в том числе все они получали NО-донор L-аргинин. Но следует отметить, что на 3-и сутки лечения при выходе из ОШ 1-я группа больных характеризовалась положительной динамикой изменений АО-системы, тогда как у пациентов 2-й группы регистрировались самая высокая концентрация NОх, низкое содержание GSH, очень низкий уровень церулоплазмина и отсутствие возрастания активности СОД, то есть наблюдались все условия для углубления окислительного и нитрозативного стрессов. Ретроспективный анализ историй болезни выявил, что в 1-й группе все выжили, а во 2-й летальность составила 100 %.
По нашему мнению, такой явно выраженный антиоксидантный дисбаланс у пострадавших 2-й группы мог нивелировать положительный эффект назначения NО-доноров у этих пациентов. Следовательно, вышеперечисленные биохимические показатели могут быть информативны при индивидуализации контроля эффективности лечения препаратами L-аргинина тяжелообожженных.
1. Мопальцев В.И. Ожоговый шок: патофизиология, клиника, лечение / В.И. Мопальцев, Т.Г. Григорьева // Лікування та діагностика. — 2004. — № 2. — С. 33-39.
2. Ожоговый шок / В.П. Шано, В.К. Гринь, Э.Я. Фисталь и др. — Донецк: Юго-восток, 2006. — 176 с.
3. Horton J.W. Arginine in burn injury improves cardiac performance and prevents bacterial translocation / J.W. Horton, J. White, D. Maas et al. // J. Appl Physiol. — 1998. — Vol. 84, № 2. — Р. 695-702.
4. Комбустиология: учебник / Э.Я. Фисталь, Г.П. Козинец, Г.Е. Самойленко и др. — Донецк, 2005. — 272 с.
5. Pacher P. Nitric oxide and peroxynitrite in health and disease / P. Pacher, J.S. Beckman, L. Liandet // Physiol. Rev. — 2007. — Vol. 87, № 1. — Р. 315-424.
6. Ho-Shiang H. Chronic L-arginine administration increases oxidative and nitrosative stress in rat hyperoxaluric kidneys and excessive crystal deposition / H. Ho-Shiang, M. Ming-Chieh, J. Chen // Am. J. Physiol. Renal. Phy–siol. — 2008. — Vol. 295, august. — Р. 388-396.
7. Каминская Л.Ю. Влияние донатора NО нитрозотиола глутатиона на уровень окислов азота и малонового диальдегида в крови крыс / Л.Ю. Каминская, А.А. Жлоба, О.М. Моисеев и др. // Артер. гипертензия. — 2005. — Т. 11, № 1.
8. Samuel T.K. Copper and nitric meet in the plasma / T.K. Samuel, J.D. Giltin // Nature Chemical Biology. — 2006. — № 2. — P. 452-453.
9. Медицинские лабораторные технологии: Справочник / Под ред. А.И. Карпищенко. — СПб.: Интермедика, 2002. — 600 с.
10. Доронина О.А. Определение активности Cu/Zn-супер-оксид-дисмутазы и пренатальная диагностика синдрома Дауна / О.А. Доронина, В.А. Бурлев, В.А. Бахарев // Пробл. репродукции. — 1996. — № 4. — С. 71-74.
11. Кіселик І.А. Особливості визначення нітратів та нітритів у крові хворих на вірусні гепатити та жовтяниці іншої етіології / І.А. Кіселик, М.Д. Луцик, Л.Ю. Шевченко // Лабораторна діагностика. — 2001. — № 3. — С. 43-45.
12. Горячковский А.М. Клиническая биохимия / А.М. Горячковский. — Одесса: Астропринт, 1998. — 608 с.
13. Hypoxia-induced endothelial NO synthase gene transcriptional activation is mediated through the tax-responsive element in endothelial cells / Jiho Min, Yoon-Mi Jin, Je-Sung Moon et al. // Hypertension. — 2006. — V. 47. — P. 1189-1196.

/131/131.jpg)