Журнал «Травма» Том 15, №4, 2014
Вернуться к номеру
Применение ультразвукового исследования в диагностике гемодинамических нарушений в послеоперационном периоде при тяжелых повреждениях кисти
Авторы: Пастернак В.В., Борзых А.В., Ковальчук Д.Ю., Соловьев И.А., Оприщенко А.А., Варин В.В. - НИИТО Донецкого национального медицинского университета им. М. Горького
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
УЗИ пораженного сегмента в В-режиме не несет значимой диагностической информации вследствие существенного снижения эхогенности, неоднородности структуры, смещения или полного отсутствия естественных анатомических ориентиров, однако позволяет выявить структуры, предположительно являющиеся кровеносными сосудами. Допплеровское картирование позволяет достоверно дифференцировать сосуды с кровотоком в них по наличию цветовой структуры, соответствующей движущейся жидкости (крови). Допплерографическая визуализация потока является убедительным свидетельством наличия кровотока, что особенно важно в затруднительных для оценки клинических случаях. Отсутствие цветовой визуализации потока свидетельствует об отсутствии кровотока в пораженном сегменте и может послужить основанием для установления показаний к повторному хирургическому вмешательству. Наиболее информативным для определения кровотока в сосудах пораженного сегмента является энергетическое допплеровское картирование, имеющее преимущества перед цветным допплеровским картированием потока при низких скоростях кровотока. Исследования кровеносных сосудов пораженного сегмента кисти в режиме импульсной допплеровской спектрографии потока недостаточно репрезентативны в связи с техническими трудностями в получении корректной спектральной кривой.
УЗД ураженого сегмента у В-режимі не несе значущої діагностичної інформації внаслідок істотного зниження ехогенності, неоднорідності структури, зміщення або повної відсутності природних анатомічних орієнтирів, проте дозволяє виявити структури, що ймовірно є кровоносними судинами. Допплерівське картування дозволяє вірогідно диференціювати судини з кровообігом у них за наявністю колірної структури, відповідної рухомій рідині (крові). Допплерографічна візуалізація потоку є переконливим свідченням наявності кровообігу, що особливо важливо в скрутних для оцінки клінічних випадках. Відсутність колірної візуалізації потоку свідчить про відсутність кровообігу в ураженому сегменті й може послужити підставою для встановлення показань до повторного хірургічного втручання. Найбільш інформативним для визначення кровообігу в судинах ураженого сегмента є енергетичне допплерівське картування, що має переваги перед кольоровим допплерівським картуванням потоку при низьких швидкостях кровообігу. Дослідження кровоносних судин ураженого сегмента кисті в режимі імпульсної допплерівської спектрографії потоку недостатньо репрезентативні у зв’язку з технічними труднощами в отриманні коректної спектральної кривої.
The ultrasonic diagnosis of the affected segment in B-mode does not have significant diagnostic information due to a significant reduction in echogenicity, heterogeneous structure, shifting or complete lack of natural anatomical landmarks, but enables to reveal the structure, presumed to be blood vessels. Doppler mapping can reliably differentiate vessels with blood flow in them by the presence of color structure corresponding to the moving fluid (blood). Doppler flow imaging is compelling evidence of blood flow, which is especially important in clinical cases which are difficult to evaluate. Absence of color flow imaging indicates the absence of blood flow in the affected segment, and can serve as a basis for establishing indications for re-intervention. Most informative to determine blood flow in the vessels of the affected segment is energetic Doppler mapping, having advantages over color Doppler flow mapping at low speeds of blood flow. Studies of the blood vessels in the affected segment of the hand in a mode of pulsed Doppler flow spectrography are underrepresented due to technical difficulties in obtaining the correct spectral curve.
ультразвуковая диагностика, допплеровское исследование, повреждения кисти.
ультразвукова діагностика, допплерівске дослідження, пошкодження кисті.
ultrasonic diagnosis, Doppler examination, hand injuries.
Статья опубликована на с. 121-125
Введение
Ультразвуковые исследования (УЗИ) находят все более широкое применение в диагностике патологических состояний костно-мышечной системы, в частности кисти [3, 4]. Известны работы, посвященные УЗИ при травмах костно-мышечной системы [4, 6]. Описана также ультразвуковая картина тканей пальцев кисти в норме и при различных повреждениях [7, 8]. Единичные исследования проводились на базе НИИ травматологии и ортопедии. Однако не найдено литературных данных о возможности использования УЗИ в послеоперационном периоде после массивных повреждений сегментов кисти (сдавления, множественные переломы костей кисти, реплантации и реваскуляризации сегментов кисти).
Материалы и методы
Ультразвуковая допплерография (УЗДГ) основана на эффекте Допплера, заключающемся в сдвиге частоты волн вследствие движения их источника [1, 5]. В диагностических целях, как правило, используют импульсное допплеровское сканирование, дуплексное допплеровское сканирование и допплеровское картирование потока или энергии (соответственно цветное или энергетическое допплеровское картирование) [1, 2]. В режимах импульсного и дуплексного сканирования возможна регистрация и количественная оценка гемодинамических показателей [1, 2].
Цветовая визуализация потоков позволяет получать двухмерную информацию о кровотоке в реальном времени в дополнение к обычной серошкальной визуализации [5, 6]. Цветовая допплеровская визуализация расширяет возможности импульсного принципа получения изображения. Сигналы, отраженные от неподвижных структур, распознаются и представляются в серошкальном виде. Если отраженный сигнал имеет частоту, отличную от излученного, производится определение допплеровского сдвига, на основании чего рассчитывается знак и величина средней скорости, что отражается на экране цветом [1, 5]. При цветном допплеровском картировании в цвете отображается поток крови, который дифференцируется в цветовой шкале по направлению. При энергетическом допплеровском картировании цветом кодируется не значение допплеровского сдвига, а его энергия [1, 2]. Использование энергетического допплеровского картирования позволяет повысить чувствительность метода к низким скоростям, однако при этом невозможно определение направления потока [10, 12].
Визуализация тока крови в режимах допплеровского картирования позволяет визуализировать движущуюся жидкость (кровь) и, следовательно, дифференцировать кровеносные сосуды от иных линейных структур, сходных по эхографическим характеристикам, в В-режиме [5]. Указывается на высокую эффективность сочетания ультразвуковой ангиографии с трехмерной реконструкцией [3]. УЗДГ широко используется в оценке ангиоархитектоники и гемодинамики при различных патологических состояниях, в частности при стенозах и окклюзиях при атеросклеротическом поражении сосудов, трансплантации паренхиматозных органов [2, 9]. В литературе имеются немногочисленные данные о допплерографических исследованиях при патологии кисти [3, 4]. Однако убедительные данные об УЗДГ сосудов кисти и пальцев в норме или при каком-либо патологическом состоянии в литературе отсутствуют, в частности, упоминаний о возможности использования данного метода в оценке восстановления кровотока при реплантации пальца или сегмента кисти не найдено. В то же время существует клиническая потребность в оценке и документировании факта и степени восстановления кровотока в поврежденном сегменте кисти. Неинвазивность, безвредность УЗИ с УЗДГ, отсутствие лучевой нагрузки, относительная дешевизна и доступность, сообщения о высокой ценности данного метода при иных патологических состояниях побуждают к поиску возможностей его применения в оценке эффективности и исхода лечения тяжелых повреждений кисти [11, 13].
На базе областной клинической травматологической больницы Донецка среди пациентов отделения микрохирургии кисти в 2013 году был проведен ряд ультразвуковых исследований. Они производились на 5-й день после операции и через 6 месяцев (контрольные осмотры). Всего УЗИ с УЗДГ на 5-й день были проведены 8 пациентам, из них 2 с реплантациями первого пальца и 6 — с неполными травматическими отчленениями пальцев с субкомпенсацией кровотока различной степени. Через 6 месяцев исследование проводилось у 6 из них. Для исследований использовали ультразвуковой сканер Nemio X6, модель SSA-580A фирмы Toshiba с линейным датчиком с рабочей частотой 5–12 МГц.
При исследовании на 5-й день положение больного лежа (что обусловлено требованиями к послеоперационному ведению пациентов после реплантации) или сидя среди пациентов с неполными отчленениями пальцев, в более же поздние сроки — сидя. Кисть и предплечье пациента располагались на поверхности стола. УЗИ выполняли при среднефизиологическом положении пальцев кисти. Датчик размещали на ладонной поверхности кисти для исследования состояния мягких тканей (подкожной клетчатки, мышц, фасций, сухожилий сгибателей и пр.) в В-режиме. Далее для исследования сухожилий разгибателей датчик размещали на тыльной поверхности. Для УЗДГ сосудов датчик располагали на боковых поверхностях пальцев. Положение датчика определяли как перпендикулярное поверхности тела в зоне сканирования. Для оптимизации визуализации использовали резиновый резервуар, наполненный водой, или «гелевую подушку». Методика «гелевой подушки» заключалась в расположении сканирующей поверхности датчика на расстоянии 0,5–1,0 см от поверхности кожи, при этом пространство между ними заполнялось контактным гелем.
Для обеспечения асептики на датчик надевали защитный чехол. Исследование проводили с особой осторожностью во избежание возможного ятрогенного воздействия в зоне операции, компрессии датчиком для улучшения визуализации избегали.
Последовательность исследований определяли в соответствии с действующими стандартами [9]. Проводили исследование зоны операции и дистально расположенных структур в В-режиме. Определяли структуры, по эхографическим характеристикам соответствующие кровеносным сосудам. Далее переходили к исследованиям с применением допплеровских методов. В режиме энергетического допплеровского картирования дифференцировали кровеносный сосуд от структур со сходными эхографическими характеристиками. За признак наличия кровотока в исследуемом сосуде принимали наличие цветовой структуры, соответствующей току жидкости (крови). Далее в области просвета сосуда устанавливали окно опроса, получали спектральную кривую и в режиме импульсной допплеровской спектрографии потока определяли гемодинамические показатели тока крови.
Изображения фиксировали на экране монитора и документировали на цифровом ультразвуковом снимке.
Результаты
Использование латексного резервуара, наполненного водой, и «гелевой подушки» позволило оптимизировать визуализацию структур кисти за счет увеличения расстояния между датчиком и объектом, а также устранения воздушной прослойки в местах анатомически обусловленных неровностей поверхности кисти.
При УЗИ в В-режиме определялись различные по эхографическим характеристикам структуры кисти, ультразвуковая картина которых в основном соответствовала описываемой в литературе [7, 8]. Визуализировалась поверхность кожи как гиперэхогенная изогнутая полоса. Подкожная жировая клетчатка характеризовалась средней или несколько пониженной эхогенностью. Мышцы выделялись как область еще более низкой эхогенности с мелкими линейными включениями. Сухожилия определялись как гиперэхогенные образования линейной формы с четкими границами и дифференцированной волокнистой структурой. Нервы визуализировались в виде изоэхогенного образования линейной формы с четкими границами и веретенообразной структурой. Хорошо различались суставные щели межфаланговых и пястно-фаланговых суставов. Кости при УЗИ кисти служили анатомическим ориентиром. Поверхность кости определялась в виде контура — яркой гиперэхогенной линии, за которой находилась акустическая тень. Места прикрепления сухожилий к кости четко выделялись относительно гиперэхогенной надкостницы.
Следует отметить, что непосредственно в области проведенной операции и вокруг нее визуализация и дифференцировка вышеописанных структур была существенно затруднена, что эхографически проявлялось значительным снижением эхогенности вследствие отека, неоднородностью структуры, смещением или полным отсутствием естественных анатомических ориентиров, особенно при травмах, обусловленных размозжением или разрывом, артефактами в зоне шва (шовный материал, спицы Киршнера) и пр.
Кровеносные сосуды (артерии и вены) при продольном сканировании визуализировались как линейные, при поперечном — округлые гипоэхогенные образования с четкими гиперэхогенными границами. Однако в зоне операции вследствие развития отека, а также в связи с малым диаметром просвета сосуда и небольшой толщиной сосудистой стенки возникали значительные затруднения в дифференцировке сосудов от иных гипоэхогенных структур, а именно зон резко пониженной эхогенности — «озерцеподобных» [7] дефектов однородной и неоднородной структуры, соответствующих микрополостям, заполненным жидкостью (гематома, теносиновит, область воспалительного процесса).
Таким образом, УЗИ зоны оперативного вмешательства в В-режиме позволило во всех проанализированных случаях получить эхографическую картину мягких тканей и сосудов зоны интереса, детальная интерпретация которой была затруднена.
При энергетическом допплеровском картировании у 3 пациентов удалось подтвердить и документировать факт наличия кровотока по артериям, в том числе восстановленным; в одном случае из них также удалось выявить и венозный кровоток на уровне пястно-фаланговых суставов. Следует отметить, что у 2 из этих больных клинических данных было недостаточно для достоверной констатации кровотока.
В 1 случае допплерографической визуализации просвет сосуда было невозможно однозначно дифференцировать в В-режиме от иных гипоэхогенных образований в области сканирования. Таким образом, только допплеровское картирование позволило достоверно подтвердить факт наличия кровотока.
Цветное допплеровское картирование потока оказалось значительно менее эффективным в констатации факта определения и наличия кровотока — в этом режиме только у 3 больных удалось визуализировать кровеносный сосуд (артерию) с движущейся в нем кровью. Причиной меньшей информативности данного метода является его меньшая чувствительность к низким скоростям, что особо актуально при исследовании мелких кровеносных сосудов в пораженном сегменте со значительно сниженным (по сравнению с контралатеральной кистью) кровотоком в них.
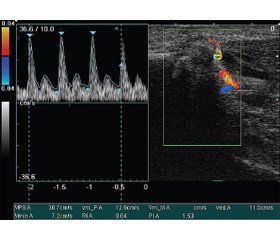
Дальнейшие исследования в режиме импульсной допплеровской спектрографии потока только в 1 случае были репрезентативными (рис. 1, 4).
У остальных пациентов не удалось получить корректную спектральную кривую кровотока в сосуде пораженного сегмента. Причиной этому явились многочисленные артефакты в области сканирования, обусловленные изменениями, вызванными травмой и оперативным вмешательством, а также малый диаметр кровеносных сосудов, отек тканей, деформирующий и уменьшающий просвет сосуда. В случаях, когда было возможно определение гемодинамических показателей тока крови в сосудах пораженного сегмента, было установлено, что таковой кровоток снижен по сравнению с соответствующим сосудом контралатеральной стороны на 15 %. Полученные данные соотносятся с данными литературы об уменьшении просвета сосуда вследствие отека зоны травмы и операции.
При динамическом контроле через 6 мес. наблюдали нормализацию эхографической картины как в В-режиме, так и при УЗДГ. В В-режиме наблюдали существенное снижение отека вплоть до полного его отсутствия, отсутствие гипоэхогенных структур, соответствующих гематомам и зонам воспалительной инфильтрации. Однако эхографическая картина пораженного сегмента отличалась от таковой контралатеральной конечности, что проявлялось в наличии гиперэхогенных структур, соответствующих по эхографическим характеристикам формирующейся рубцовой ткани, а также в ряде случаев нарушением нормальной эхографической анатомии мягких тканей и костных структур.
В режимах допплеровского картирования во всех случаях удалось визуализировать кровоток в сосудах пораженного сегмента и получить репрезентативную спектральную кривую. Отмечено улучшение кровотока по восстановленным артериям, причем скоростные показатели максимально приближались к таковым контралатеральной стороны (от 90 % до полной нормализации).
Выводы
УЗИ пораженного сегмента в В-режиме не несет значимой диагностической информации вследствие существенного снижения эхогенности, неоднородности структуры, смещения или полного отсутствия естественных анатомических ориентиров, однако позволяет выявить структуры, предположительно являющиеся кровеносными сосудами. Допплеровское картирование позволяет достоверно дифференцировать сосуды с кровотоком в них по наличию цветовой структуры, соответствующей движущейся жидкости (крови). Допплерографическая визуализация потока является убедительным свидетельством наличия кровотока, что особенно важно в затруднительных для оценки клинических случаях. Отсутствие цветовой визуализации потока свидетельствует об отсутствии кровотока в пораженном сегменте и может послужить основанием для установления показаний к повторному хирургическому вмешательству. Наиболее информативным для определения кровотока в сосудах пораженного сегмента является энергетическое допплеровское картирование, имеющее преимущества перед цветным допплеровским картированием потока при низких скоростях кровотока. Исследования кровеносных сосудов пораженного сегмента кисти в режиме импульсной допплеровской спектрографии потока недостаточно репрезентативны в связи с техническими трудностями в получении корректной спектральной кривой.
1. Зубарев А.В. Диагностический ультразвук: костно-мышечная система / А.В. Зубарев. — М.: Фирма Стром. — 2002. — 136 с.
2. Клінічна допплерівська ультрасонографія / П.Л. Аллан, П.А. Даббінс, М.А. Поздняк, В. Норман Мак-Дікена: Пер. з англ. — Львів: Медицина світу, 2007. — 374 с.
3. Лелюк В.Г. Ультразвуковая ангиология / В.Г. Лелюк, С.Э. Лелюк. — М.: Реальное время. — 2003. — 322 с.
4. Мак-Нелли Ю. Ультразвуковая диагностика костно-мышечной системы: практическое руководство / Ю. Мак-Нелли. — М.: ВИДАР, 2007. — 400 с.
5. Протоколи ультразвукового дослідження органів та систем: Методичні матеріали / Медведєв В.Є., Волик Н.К., Гуч А.О. — К., 2005. — 38 с.
6. Современная ультрасонографическая диагностика повреждений сухожилий пальцев кисти / И.Г. Чуловская и др. // Радиология-практика. — 2005. — № 3. — С. 17-25.
7. Ультразвуковые методы в оценке консолидации после применения металлоостеосинтеза при переломах костей / В.Д. Завадовская и др. // Ультразвуковая и функциональная диагностика. — 2008. — № 3. — С. 84-90.
8. Финешин А.И. Ультразвуковая диагностика при заболеваниях и повреждениях мягких тканей кисти и предплечья: Автореф. дис... канд. мед. наук. — М., 2006. — 18 с.
9. Цвибель В. Ультразвуковое исследование сосудов. Издание 5-е / В. Цвибель, Дж. Пеллерито. — М.: ВИДАР, 2008. — 646 с.
10. Ascher E., Gopal K., Marks N. et al. Duplex-guided endovascular repair of polpliteal artery aneurysms (PAAs): a new approach to avert the use of contrast material and radiation exposure // Eur. J. Vasc. Endovasc. Surg. — 2010. — 19, 39. — 769-73.
11. Kallakuri S., Ascher E., Hingorani A.P. et al. Effect of duplex atreriography in the mamagment of acute limb-threatening ischemia from thrombosed popliteal aneurysms // Angiology. — 2008. — Apr 29.
12. Ricco J.B., Forbes T.L. Trans-Atlantic Debate: Nonoperative vs Surgical Management of Small (less than 3 cm), Asymptomatic Popliteal Artery Aneurysms // Eur. J. Vasc. Endovasc. Surg. — 2011. — 41. — 445-9.
13. Grigore M., Gafiteanu G., Cojocaru C. The fetal abdominal wall defrcts 2D and 3D ultrasound. Pictorial essay // Medical Ultrasonography. — Dec. 2012. — Vol. 14, Issue 4. — Р. 341.

/123/123.jpg)
/123/123_2.jpg)