Журнал «Медицина неотложных состояний» 4 (59) 2014
Вернуться к номеру
Жировые эмульсии: современное состояние проблемы при проведении интенсивной терапии у больных в критическом состоянии
Авторы: Сорокина Е.Ю. - ГУ «Днепропетровская медицинская академия» МЗ Украины
Рубрики: Медицина неотложных состояний, Хирургия
Разделы: Справочник специалиста
Версия для печати
В статье приведен литературный обзор современного состояния проблемы использования жировых эмульсий как компонента парентерального питания при проведении интенсивной терапии. Показано, что жировые эмульсии, которые в настоящее время используются для полного и частичного парентерального питания, по-разному влияют на иммунологические функции у больных в критическом состоянии и их прогноз. Это в первую очередь обусловлено отличиями в составе жировых эмульсий различных производителей, представленных в настоящее время в Украине, а именно разным качественным и количественным содержанием жирных кислот. Сделан вывод, что олеиновая кислота (ω-9) наиболее устойчива к перекисному окислению липидов и в незначительной степени влияет на синтез медиаторов воспаления, не вызывает иммунодепрессию или иммуносупрессию. Данный факт делает приоритетным использование в медицине неотложных состояний жировых эмульсий, преимущественно содержащих в своем составе олеиновую кислоту (ω-9). Этим требованиям полностью соответствует липидная эмульсия КлинОлеик на основе оливкового масла, которая содержит наибольшее количество иммунонейтральной олеиновой кислоты (ω-9). Липидная эмульсия КлинОлеик является компонентом трехкамерных мешков для проведения парентерального питания под торговым названием Оликлиномель («Бакстер»). Таким образом, жировая эмульсия на основе оливкового масла КлинОлеик в составе препарата Оликлиномель иммунонейтральна и может применяться у большинства пациентов при различных состояниях (длительное парентеральное питание, больные хирургического профиля, больные в критических состояниях, в том числе с усиленной или ослабленной воспалительной реакцией).
У статті наведено літературний огляд сучасного стану проблеми використання жирових емульсій як компонента парентерального харчування при проведенні інтенсивної терапії. Показано, що жирові емульсії, що сьогодні використовуються для повного і часткового парентерального харчування, по-різному впливають на імунологічні функції у хворих у критичному стані та їх прогноз. Це у першу чергу зумовлено відмінностями у складі жирових емульсій різних виробників, представлених на сьогодні в Україні, а саме різним якісним та кількісним умістом жирних кислот. Зроблено висновок, що олеїнова кислота (ω-9) є найбільш стійкою до перекисного окислення ліпідів і незначною мірою впливає на синтез медіаторів запалення, не викликає імунодепресію або імуносупресію. Цей факт робить пріоритетним використання у медицині невідкладних станів жирових емульсій, що переважно містять у своєму складі олеїнову кислоту (ω-9). Цим вимогам повністю відповідає ліпідна емульсія КлінОлеїк, яка зроблена на основі оливкової олії і містить найбільшу кількість імунонейтральної олеїнової кислоти (ω-9). Ліпідна емульсія КлінОлеїк є компонентом трьохкамерних мішків для проведення парентерального харчування під торговельною назвою Олікліномель («Бакстер»). Отже, жирова емульсія на основі оливкової олії КлінОлеїк у складі препарату Олікліномель є імунонейтральною і може застосовуватися у більшості пацієнтів при різних станах (тривале парентеральне харчування, хворі хірургічного профілю, хворі у критичних станах, у тому числі з посиленою або послабленою запальною реакцією).
The article presents a literature review of the current state of the problem of the use of fat emulsions as a component of parenteral nutrition in intensive care. It is found that fat emulsions currently used for complete or partial parenteral nutrition showed different effects on immunological functions in critically ill patients, and their prognosis. It is primarily due to the differences in the composition of fat emulsions of various manufacturers available in Ukraine now, namely the different qualitative and quantitative content of fatty acids. It is concluded that oleic acid (ω-9) is the most resistant to lipid peroxidation and has insignificant effect on the synthesis of inflammation mediators without provoking immunodepression or immunosuppression. This fact places a priority on the use of fat emulsions containing mainly oleic acid (ω-9) in the medicine of emergency. Lipid emulsion ClinOleic based on olive oil and containing the largest amount of immunoneutral oleic acid (ω-9) fully complies these requirements. Lipid emulsion ClinOleic is a component of three-compartment bags for parenteral nutrition under the trade name Oliclinomel (Baxter). Therefore, ClinOleic, fat emulsion based on olive oil, is immunoneutral being a part of the composition of Oliclinomel and can be used in the majority of the patients in various conditions (long-term parenteral nutrition, surgery patients, critically ill patients, including those with enhanced or weakened inflammatory response).
интенсивная терапия, парентеральное питание, жировые эмульсии, КлинОлеик, Оликлиномель.
інтенсивна терапія, парентеральне харчування, жирові емульсії, КлінОлеїк, Олікліномель.
intensive care, parenteral nutrition, fat emulsions, ClinOleic, Oliclinomel.
Статья опубликована на с. 29-36
Реакция на хирургический стресс, критические состояния, травмы и ожоги сопровождается метаболическими расстройствами, которые обусловлены в острую фазу воспалительным и гормональным ответом с выбросом стрессорных гормонов (кортизола, глюкагона, катехоламинов), продукцией и накоплением провоспалительных цитокинов. Как результат развивается гиперметаболизм и гиперкатаболизм, который сопровождается атрофией мышц, нарушением иммунной функции и заживления ран, развитием полиорганной недостаточности и смерти [1].
Постагрессивная реакция — это не только совокупность нарушений белкового и энергетического обмена, но и сложнейшая грубая дисрегуляторная патологическая ситуация, при которой происходят существенные изменения в системе кислородного транспорта, органной перфузии и обеспечении нутриентами, меняется направленность и выраженность целого ряда важнейших биохимических процессов, развивается грубая белково-энергетическая недостаточность [2].
К характерным изменениям в метаболизме углеводов, белков, жиров при критических состояниях относятся [3]:
— развитие стресс-индуцированной гипергликемии за счет усиленного синтеза глюкозы и инсулинорезистентности. Стимулируют высвобождение глюкозы и препятствуют ее тканевому усвоению некоторые виды патогенетической терапии (поддержка катехоламинами, назначение кортикостероидов);
— протеолиз в скелетной мускулатуре, глюконеогенез в печени, продукция острофазных биологически активных веществ и цитокинов;
— липолиз и замещение глюкозы липидами в качестве предпочтительного источника энергии для большинства тканей.
Составление плана лечебного питания должно быть оптимальным для каждого пациента на основании применения различных методов нутритивной поддержки и охватывать весь периоперационный период [4].
Парентеральное питание (ПП), либо самостоятельное, либо в комбинации с энтеральным (ЭП), может улучшить доставку питательных веществ у критически больных пациентов [5]. Основными показаниями для проведения парентерального питания у пациентов отделений интенсивной терапии являются: ПП в качестве дополнения к энтеральному питанию у пациентов с выраженным катаболизмом, когда только ЭП не позволяет справиться с потерями и дефицитом протеинов (сепсис, ожоги, онкология, политравма); недостаточная функция желудочно-кишечного тракта (например, сразу же после травмы или хирургического вмешательства). Полное ПП применяется в клинических ситуациях, при которых зондовое кормление невозможно или неэффективно (непереносимость ЭП, обширные резекции кишки, воспалительные заболевания кишечника, синдром мальабсорбции, неукротимая рвота, сильный понос, паралитическая кишечная непроходимость).
Дефицит энергии — это распространенная и серьезная проблема в отделениях интенсивной терапии, которая связана с повышением частоты осложнений, длительностью госпитализации и смертностью [6, 7].
Наиболее традиционными источниками энергии в практике ПП являются углеводы (1 г глюкозы обеспечивает 4,1 ккал/г = 17,1 кДж). При парентеральном питании водные растворы глюкозы обеспечивают 40–60 % энергетической потребности организма. Глюкоза является источником энергии для центральной нервной системы, эритроцитов, мозгового вещества почки, костного мозга и грануляционной ткани. Минимальная потребность в глюкозе для взрослых определена как 200 г/сутки, независимо от веса тела. Но применение одной только глюкозы в качестве источника энергии часто приводит к серьезным осложнениям, особенно в практике медицины критических состояний: к гипергликемии с гиперосмолярным синдромом, риску гипогликемии в связи с добавлением в концентраты глюкозы инсулина, к активации липонеогенеза и жировой инфильтрации печени, увеличению минутного объема дыхания и изменению респираторного коэффициента [8].
Проведение ПП, содержащего жировые эмульсии, позволяет предотвратить развитие гипергликемии и ее осложнений. Липиды являются основным источником калорий в составе программы ПП, предотвращают или корригируют дефицит энергии, улучшая результат лечения [9]. Липиды являются более высококалорийными источниками калорий (при окислении 1 г жиров образуется 9,1 ккал/г = 37,64 кДж), чем аминокислоты (4 ккал/г) или глюкоза.
Однако на протяжении многих лет в центре внимания оставался вопрос о неблагоприятном воздействии липидов на результаты лечения пациентов в критическом состоянии, в основном в связи с нарушениями иммунной защиты, изменением воспалительных реакций и развитием инфекционных осложнений [10].
В связи с этим выдвигается положение, что назначение ПП, содержащего жировые эмульсии, должно быть обосновано имеющимися клиническими данными конкретного пациента и патофизиологией заболевания [11].
Цель работы. Обосновать необходимость, безопасность и эффективность применения жировых эмульсий в составе парентерального питания при проведении интенсивной терапии.
Классификация жирных кислот (ЖК) основывается на характеристиках их структуры, включающих длину углеродной цепи, наличие и положение двойных связей в цепи и их конфигурацию (то есть цис- или транс-).
ЖК можно разделить на насыщенные (нет двойных связей) и ненасыщенные (одна или более двойная связь). По положению двойной связи в углеродной цепи, как правило, выделяют три семейства: омега-3, омега-6 и омега-9 (которые также обозначают w-3, w-6 и w-9). Цифра обозначает положение двойной связи по отношению к метальной группе, расположенной на конце цепи (рис. 1).
/30/30.jpg)
Ненасыщенные ЖК подразделяют на мононенасыщенные (одна двойная связь — олеиновая кислота 18:1 w-9) и полиненасыщенные: две (линолевая кислота 18:2 w-6) или более двойных связи (a-линоленовая кислота 18:3 w-3).
В зависимости от длины цепи жирные кислоты разделяют на короткоцепочечные (< 8 атомов углерода), среднецепочечные (8–14 атомов углерода — MCT) и длинноцепочечные (16 или более атомов углерода — LCT). Жирные кислоты, цепь которых состоит из 20 или более атомов углерода, иногда называют жирными кислотами с очень длинной цепью.
Почему нужны жировые эмульсии при проведении парентерального питания?
Липиды должны быть неотъемлемой частью ПП (ESPEN, 2009) для обеспечения энергии и незаменимых жирных кислот у больных отделения интенсивной терапии [12]. Рекомендовано внутривенное введение эмульсии липидов в дозе от 0,7 до 1,5 г/кг в течение 12–24 часов.
Акцентируется внимание, что применение смеси длинноцепочечных (LCT) и среднецепочечных (MCT) липидных эмульсий имеет клинические преимущества по сравнению с LCT, но это требует подтверждения в проспективных контролируемых исследованиях. Жировые эмульсии для парентерального питания на основе оливкового масла хорошо переносятся больными в критическом состоянии. Отмечается, что добавление эйкозапентаеновой (ЭПК) и докозагексаеновой кислоты (ДГК) в липидные эмульсии оказывает очевидный эффект на клеточные мембраны и воспалительные процессы, в связи с чем липидные эмульсии, содержащие рыбий жир, вероятно, могут уменьшить длительность пребывания больных в критическом состоянии.
Печень играет ключевую роль в метаболизме жирных кислот и процессах липогенеза. Жирные кислоты синтезируются в организме человека и необходимы как структурные липиды для построения биологических мембран, влияя на их проницаемость, либо для создания тканевых депо. Однако некоторые из ЖК печень синтезировать неспособна, поэтому они называются незаменимыми (эссенциальными). К таким относятся w-3 (aльфа-линоленовая) и w-6 (линолевая) полиненасыщенные жирные кислоты, которые содержатся в основном в растительных жирах.
В связи с этим липиды в составе ПП являются и источниками полиненасыщенных жирных кислот. Типичный пациент отделения интенсивной терапии должен получать линолевую кислоту в количестве 9–12 г/сут и aльфа-линоленовую кислоту — в количестве 1–3 г/сут [12]. В процессе их метаболизма образуются менее насыщенные длинноцепочечные жирные кислоты, имеющие очень большое значение, такие как арахидоновая кислота (w-6), эйкозапентаеновая кислота и докозагексаеновая кислота (обе они — w-3). Рыбий жир содержит ЭПК и ДГК, которые необходимы для работы головного мозга, положительно влияют на когнитивные и поведенческие функции. Производные арахидоновой кислоты (эйкозаноиды) необходимы для работы половой системы, индукции и течения воспалительного процесса, для свертывания крови, регуляции кровяного давления, они также могут быть задействованы в аллергических реакциях.
Печень принимает активное участие в обмене холестерина, который является компонентом клеточных мембран, предшественником солей желчных кислот, стероидных гормонов и витамина D. При патологии холестерин является патогенетическим звеном развития атеросклероза. В условиях голодания (когда отсутствует экзогенная глюкоза) эндогенные триглицериды жировой клетчатки претерпевают обратное превращение путем липолиза в свободные жирные кислоты и глицерин. Печень является местом синтеза кетоновых тел (ацетоуксусная кислота, бета-оксимасляная кислота и ацетон).
Липиды выполняют регуляторную функцию, к липидам относятся стероидные гормоны, секретируемые половыми железами и корой надпочечников. Среди липидов есть вторичные посредники — вещества, участвующие в передаче сигнала от гормонов или других биологически активных веществ внутри клетки. Липиды являются растворителями жирорастворимых витаминов (А, D, Е, К). Обеспечение этими витаминами в значительной степени зависит от попадания жиров в организм.
Таким образом, с одной стороны, высокая калорийность жировых эмульсий в малом объеме вводимого раствора позволяет обеспечить 30–50 % небелковых энергетических потребностей организма, с другой стороны, они являются источниками незаменимых ЖК, участвуют как структурные липиды в построении биологических мембран.
Иммуносупрессия как побочное действие липидных растворов
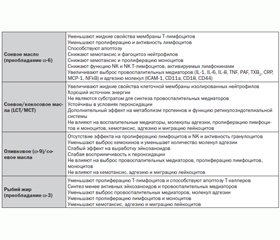
На современном этапе развития медицины критических состояний общепринята точка зрения о преобладающей роли синдрома системного воспалительного ответа в формировании критического состояния любой этиологии [13]. Поэтому вид и качественные характеристики липидов, применяемых у пациентов в критическом состоянии, могут иметь большое значение для клинического исхода. Воздействие липидных эмульсий на иммунную систему у больных в критическом состоянии представлено в табл. 1.
Жирные кислоты могут оказывать влияние на воспалительные и иммунные процессы путем воздействия на структуру клеточных мембран и их функционирование, модификации профиля воспалительных медиаторов и изменения экспрессии генов. По данным M. Jędrzejczak-Czechowicz, M.L. Kowalski (2011), на сегодня более уместно говорить о влиянии липидных эмульсий на функции иммунной системы и воспалительные процессы, сопровождающие основное заболевание (об иммунологических нарушениях у больных в критических состояниях) [14].
Провоспалительные и противовоспалительные эффекты линолевой кислоты (18:2 w-6) и aльфа-линоленовой кислоты (18:3 w-3) соответственно обусловлены метаболизмом эссенциальных жирных кислот.
В процессе метаболизма линолевой кислоты (w-6) образуется арахидоновая кислота (20:4 w-6). Цикл арахидоновой кислоты проходит с образованием: по циклооксигеназному пути — 2-й серии простагландинов (PG2th series) и тромбоксанов (TX2th series), по липоксигеназному пути — лейкотриенов 4-й серии (LT4th series).
Синтез медиатора воспаления PGE2 сопровождается повышением температуры тела, развитием вазодилатации и гиперемии, развитием отеков и гипералгезией. TXA2 синтезируется в тромбоцитах, стимулирует агрегацию тромбоцитов, обусловливает вазоконстрикторный и бронхоконстрикторный эффекты.
Синтез LTB4 сопровождается стимуляцией хемотаксиса: вызывает адгезию лейкоцитов с сосудистым эндотелием и способствует их экстравазации. Стимулами для синтеза эйкозаноидов являются гипоксия, ишемия, повреждение тканей, пирогены и эндотоксины.
Метаболизм эйкозапентаеновой кислоты (производной aльфа-линоленовой кислоты 20:5 w-3) проходит с образованием: по циклооксигеназному пути — 3-й серии простагландинов (PG3th series) и тромбоксанов (TX3th series), по липоксигеназному пути — лейкотриенов 5-й серии (LT5th series), которые обеспечивают противовоспалительный эффект.
Для уменьшения воздействия липидных эмульсий на иммунную систему рекомендуется замещение части соевого масла (w-6) менее биологически активными компонентами, такими как кокосовое масло (среднецепочечные жирные кислоты), оливковое масло (w-9) — мононенасыщенные ЖК, рыбий жир (w-3) — полиненасыщенные ЖК [15].
Ряд исследований показал, что абсолютные концентрации некоторых полиненасыщенных ЖК являются более важными, чем их соотношение, в определении их биологических эффектов [16, 17].
Жировая эмульсия на основе оливкового масла представлена эмульсией КлинОлеик (ClinOleic). Композиция КлинОлеик представляет собой сбалансированный состав жирных кислот. За счет комбинации оливкового и соевого масел достигается необходимый для получения питательного и энергетического эффекта (сопоставимо с нормальным питанием) баланс жирных кислот: мононенасыщенные жирные кислоты — 65 %, насыщенные жирные кислоты — 15 %, полиненасыщенные жирные кислоты — 20 % (w-6 : w-3 = 9 : 1), что обеспечивает умеренную долю незаменимых жирных кислот и антиоксиданты. Соотношение фосфолипидов и триглицеридов = 0,06. Такая специфическая композиция наилучшим образом способствует физиологическому метаболизму жиров, а кинетика триглицеридов сопоставима с таковой естественных хиломикронов, что подтверждено клиническими исследованиями [18].
КлинОлеик является компонентом трехкамерных мешков для проведения парентерального питания под торговым названием Оликлиномель («Бакстер»). Основной идеей создания систем «3 в 1» является стремление стандартизировать полное парентеральное питание с целью достижения максимального клинического эффекта с минимизацией возможных осложнений, особенно при критических состояниях с синдромом гиперметаболизма.
Оливковое масло содержит олеиновую кислоту, являющуюся w-9 мононенасыщенной кислотой, способствует сохранению смеси для парентерального питания, благоприятно влияет на уровень глюкозы крови [19], имеет преимущества в плане снижения риска раковых заболеваний.
Потребление насыщенных ЖК должно быть ограниченным для снижения риска развития сахарного диабета 2-го типа и ишемической болезни сердца (ИБС). Так, известно, что чрезмерное потребление насыщенных ЖК связано с высоким риском развития толерантности к глюкозе, гиперинсулинемии и гипергликемии натощак, а повышение их доли в липидах сыворотки крови может привести к снижению чувствительности к инсулину. Взаимосвязь между чрезмерным потреблением насыщенных ЖК и повышением общего холестерина и холестерина липопротеидов низкой плотности определяет риск развития ИБС. Потребление полиненасыщенных ЖК должно быть ограниченным для снижения риска перекисного окисления липидов (ПОЛ), остеопорозных переломов у пожилых пациентов, отсроченных побочных эффектов на фоне гиперинсулинемии, атеросклероза и онкогенеза, развивающихся в результате повышенного содержания w-6 полиненасыщенных ЖК в пищевом рационе. Олеиновая кислота улучшает липидный состав крови (снижает уровень холестерина и холестерина липопротеидов низкой плотности).
Oлеиновая кислота (ω-9) ассоциируется с меньшим риском перекисного окисления липидов и дополнительного оксидативного стресса
Активация перекисного окисления липидов является одним из возможных компонентов быстрой реакции на стресс. ПОЛ — это цепные реакции, обеспечивающие расширенное воспроизводство свободных радикалов, частиц, имеющих неспаренный электрон, которые инициируют дальнейшее распространение перекисного окисления.
Известно, что в нормальных условиях жизнедеятельности клетки постоянно присутствует определенный уровень ПОЛ, индуцированный образованием активных форм кислорода: ОН+ — гидроксильный радикал, О2– — супероксидный анион, Н2О2 — пероксид водорода. Активные формы кислорода могут взаимодействовать и повреждать клеточные мембраны путем окисления липидов, белков и ДНК [20]. В результате появления в гидрофобном слое мембран гидрофильных зон за счет образования гидропероксидов жирных кислот в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению [21].
Главным источником активных форм кислорода являются митохондрии в таких клетках, как нейтрофилы и макрофаги. Перекисное окисление липидов в клетке поддерживается на постоянном уровне благодаря многоуровневой антиоксидантной системе защиты, что является необходимым условием для поддержания нормальной жизнедеятельности. При критических состояниях повышение образования активных форм кислорода происходит на фоне снижения системы антиоксидантной защиты за счет истощения антиоксидантов, селена, цинка при травмах и ожогах, уменьшения уровня витаминов А, С и Е после операции [22].
К состояниям, сопровождающимся опосредованным повреждением тканей активными формами кислорода, относятся: септический шок, острый респираторный дистресс-синдром, синдром системного воспалительного ответа, диссеминированное внутрисосудистое свертывание, синдром полиорганной недостаточности, ожоги, сердечно-сосудистые заболевания, сахарный диабет, политравма, реперфузионные повреждения и онкологические заболевания [23].
Как известно, липидные эмульсии на основе соевого масла, используемые для ПП с 1980-х годов, могут вызвать окислительный стресс [24]. Это обусловлено тем, что полиненасыщенные жирные кислоты, содержащие двойные связи, расположенные через СН2-группу, наиболее подвержены действию активных форм кислорода. Именно от этой СН2-группы свободный радикал (инициатор окисления) легко отнимает электрон, превращая липид, содержащий эту кислоту, в свободный радикал.
B. Fuhrmana et al. (2006) было высказано предположение, что мононенасыщенные ЖК с одной двойной связью, полученные из оливкового масла (олеиновая кислота 18:1 w-9), могут быть менее чувствительны к перекисному окислению липидов, чем w-6 и w-3 полиненасыщенные жирные кислоты с несколькими двойными связями [25].
O. Goulet et al. (1999) в проспективном рандомизированном исследовании продемонстрировали эффективность и безопасность жировой эмульсии на основе оливкового масла за счет снижения перекисного индекса на 60-й день наблюдения у 18 детей с гастроинтестинальной дисфункцией по сравнению с эмульсиями на основе сои [26]. На фоне приема КлинОлеик перекисный индекс снижался до 83,7 мкмоль/л по сравнению с 104,6 мкмоль/л при терапии интралипидом (р = 0,0027).
У пациентов с тяжелыми ожогами, которым после выхода из ожогового шока проводилось ПП, калораж 35 ккал/сутки, доза жировых эмульсий 1,3 г/кг/сут, было проведено проспективное рандомизированное исследование [27]. Показано, что на фоне приема жировой эмульсии на основе оливкового масла у больных с тяжелыми ожогами нарушения функции печени встречались реже по сравнению с пациентами, которым назначались среднецепочечные ЖК (р = 0,04, Suissa-Shuster test). На фоне приема КлинОлеик средняя продолжительность госпитализации составила 57,0 дня по сравнению с 64,9 дня у пациентов на фоне терапии липофундином.
J. Mateu de Antonio et al. (2008) провели ретроспективное обсервационное исследование, в котором продемонстрировали, что жировые эмульсии на основе сои с высоким содержанием линолевой кислоты при ПП могут повысить риск гнойно-септических осложнений [28]. Обосновано, что оливковое масло с высоким содержанием олеиновой кислоты имеет меньше иммунных эффектов.
Как известно, наиболее распространенным антиоксидантом в природе является витамин Е (aльфа-токоферол). Витамин Е является липофильной молекулой, которая ингибирует свободнорадикальное окисление путем отдачи электрона, что приводит к инактивации радикала липида непосредственно в гидрофобном слое мембран. При этом витамин Е превращается в стабильный, полностью окисленный токоферолхинон. Сочетание aльфа-токоферола с полиненасыщенными жирными кислотами повышает содержание в организме витамина Е и снижает интенсивность перекисного окисления липидов. Кроме того, витамин Е оказывает выраженный антиоксидантный эффект как у взрослых, так и у детей при длительном парентеральном питании.
Оливковое масло содержит значительное количество aльфа-токоферола, соотношение которого с полиненасыщенными жирными кислотами сбалансировано и соответствует 0,5 г альфа-токоферола/1 г полиненасыщенных жирных кислот. Таким образом, КлинОлеик особенно показан для длительного парентерального питания при стрессе, сепсисе, воспалительных состояниях, когда на фоне повышенной продукции свободных радикалов механизмы антиоксидантной защиты дефицитны. Следует отметить физическую стабильность жировой эмульсии, что подтверждено исследованиями [29].
Доказательство иммунонейтрального эффекта ПП предоставлено исследованием, которое показало отсутствие оксидативного повреждения или изменения оксидантно-антиоксидантного баланса у значительного количества (40 %) пациентов в популяции, 75 % которых принимали ПП на основе оливкового масла [30].
P. Yaqoob et al. (1998) продемонстрировали, что увеличение употребления олеиновой кислоты в диете здоровых волонтеров в течение 2 месяцев заметно уменьшило экспрессию молекул адгезии человеческих мононуклеарных клеток, при этом не оказывая эффекта на пролиферацию лимфоцитов и активность NK [31]. Похожий иммунонейтральный эффект наблюдали при парентеральном введении эмульсий на основе оливкового масла по сравнению с жировой эмульсией на основе соевого масла [32]. Экспериментальные исследования на животных (in vivo) подтвердили иммунонейтральный эффект олеиновой кислоты на функцию лейкоцитов [33, 34].
В исследовании J.M. Reimund et al. (2004) показано, что оливковое масло уменьшает продукцию провоспалительных факторов в изолированных человеческих мононуклеарных клетках в намного меньшей степени, чем соевое масло и LCT-MCT [35].
Y. Feng еt al. (2013) в экспериментальном исследовании на мышах изучали влияние различных внутривенных эмульсий липидов в комплексе парентерального питания на эпителий кишечника [36]. В трех группах на протяжении 7 дней использовали жировые эмульсии: на основе сои (w-6); 80 % оливкового масла (w-9) с добавкой w-6; эмульсии c сочетанием w-6, среднецепочечных ЖК, оливкового масла и рыбьего жира (w-3). Показано, что лучшая выживаемость и положительное влияние на целостность кишечника регистрировались в группе оливкового масла, что было обусловлено самыми низкими уровнями фактора некроза опухоли w-, IL-6 и интерлейкина-1b.
Таким образом, w-9 олеиновая кислота — это иммунонейтральная жирная кислота, которая не участвует в образовании провоспалительных медиаторов, не вызывает иммунодепрессию или иммуносупрессию [37].
Венозные тромбоэмболические осложнения являются распространенными и серьезными осложнениями у больных хирургического профиля. Тромбоз глубоких вен встречается у 5–10 % пациентов в критическом состоянии, даже если они получают для профилактики нефракционированные гепарины [38]. w-9 олеиновая кислота уменьшает риск тромбоза за счет снижения агрегации тромбоцитов [39].
Выводы
1. Пациенты, находящиеся в критическом состоянии и имеющие клинические проявления органной дисфункции, являются группой больных, в которой наиболее часто предпринимаются попытки использовать методы нутритивной поддержки. Поступление в организм пострадавшего достаточного количества энергетических субстанций способствует снижению катаболизма, оказывает иммуномодулирующий эффект.
2. Липидные эмульсии по-разному влияют на иммунологические функции. Наличие у пациентов синдрома системного воспалительного ответа должно определять выбор липидной эмульсии у больных в клинике интенсивной терапии.
3. Олеиновая кислота устойчива к перекисному окислению липидов и в незначительной степени влияет на синтез эйкозаноидов и медиаторов воспаления.
4. КлинОлеик обладает иммунонейтральным действием и не вызывает иммунодепрессию или иммуносупрессию. Оливковые/соевые липидные эмульсии могут быть использованы у большинства пациентов.
1. The surgically induced stress response / Finnerty C.C., Mabvuure N.T., Ali A., Kozar R.A., Herndon D.N. // JPEN J. Parenter. Enteral Nutr. — 2013. — Vol. 37, № 5. — P. 21–29.
2. Prognostic impact of disease-related malnutrition / K. Norman, C. Pichard, H. Lochs, M. Pirlich // Clin. Nutr. — 2008. — Vol. 27. — P. 5–15.
3. Специализированное клиническое питание — дополнительные возможности нормализации углеводного обмена в хирургии и интенсивной терапии / Михельсон В.А., Салтанов А.И., Шараева Т.Е. // Вестник интенсивной терапии. — 2005. — № 3. — С. 68–74.
4. Perioperative nutrition: what is the current landscape? / Martindale R.G., McClave S.A., Taylor B., Lawson C.M. // JPEN J. Parenter. Enteral Nutr. — 2013. — Vol. 37, № 5. — P. 5–20.
5. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (ASPEN) / McClave S.A., Martindale R.G., Vanek V.W., McCarthy M., Roberts P., Taylor B., Ochoa J.B., Napolitano L., Cresci G. // JPEN J. Parenter. Enteral Nutr. — 2009. — Vol. 33. — P. 277–316.
6. Dvir D. Computerized energy balance and complications in critically ill patients: an observational study / D. Dvir, J. Cohen, P. Singer // Clin. Nutr. — 2006. — Vol. 25, № 1. — P. 37–44.
7. Fraipont V. Energy estimation and measurement in critically ill patients / V. Fraipont, J.C. Preiser // JPEN J. Parenter. Enteral Nutr. — 2013. — Vol. 37, № 6. — P. 705–713.
8. Vinnars E. 25 years with ESPEN, the history of nutrition / E. Vinnars, F. Hammarqvist // Clin. Nutr. — 2004. — Vol. 23. — P. 955–962.
9. Lipid emulsions in parenteral nutrition of intensive care patients: current thinking and future directions / Calder P.C., Jensen G.L., Koletzko B.V., Singer P., Wanten G.J.A. // Intensive Care Medicine. — 2010. — Vol. 36, № 5. — P. 735–749.
10. Wanten G.J.A. Immune modulation by parenteral lipid emulsions / G.J.A. Wanten, P.C. Calder // Am. J. Clin. Nutr. — 2007. — Vol. 85. — P. 1171–1184.
11. Appropriate use of parenteral nutrition through the perioperative period / McClave S.A., Martindale R., Taylor B., Gramlich L. // JPEN J. Parenter. Enteral Nutr. — 2013. — Vol. 37, № 5. — P. 73–82.
12. ESPEN Guidelines on Parenteral Nutrition: Intensive care / Singer P., Berger M.M., Van den Berghe G., Biolo G., Calder P., Forbes A., Griffiths R., Kreyman G., Leverve X., Pichard C. // Clinical Nutrition. — 2009. — Vol. 28. — Р. 387–400.
13. Расстройства липидного обмена при тяжелом сепсисе: клиническое значение и новые методы коррекции / Малкова О.Г., Лейдерман И.Н., Левит А.Л., Ниценко С.П. // Общая реаниматология. — 2009. — Т. V, № 4. — С. 66–74.
14. Jędrzejczak-Czechowicz M. Effects of parenteral lipid emulsions on immune system response / M. Jędrzejczak-Czechowicz, M.L. Kowalski // Аnaesthesiology Intensive Therapy. — 2011. — Vol. XLIII, № 4. — P. 207–213.
15. Wanten G.J.A. Immune modulation by parenteral lipid emulsions / G.J.A. Wanten, P.C. Calder // Am. J. Clin. Nutr. — 2007. — Vol. 85. — P. 1171–1184.
16. UK Food Standards Agency Workshop Report: the effects of the dietary n-6:n-3 fatty acid ratio on cardiovascular health / Stanley J.C., Elsom R.L., Calder P.C., Griffin B.A., Harris W.S., Jebb S.A., Lovegrove J.A., Moore C.S., Riemersma R.A., Sanders T.A. // Br. J. Nutr. — 2007. — Vol. 98. — P. 1305–1310.
17. Common genetic variants of the FADS1 FADS2 gene cluster and their reconstructed haplotypes are associated with the fatty acid composition in phospholipids / Schaeffer L., Gohlke H., Muller M., Heid I.M., Palmer L.J., Kompauer I., Demmelmair H., Illig T., Koletzko B., Heinrich J. // Hum. Mol. Genet. — 2006. — Vol. 15. — P. 1745–1756.
18. Зингеренко В.Б. «Все в одном»: инновационная технология полного парентерального питания / В.Б. Зингеренко, А.Е. Шестопалов // Медицина неотложных состояний. — 2010. — № 4 (29). — С. 21–27.
19. Olive oil based nutrition in multiple trauma patients: a pilot study / Huschak G., Zur N.K., Hoell T., Riemann D., Mast H., Stuttmann R. // Intensive Care Med. — 2005. — Vol. 31. — Р. 1202–1208.
20. Mishra V. Oxidative stress and role of antioxidant supplementation in critical illness / V. Mishra // Clin. Lab. — 2007. — Vol. 53. — Р. 199–209.
21. Биохимия: Учеб. для вузов / Под ред. Е.С. Северина. — М.: ГОЭТАР-Мед, 2003. — 779 с.
22. Lipid emulsions in parenteral nutrition of intensive care patients: current thinking and future directions / Calder P.C., Jensen G.L., Koletzko B.V., Singer P., Wanten G.J.A. // Intensive Care Medicine. — 2010. — Vol. 36, № 5. — P. 735–749.
23. Goodyear-Bruch C., Pierce J.D. Oxidative stress in critically ill patients // Am. J. Crit. Care. — 2002. — Vol. 11. — P. 543–551.
24. Roche L.D. Oxidative stress: the dark side of soybean-oil-based emulsions used in parenteral nutrition / Livan Delgado Roche // Oxid. Antioxid. Med. Sci. — 2012. — Vol. 1, № 1. — P. 11–14.
25. Fuhrmana B. Postprandial serum triacylglycerols and oxidative stress in mice after consumption of fish oil, soy oil or olive oil: Possible role for paraoxonase-1 triacylglycerol lipase-like activity / B. Fuhrmana, N. Volkova, M. Aviram // Nutrition. — 2006. — Vol. 22, № 9. — P. 922–930.
26. Long-term efficacy and safety of a new olive oil-based intravenous fat emulsion in pediatric patients: a double-blind randomized study / Goulet O., de Potter S., Antébi H., Driss F., Colomb V., Bereziat G., Alcindor L.G., Corriol O., Le B.A., Dutot G., Forget D., Perennec V., Ricour C. // Am. J. Clin. Nutr. — 1999. — Vol. 70. — P. 338–345.
27. Parenteral nutrition providing a restricted amount of linoleic acid in severely burned patients: a randomised double-blind study of an olive oil–based lipid emulsion v. medium/long-chain triacylglycerols / García-de-Lorenzo A., Denia R., Atlan P., Martinez-Ratero S., Le B.A., Evard D., Bereziat G. // Br. J. Nutr. — 2005. — Vol. 94. — P. 221–230.
28. Comparative effects of olive oil-based and soyabean oil-based emulsions on infection rate and leucocyte count in critically ill patients receiving parenteral nutrition / Mateu de Antonio J., Grau S., Luque S., Marin-Casino M., Albert I., Ribes E. // Br. J. Nutr. — 2008. — Vol. 99. — Р. 846–854.
29. Peroxidation Potential of Lipid Emulsions After Compounding in All in One Solutions / Pironi L., Guidetty M., Zolezzi C., Fasano M.C., Paganelli F., Merli C., Bersani G., Pizzoferrato A., Miglioli M. // Nutrition. — 2003. — Vol. 19. — P. 784–788.
30. No evidence for oxidative stress in patients on home parenteral nutrition / Schepens M.A., Roelofs H.M., Peters W.H., Wanten G.J. // Clin. Nutr. — 2006. — Vol. 25. — Р. 939–948.
31. Effect of olive oil on immune function in middle-aged men / Yaqoob P., Knapper J.A., Webb D.H., Williams C.M., Newsholme E.A., Calder P.C. // Am. J. Clin. Nutr. — 1998. — Vol. 67. — P. 129–35.
32. Effects of parenteral lipid emulsions with different fatty acid omposition on immune cell functions in vitro / Granato D., Blum S., Rossle C., Le Boucher J., Malnoe A., Dutot G. // J. Parenter. Enteral Nutr. — 2000. — Vol. 24. — P. 113–118.
33. In vivo effects of olive oil-based lipid emulsion on lymphocyte activation in rats / Moussa M., Le Boucher J., Garcia J., Tkaczuk J., Ragab J., Dutot G., Ohayon E., Ghisolfi J., Thouvenot J.P. // Clin. Nutr. — 2000. — Vol. 19. — P. 49–54.
34. Effects of three intravenous lipid emulsions on the survival and mononuclear phagocyte function of septic rats / Garnacho-Montero J., Ortiz-Leyba C., Garnacho-Montero M.C., Garcia-Garmendia J.L., Pérez-Paredes C., Moyano-Del Estad M.R., Barrero Almodóvar A., Jiménez-Jiménez F.J. // Nutrition. — 2002. — Vol. 18. — P. 751–754.
35. Potential usefulness of olive oil-based lipid emulsions in selected situations of home parenteral nutrition-associated liver disease / Reimund J.M., Arondel Y., Joly F., Messing B., Duclos B., Baumann R. // Clin. Nutr. — 2004. — Vol. 23. — P. 1418–1425.
36. Feng Y. Effects on varying intravenous lipid emulsions on the small bowel epithelium in a mouse model of parenteral nutrition / Y. Feng, P. Browner, D.H. Teitelbaum // JPEN J. Parenter. Enteral Nutr. — 2013. — Vol. 7, № 6. — Р. 775–786.
37. Cury-Boaventuraa M.F. Comparative toxicity of oleic acid and linoleic acid on Jurkat cells / M.F. Cury-Boaventuraa, C. Pompéiab, R. Curia // Clinical Nutrition. — 2004. — Vol. 23, Issue 4. — P. 721–732.
38. Crowther M.A. Thromboprophylaxis in medical-surgical critically ill patients / M.A. Crowther, D.J. Cook // Curr. Opin. Crit. Care. — 2008. — Vol. 14. — P. 520–523.
39. Verdier P. Lipid emulsions and hemofilter duration in continuous hemodiafiltration / P. Verdier, I. Mellot-Verdier, R. Chausset // Nutr. Clin. Metabol. — 2002. — Vol. 6. — P. 85–90.

/32/32.jpg)