Журнал «Здоровье ребенка» 3 (54) 2014
Вернуться к номеру
Участие интерлейкинового семейства 1 в развитии воспалительной реакции при инфекционном процессе. 2. Роль IL-1F1 (IL-1a) и IL-1F2 (IL-1β)
Авторы: Абатуров А.Е. - ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины»; Волосовец А.П. - Национальный медицинский университет им. А.А. Богомольца; Юлиш Е.И. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Педиатрия/Неонатология
Версия для печати
В обзоре представлена характеристика IL-1F1 (IL-1α) и IL-1F2 (IL-1β), их рецепторов, механизмов действия и значения данных интерлейкинов в развитии воспалительной реакции.
В огляді надана характеристика IL-1F1 (IL-1α) і IL-1F2 (IL-1β), їх рецепторів, механізмів дії та значення даних інтерлейкінів у розвитку запальної реакції.
The review presents the characteristics of IL-1F1 (IL-1α) and IL-1F2 (IL-1β), their receptors, mechanisms of action and value of these interleukins in the development of inflammatory response.
воспаление, цитокины IL-1F1 (IL-1α) и IL-1F2 (IL-1β), инфекционный процесс.
запалення, цитокіни IL-1F1 (IL-1α) і IL-1F2 (IL-1β), інфекційний процес.
inflammation, cytokines IL-1F1 (IL-1α) and IL-1F2 (IL-1β), infection process.
Статья опубликована на с. 154-159
Введение
В 1985 году от LPS-индуцированных макрофагов были изолированы два протеина с молекулярно-биологическими характеристиками IL-1, которые получили название IL-1a и IL-1b [4]. Согласно новой классификации, данные цитокины IL-1a, IL-1b получили обозначения IL-1F1 и IL-1F2 соответственно.
Синтез, процессинг и высвобождение IL-1F1 –(IL-1a) и IL-1F2 (IL-1b)
IL-1F1 (IL-1a) и IL-1F2 (IL-1b) первично синтезируются как длинные проформы, состоящие из 271 (30,6 kDa) и 269 аминокислотных остатков (30,7 kDa) соответственно [2; 5].
Продуценты IL-1F1 (IL-1a) и IL-1F2 (IL-1b)
Основными продуцентами IL-1F1 (IL-1a) и IL-1F2 (IL-1b) являются макрофаги и моноциты. Проформа IL-1F1 (IL-1b) конститутивно также присутствует в кератиноцитах кожи, клетках печени, легких, почек, тромбоцитах. Цитокин IL-1F2– –(IL-1b) является продуктом ограниченного числа клеток, таких как моноциты крови, тканевые макрофаги и дендритные клетки [7, 20].
Процессинг IL-1F2 (IL-1b)
В отличие от IL-1F1 (IL-1a) IL-1F2 (IL-1b) не присутствует в клетках здоровых людей. Стимулирующими факторами синтеза про-IL-1F2 (IL-1b) могут быть PAMP патогенов, цитокины (TNF, –IL-18, IL-1a, IL-1b). Самоиндукции синтеза IL-1F2 (IL-1b) является частью механизма аутовоспаления. Молекула про-IL-1F2 (IL-1b) сохраняется в цитоплазме клетки до тех пор, пока каспаза-1, активированная инфламмасомой, не вызовет его протеолитическое расщепление с образованием активной формы протеина с молекулярной массой 17 kDa, содержащего 113–271 аминокислотные остатки первичной молекулы [8, 9]. Однако показано, что в некоторых клетках, в частности микроглиоцитах, про-IL-1F2 (IL-1b) может транслоцироваться в ядро, но его внутриядерные функции до настоящего времени остаются неизвестными [17]. Каспаза-1 расщепляет цитоплазматически расположенные молекулы про-IL-1F2 (IL-1b) между Asp116 и Ala117 аминокислотными остатками [12]. Процессинг про-IL-1F2 (IL-1b) может происходить и без участия каспазы-1. Так, было показано, что про-IL-1F2 (IL-1b) является субстратом для таких ферментов нейтрофилов, как эластаза, протеиназа-3, химаза, гранзим A и катепсин G [3, 14].
Высвобождение IL-1F1 (IL-1a)
Проформа IL-1F1 (IL-1a) является активным цитокином, который свое основное действие оказывает внутри клетки. Однако при патологических состояниях про-IL-1F1 (IL-1a) может транслоцироваться через цитоплазматическую мембрану и активировать соседние клетки, несущие рецептор IL-1. При некротической гибели клеток, возникающей вследствие различных причин, происходит высвобождение про-IL-1F1 (IL-1a) в экстрацелюллярное пространство, и, выступая в роли DAMP, может индуцировать развитие «стерильного» воспаления [22, 27].
Высвобождение IL-1F2 (IL-1b)
Подавляющее большинство молекул IL-1F2 (IL-1b) в LPS-активированных моноцитах локализуется в цитоплазме, а определенная их часть находится в везикулах и защищена от расщепления трипсином. Эти везикулы впоследствии сливаются с лизосомами и формируют аутолизосому с протеолитическим расщеплением их содержимого. При ингибировании аутофагии происходит секреция IL-1b во внеклеточную среду, а при активации аутофагии — ее снижение. IL-1F2 (IL-1b) может высвобождаться из клетки при помощи микровезикул и экзосом. Также каспаза-1 вызывает образования пор (1,1–2,4 нм в диаметре) в цитоплазматической мембране. Эти каспаза-1-зависимые поры могут предоставлять канал, по которому IL-1F2 (IL-1b) высвобождается во внеклеточное пространство [16].
Рецепторы IL-1F1 (IL-1a) и IL-1F2 (IL-1b)
Интерлейкины IL-1F1 (IL-1a) и IL-1F2 (IL-1b) взаимодействуют с двумя рецепторами, один из которых состоит из двух цепей IL-1R1 и IL-1R3, а второй — только из одной цепи IL-1R2. Активация IL-1R1 приводит к рекрутированию адаптерной молекулы MyD88, активации IRAK и последующему возбуждению фактора транскрипции NF-kB, MAPK JNK (c-jun n-terminal kinase) и p38 [1]. Взаимодействие данных интерлейкинов с рецептором IL-1R2, у которого отмечается недостаток внутриклеточного домена, не сопровождается возбуждением внутриклеточных сигнальных путей [21]. В лиганд-рецепторных взаимоотношениях IL-1F1 (IL-1a) и IL-1F2 (IL-1b) принимает участие еще один протеин — естественный антагонист IL-1R1 — IL-1F3 (IL-1Ra), который продуцируется теми же клетками, что и IL-1F1 (IL-1a) и IL-1F2 (IL-1b). Идентифицированы четыре изоформы IL-1F3: три внутриклеточные (icIL-1Ra1, icIL-1Ra2, icIL-1Ra3) и одна солютабная внеклеточная изоформа sIL-1Ra. Взаимодействие sIL-1Ra с IL-1R1 блокирует рецептор [9, 15].
Внутриклеточное действие IL-1F1 (IL-1a)
Про-IL-1F1 (IL-1a), как протеин, который содержит каноническую последовательность ядерной локализации, после синтеза транслоцируется в ядро клетки, где, взаимодействуя с гистоновыми ацетилтрансферазами, внутриядерным ингибитором роста и продукции коллагена некдином, HAX-1 (HS1-associated protein X-1), внутриядерным –IL-1RII, цитоспецифически модулирует транскрипцию различных генов (табл. 1).
Так, гиперэкспрессия про-IL-1F1 (IL-1a) в фибробластах индуцирует пролиферацию, в клетках эндотелиальной линии и клетках человеческой остеосаркомы (SaOS-2) обусловливает ингибирование пролиферации, а в клетках эмбриональной почечной линии (HEK-293) вызывает апоптоз [17]. Часть молекул про-IL-1F1 (IL-1a) расщепляется кальпаином и остается в цитоплазме клетки; его высвобождение в экстрацеллюлярное пространство наблюдается при некротической гибели клетки [24].
Внеклеточное действие IL-1F1 (IL-1a) и IL-1F2 (IL-1b)
Экстрацеллюлярно расположенные IL-1F1 –(IL-1a) и IL-1F2 (IL-1b), активируя рецептор –IL-1R1/IL-1R3, обусловливают возбуждение факторов транскрипции NF-kB, AP-1, которые индуцируют экспрессию mRNA сотен различных, в том числе и собственных, генов, в различных клетках — моноцитах, макрофагах, эпителиоцитах, эндотелиоцитах, хондроцитах, фибробластах. Стимулирование транскрипции генов происходит всего через 30 минут после воздействия IL-1F1 (IL-1a) или IL-1F2 (IL-1b), и активность генов IL-1a, IL-1b сохраняется на протяжении нескольких часов [26].
Эффекты IL-1F2 (IL-1b)
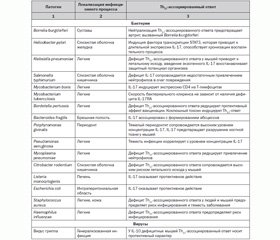
IL-1F2 (IL-1b) является одним из ключевых, проксимальных интерлейкинов, предопределяющих течение воспалительного процесса. В физиологических условиях концентрация в сыворотке крови IL-1F2 (IL-1b) очень низкая. IL-1F2 (IL-1b) стимулирует продукцию IL-1F1 (IL-1a), IL-1F2 (IL-1b), IL-1Ra, IL-2, IL-3, IL-6, IL-8, IkBa, индуцибельной нитрооксидсинтазы (iNOS), циклооксигеназы-2 (COX-2), молекул адгезии, интегринов, острофазовых белков, тканевых ремодулирующих ферментов (матриксных металлопротеиназ) и др. [26]. Под влиянием IL-1F2 (IL-1b) активируется продукция многочисленными типами клеток хемокинов, в том числе MCP-1 (monocyte chemoattractant protein 1), MIP-2 и KC, которые являются мощными аттрактантами, привлекающими нейтрофилы в регион поражения. В последнее время установлено, что IL-1F2 (IL-1b) в присутствии IL-6 является ключевым индуктором дифференцирования наивных Т-лимфоцитов в IL-17-продуцирующие клетки (Th17) [10]. Yeonseok Chung и соавт. [6] показали, что в наивных Т-лимфоцитах IL-1F2 (IL-1b) индуцирует экспрессию фактора транскрипции IRF4 и ядерного рецептора RORyt (orphan retinoid nuclear receptor), которые предопределяют дифференциацию незрелых форм в Th17-лимфоциты. Th17-клетки продуцируют IL-17A, IL-17F. В свою очередь, IL-17A, IL-17F, воздействуя на различные типы клеток, индуцируют продукцию IL-6, нитрооксидсинтазы-2, GM-CSF (granulocyte/macrophage colony-stimulatory factor), G-CSF (granulocyte colony-stimulatory factor), матриксных металлопротеиназ, хемокинов, таких как IL-8, CXCL 1, CXCL 10, CCL 20. Именно через индукцию IL-17A, IL-17F IL-1F2 (IL-1b) обеспечивает рекрутирование и активацию нейтрофилов. Th17-клетки активно влияют и на функционирование В-клеточной популяции. Они активно продуцируют IL-6, который способствует матурации В-клеток; IL-21, который является мощным фактором дифференциации В-лимфоцитов [19]. Th17-клетки принимают активное участие в системе неспецифической защиты макроорганизма от патогенных инфекционных агентов (табл. 2), но их выраженная и длительная активация может привести к развитию хронических воспалительных и аутоиммунных заболеваний [19].
Таким образом, вызываемый IL-1F2 (IL-1b) каскад цитокиновой продукции обусловливает развитие нейтрофильно-макрофагального воспаления и может быть молекулярной основой развития аутоиммунных заболеваний [11, 26].
Также IL-1F2 (IL-1b) участвует в регуляции гемопоэза, температуры, аппетита, активности метаболизма костной ткани. IL-1F2 (IL-1b) является самым мощным известным эндогенным пирогеном [18]. IL-1F2 (IL-1b) по аноректическому эффекту превосходит лептин в 1000 раз [2, 13]. Введение нескольких десятков нанограмм IL-1F2 (IL-1b) вызывает повышение температуры тела, нейтрофилез, тромбоцитоз и продукцию кортиколиберина, острофазовых белков. IL-1F2 (IL-1b) секретируется преимущественно макрофагами и моноцитами. Попадая в кровеносное русло, IL-1F2 (IL-1b) активирует рецепторы к IL-1 эндотелиоцитов, индуцируя продукцию IL-6. В свою очередь, IL-6 стимулирует синтез острофазовых белков гепатоцитами, увеличивает мобилизацию предшественников гранулоцитов и зрелых нейтрофилов из костного мозга, обусловливая развитие нейтрофильной реакции, активирует тромбоцитообразование. IL-1F2 (IL-1b), достигая сосудистой сети гипоталамуса, индуцирует синтез циклооксигеназы-2, что приводит к повышению местной концентрации простагландина E2, который, оказывая влияние на центр терморегуляции, способствует повышению температуры тела. Также IL-1F2 (IL-1b) снижает эффективность действия эритропоэтина, обусловливая развитие анемии [8, 9].
Клинические проявления гипо- и гиперпродукции IL-1F1 (IL-1a), IL-1F2 (IL-1b)
У IL-1F1 (IL-1a)-дефицитных мышей наблюдается спонтанное развитие артрита, болезни, подобной псориазу, артериита, в то время как мыши с дефицитом продукции IL-1F2 (IL-1b) склонны к возникновению инфекций, особенно вызываемых грамположительными бактериями (Listeria monocytogenes и Staphylococcus aureus) [25].
Проявления IL-1F2 (IL-1b)-дефицитного возбуждения [25]:
а) нарушения состояния иммунитета:
— низкий уровень Th1-ответа;
— низкая продукция IFN-y;
б) повышенная чувствительность к развитию инфекций, вызванных:
— Staphylococcus aureus;
— Streptococcus pneumoniae;
— Listeria monocytogenes;
— Shigella flexneri;
— Salmonella typhimurium;
— вирусом гриппа А;
— Candida albicans.
Длительная гиперпродукция IL-1F2 (IL-1b) лежит в основе хронических воспалительных, аутовоспалительных заболеваний и может способствовать канцерогенезу [10].
Значение IL-1F2 (IL-1b) при инфекционных заболеваниях
Установлено, что IL-1F2 (IL-1b) оказывает протективное действие при многих бактериальных, вирусных и грибковых инфекционных заболеваниях. Ингибирование активности IL-1F2 (IL-1b) с использованием антагониста IL-1R (Kineret) сопровождается повышением восприимчивости к бактериальным инфекционным агентам.
Заключение
Цитокины IL-1F1 (IL-1a) и IL-1F2 (IL-1b) являются самыми мощными провоспалительными факторами, которые участвуют в развитии процесса воспаления всех органов и систем. IL-1F2 (IL-1b), вызывая лихорадочную реакцию, активируя рекрутирование нейтрофилов в очаг воспаления, продукцию других провоспалительных цитокинов и хемокинов, экспозицию эндотелиальных адгезионных молекул и стимулируя специфический иммунный ответ, участвует в защите организма от инфекционных агентов.
1. Akira S., Uematsu S., Takeuchi O. Pathogen recognition and innate immunity // Cell. — 2006. — Vol. 124, № 4. — P. 783-801.
2. Arend W.P., Palmer G., Gabay C. IL-1, IL-18, and IL-33 families of cytokines // Immunol. Rev. — 2008. — Vol. 223. — P. 20-38. doi: 10.1111/j.1600-065X.2008.00624.x.
3. Caspase-1-independent activation of interleukin-1beta in neutrophilpredominant inflammation / M. Guma, L. Ronacher, R. Liu-Bryan, S. Takai, M. Karin, M. Corr // Arthritis Rheum. — 2009. — Vol. 60, № 12. — P. 3642-3650. doi: 10.1002/art.24959.
4. Cloning, sequence and expression of two distinct human interleukin-1 complementary DNAs / C.J. March, B. Mosley, A. Larsen, D.P. Cerretti, G. Braedt, V. Price, S. Gillis, C.S. Henney, S.R. Kronheim, K. Grabstein, P.J. Conlon, T.P. Hopp, D. Cosman // Nature. — 1985. — Vol. 315, № 6021. — P. 641-647.
5. Complete nucleotide sequence of the gene for human interleukin 1 / Y. Furutani, M. Notake, T. Fukui, M. Ohue, H., Nomura M. Yamada, S. Nakamura // Nucleic Acids Res. — 1986. — Vol. 14, № 8. — P. 3167-3179.
6. Critical regulation of early Th17 cell differentiation by interleukin-1 signaling / Y. Chung, S.H. Chang, G.J. Martinez, X.O. Yang, R. Nurieva, H.S. Kang, L. Ma, S.S. Watowich, A.M. Jetten, Q. Tian, C. Dong // Immunity. — 2009. — Vol. 30, № 4. — P. 576-587. doi: 10.1016/j.immuni.2009.02.007.
7. Differential requirement for the activation of the inflammasome for processing and release of IL-1beta in monocytes and macrophages / M.G. Netea, C.A. Nold-Petry, M.F. Nold, L.A. Joosten, B. Opitz, J.H. van der Meer, F.L. van de Veerdonk, G. Ferwerda, B. Heinhuis, I. Devesa, C.J. Funk, R.J. Mason, B.J. Kullberg, A. Rubartelli, J.W. van der Meer, C.A. Dinarello // Blood. — 2009. — Vol. 113, № 10. — P. 2324-2335. doi: 10.1182/blood-2008-03-146720.
8. Dinarello C.A. Biologic basis for interleukin-1 in disease // Blood. — 1996. — Vol. 87, № 6. — P. 2095-2147.
9. Dinarello C.A. Blocking IL-1 in systemic inflammation // J. Exp. Med. — 2005. — Vol. 201, № 9. — P. 1355-1359.
10. Dinarello C.A. Why not treat human cancer with interleukin-1 blockade? // Cancer Metastasis Rev. — 2010. — Vol. 29, № 2. — P. 317-329. doi: 10.1007/s10555-010-9229-0.
11. Gamero A.M., Oppenheim J.J. IL-1 can act as number one // Immunity. — 2006. — Vol. 24, № 1. — P. 16-17.
12. Hazuda D.J., Lee J.C., Young P.R. The kinetics of interleukin 1 secretion from activated monocytes. Differences between interleukin 1 alpha and interleukin 1 beta // J. Biol. Chem. — 1988. — Vol. 263, № 17. — P. 8473-8479.
13. IL-33, an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines / J. Schmitz, A. Owyang, E. Oldham, Y. Song, E. Murphy, T.K. McClanahan, G. Zurawski, M. Moshrefi, J. Qin, X. Li, D.M. Gorman, J.F. Bazan, R.A. Kastelein // Immunity. — 2005. — Vol. 23, № 5. — P. 479-490.
14. Inflammatory arthritis in caspase 1 gene-deficient mice: Contribution of proteinase 3 to caspase 1-independent production of bioactive interleukin-1 beta / L.A. Joosten, M.G. Netea, G. Fantuzzi, M.I. Koenders, M.M. Helsen, H. Sparrer, C.T. Pham, J.W. van der Meer, C.A. Dinarello, W.B. van den Berg // Arthritis Rheum. — 2009. — Vol. 60, № 12. — P. 3651-3662. doi: 10.1002/art.25006.
15. Jeru I., Amselem S. Inflammasome et interleukine 1 // La Revue de medecine interne. — 2010. — Vol. 32, № 4. — P. 218-224. doi: 10.1016/j.revmed.2010.02.013.
16. Lopez-Castejon G., Brough D. Understanding the mechanism of IL-1b secretion // Cytokine Growth Factor Rev. — 2011. — Vol. 22, № 4. — P. 189-195. doi: 10.1016/j.cytogfr.2011.10.001.
17. Luheshi N.M., Rothwell N.J., Brough D. Dual functionality of interleukin-1 family cytokines: implications for anti-interleukin-1 therapy // Br. J Pharmacol. — 2009. — Vol. 157, № 8. — P. 1318-1329. doi: 10.1111/j.1476-5381.2009.00331.x.
18. Murakami N., Sakata Y., Watanabe T. Central action sites of interleukin-1 beta for inducing fever in rabbits // J. Physiol. — 1990. — Vol. 428. — P. 299-312.
19. Romagnani S. Human Th17 cells // Arthritis Res Ther. — 2008. — Vol. 10, № 2. — P. 206. doi: 10.1186/ar2392.
20. Sims J.E., Smith D.E. The IL-1 family: regulators of immunity // Nat. Rev. Immunol. — 2010. — Vol. 10, № 2. — P. 89-102. doi: 10.1038/nri2691.
21. Sims J.E. IL-1 and IL-18 receptors, and their extended family // Curr. Opin. Immunol. — 2002. — Vol. 14, № 1. — P. 117-122.
22. Sterile inflammation of endothelial cell-derived apoptotic bodies is mediated by interleukin-1 / Y. Berda-Haddad, S. Robert, P. Salers, L. Zekraoui, C. Farnarier, C.A. Dinarello, F. Dignat-George, G. Kaplanski // Proc. Natl. Acad. Sci. USA. — 2011. — Vol. 108, № 51. — P. 20684-20689. doi: 10.1073/pnas.1116848108.
23. Th17 responses and host defense against microorganisms: an overview / F.L. van de Veerdonk, M.S. Gresnigt, B.J. Kullberg, J.W.M. van der Meer, L.A.B. Joosten, M.G. Netea // BMB. — 2009. — Vol. 42, № 12. — P. 776-787.
24. The precursor form of IL-1alpha is an intracrine proinflammatory activator of transcription / A. Werman, R. Werman-Venkert, R. White, J.K. Lee, B. Werman, Y. Krelin, E. Voronov, C.A. Dinarello, R.N. Apte // Proc. Natl. Acad. Sci. USA. — 2004. — Vol. 101, № 8. — P. 2434-2439.
25. The role of IL-1 in the immune system / S. Nakae, R. Horai, Y. Komiyama, A. Nambu, M. Asano, A. Nakane, Y. Iwakura // The Cytokine Knockouts / Ed. by G. Fantuzzi. — 2nd еd. — Humana Press, 2003. — P. 95-110.
26. Weber A., Wasiliew P., Kracht M. Interleukin-1 (IL-1) Pathway // Sci. Signal. — 2010. — Vol. 3, № 105. — P. cm.1.
27. Yazdi A.S., Drexler S.K. Regulation of interleukin 1b secretion by inflammasomes // Ann. Rheum. Dis. — 2013. — Vol. 72, Suppl. 2. — P. ii96-9. doi: 10.1136/annrheumdis-2012-202252.

/155/155.jpg)
/156/156.jpg)
/157/157.jpg)