Журнал «Здоровье ребенка» 3 (54) 2014
Вернуться к номеру
Антибактериальная терапия при острых бактериальных заболеваниях органов дыхания у детей
Авторы: Юлиш Е.И. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Семейная медицина/Терапия, Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
В работе представлены данные по выбору и рациональному использованию антибиотиков при лечении у детей острых респираторных заболеваний, вызванных различными этиологически значимыми микроорганизмами.
У роботі наведені дані щодо вибору та раціонального використання антибіотиків при лікуванні у дітей гострих респіраторних захворювань, викликаних різними етіологічно значущими мікроорганізмами.
The paper presents data on the selection and rational use of antibiotics in the treatment of children with acute respiratory infections caused by various etiologically significant microorganisms.
дети, инфекция, респираторные заболевания, антибиотики.
діти, інфекція, респіраторні захворювання, антибіотики.
children, infection, respiratory diseases, antibiotics.
Статья опубликована на с. 85-91
На протяжении длительного периода истории ведущими причинами смерти человека были инфекции. Именно инфекционные болезни определяли очень малую продолжительность жизни. Еще совсем недавно, чуть более полувека тому назад, диагнозы сепсиса, пневмонии, перитонита, не говоря о чуме, холере, тифе, нередко являлись приговором в судьбе больного. И сколько знает себя мир, столько продолжается борьба с инфекциями. Особенно много исследований, посвященных данной проблеме, начало проводиться в XIX веке. Однако созданные тогда на основе ртути, мышьяка, серебра и тому подобного препараты для лечения инфекций отличались высокой токсичностью и низкой эффективностью. Первые вещества, губительно воздействующие на микроорганизмы, но приемлемые для человека, были открыты во Франции в институте Пастера только в 30-х годах XX века среди производных синтетических красителей. Они получили название «сульфаниламиды» (или «химиопрепараты»), а процесс лечения ими был назван химиотерапией.
Перелом в проблеме лечения инфекционных заболеваний наступил примерно в те же годы, в 1929 году, когда английский микробиолог А. Флеминг открыл первый антибиотик — пенициллин. Это стало хотя и случайным, но самым выдающимся открытием XX века, которое ознаменовало начало новой эры в медицине — эры антибиотиков. Человечество научилось использовать явление антибиоза (антагонизма) бактерий, при котором в борьбе за существование бактерии, как и другие живые существа, вынуждены противоборствовать друг другу. И основным оружием в этой борьбе являются ферменты, вырабатываемые одними видами бактерий и губительно действующие на другие виды.
Благодаря этому величайшему открытию медицинская наука и практика сделали огромный шаг в спасении миллионов человеческих жизней. Казалось, обнаружена панацея, навсегда избавляющая человечество от инфекционных бед. С каждым годом появлялись новые классы антибиотиков, а к 70-м годам XX века сложилось впечатление, что все основные инфекционные заболевания уже побеждены. Более того, в 1969 году Вильям Стюарт, президент Международной ассоциации хирургов, заявил: «Учитывая достижения антибактериальной терапии и программ вакцинации, в ближайшее время можно будет закрыть книгу инфекционных болезней».
Однако очень скоро выяснилось, что праздновать победу над болезнетворными микроорганизмами рано, превосходство человека над природой было иллюзорным. Более того, вопрос о том, кто кого — мы микробов или они нас, — приобрел драматическую остроту. Уже в 1940 году E. Abraham и E. Chain обнаружили штамм Escherichia coli, не чувствительный к пенициллину [1], а к концу шестидесятых — середине семидесятых годов прошлого столетия, то есть всего через 20–25 лет после начала широкого использования антибиотиков, разразилась «стафилококковая чума». Микроорганизмы, в частности стафилококки, приспособившись к широко используемому тогда пенициллину, мутировали, укрепили свою оболочку, что препятствовало проникновению препарата в клетку, и активно начали вырабатывать ферменты — b-лактамазы, гидролизующие (разрушающие) антибактериальные препараты. И на сегодня уже обнаружено более 350 b-лактамаз, синтезируемых как грамположительными, так и грамотрицательными микроорганизмами.
В первые годы развития антибиотикотерапии новые препараты получали из природных продуктов. В дальнейшем, с внедрением методов их химического синтеза, появились полусинтетические модификации природных молекул, а затем и полностью синтетические антибиотики. Недостатками природного пенициллина, кроме подверженности его действию b-лактамаз, были инактивация препарата в кислой среде желудка и, следовательно, невозможность энтерального применения, а также короткий период полувыведения, что вынуждало увеличивать кратность его парентерального введения до 6 раз в сутки.
Эти недостатки пенициллина в совокупности с успешным определением в середине 50-х годов химической структуры 6-аминопенициллановой кислоты («пенициллиновое ядро») послужили предпосылкой для создания более совершенных полусинтетических антибиотиков пенициллинового ряда. В 1960 году синтезируется первый b-лактамный антибиотик метициллин, устойчивый к действию стафилококковых b-лактамаз, и кислотоустойчивый — ампициллин (1961 г.), активный в отношении не только грамположительных кокков, но и таких грамотрицательных микроорганизмов, как Haemophilus influenzae, Escherichia coli, Proteus mirabilis и др. [2]. Дальнейшие разработки привели к созданию в 1972 году препарата амоксициллин, отличающегося от своих предшественников значительно улучшенными фармакокинетическими свойствами и большей активностью в отношении целого ряда микроорганизмов.
Большинство назначений антибиотиков по поводу острых инфекционных заболеваний лор-органов и дыхательных путей у детей проводится в амбулаторной практике. Ведущим показанием к использованию антибактериальных средств при инфекционной респираторной патологии у детей является бактериальная инфекция — высоковероятная или доказанная.
Выбранный антибиотик для стартовой терапии респираторных бактериальных инфекций должен иметь высокую природную активность в отношении основных возбудителей заболевания, низкий уровень вторичной резистентности, с учетом региональных и локальных данных о резистентности, и безопасность с точки зрения доказательной медицины. При этом следует учитывать характер антибактериальной терапии, которую ребенок получал в предшествующие 2–3 месяца, что повышает риск носительства резистентной микрофлоры [3].
На выбор стартовой противомикробной терапии в первую очередь влияет выделенный этиологически значимый патогенный микроорганизм и спектр его чувствительности к антибиотикам. Согласно данным литературы и результатам собственных исследований, основными возбудителями острых отитов и синуситов, острого тонзиллита и фарингита являются Streptococcus pneumoniae (пневомококк), Haemophilus influenzae (гемофильная палочка), Streptococcus pyogenes [4]. Ведущими патогенами при инфекциях нижних дыхательных путей у детей в амбулаторных условиях являются пневмококки, реже — гемофильная палочка и внутриклеточные патогены. Доля пневмококков может доходить до 60–70 %, на втором месте — гемофильная палочка [5–8]. Перечисленный спектр микроорганизмов позволяет сделать вывод, что для стартовой эмпирической антибактериальной терапии инфекций респираторного тракта и лор-органов в большинстве случаев подходят b-лактамные антибиотики, к которым резистентность респираторных патогенов в странах Европы, в т.ч. и в Украине, незначительна, и эффективность b-лактамных антибиотиков по прогнозам на ближайшие 5–7 лет будет сохраняться.
Особенности фармакокинетики b-лактамов позволяют выполнить еще одно важнейшее правило рациональной антибактериальной терапии — создать терапевтическую концентрацию антибиотика в очаге инфекции и поддерживать ее на протяжении всего курса лечения. Среди многочисленных b-лактамных антибиотиков как препарат стартовой терапии острых бактериальных инфекций респираторного тракта ведущее место в рекомендациях Всемирной организации здравоохранения (ВОЗ) занимает амоксициллин [9].
Среди амоксициллинов в педиатрической практике в мире широко используется Флемоксин Солютаб® [10]. Следует отметить диспергируемость лекарственной формы препаратов, созданных по технологии солютаб. Таблетка Солютаб состоит из отдельных микросфер, заключенных в наполнитель. Попадая в любую жидкость, таблетка начинает распадаться на микросферы при воздействии бикарбонатов. Микросферы не подвержены воздействию ферментов желудочного сока, начинают «раскрываться» только в верхних отделах тонкого кишечника, где они становятся проницаемыми и создаются оптимальные условия для максимального всасывания активных веществ. Таким образом, действующее вещество высвобождается в зоне максимального всасывания. Это, в свою очередь, обеспечивает более равномерное и максимально полное всасывание активных компонентов препаратов по сравнению с аналогами. Форма Солютаб также обеспечивает минимальную остаточную концентрацию действующего вещества в кишечнике, что гарантирует как предсказуемую эффективность, так и благоприятный профиль безопасности вследствие минимального влияния препарата на микрофлору кишечника и минимального раздражающего действия. Антибиотики в форме Солютаб позволяют выбрать удобный для каждого пациента способ приема (их можно принимать целиком либо растворять в воде с образованием сиропа или суспензии с приятным вкусом), обеспечивают наиболее высокую биодоступность среди аналогов, выпускающихся в твердой лекарственной форме, они гораздо проще суспензий в приготовлении и хранении.
Изучение эффективности Флемоксина Солютаб® при острых бактериальных инфекциях органов дыхания у детей различного возраста было проведено в клинике профессора В.В. Бережного [11]. На фоне терапии Флемоксином Солютаб® наблюдалась быстрая положительная динамика у детей в возрасте от 6 месяцев до 5 лет с острым средним отитом: со 2–3-го дня исчезли боль в ухе, температурная реакция, нормализовался сон; на 3-и — 5-е сутки улучшилась отоскопическая картина, которая полностью нормализовалась на 5–6-е сутки.
У детей в возрасте от 7 до 12 лет с катаральным гайморитом, получавших Флемоксин Солютаб®, четко прослеживалась положительная динамика со 2–3-го дня приема препарата: нормализовалась температура, исчезали головные боли, с 3–5-го дня улучшилось носовое дыхание, а к 7–10-му дню риноотоскопическая картина и показатели гемограммы приходили в норму.
У больных в возрасте от 3 до 7 лет с лакунарной ангиной на фоне приема Флемоксина Солютаб® также наблюдалась положительная клиническая динамика: улучшалось общее состояние, нормализовалась температура, со 2–3-го дня исчезали боли в горле при глотании, на 3–5-й день уменьшались подчелюстные лимфоузлы. Через 10 дней в анализах крови и мочи патологических изменений не было выявлено. Авторами была также доказана эффективность использования в течение 7 дней Флемоксина Солютаб® у детей с обострением хронического тонзиллита на фоне перенесенной острой респираторной вирусной инфекции (ОРВИ) и в случаях рецидивирующего бронхита у часто болеющих детей в возрасте 2–10 лет с наличием хронических очагов инфекции лор-органов (хронический аденотонзиллит) и требовавших проведения антибактериальной терапии.
Введение Флемоксина Солютаб® в комплекс терапии детей с неосложненной бронхопневмонией способствовало в сравнении с использованием ампициллина положительной динамике в состоянии больных и течении заболевания. Улучшение общего состояния, уменьшение кашля, снижение температуры тела и купирование одышки наступали после 2–3-го дня приема антибиотика. Полная нормализация состояния и температуры, уменьшение хрипов в легких выявлены после 5–7-го дня терапии. Нормализация показателей периферической крови, полное исчезновение хрипов и рассасывание инфильтративных теней в легких отмечалось у всех детей по окончании комплексного лечения пневмонии. Высокую эффективность и переносимость Флемоксина Солютаб® связывают с его прекрасной биодоступностью и хорошей всасываемостью в кишечнике [12].
Длительность курса терапии Флемоксином Солютаб® составляет: при отите — до 7 дней, негнойном синусите и бронхите — 7–10 дней, ангине, обострении хронического тонзиллита — 10 дней, бронхопневмонии — 10–14 дней. Средняя возрастная доза препарата — 40 мг/кг/сут в 2–3 приема. При тяжелом течении инфекции доза препарата Флемоксин Солютаб® увеличивается до 60 мг/кг/сут в 3 приема).
Активное клиническое использование полусинтетических пенициллинов привело к быстрому распространению плазмидной резистентности к ним грамотрицательной флоры. Не прошло и 10 лет, как к только что внедренным в клиническую практику ампициллину и амоксициллину сформировался высокий уровень резистентности большинства микробов [13]. В этой связи необходимо отметить, что немалую долю — до 30–40 % популяции — составляют часто и длительно болеющие респираторными заболеваниями дети, нередко страдающие хроническими заболеваниями: хроническим тонзиллитом, фарингитом, синуситом, аденоидитом, рецидивирующим отитом, рецидивирующим бронхитом и т.д. У таких детей ОРВИ достаточно часто сопровождается обострением основного заболевания и развитием инфекционных осложнений [14]. Именно для данной категории детей характерны повторные пневмонии и госпитализации, неоднократные курсы антибактериальной терапии, что формирует антибиотикорезистентность этиологически значимой флоры и изменяет спектр ее чувствительности к антибиотикам [15, 16].
В начале 70-х годов из культуры Streptomyces clavuligeris был получен первый мощный ингибитор b-лактамаз — клавулановая кислота [17]. А в 1981 г. в клинической практике появился первый комбинированный препарат, содержащий амоксициллин и клавулановую кислоту, — амоксиклав.
Клавулановой кислоте свойственно подавление активности b-–лактамаз бактерий благодаря наличию в ее структуре b-лактамного кольца. Она образует с b-лактамазой комплекс, предотвращающий инактивацию антибиотика. Более того, клавулановая кислота препятствует росту антибиотикорезистентности микробов в дальнейшем. Впоследствии получены данные, что сочетание амоксициллина и клавулановой кислоты восстанавливает противомикробные свойства антибиотика по отношению к H.influenzae, Moraxella сatarrhalis, стафилококкам, гонококкам, неспорообразующим анаэробам, а также способствует появлению активности препарата к ряду грамотрицательных микроорганизмов, ранее имеющих природную резистентность к пенициллинам [18]. Амоксициллин/клавуланат имеет высокую биодоступность при энтеральном приеме, хорошо проникает практически во все ткани и жидкости организма, что определяет высокую концентрацию антибиотика в зоне микробного поражения. Согласно многочисленным исследованиям амоксициллин/клавуланат достаточно хорошо переносится детьми различного возраста — нежелательные явления при применении антибиотика развиваются весьма редко [19].
За более чем 30 лет использования амоксициллина/клавуланата в лечении инфекционных заболеваний доказана высокая клиническая эффективность препарата у пациентов различного возраста, в том числе и у детей. Такое «долгожительство» антибиотика стало возможным благодаря совокупности его бактерицидного механизма действия, широкого спектра активности, включающего большую часть бактерий-продуцентов b-лактамаз, благоприятного профиля безопасности и выгодных фармакодинамических и фармакокинетических параметров. Кроме того, амоксициллин/клавуланат так же, как и незащищенный амоксициллин, сохраняет высокую активность в отношении S.pneumoniae. Амоксициллин/клавуланат остается эффективным и против так называемых проблемных возбудителей: H.influenzae, M.catarrhalis и микроорганизмов из семейства Enterobacteriaceae (в первую очередь E.coli и K.pneumoniae), которые не только продуцируют b-лактамазы, но и обладают другими механизмами резистентности.
В настоящее время благодаря множеству контролируемых клинических исследований с участием десятков тысяч пациентов амоксициллин/клавуланат является одним из наиболее изученных антибиотиков в мире. Высокая активность препарата по отношению как к грамположительной, так и к грамотрицательной флоре, низкий риск развития побочного действия, делают амоксициллин/клавуланат одним из наиболее популярных антибактериальных препаратов, применяемых в педиатрии, в частности, при лечении заболеваний органов дыхания.
В последние годы в педиатрической практике широко используется форма амоксициллина/клавуланата — Флемоклав Солютаб®. Отличительной чертой препарата является создание оптимальных концентраций активных компонентов в очаге инфекции за счет максимально полного и предсказуемого всасывания амоксициллина и клавулановой кислоты в желудочно-кишечном тракте. С клинической точки зрения это означает, что диспергируемая лекарственная форма обеспечивает более стабильное и прогнозируемое терапевтическое действие и способствует минимизации вероятности развития нежелательных лекарственных реакций, в частности развития диареи и диспептических расстройств [22].
Помимо прочего, новая форма амоксициллина/клавуланата — диспергируемые таблетки Солютаб — позволяет максимально улучшить комплаентность: таблетки можно принимать разными способами — проглотить целиком или растворить в воде. Лучшая переносимость амоксициллина/клавуланата в форме Солютаб по сравнению с оригинальным препаратом у детей и взрослых была продемонстрирована в ряде исследований [23–26].
Суточная доза обычно составляет 20–30 мг амоксициллина и 5–7,5 мг клавулановой кислоты на 1 кг массы тела.
При тяжелых инфекциях эти дозы можно удваивать (максимальная суточная доза составляет 60 мг амоксициллина и 15 мг клавулановой кислоты на 1 кг массы тела). Взрослым и детям с массой тела более 40 кг препарат назначают по 500/125 мг 3 р/сут. При тяжелых, хронических, рецидивирующих инфекциях эту дозу можно удвоить. Продолжительность лечения зависит от тяжести инфекции и без необходимости не должна превышать 14 дней.
Исследования последних лет указывают на возрастающую роль в развитии бронхолегочных заболеваний у детей иных внутриклеточных пневмотропных возбудителей, таких как Mycoplasma pneumoniae, Chlamydophila pneumoniae, респираторные вирусы и дp. Термин «атипичные пневмонии», обусловленные данными возбудителями, был введен 20–30 лет назад в связи с их различным в сравнении с «типичными», вызываемыми внеклеточными агентами — стрептококками, стафилококками и т.д., течением, а также трудностью и редкостью их выявления в прошлые годы. Сегодня ситуация изменилась…
Согласно многочисленным данным, в т.ч. полученным нами в 2001–2012 гг., отмечается значимый рост распространенности патологии органов дыхания у детей и взрослых, вызываемой внутриклеточными персистирующими микроорганизмами — Chlamydia trachomatis, Ch.pneumoniae, Myсoplasma pneumoniae, Legionella pneumoniae. Согласно [27–31], указанные возбудители пневмонии у детей в возрасте 1–6 месяцев выявляются более чем у 20 %, чаще это Ch.trachomatis, реже — Mycoplasma hominis. Ch.pneumoniae и M.pneumoniae определяются более чем у трети детей, больных внебольничной пневмонией, в возрасте от 1 года до 6 лет. В школьном возрасте (7–15 лет) частота пневмоний, вызываемых данными инфекционными агентами, составляет 24 и 22 % соответственно, чаще в ассоциации с внеклеточными бактериями — стрептококком, гемофильной палочкой, стафилококком. В методических рекомендациях «Внебольничная пневмония у детей: распространенность, диагностика, лечение и профилактика», изданных при участии большого количества экспертов стран СНГ в 2011 году, представлены аналогичные данные [32]. Следует подчеркнуть, что почти у каждого второго больного отмечается ассоциация пневмококковой и хламидийной или микоплазменной инфекции [33].
Рекомендованные в качестве начальной терапии респираторных инфекций b-лактамы обладают высокой терапевтической активностью к S.pneumoniae, H.influenza и M.сatarrhalis. Вместе с тем данный класс антибактериальных препаратов имеет весьма ограниченную активность в отношении хламидий, вызывающих треть острой патологии респираторного тракта у детей [34]. Хотя b-лактамные антибиотики подавляют рост хламидий in vitro, однако вызывают их L-подобную трансформацию и способствуют развитию персистентной инфекции, поэтому не рекомендованы для лечения хламидийной инфекции. Более того, предварительное применение b-лактамов у больных с хламидийной инфекцией значимо снижает эффективность последующего применения адекватной антибактериальной терапии.
Среди антибактериальных препаратов рациональной альтернативой b-лактамам в лечении респираторных инфекций, особенно в случаях заболеваний хламидийной и микоплазменной этиологии, стали макролиды, которые за счет высокой эффективности и относительной безопасности являются одним из наиболее интенсивно развивающихся классов антибиотиков. Они имеют широкий спектр антимикробной активности и благоприятные фармакокинетические свойства, сочетают высокую эффективность в лечении инфекций и хорошую переносимость пациентами. Так, клинико-бактериологический мониторинг определения чувствительности основных пневмотропных бактерий, проведенный в НИИ педиатрии НЦЗД РАМН, позволил выявить, что при заболеваниях органов дыхания у детей St.pneumoniae и H.influenzae сохраняют высокую чувствительность к макролидам [35]. На основании этого в клиническом руководстве Национального центра нормативной документации США лечение внебольничных пневмоний у детей 5 лет и старше рекомендовано проводить макролидами, а в случаях тяжелого течения заболевания сочетать их с b-лактамными антибиотиками [36].
Вместе с высокой эффективностью применения макролидов в последние годы появились данные о росте к ним микробной резистентности, в частности кокковой флоры [37]. Вместе с тем частота выявляемой резистентности флоры к разным макролидам различается: резистентность пневмококков и пиогенного стрептококка к 14- и 15-членным препаратам в 2–4 раза выше, чем к 16-членным, что связано со способностью последних противостоять эффлюксному механизму устойчивости бактерий [38]. Это в полной мере относится к одному из представителей 16-членных макролидов — джозамицину.
Согласно проведенному российскими коллегами исследованию чувствительности бактериальной флоры к антибиотикам ПеГАС-III (2006–2009 гг.) выявлено, что джозамицин обладает максимальной активностью среди всех макролидов в отношении S.pneumoniae [39]. Получены данные о наиболее высокой активности джозамицина среди всех 16-членных макролидов и в отношении других стрептококков [40]. В крупном постмаркетинговом исследовании эффективность джозамицина при лечении внебольничной пневмонии достигала 96,5 % с хорошей переносимостью и быстрым развитием клинического эффекта [41].
Среди положительных эффектов применения 16–членных макролидов, и в частности джозамицина, отмечается их большая безопасность в сравнении с 14- и 15-членными. Так, они в меньшей степени воздействуют на печеночные оксидазы, а значит, реже вызывают неблагоприятные взаимодействия со многими лекарственными средствами, в частности с теофиллинами, антиаритмическими средствами, дигоксином, иммунотропными средствами и др. Получены данные о значимо менее выраженном ингибирующем влиянии джозамицина на микросомальные ферменты печени [42].
Кроме того, достаточно хорошо известен мотилиноподобный эффект макролидов и их способность к стимулированию моторики кишечника с развитием рвотного и диарейного синдрома у детей. В частности, описаны случаи развития пилоростеноза при применении 14- и 15-членных макролидов, в т.ч. и азитромицина [43]. В связи с этим в лечении детей первых месяцев жизни рекомендовано использовать 16-членные макролиды, практически лишенные прокинетического действия, в частности джозамицин. Кроме того, следует отметить, что в отличие от других макролидов пища не влияет на фармакокинетику джозамицина, что не влияет на его дозирование.
В Украине зарегистрирована новая растворимая диспергируемая форма джозамицина — Вильпрафен Солютаб. Главный принцип технологии Солютаб описан в данной работе выше.
Суточная доза Вильпрафена Солютаб для детей старше 5 лет назначается из расчета 40–50 мг/кг массы тела ежедневно, разделенная на 2–3 приема. Для взрослых и подростков в возрасте старше 14 лет — 1–2 г в 2–3 приема. В случае необходимости доза может быть увеличена до 3 г/сутки. Продолжительность лечения Вильпрафеном Солютаб составляет 5–21 день в зависимости от характера и тяжести инфекции.
Диспергируемые таблетки Вильпрафен Солютаб могут быть приняты различными способами: таблетку можно проглотить целиком, запивая водой, или предварительно, перед приемом, растворить в воде. Таблетки следует растворять в 20 мл воды. Перед приемом следует тщательно перемешать образовавшуюся суспензию.
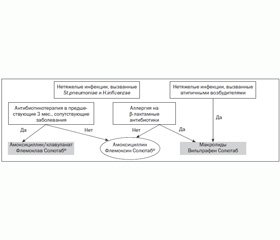
Таким образом, при выборе антибактериальной терапии детей с острыми бактериальными заболеваниями органов дыхания необходимо учитывать чувствительность к антибиотикам и характер этиологически значимой флоры, состояние преморбидного фона ребенка, тяжесть патологического процесса. У эпизодически болеющих детей, с редким применением лечения антибактериальными средствами, для стартовой терапии острых заболеваний органов дыхания бактериальной этиологии используются аминопенициллины (рис. 1).
В случаях, когда заболевшие дети имели в анамнезе частую респираторную заболеваемость, повторные пневмонии и прием антибиотиков в анамнезе в предыдущие 3 месяца, препаратами выбора являются защищенные аминопенициллины. При подозрении на атипичную этиологию (микоплазменную, хламидийную) инфекции показаны макролиды, в частности джозамицин. Следует отметить, что применение лекарственной формы этих препаратов, выполненной по технологии Солютаб, отличается лучшей фармакодинамикой, безопасностью и удобством использования.
1. Abraham E.P., Chain E. An enzyme from bacteria able to destroy penicillin // Nature. — 1940. — 373. — 837.
2. Rolinson G.N. Forty years of b-lactam research // J. Antimicrob. Chemother. — 1998. — 41. — 589–603.
3. Таточенко В.К. Рациональная терапия ОРЗ // Лечащий врач. — 2011. — № 8.
4. Юлиш Е.И., Чернышева О.Е., Кривущев Б.И., Глинская Е.В. Рациональная антибактериальная терапия — условие эффективности лечения острого среднего отита у детей раннего возраста // Здоровье ребенка. — 2013. — № 3. — С. 56–59.
5. World Health Organisation. Cough and cold remedies for the treatment of acute respiratory infections in young children. — WHO/FCH/CAH/01.02. WHO.2001.
6. Strengell T., Uhari M., Tarkka R. et al. Antipyretic agents for preventing recurrences of febrile seizures: randomized controlled trial // Arch. Pediatr. Adolesc. Med. — 2009 Sep. — 163(9). — 799–804.
7. Юлиш Е.И., Балычевцева И.В., Гадецкая С.Г. Диспергируемая лекарственная форма амоксациллина в лечении нетяжелых внебольничных пневмоний у детей // Здоровье ребенка. — 2013. — № 2. — С. 59–62.
8. Meropol S.B., Localio A.R., Metlay J.P. Risks and benefits associated with antibiotic use for acute respiratory infections: a cohort study // Ann. Fam. Med. — 2013. — 11(2). — 165–72.
9. Баранов А.А., Богомильский М.Р., Волков И.К., Геппе Н.А., Козлов Р.С., Козлова Л.В., Коровина Н.А., Манеров Ф.К., Мизерницкий Ю.Л., Намазова Л.С., Насонова В.А., Самсыгина Г.А., Сергеева Т.В., Спичак Т.В., Страчунский Л.С., Таточенко В.К., Якушин С.Б. Практические рекомендации по применению антибиотиков у детей в амбулаторной практике // Современные клинические рекомендации по антимикробной терапии. — Смоленск: МАКМАХ, 2007. — Вып. 2.
10. Татотченко В.К. Флемоксин Солютаб — оптимальная форма амоксициллина // Детский доктор. — 2001. — № 1. — С. 42–44.
11. Бережной В.В., Орлюк Б.И., Козачук В.Г., Аносова Л.Г., Гилевич Ю.Л. Опыт применения антибиотика Флемоксин Солютаб в амбулаторном лечении детей с инфекциями лор-органов и бронхолегочной системы // Здоровье Украины. — 2003. — № 70.
12. Богомильский М.Р. Острое воспаление среднего уха в детском возрасте // Consilium Medicum. Прил. Педиатрия. — 2008. — 1. — 80–5.
13. Anthonisen N.R., Manfreda J., Warren C.P. et al. Antibiotic therapy in exacerbations of chronic obstructive pulmonary disease // Ann. Intern. Med. — 1987. — 106. — 196–204.
14. Самсыгина Г.А. Амоксициллин клавуланат в лечении заболеваний респираторного тракта у детей // Педиатрия. — 2007. — Т. 9, № 1.
15. Самсыгина Г.А., Дудина Т.А., Овечкина И.В. и др. Воздействие амоксициллина клавуланата на состояние микробиоценоза кишечника // Тез. докл. IХ Российского национального конгресса «Человек и лекарство». Москва, 8–12 апреля 2002. — С. 141.
16. Юлиш Е.И., Чернышева О.Е., Глинская Е.В. Выбор антибактериальной терапии при неосложненных формах респираторных бактериальных заболеваний у детей // Здоровье ребенка. — 2013. — № 1.
17. Reading C., Cole M. Ctavulanic acid: a beta-lactamase-inhibiting beta-lactam from Streptomyces clavuligerus // Antimicrob. Agents. Chemother. — 1977. — 11(5). — 852–7.
18. Зайцев А.А., Синопальников А.И. Защищенные аминопенициллины: эпоха ренессанса лактамов // РМЖ. — 2007. — Т. 15, № 7. — С. 572.
19. Neu H.C., Wilson A.P.R., Gruneberg R.N. Amoxycillin/clavulanic acid: a review of its efficacy in over 38,500 patients from 1979 to 1992 // J. Chemother. — 1993. — 5. — 67–93.
20. Wald E.R., Nash D., Eickhoff J. Effectiveness of Amoxicillin/Clavulanate Potassium in the Treatment of Acute Bacterial Sinusitis in Children // Pediatrics. — 2009. — 124. — 9–15.
21. Metz-Gercek S., Maieron A., Strau R. et al. Ten years of antibiotic consumption in ambulatory care: Trends in prescribing practice and antibiotic resistance in Austria // BMC Infectious Diseases 2009. — http://www.biomedcentral.com/1471-2334/9/61.
22. Карпов О.И., Рязанцев С.В., Тихомирова И.А. Путь повышения эффективности и переносимости антибиотикотерапии при синусите у детей // Детские инфекции. — 2006. — № 3. — С. 57–60.
23. Гучев И.А., Козлов Р.С. Безопасность и эффективность различных форм амоксициллина/клавулановой кислоты при инфекциях нижних дыхательных путей у взрослых: открытое проспективное рандомизированное исследование // Пульмонология. — 2008. — 2. — 73–80.
24. Guchev I.A., Ratchina S.A., Kozlov R.S. Efficacy and safety of novel amoxicillin/clavulanic acid formulation versus originator film–coated tablets in adult patients with lower respiratory tract infections // 18th European Congress of Clinial Microbiology and Infectious Diseases. — 2008 19–22, Apr. — Barcelona, Spain; 2008.
25. Sourgeons H., Steinbrede H., Verschoor J.S., Bertola M.A., Rayer B. Bioequivalence study of a novel Solutab tablet formulation of amoxicillinclavulanic acid versus the originator film-coated tablet // International journal of clinical pharmacology and theraupetics. — 2001. — 39. — 57–60.
26. Woodhead M., Blasi F., Ewig S. et al. Guidelines for the management of adult lower respiratory tract infections // Eur. Respir. J. — 2005. — 26. — 1138–80.
27. Юлиш Е.В., Самойленко И.Г., Бухтияров Э.В., Коринева Л.С. Роль хламидийной инфекции в заболевании органов дыхания у детей раннего возраста // Педіатрія, акушерство та гінекологія. — 2004. — № 3. — С. 178–179.
28. Юлиш Е.И., Подоляка В.Л., Бухтияров Э.В., Коринева Л.С. Изменение этиологической структуры возбудителей внебольничных пневмоний и их чувствительности к антибиотикам у детей в течение пяти лет (2001–2006 гг.) // Здоровье ребенка. — 2006. — № 2. — С. 11–15.
29. Юлиш Е.И. Макролиды в лечении инфекций органов дыхания у детей // Medicus Amicus. — 2007. — № 2.
30. Юлиш Е.И., Коринева Л.С. Оптимизация лечения внебольничных пневмоний у детей с хламидофильной инфекцией и кандидозом дыхательных путей // Врачебная практика. — 2007. — № 6(60). — С. 92–96.
31. Юлиш Е.И., Волосовец А.П., Абатуров А.Е. Хламидиоз у детей. — Донецк — Киев — Днепропетровск, 2009. — 226 с.
32. Внебольничная пневмония у детей: распространенность, диагностика, лечение и профилактика. — Россия, 2011. — 63 с.
33. Ушкалова Е.А. Макролиды в фармакотерапии внебольничных пневмоний // Трудный пациент. — 2006. — № 4.
34. Marrie T.J., Peeling R.W., Reid T., De Carolis E., Canadian Community-Acquired Pneumonia Investigators. Chlamydia species as a cause of community-acquired pneumonia in Canada // Eur. Respir. J. — 2003. — Vol. 21. — P. 779–784.
35. Середа Е.В., Катосова Л.К. Место азитромицина в педиатрической практике // Лечащий врач. — 2008. — № 9.
36. Mandell L.A., Wunderink R.G., Anzueto A. et al. Infectious Diseases Society of America; American Thoracic Society. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults // Clin. Infect. Dis. — 2007. — 44(Suppl. 2). — S27–S72.
37. Таточенко В.К. Джозамицин в педиатрической практике // Педиатрия. — 2011. — Т. 90, № 5. — С. 123–128.
38. Buxbaum A., Forsthuber S., Graninger W., Geogropoulos A. on behalf of The Austrian Bacterial Surveilance Network. Serotype distribution and antimicrobial resistance of Streptococcus pneumonia in Austria // J. Antimicrob. Chemother. — 2004. — 54. — 247–250.
39. Козлов Р.С., Сивая О.В., Кречикова О.И. и др. Динамика резистентности Streptococcus pneumoniae к антибиотикам в России за период 1999–2009 гг. Результаты многоцентрового проспективного исследования ПеГАС // Клин. микробиол. антимикроб. химиотер. — 2010. — 12(4). — 329–341.
40. Сидоренко С.В., Грудинина С.А., Филимонова О.Ю. и др. Резистентность к макролидам и линкозамидам среди Streptococcus pneumoniae и Streptococcus pyogenes в Российской Федерации // Клин. фармакол. и терапия. — 2008. — 17(2). — 1–4.
41. Lozano R., Balaguer A. Josamycin in the treatment of bronchopulmonary infections // Clin. Ther. — 1991. — 13(2). — 181–288.
42. Рачина С.А. и др. Группа макролидов / Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. — Смоленск: МАКМАХ, 2007. — 101–110.
43. Morrison W. Infantile hypertrophic pyloric stenosis in infants treated with azithromycin // Pediatr. Infect. Dis. J. — 2007. — 26(2). — 186–188.

/90/90.jpg)