Журнал «Здоровье ребенка» 3 (54) 2014
Вернуться к номеру
Досвід застосування цефіксиму в лікуванні інфекцій сечової системи у дітей
Авторы: Леженко Г.О., Пашкова О.Є. - Запорізький державний медичний університет; Рудова О.І., Рубанова Є.І. - КУ «Запорізька обласна клінічна дитяча лікарня ЗОР»
Рубрики: Нефрология, Педиатрия/Неонатология, Урология
Разделы: Клинические исследования
Версия для печати
Вивчена ефективність застосування препарату Цефікс (цефіксим) як монотерапії гострого циститу, гострого та хронічного пієлонефриту у дітей. Показано, що застосування цефіксиму як засобу антибактеріальної терапії при циститі та неускладненому перебігу пієлонефриту у дітей є етіологічно обґрунтованим, високоефективним та безпечним.
Изучена эффективность применения препарата Цефикс (цефиксим) в качестве монотерапии острого цистита, острого и хронического пиелонефрита у детей. Показано, что применение цефиксима в лечении цистита и пиелонефрита с неосложненным течением у детей является этиологически обоснованным, высокоэффективным и безопасным.
There has been investigated the efficiency of Cefix (cefixim) application as a monotherapy of acute cystitis, acute and chronic pyelonephritis in children. Cefixime was found to be etiologically reasonable, high-performance and safe for the therapy of non-complicated cystitis and pyelonephritis in children.
цистит, пієлонефрит, пероральні цефалоспорини, цефіксим, діти.
цистит, пиелонефрит, пероральные цефалоспорины, цефиксим, дети.
cystitis, pyelonephritis, oral cephalosporins, cefixime, children.
Статья опубликована на с. 12-16
Інфекції органів сечової системи є одним із найчастіших захворювань у дітей. Щорічно в світі серед дітей реєструється близько 50 млн випадків інфекцій сечовивідних шляхів [3]. Поширеність інфекцій сечової системи згідно з епідеміологічним дослідженням, проведеним в Україні, становить 19,1 на 1000 дитячого населення, за даними медичної статистики, — 29,5. Інфекції сечової системи зустрічаються в 77–89 % випадків госпіталізації дітей у нефрологічні стаціонари [1].
Лікування інфекцій сечової системи (ІСС) буває успішним не в усіх хворих. У найближчі 3 місяці після першого епізоду інфекції сечової системи рецидивують у більшої частини пацієнтів, що зумовлено особливостями будови органів сечостатевої системи, кровопостачання, іннервації сечовивідних шляхів у дітей, а також віковою дисфункцією імунної системи дитини та властивостями мікроорганізмів, що викликають дану патологію [4]. У зв’язку з цим нерідко потрібне проведення повторних курсів антибактеріальної терапії. Від того, наскільки правильно вибрана стартова антимікробна терапія ІСС, залежать у кінцевому підсумку ефективність лікування та прогноз хвороби [5, 8, 12, 14].
Швидке формування і значна поширеність антибіотикорезистентних та антибіотикозалежних штамів мікроорганізмів, підвищення питомої ваги мікробних асоціацій диктують необхідність удосконалення антибактеріальної терапії, пошуку нових високоефективних лікувальних та профілактичних методів з використанням антибіотиків максимально широкого спектра дії [17].
Головним чинником, що визначає резистентність бактерій до антибіотиків, є здатність до продукції мікроорганізмами бета–лактамаз, які інгібують активність антибіотиків. Відомо, що до 47–71 % видів кишкової палички, 80 % стафілококів, 58–100 % видів клебсієл здатні до синтезу бета–лактамаз, що зумовлює зниження ефективності антибіотикотерапії, що проводиться [9].
Згідно з сучасними рекомендаціями, вибір стартового антибіотика повинен базуватися не тільки на локальних даних мікробіологічних досліджень, але й ураховувати терапевтичну ефективність і безпеку різних антибактеріальних засобів [7, 11, 12]. За даними попередніх років, лікування пієлонефриту у дітей передбачало парентеральне введення антибактеріальних засобів. Однак проведені рандомізовані клінічні дослідження показали, що не менш ефективною є пероральна стартова антибактеріальна терапія, а при тяжкому перебігу найбільш раціональною є ступінчаста терапія, тобто короткі курси (2–4 дні) парентерального введення антибіотика з переходом на пероральний режим уведення [12, 15, 16]. Застосування ступінчастої терапії сприяє зниженню ризику післяін’єкційних ускладнень, додаткового навантаження на медичний персонал і, що дуже важливо для хворої дитини, дозволяє уникнути психоемоційного стресу від внутрішньом’язових ін’єкцій.
Сьогодні фармацевтичний ринок має в своєму розпорядженні достатню кількість антибактеріальних засобів. Незважаючи на те, що антибіотики є високоефективними препаратами, здатними при раціональному використанні врятувати дитині життя, терапія ними завжди є компромісом між бажаною дією препарату і наявністю можливих побічних ефектів.
Типовою помилкою при проведенні антибіотикотерапії інфекцій органів сечової системи є вибір препарату без урахування спектра активності антибіотика, особливостей його фармакокінетики, небажаних лікарських реакцій.
На цьому тлі цефалоспорини по праву займають провідне місце в клінічній практиці лікаря–педіатра, що зумовлено широким спектром антимікробної дії, бактерицидним механізмом дії, базовою захищеністю препаратів від бета–лактамаз порівняно з іншими групами антибактеріальних засобів, доброю переносимістю і невеликою частотою побічних явищ. Важливим для даної групи антибактеріальних препаратів є здатність проникати і накопичуватися у вогнищі запалення в необхідних концентраціях. Механізм дії цефалоспоринів пов’язаний із пригніченням синтезу пептидоглікану клітинної стінки мікроорганізму. При уроінфекціях найчастіше застосовують цефалоспорини III покоління, що активні як до грампозитивних, так і до грамнегативних бактерій, при цьому їх спектр порівняно з першим і другим поколіннями значно розширений у бік грамнегативних бактерій.
Цефалоспорини в основному є препаратами для парентерального застосування і широко використовуються в стаціонарах для лікування різних інфекцій, займаючи одне з провідних місць серед застосованих антибіотиків. Проте останніми роками з’явилися цефалоспорини виключно для перорального застосування. Крім того, згідно з даними професора А.П. Вікторова (2006), алергічні реакції на цефалоспорини зустрічаються значно рідше, ніж на антибіотики пеніцилінового ряду. Залежно від ступеня ризику алергічних реакцій цефалоспорини можливо розмістити в такому порядку: цефтріаксон - цефоперазон - цефокситин - цефтазидин - цефотаксим - цефуроксим [2].
З огляду на це перспективним у лікуванні інфекцій сечовивідної системи як із клінічної, так і з фармакоекономічної точки зору є пероральний цефалоспорин III покоління Цефікс (цефіксим). Вибір даного препарату в лікуванні пієлонефриту у дітей обумовлений перш за все його фармакодинамікою. Цефіксим є високоефективним і безпечним препаратом при застосуванні у дітей із 6 місяців [6, 10]. Зазначений антибіотик характеризується широким спектром дії і високою активністю щодо багатьох грампозитивних і грамнегативних мікроорганізмів: цефіксим за рахунок своєї оригінальної структури проявляє вищу активність, ніж амінопеніциліни і цефалоспорини попередніх поколінь, щодо деяких грампозитивних і грамнегативних бактерій, що продукують бета–лактамази. Важливо підкреслити, що препарат проявляє виражену активність щодо штамів Enterobacteriaceae, зокрема E.coli, Klebsiella spp., Proteus mirabilis — збудників інфекції сечовивідної системи, що продукують плазмідні бета–лактамази широкого спектра, які значно знижують антимікробний потенціал інших ентеральних і парентеральних цефалоспоринів II–III покоління. Слід відзначити, що цефіксим швидко всмоктується в кишково–шлунковому тракті. Його біодоступність становить близько 50 % незалежно від прийому їжі, причому при прийомі разом із їжею всмоктування препарату дещо прискорюється, максимальна концентрація у сироватці досягається через 4 години після вживання. Частина препарату (65 %) зв’язується з білками плазми. Він добре проникає в різні органи і тканини, а його концентрація в сечі не поступається плазмовій. Приблизно половина введеної дози цефіксиму в незміненому вигляді виводиться з сечею протягом доби. Ці фармакокінетичні параметри дозволяють застосовувати препарат усере–дину 1–2 рази на добу.
Метою нашої роботи була оцінка клінічної та бактеріологічної ефективності препарату Цефікс (цефіксим) у лікуванні інфекцій сечової системи у дітей.
Матеріал і методи
Нами було проаналізовано ефективність застосування цефіксиму (Цефікс) у терапії активної стадії інфекції сечової системи 70 дітей, серед яких у 22 хворих було діагностовано гострий цистит, у 28 — гострий пієлонефрит, у 20 — загострення хронічного пієлонефриту. Середній вік пацієнтів становив 10,2 ± 1,1 року. У всіх хворих діагноз був підтверджений даними анамнезу, клініко–лабораторного, рентгенологічного, мікробіологічного обстеження та ультразвукового дослідження органів сечовивідної системи згідно з протоколом МОЗ України (наказ МОЗ України № 627 від 03.11.2008 р.).
До призначення цефіксиму хворі антибактеріальну терапію не отримували. Препарат застосовувався в дозі 8 мг/кг 1 раз або 4 мг/кг 2 рази на добу в комплексі з іншими препаратами патогенетичної та симптоматичної терапії. Тривалість курсу лікування становила: при циститі — 5 діб, при пієлонефриті — 10–14 діб.
Аналіз результатів лікування проводили на основі клінічної оцінки ефективності терапії, а також динаміки об’єктивних досліджень: лабораторних даних, посівів сечі, ультразвукового дослідження нирок. Ефективність лікування оцінювалась як добра, якщо спостерігалося швидке (на 2–гу — 3–тю добу) поліпшення стану хворих: нормалізація або зниження до субфебрильної температури тіла, зникнення болю, зниження лейкоцитозу, нейтрофільозу в аналізі крові, лейкоцитурії та бактеріурії в сечі. Клінічний ефект вважали задовільним, коли спостерігали зменшення вираженості, аж до повного зникнення, клінічних симптомів запального процесу, а позитивна динаміка аналізів крові та сечі наставала в пізніший строк — на 5–6–ту добу від початку лікування. За відсутності суб’єктивної та об’єктивної клініко–лабораторної та інструментальної динаміки в перебігу захворювання результат лікування вважався незадовільним.
Результати та обговорення
Клінічна картина активності процесу в групах дітей, хворих на пієлонефрит, характеризувалася такими симптомами: болі в поперековій ділянці з ураженого боку, підвищення температури тіла, пітливість, головний біль, слабкість, нездужання, нудота, дизуричні розлади у вигляді почастішання сечовипускання, болю при сечовипусканні, імперативних позивів (табл. 1).
Сечовий синдром виявлявся у вигляді нейтрофільної лейкоцитурії > 10/мм3, мікропротеїнурії, бактеріурії > 102/мл КУО при циститі та > 104/мл КУО при пієлонефриті. У загальному аналізі крові в усіх хворих визначався помірний або виражений лейкоцитоз із нейтрофільним зсувом лейкоцитарної формули вліво, збільшення ШОЕ. У 9 (32,1 %) хворих на гострий пієлонефрит та у 12 (60 %) пацієнтів із хронічним пієлонефритом спостерігалася анемія І ступеня.
Ультразвукова картина гострого циститу характеризувалася нерівномірним стовщенням стінки сечового міхура, в просвіті якого визначалася дрібнодисперсна суспензія.
При ультразвуковому дослідженні нирок у 21 (75,0 %) хворого на гострий пієлонефрит спостерігалося збільшення розмірів ураженої нирки, у 20 (71,4 %) пацієнтів — розширення ниркової миски, у 19 (67,9 %) — підвищення ехогенності збірної системи нирок та у 12 (42,9 %) — згладженість паренхіми. У 15 (53,6 %) хворих процес був правобічний, у 10 (35,7 %) дітей — лівобічний та у 3 (10,7 %) пацієнтів — двобічний.
У 18 (90,0 %) хворих із загостренням хронічного пієлонефриту при ультразвуковому дослідженні нирок було діагностовано різні аномалії розвитку сечової системи: деформація чашково–мискової системи — у 6 (30,0 %) пацієнтів, подвоєння чашково–мискового комплексу — у 3 (15,0 %), гідронефроз — у 4 (20,0 %), підковоподібна нирка — в 1 (5,0 %), гіпоплазія нирок — у 2 (10,0 %), агенезії нирки — в 1 (5,0 %), тазова дистонія нирки — в 1 (5,0 %) хворого. Збільшення розмірів нирки як наслідок запалення зустрічалось у 13 (65,0 %) хворих, розширення чашково–мискової системи спостерігалось у 17 (85,0 %) дітей, які знаходилися під спостереженням.
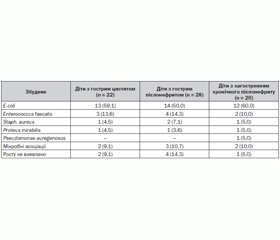
Аналіз структури мікробного складу сечі у дітей, хворих на гострий цистит (табл. 2), показав наявність позитивних посівів до лікування у 20 (90,9 %) пацієнтів.
У 13 (59,1 %) випадках виявлена E.coli, у 3 (13,6 %) — Enterococcus faecalis, в 1 (4,5 %) — Staph. аureus, в 1 (4,5 %) випадку виявлено Proteus mirabilis та у 2 (9,1 %) випадках були виявлені мікробні асоціації, що були представлені в основному поєднанням таких збудників: E.coli, Staph. epidermidis, Strept. faecalis, Klebsiella spp. і Enterococcus faecalis.
При проведенні аналізу структури збудників захворювання у хворих на гострий пієлонефрит (табл. 2) до лікування позитивні посіви становили 85,7 % (24 дитини).
У 4 (14,3 %) пацієнтів при бактеріологічному дослідженні не було встановлено етіологічних чинників. У 14 (50,0 %) випадках виявлена E.coli, у 4 (14,3 %) хворих виділено Enterococcus faecalis, у 2 (7,1 %) — Staph. аureus, в 1 (3,6 %) — Proteus mirabilis, в 3 (10,7 %) випадках були виявлені мікробні асоціації, що представлені поєднанням E.coli та Strept. faecalis, Klebsiella spp. і Enterococcus faecalis.
У структурі збудників хронічного пієлонефриту в пацієнтів, які перебували під наглядом, також домінувала E.сoli (60,0 %). Enterococcus faecalis виявлений у 2 (10,0 %) хворих, Proteus mirabilis — в 1 (5,0 %), Staph. аureus — в 1 (5,0 %), ще в 1 (5,0 %) пацієнта було виділено з сечі Pseudomonas auregenosus. Виявлені мікробні асоціації при бактеріологічному дослідженні сечі у 2 дітей (10,0 %) були представлені грамнегативною флорою. В одному випадку (5,0 %) росту мікроорганізмів сечі не виявлено.
Аналіз чутливості мікрофлори сечі до антибактеріальних препаратів показав домінуюче значення цефалоспоринів III покоління, що необхідно враховувати при визначенні емпіричної стартової терапії інфекції сечовивідної системи у дітей.
На тлі лікування Цефіксом у всіх пацієнтів, хворих на цистит та гострий пієлонефрит, та у 19 (95,0 %) хворих із хронічним пієлонефритом відмічалася позитивна динаміка. При цьому у 20 (90,9 %) хворих на гострий цистит, у 25 (89,3 %) пацієнтів із гострим пієлонефритом та у 16 (80,0 %) дітей із хронічним пієлонефритом ефективність лікування оцінювалася як висока, що супроводжувалося швидкою регресією інтоксикаційного синдрому та нормалізацією лабораторних показників. Уже на 2–гу —3–тю добу від початку лікування температура тіла знизилася до нормальної, зникли болі у поперековій ділянці, поліпшився апетит, поступово зникали дизуричні явища. На тлі проведеної терапії паралельно з позитивною динамікою клінічних симптомів відзначено відновлення лабораторних показників, що свідчило про зменшення запального процесу в сечовивідній системі. На 4–5–й день на тлі терапії Цефіксом спостерігалося зменшення лейкоцитурії з повною ліквідацією на 7–8–й день при гострому та на 9–10–й день при хронічному пієлонефриті, на 10–й день лікування нормалізувалися показники загального аналізу крові. Задовільний результат лікування зафіксовано лише у 2 (9,1 %) хворих на гострий цистит, 3 (10,7 %) дітей, хворих на гострий пієлонефрит, та у 3 (15,0 %) пацієнтів із хронічним пієлонефритом, у яких динаміка клініко–лабораторних показників була більш повільною (на 4–5–й день), а окремі симптоми захворювання, зміни лейкограми, лейкоцитурія простежувались на 7–8–му добу спостереження. Причому у більшості хворих результати бактеріологічного дослідження виявилися негативними. Подовження антибактеріальної терапії до 14 діб приводило до повної нормалізації клінічної картини та лабораторних показників. В 1 (5,0 %) пацієнта з загостренням хронічного пієлонефриту не отримано позитивного ефекту від застосування цефіксиму. У нього при бактеріологічному дослідженні сечі було виділено Pseudomonas auregenosus, що потребувало зміни антибактеріального препарату.
Слід зазначити, що за даними контрольного мікробіологічного дослідження на 7–8–му добу лікування в усіх хворих спостерігалася стерилізація сечі, а на 8–10–й день лікування — повна нормалізація клінічного аналізу крові і сечового синдрому. Ультразвуковий моніторинг розмірів нирок та товщини ниркової паренхіми на 10–ту добу зафіксував позитивну динаміку з наближенням цих показників до норми в усіх пацієнтів. Препарат Цефікс добре переносився пацієнтами. На тлі лікування у жодного хворого не відзначено погіршення характеру випорожнень, не виявлено змін рівня трансамі–наз, білірубіну, порушень азотовидільної функції нирок та інших побічних явищ і небажаних реакцій.
Висновки
1. Цефікс (цефіксим) є ефективним та безпечним лікарським засобом із зручним застосуванням (1–2 рази на день), що дозволяє рекомендувати його як базовий препарат в комплексній терапії інфекцій сечовивідної системи у дітей із середньотяжким перебігом захворювання як на догоспітальному етапі, так і в умовах стаціонару.
2. Широкий спектр антибактеріальної дії, резистентність до збудників, що синтезують бета–лактамази, низька токсичність дозволяють застосовувати Цефікс у вигляді монотерапії при циститі та неускладненому перебігу пієлонефриту як стартовий препарат на етапі, коли мікроорганізм–збудник ще не ідентифіковано.
Конфлікт інтересів: не заявлено.
1. Борисова Т.П. Инфекция мочевой системы у детей. Часть I. Причины, механизмы развития, клинические проявления / Т.П. Борисова, И.В. Багдасарова // Здоровье ребенка. — 2007. — № 3. — С. 112–118.
2. Викторов А.П. Побочные действия антибиотиков группы цефалоспоринов в Украине. Итоги 2005 года / А.П. Викторов, К.А. Посохова, Е.В. Матвеева, Н.А. Логвина // Острые и неотложные состояния в практике врача. — 2006. — № 2. — С. 3.
3. Зоркин С.Н. Не допустить рецидива инфекции мочевыводящих путей у детей / С.Н. Зоркин // Consilium Provisorum. — 2006. — Т. 4, № 2. — C. 33–34.
4. Зоркин С.Н. Лечение инфекции мочевыводящих путей у детей / С.Н. Зоркин, Л.К. Катосова, З.Н. Музыченко // Медицинский совет. — 2009. — № 4. — С. 25–30.
5. Зоркин С.Н. Взгляд на антибактериальную терапию у детей с урологической патологией / С.Н. Зоркин, Л.К. Катосова, З.Н. Музыченко // Лечащий врач. — 2010. — № 8. — С. 6–10.
6. Иванов Д.Д. Цефикс в ступенчатой терапии пиелонефрита у детей / Д.Д. Иванов, С.В. Кушниренко // Современная педиатрия. — 2009. — № 6. — С. 127–129.
7. Козлов Р.С. Современные клинические рекомендации по антимикробной терапии. Вып. 2 / Р.С. Козлов, А.В. Дехнич. — Смоленск: МАКМАХ, 2007. — 608 с.
8. Коровина Н.А. Клинические аспекты применения цефалоспориновых антибиотиков в педиатрической практике / Н.А. Коровина, И.Н. Захарова, А.Л. Заплатников. — М., 2000.
9. Коровина Н.А. Практические рекомендации по антибактериальной терапии инфекций мочевой системы внебольничного происхождения у детей / Н.А. Коровина, И.Н. Захарова, Л.С. Страчунский [и др.] // Клин. микробиол. и антимикроб. химиотер. — 2002. — № 4(4). — С. 337–346.
10. Крамарєв С.О. Досвід застосування орального цефалоспорину III покоління цефіксу (цефіксиму) в терапії гострих кишкових інфекцій у дітей / С.О. Крамарєв, О.А. Дмітрієва // Здоровье Украины. — 2007. — № 11–12. — C. 70–71.
11. Шевелев А.Н. Современные аспекты антибактериальной терапии инфекций мочевыводящих путей у детей / А.Н. Шевелев // Фарматека. — 2008. — № 4. — С. 50–55.
12. American academy of pediatrics. Practice Parameter: The Diagnosis, Treatment, and Evaluation of the Initial Urinary Tract Infection in Febrile Infants and Young Children // Pediatrics. — 1999. — Vol. 103, № 4. — P. 843–852.
13. Alper B.S. Urinary Tract Infection in Children. / B.S. Alper, S.H. Curry // American Family Physician. — 2005. — Vol. 72. — P. 2483–2488.
14. Bartkowski D.P. Recognizing UTIs in infants and children. Early treatment prevents permanent damage / D.P. Bartkowski // Postgraduate medicine. — 2001. — Vol. 109, № 1. — P. 177–181.
15. Baumer J.H. Urinary tract infection in children, National Institute for Health and Clinical Excellence. Archives of Disease in Childhood / J.H. Baumer, R.W.A. Jones // Education and Practice. — 2007. — Vol. 92. — P. 189–192.
16. Montini G. Antibiotic treatment for pyelonephritis in children: multicentre randomised controlled non–inferiority trial / G. Montini, A. Toffolo, P. Zucchetta [et al.] // BMJ. — 2007. — Vol. 335. — P. 386–393.
17. Tenover F.C. Глобальная проблема антимикробной резистентности / F.C. Tenover // Русский медицинский журнал. — 1996. — Т. 3, № 4. — C. 217–219.
Рецензенты: заведующий кафедрой педиатрии ЗМАПО, д.м.н., профессор Овчаренко Леонид Сергеевич, заведующая кафедрой факультетской педиатрии ЗГМУ, д.м.н., профессор Недельская Светлана Николаевна.

/14/14.jpg)
/15/15.jpg)