Журнал «Медицина неотложных состояний» 3 (58) 2014
Вернуться к номеру
Профилактика и коррекция гепатоцеребральной недостаточности у пациентов с тяжелыми расстройствами, вызванными злоупотреблением алкоголем
Авторы: Глумчер Ф.С., Стрепетова Е.В., Мухоморов А.Е., Перебийнис М.В. - Национальный медицинский университет имени А.А. Богомольца, кафедра анестезиологии и интенсивной терапии Клиника «Борис», г. Киев
Рубрики: Медицина неотложных состояний, Неврология, Психиатрия
Разделы: Клинические исследования
Версия для печати
В исследовании проведен анализ эффективности коррекции и профилактики гепатоцеребральной недостаточности у пациентов с алкогольной интоксикацией различной степени тяжести. По литературным данным обосновано применение L-орнитина-L-аспартата у данной группы пациентов. Описана и статистически доказана эффективность коррекции печеночной энцефалопатии при применении оригинального L-орнитина-L-аспартата (Гепа-Мерц, «Мерц Фарма ГмбХ и Ко. КГаА»).
У дослідженні проведено аналіз ефективності корекції та профілактики гепатоцеребральної недостатності в пацієнтів з алкогольною інтоксикацією різного ступеня тяжкості. За літературними даними обґрунтуване застосування L-орнітину-L-аспартату в цiєї групи пацієнтів. Описано й статистично доведено ефективність корекції печінкової енцефалопатії при застосуванні оригінального L-орнітину-L-аспартату (Гепа-Мерц, «Мерц Фарма ГмбХ і Ко. КГаА»).
The study analyzes the effectiveness of correction and prevention for hepatocerebral insufficiency in patients with alcohol intoxication of varying severity. According to the literature data there has been substantiated the use of the method in this group of patients. We described and statistically proved effectiveness of correction of hepatic encephalopathy when using the original L-ornithine-L-aspartate (Hepa-Merz, «Merz Pharma GmbH & Co. KGaA»).
гепаторенальный синдром, когнитивные дисфункции, алкогольная интоксикация, гепатоцеребральная недостаточность.
гепаторенальний синдром, когнітивні дисфункції, алкогольна інтоксикація, гепатоцеребральна недостатність.
hepatorenal syndrome, cognitive dysfunctions, alcoholic intoxication, hepatocerebral insufficiency.
Статья опубликована на с. 114-118
Проблема лечения алкогольной интоксикации (АИ) и ее осложнений является очень актуальной для специалистов как многопрофильных стационаров, так и специальных клиник в Украине. Наша страна на 2013 г. уже находится среди лидеров по количеству употребляемого алкоголя на душу населения (после России, Беларуси, Венгрии и Румынии), а по детскому алкоголизму — остается на 1-м месте. В Украине официальная статистика насчитывает до 1 млн алкоголиков, из них, по данным Всемирной организации здравоохранения, 60–70 % — больные с тяжелыми психосоматическими расстройствами, 10 % из которых — пациенты с деменцией [1].
Известно, что АИ развивается вследствие хронического употребления продуктов, содержащих этанол, характеризуется нарушением физиологических, психических (поведенческих) функций, вызывает состояние острого или хронического отравления. Легкая степень интоксикации (концентрация алкоголя от 0,5–1,5 ‰) сопровождается умеренными изменениями, характеризуясь преимущественно эйфорией, отсутствием органических поражений органов и систем. При средней степени АИ (от 1,5 до 2,5 ‰) вариации психофизиологических расстройств достаточно разнообразны: от замедления мышления, смазанной речи, нарушения внимания, ориентировки во времени и пространстве до отсутствия восприятия окружающих, возможности дать правильную оценку происходящему и появления неврологического дефицита. Для неврологических нарушений характерна дискоординация движений, шаткая походка, нарушение речи, ослабление чувствительности; отмечаются вегетативные проявления — покраснение лица, которое сменяется бледностью, возникают тошнота и рвота. У пациентов с тяжелой АИ (от 2,5 до 4 ‰) общее состояние характеризуется потерей сознания с пассивным положением тела, отсутствием реакции на болевые раздражители, сужением зрачков. При концентрации алкоголя в крови больше 4 ‰ нередко происходит остановка дыхания и смерть от гипоксии, хотя при выраженной толерантности у хронических алкоголиков при аналогичной концентрации может сохраняться способность вступать в контакт и отвечать на вопросы. Уже при АИ средней степени определяются тяжелые метаболические расстройства: повышенное образование ацетальдегида — кетоз, ацидоз, который приводит к отеку-набуханию головного мозга (нарушение электролитного баланса — транспорта натрия), гипокалиемия вследствие воздействия на GIRK-каналы (клинически — нарушения сердечного ритма), алиментарный дефицит энергетических соединений, эксайтотоксические эффекты глутамата и аспартата, индуцированные алкоголем, а также прямое гепато- и нейротоксическое действие. Церебральные осложнения наблюдаются в остром состоянии в виде токсической энцефалопатии. При хронической интоксикации развиваются алкогольный делирий, острый галлюциноз, индуцированный алкоголем, и параноидные состояния. При хронических нелеченых состояниях проявляются полинейропатия Вернике, корсаковский психоз, алкогольная деградация [2, 3].
Ведущим патогенетическим фактором тяжелых алкогольных расстройств является нарушение обменных и нейровегетативных процессов, а также повреждение печени. Гепатотоксичность этанола имеет специфические и неспецифические механизмы реализации. Следствием неполноценной работы органа является увеличение содержания в циркулирующей крови аммиака — гипераммониемия. Аммиак считают одним из основных эндогенных нейротоксинов. В физиологических условиях аммиак утилизируется с участием орнитина и аспартата [3–5], подвергаясь метаболизму в печени. В условиях нарушения функции печени клиренс аммиака снижен, с периферическим кровотоком он попадает в головной мозг, при этом проницаемость гематоэнцефалического барьера для аммиака значительно повышается [7]. С повышением уровня аммиака связывают снижение регионарного метаболизма глюкозы, увеличение концентрации продуктов обмена аммиака — a-кетоглутаровой кислоты, накопление глутамина, что непосредственно влияет на степень проявления печеночной энцефалопатии (ПЭ). Наиболее подвержены действию токсинов глиальные элементы. В условиях гипер–аммониемии развиваются характерные для ПЭ изменения астроглии, возникают астроцитоз и гипергидратация клеток. Кроме деполяризации мембран корковых астроцитарных клеток, происходит активация NMDA-рецепторов и нарушается межклеточная передача возбуждения, преимущественно в лобных и височных областях головного мозга [9]. Данным фактом объясняется клиническая картина поведенческих и когнитивных расстройств у пациентов с гепатоэнцефалопатией. Повышение концентрации аммиака приводит к увеличению уровня NO-синтетазы и связанному с этим процессом оксидантному стрессу [7, 9]. При этом отмечается повышение потребления L-орнитина — предшественника NO-синтетазы. В митохондриях перипортальных гепатоцитов функционирует орнитиновый цикл, в котором аммиак связывается с аминокислотами с образованием нетоксичной мочевины, 80 % которой выводится с мочой, 20 % — поступает обратно в желудочно-кишечный тракт, где вновь под действием уреаза-положительных бактерий разлагается до аммиака. Так, дефицит L-орнитина, в свою очередь, приводит к снижению продукции мочевины и нарушению процесса инактивации аммиака.
Повышение концентрации аммиака приводит к увеличению уровня меркаптенов и короткоцепочечных жирных кислот, также стимулируя развитие отека головного мозга. При печеночной недостаточности происходит разобщение работы нейроингибиторной системы гамма-аминомасляной кислоты (ГАМК), что приводит к увеличению проницаемости гематоэнцефалического барьера, нарушению пресинаптического ингибирования высвобождения ГАМК, связанного с уменьшением рецепторов ГАМК-b и высвобождением нейростероидов. Кроме ГАМКергической системы затрагиваются и другие нейротрансмиттерные системы, дофаминергическая и глутаминергическая, путем формирования ложных нейротрансмиттеров (фенилэтаноламин, октопамин, тирамин), которые, замещая истинные нейротрансмиттеры, реализуют свои нейротоксические свойства.
По данным макроскопического исследования, особые изменения у пациентов с печеночной энцефалопатией не выявляются. Однако существуют специфические отличия, характеризующие данную патологию: астроцитоз и гипергидратация клеток, ламинарный или псевдоламинарный некроз коры, образование множественных микрополостей на границе серого и белого веществ головного мозга, в базальных ганглиях и мозжечке, наличие церебральной атрофии. Так, в основе астроцитарной дисфункции лежит внутриклеточный отек без признаков внутричерепной гипертензии, что подтверждается методами нейровизуализации [9].
Терапия пациентов с гепатоцеребральной недостаточностью многогранна и достаточно сложна. Подход к терапии ПЭ, вне зависимости от профиля пациента, должен быть комплексным, включая лечение основного заболевания, возможное хирургическое вмешательство и/или сбалансированную инфузионную терапию. Учитывая механизм развития ПЭ, токсическое влияние аммиака и других биологически активных веществ на головной мозг в условиях дисфункции печени, обоснованным является применение препаратов, точка приложения которых — ускорение обезвреживания аммиака путем активизации синтеза мочевины.
Основными направлениями лечения пациентов с нарушенной функциональной способностью печени вследствие алкогольной интоксикации и развившимися на этом фоне церебральными расстройствами мы считаем следующие [4–6]:
1) детоксикация (инфузионная терапия, Гепа-Мерц, энтеросорбция);
2) седация (гипнотики — пропофол, дексдор; бензодиазепины — сибазон);
3) коррекция функционального состояния печени (гепатопротекторные средства: Гепа-Мерц, глутаргин, гепасол-нео);
4) ксенон (антиэксайтотоксическое действие, нейропротекция и облегчение седации);
5) нейролептики (галоперидол — купирование галлюцинаторного синдрома);
6) симптоматическая коррекция.
Одним из новых препаратов, применяющихся при алкогольных расстройствах в целях коррекции биохимического гомеостаза, является препарат Гепа-Мерц (оригинальный L-орнитин-L-аспартат) — стимулирующий орнитин-аспартатный комплекс обезвреживания аммиака — цикла синтеза мочевины. В некоторых исследованиях, проведенных большей частью на территории постсоветского пространства, отмечалось достаточно эффективное действие данного препарата не только у пациентов с ПЭ, индуцированной первичным повреждением печени, но и в предоперационной подготовке больных с высокой степенью риска развития печеночных осложнений после оперативного вмешательства. Отдельного внимания заслуживают мультицентровые исследования по применению оригинального L-орнитин-L-аспартата (Гепа-Мерц, «Мерц Фарма ГмбХ и Ко. КГаА») в комплексной терапии острого панкреатита при критическом нарушении функции печени [10, 11]. Гипоаммониемическое действие препарата, в состав которого входят L-орнитин и L-аспартат, связано со стимуляцией карбамоилфосфатсинтетазы — ведущего фермента синтеза мочевины в перипортальных гепатоцитах (L-орнитин), а также стимуляцией глутаминсинтетазы в перивенозных гепатоцитах, мышцах и головном мозге (L-аспартат). Кроме того, L-орнитин и L-аспартат сами являются субстратами, участвующими в синтезе мочевины [3, 5]. Данное обстоятельство послужило основанием для включения препарата Гепа-Мерц в комплексную терапию пациентов с гепатоцеребральной недостаточностью, индуцированной воздействием алкоголя [11].
В условиях интоксикации алкоголем особенно актуальными являются нормализация функции печени и профилактика развития гепатоцеребральной недостаточности, так как, учитывая повреждающее действие алкоголя на головной мозг, развитие психоорганической симптоматики может иметь необратимый характер.
Целью нашего исследования явилась оптимизация коррекции гепатоцеребральной недостаточности у пациентов с алкогольными расстройствами с включением в комплекс интенсивной терапии оригинального препарата L-орнитин-L-аспартата (Гепа-Мерц, «Мерц Фарма ГмбХ и Ко. КГаА»).
Материалы и методы
Основную группу составили 27 больных, которым в комплекс ИТ включили Гепа-Мерц в дозе 20 г действующего вещества (4 ампулы) в течение 6 дней. В контрольную группу вошли 10 пациентов с обычной терапией. Изучали сроки пребывания в отделении интенсивной терапии, необходимость в седации по шкале RASS, когнитивные функции (шкала MMSE), динамику основных лабораторных данных, характеризующих печеночную недостаточность (трансаминаза, мочевина, креатинин, билирубин), наличие или отсутствие делирия по шкале CAM-ICU.
У всех пациентов наблюдали типичные симптомы АИ с нарушением сознания, вегетативными расстройствами, расстройствами гемодинамики: выраженную тахикардию, гипертензию, сменяющуюся гипотензией, а также нарушения водно-электролитного баланса, признаки печеночно-почечной недостаточности (повышение уровня трансаминаз, креатинина и мочевины более чем в 2 раза).
Обсуждение результатов
В динамике по оценке восстановления печеночных ферментов лечение больных основной группы показало себя как более эффективное. На 1-е — 3-и сутки статистически значимых различий по уровню аланинаминотрансферазы (АЛТ) не выявлено, показатели находились в диапазоне 395–430 ммоль/л. После 2 дней интенсивной терапии происходит существенное снижение уровня АЛТ, но более выраженная нормализация показателя наблюдалась в группе больных на фоне применения терапии препаратом Гепа-Мерц. К 6-м суткам в контрольной группе уровень АЛТ остается выше, чем в основной; p < 0,05 (рис. 1).
/116/116.jpg)
При анализе уровня аспартатаминотрансферазы (АСТ) отмечается следующая динамика. Так, с 1-х по 3-и сутки показатели оставались достаточно высокими. Однако к 5-му дню в группе пациентов, в схему терапии которых включали Гепа-Мерц, отмечалось существенное снижение фермента, что говорило о стабилизации печеночной функции. В контрольной группе также отмечалось снижение показателя, которое было менее существенным по сравнению с основной группой, но значительным в сравнении с исходными данными (рис. 2).
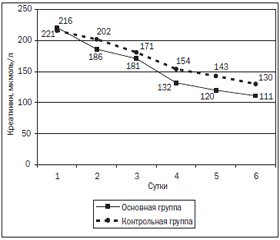
Высокие уровни креатинина (в среднем 220,12 ± 3,34 мкмоль/л) и сравнительно нормальные показатели мочевины (5,6 ± 1,1 ммоль/л) свидетельствовали о наличии гепаторенального синдрома как проявления недостаточности детоксикационной функции печени. Так, уровни креатинина в изучаемых группах на протяжении всего периода наблюдений достоверно не различались и имели достоверную тенденцию к снижению (рис. 3). Концентрация мочевины на протяжении всего исследования в обеих группах достоверных различий не имела.
За 6 суток терапии отмечена тенденция к снижению уровня общего билирубина — с 56,9 ± 2,7 ммоль/л до 23,7 ± 1,2 ммоль/л в основной группе и с 57,8 ± 1,1 ммоль/л до 30,1 ± 2,9 ммоль/л — в контрольной. Динамика билирубина указывает на снижение печеночного цитолиза, более существенное при использовании оригинального L-орнитин-L-аспартата (Гепа-Мерц, «Мерц Фарма ГмбХ и Ко. КГаА»).
При терапии с включением Гепа-Мерц значительно облегчалась седация, что клинически проявлялось меньшей степенью возбуждения у пациентов основной группы в сравнении с контрольной. При оценке контроля когнитивного дефицита, осуществляемой с помощью шкалы MMSE (mini-mental scale estimation) в динамике, также отмечено сравнительно более быстрое восстановление когнитивных функций у пациентов основной группы. Путем сравнения выявлено, что при поступлении оценка в среднем соответствовала 19,7 ± 1,2 балла в основной группе и 20,1 ± 2,3 балла — в контрольной, что было сопоставимо в обеих группах (р < 0,05). Данные показатели свидетельствуют об остром и выраженном когнитивном дефиците. В динамике на 4-й день интенсивной терапии в основной группе средний показатель составлял 25,7 ± 1,5 балла, а к 6-м суткам — 27,1 ± 1,2 балла, что практически было близким к норме (28–30 баллов). В контрольной группе при несколько более высоком исходном уровне динамика к 4-му дню также прослеживалась, однако была менее выраженной — 23,1 ± 2,5 балла, а к 6-м суткам показатель составлял 25,6 ± 1,7 балла, что говорило об оставшемся когнитивном дефиците после проведенного лечения (табл. 1).
Выводы
1. Представленные результаты позволяют сделать вывод о том, что оригинальный L-орнитин-L-аспартат (Гепа-Мерц, «Мерц Фарма ГмбХ и Ко. КГаА») может успешно применяться у пациентов с алкогольными расстройствами различной степени тяжести в качестве детоксикационного агента, обезвреживающего аммиак стимуляцией действия орнитин-аспартатного комплекса.
2. При применении оригинального L-орнитин-L-аспартата (Гепа-Мерц, «Мерц Фарма ГмбХ и Ко. КГаА») в основной группе пациентов в течение 6 суток лечения по 20 г действующего вещества (4 ампулы) замечено существенное снижение уровня печеночных ферментов (АЛТ, АСТ) — более чем в 4 раза, снижение уровня креатинина в 2 раза. Также отмечался стабильный прирост оценки по шкале когнитивного дефицита MMSE: в основной группе — с 19,7 ± 1,2 балла до 27,1 ± 1,2 балла (р6–1 = 0,0001) и в контрольной группе — с 20,1 ± 2,3 балла до 25,6 ± 1,7 балла (р6–1 = 0,0001), что свидетельствует о более быстром восстановлении когнитивных функций в основной группе больных.
3. Комплексное применение оригинального L-орнитин-L-аспартата (Гепа-Мерц, «Мерц Фарма ГмбХ и Ко. КГаА») позволило улучшить результаты коррекции гепатоцеребральной недостаточности у пациентов с ранними признаками психосоматических расстройств при данной патологии, что проявляется в более быстром восстановлении когнитивного дефицита и стабилизации показателей функции печени.
1. Всемирная организация здравоохранения (ВОЗ), доклад «О положении в области алкоголя и здоровья» [Электронный ресурс] / По данным: Газета.ru, 18.02.2011; Режим доступа: http://www.gazeta.ru/social/2011/02/18/3530314.shtml.
2. Буеверов А.О. Печеночная энцефалопатия как основное проявление недостаточности функции печени // Материалы сателлитного симпозиума компании Мерц «Заболевания печени и печеночная энцефалопатия», 18 апреля 2004 г. — М., 2004. — С. 8.
3. Маркизова Н.Ф., Гребенюк А.Н., Иваницкий Ю.Ю. Токсикология спиртов: учебное пособие. — СПб.: Военно-медицинская академия, 2001. — 120 с.
4. Энтин Г.М. и др. Алкогольная и наркотическая зависимость. — М.: Медпрактика-М, 2002. — С. 77.
5. Mullen K.D. Hepatic Encephalopathy // Hepatology / Ed. by Boyer T.D., Wright T.L., Manns M.P. — 5th ed. — Saunders Elsevier, 2006. — Ch. 18.
6. Буров Н.Е. Представления о механизме анестезиологических и лечебных свойств ксенона // Ксенон и инертные газы в отечественной медицине. — М.: ГВКГ им. Н.Н. Бурденко, 2010. — С. 39–54.
7. Butterworth R.F. Cerebral consequences of alcoholic liver disease // Ethanol and liver / Ed. by Sherman D.I.N. et al. — 2012. — P. 512.
8. Larsen F.S. // Metabolic liver disease. — 2002. — Vol. 17. — P. 229.
9. Дамулин И.В. Печеночная энцефалопатия: патогенез, клиника, лечение // Нервные болезни. — 2008. — № 1. — С. 8–14.
10. Лаптев В.В., Цкаев А.Ю., Гивировская Н.Е. Эффективность Гепа-Мерц в комплексной терапии острого панкреатита // Материалы XVII международного конгресса хирургов-гепатологов стран СНГ «Актуальные проблемы хирургической гепатологии». — Уфа, 2010. — С. 69.
11. Ермолова Т.В., Шабров А.В., Ермолов С.Ю., Олейник В.В. Изучение эффективности l-орнитина-l-аспартата (Гепа-мерц) в профилактике послеоперационных осложнений у больных хроническими заболеваниями печени [Электронный ресурс]. — СПб., 2013. — http://all.textedu.ru/docs/12/index–7889.html

/117/117.jpg)
/117/117_2.jpg)