Журнал «Медицина неотложных состояний» 3 (58) 2014
Вернуться к номеру
Опыт применения антагониста глутаматных NMDA-рецепторов (ПК-Мерц) при повреждениях головного мозга травматического происхождения в остром периоде (описание клинического случая)
Авторы: Колесников А.Н., Чернуцкий С.О., Стасюк В.Н., Дружинская Е.А. - КМУ «Клиническая Рудничная больница», г. Макеевка
Рубрики: Медицина неотложных состояний, Неврология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 101-104
В настоящее время большое внимание уделяется изучению патофизиологических механизмов повреждения мозга при острой церебральной недостаточности (ОЦН) и возможных путей их коррекции. Углубление представлений о формировании повреждения мозга видоизменило взгляды на стратегию патогенетического лечения ОЦН. Анализ динамики развертывания молекулярных и биохимических механизмов установил четкую временную последовательность их «включения». В течение первых трех часов с момента повреждения максимально представлен энергетический дефицит в поврежденной ткани; через 3–6 ч развивается феномен глутаматной эксайтотоксичности, приводящий к нарушениям кальциевого гомеостаза и лактат-ацидозу, угасающему к концу первых суток. Отдаленные последствия начинают проявляться на 2–3-й час, достигая максимума через 12–36 ч (оксидантный стресс, провоцирующий локальное воспаление) и на 2-е — 3-и сутки заканчиваясь апоптозом.
Схему последовательных этапов ишемического каскада можно представить следующим образом:
1 — снижение мозгового кровотока;
2 — глутаматная эксайтотоксичность;
3 — внутриклеточное накопление кальция;
4 — активация внутриклеточных ферментов;
5 — повышение синтеза NO и развитие оксидантного стресса;
6 — экспрессия генов раннего реагирования;
7 — локальная воспалительная реакция, микроциркуляторные нарушения, повреждения гематоэнцефалического барьера;
8 — апоптоз.
Возникающие после первичного повреждения головного мозга патофизиологические изменения приводят к вторичным (отсроченным) повреждениям. Интенсивная терапия направлена прежде всего на предотвращение и уменьшение вторичного повреждения мозга. В ответ на повреждение повышается активность глутаматергических нейронов, увеличивается высвобождение глутамата (возбуждающей аминокислоты) и, как следствие, усугубляется повреждающее воздействие на клетку. По мере истощения адаптационных возможностей развиваются ацидоз, ионный дисбаланс, возрастает концентрация возбуждающих аминокислот (в том числе глутамата), образуются свободные радикалы. Окислительные радикалы способствуют высвобождению цитокинов, а также высвобождению пресинаптическими нервными окончаниями избыточного количества глутамата, который оказывает цитотоксическое действие (феномен глутаматной эксайтотоксичности, в этом случае эксайтотоксичность может быть нейтрализована блокадой NMDA–рецепторов). Затем через определенный промежуток времени развивается апоптоз.
Одним из перспективных направлений коррекции церебрального гомеостаза является применение препаратов, направленных на прерывание быстрых реакций глутамат-кальциевого каскада. Число таких реально действующих препаратов, прошедших рандомизированные клинические испытания у больных с острой церебральной недостаточностью, в настоящее время чрезвычайно мало.
К препаратам с глутамат-блокирующим действием относится давно известный в неврологии препарат амантадин (ПК-Мерц), позиционируемый ранее только как противопаркинсоническое средство. Однако по механизму действия амантадин способен не только активно стимулировать выделение дофамина из нейрональных депо, повышать чувствительность дофаминергических рецепторов к медиатору дофамину и нормализовать нейрофизиологические интрацеребральные процессы, но одновременно оказывать стабилизирующее действие на специфические глутаматергические рецепторы, прерывая нарастание глутаматного выброса и подавляя глутаматную эксайтотоксичность, запускающую последующие патобиохимические механизмы постишемического каскада. Поскольку именно глутаматная эксайтотоксичность лежит в основе неуклонно прогрессирующего при ишемии и гипоксии нейромедиаторного дисбаланса, стимулирующего постишемическую энергетическую, белковую и электролитную дисрегуляцию, то именно при ее сохранении неотвратимо уменьшается зона пенумбры, а прерывание или ингибирование способны оказывать прямое церебропротекторное действие.
В отделении анестезиологии и интенсивной терапии (ОАИТ) КМУ «Клиническая Рудничная больница» уже имеется собственный клинический опыт применения (более 70 пациентов) препарата ПК-Мерц в схеме лечения у пациентов с ишемическими инсультами, геморрагическими инсультами, инсультами в вертебробазилярном бассейне и с тяжелой черепно-мозговой травмой (ЧМТ).
Интересен клинический случай восстановления сознания у пациента с тяжелой ЧМТ и вторичным ишемически-геморрагическим поражением всей правой гемисферы.
Больной К., 40 лет, поступил в ОАИТ КМУ КРБ г. Макеевки после травмы, полученной в результате дорожно-транспортного происшествия.
После проведения комплекса диагностических мероприятий был установлен диагноз:
I. 1. Закрытая ЧМТ, ушиб головного мозга тяжелой степени с наличием очагов ушиба с геморрагическим пропитыванием лобной области справа. Субарахноидальное кровоизлияние. Скальпированные раны мягких тканей головы.
2. Тупая травма грудной клетки. Пневмоторакс слева. Перелом 6–7-го ребра слева по среднеключичной линии, 6-го — оскольчатый. Подкожная эмфизема.
3. Тупая травма живота. Ушиб печени, подкапсульная гематома.
4. Открытый перелом костей голени справа (многооскольчатые переломы правой большеберцовой и малоберцовой костей с захождением отломков).
II. 1. Отек-набухание головного мозга.
2. Травматический шок 2-й ст.
3. Геморрагический шок 2-й ст.
При поступлении больной находился в крайне тяжелом состоянии. Уровень сознания — кома 1-й ст. (7 баллов по шкале комы Глазго (ШКГ)). Глазные щели равны, зрачки сужены, D > S. Поворот глазных яблок вправо. Фотореакция вялая. Менингеальных знаков, патологических рефлексов нет. Левосторонняя гемиплегия. Выраженная судорожная готовность.
Самостоятельное дыхание эффективное. Проводилась инсуфляция увлажненного кислорода через лицевую маску. Аускультативно над легкими везикулярное дыхание с жестким оттенком, резко ослабленное в верхних и средних отделах слева. Гемодинамика компенсирована. Сердечная деятельность ритмична, тоны глухие. Артериальное давление (АД) — 140/80 мм рт.ст. Пульс — 82 в 1 минуту.
Родственники больного предоставили юридически заверенный отказ больного от трансфузии эритроцитарной массы и препаратов крови по религиозным убеждениям (больной К. принадлежит к религиозной организации «Свидетели Иеговы»).
Больному К. назначена комплексная интенсивная терапия, направленная на поддержку функций дыхания и кровообращения, мозгового кровообращения, коррекцию метаболических и волемических нарушений, контроль уровня гликемии, артериального давления, электролитного состава плазмы, профилактику инфекционных осложнений.
Больной К. получал антибиотики широкого спектра действия (меропенем, цефтаролин), парентеральные препараты железа (венофер), эритропоэтина (эпрекс), раствор перфторуглерода (перфторан 100 мл 2 раза в сутки), постоянно проводилась инсуфляция увлажненного кислорода, проведено 10 сеансов гипербарической оксигенации.
Проводился интенсивный мониторинг неврологического и соматического статуса больного — неинвазивное измерение артериального давления, частоты дыхания, частоты сердечных сокращений, температуры тела, линейной скорости кровотока (ЛСК), измерение биспектрального индекса, лабораторный мониторинг основных клинических и биохимических показателей.
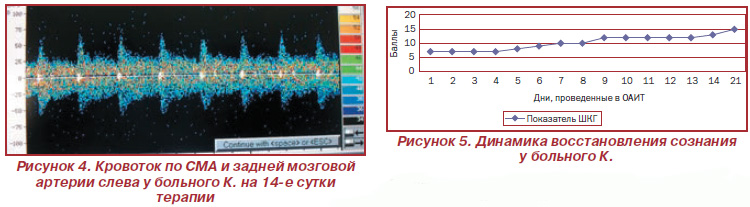
При проведении транскраниальной допплерографии и оценке линейной скорости кровотока наблюдалась гемодинамически значимая правосторонняя (S < D) асимметрия скорости артериального кровотока в бассейнах средней мозговой артерии (СМА) М1 и М2 (72–76 %) за счет резкого замедления скорости кровенаполнения слева. Гемодинамически значимая левосторонняя (S > D) асимметрия скорости артериального кровотока в бассейнах мозжечковой артерии (188 %) за счет резкого замедления. Линейная скорость мозгового кровотока по СМА с обеих сторон не превышала 35–44 % от возрастных норм.
/103/103.jpg)
После регрессии отека головного мозга, с учетом пробуждающего действия амантадина (за счет снижения уровня глутамата и блокады NMDA-рецепторов), больному с 4-го дня к интенсивной терапии был добавлен амантадина сульфат (ПК-Мерц) в виде инфузионного раствора 500 мл (200 мг) 2 раза в сутки внутривенно капельно. Время инфузии составляло не менее 2,5–3 ч, что позволяло длительно поддерживать высокую концентрацию препарата в крови. Оценивали скорость выхода из комы и восстановления скорости мозгового кровотока. Необходимость добавления инфузии ПК-Мерц была обоснована влиянием на патогенетические механизмы повреждения головного мозга (коррекция глутаматной токсичности) и эффективностью действия препарата при дофаминергической недостаточности, которая развивается в результате повышенной нейромедиаторной активности в первые часы и дни после получения травмы.
Уже через 24 часа на фоне проведения интенсивной терапии достигнута положительная динамика. С 5-х суток уровень сознания — глубокое оглушение — сопор (8–9 баллов по ШКГ). Глазные щели равны, зрачки сужены, D = S. Фотореакция сохранена. Менингеальных знаков, патологических рефлексов нет. Левосторонняя гемиплегия. Судорог нет. Судорожная активность не определяется.
На 14-е сутки терапии выполнена контрольная спиральная компьютерная томография головного мозга. У больного отмечено рассасывание внутримозговой гематомы, значительное уменьшение контузионного очага, регрессия отека головного мозга.
Уровень сознания — оглушение (12 баллов по ШКГ). Глазные щели равны, зрачки равных размеров, D = S. Фотореакция живая. Менингеальных знаков, патологических рефлексов нет. Левосторонний умеренный гемипарез.
Самостоятельное дыхание эффективное. Аускультативно над легкими везикулярное дыхание с жестким оттенком. Гемодинамика компенсирована. Сердечная деятельность ритмична, тоны глухие. АД — 135/85 мм рт.ст. Пульс — 78 в 1 минуту.
По данным транскраниальной допплерографии отсутствует значимая асимметрия скорости артериального кровотока в бассейнах СМА, регрессировала асимметрия кровотока по мозжечковым артериям. ЛСК достигла нормальных величин. Отсутствуют признаки повышенного внутричерепного давления, отека мозговой ткани. Линейная скорость мозгового кровотока по основным артериям с обеих сторон на уровне возрастной нормы.
К концу 3-й недели пребывания в ОАИТ состояние больного с положительной динамикой. Больной в сознании, выполняет команды, отвечает на вопросы, выражает эмоции, ориентирован частично, выражена ретро- и антероградная амнезия, сохраняется умеренный левосторонний гемипарез.
Для дальнейшего лечения больной переведен в травматологическое отделение на 22-е сутки пребывания в ОАИТ.
Выводы
1. При вторичном ишемическом повреждении головного мозга у пациентов с ОЦН патогенетически значимо явление эксайтотоксичности, в реализации которого основную роль играет глутаматный каскад, запускающий последовательность патофизиологических процессов, в конечном итоге приводящих к апоптозу (гибели клеток центральной нервной системы). Степень апоптоза определяется выраженностью неврологического дефицита, что предопределяет и исход заболевания.
2. Применение препарата амантадина сульфат (ПК-Мерц) позволяет уменьшить проявления эксайтотоксичности и выраженности глутаматного каскада, способствует регрессии неврологической симптоматики и в конечном итоге может приводить к снижению инвалидизации и летальности.
3. Основным критерием эффективности препарата ПК-Мерц является влияние на неврологический дефицит и динамику тяжести состояния. Возможность патогенетической терапии эксайтотоксичности позволяет уменьшить длительность нахождения пациента в условиях отделения реанимации и интенсивной терапии.


/102/102.jpg)
/103/103_2.jpg)