Журнал «Медицина неотложных состояний» 3 (58) 2014
Вернуться к номеру
Гостра серцева недостатність у хворих на гострий інфаркт міокарда з елевацією сегмента ST на ЕКГ
Авторы: Пархоменко О.М., Кожухов С.М. - ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України, м. Київ
Рубрики: Медицина неотложных состояний, Кардиология
Разделы: Клинические исследования
Версия для печати
Досягнуто успіхів у лікуванні гострого інфаркту міокарда. Незважаючи на використання реперфузії у веденні таких пацієнтів, частота гострої серцевої недостатності досягає 30 %. Накопичені дані показують, що гостра серцева недостатність є незалежним чинником ризику рецидиву інфаркту міокарда й серцево-судинної смерті. Наші дані свідчать, що гостра серцева недостатність тільки протягом першого року після інфаркту міокарда збільшує ризик серцево-судинної смерті на 11,0 % (р < 0,001). Дуже важливі відомості про те, що час початку й тривалість симптомів гострої серцевої недостатності відіграють важливу роль у виникненні серцево-судинних ускладнень. У першу добу гострого інфаркту міокарда хворі з гострою серцевою недостатністю й пацієнти без цих ускладнень мають подібну виживаність. Але тривалість гострої серцевої недостатності понад 5 днів асоціюється з додатковим збільшенням серцево-судинної смерті до 6 % (р < 0,05).
Інше питання — виживаність пацієнтів із гострою серцевою недостатністю й збереженою фракцією викиду лівого шлуночка. Прогноз цих хворих схожий із таким у пацієнтів зі зниженою фракцією викиду. Наші дані показали, що у хворих із гострим інфарктом міокарда й фракцією викиду ≥ 45 %, що має ознаки гострої серцевої недостатності, ризик серцево-судинної смерті протягом першого року підвищується у два рази (р < 0,023).
У цій статті узагальнений досвід лікування пацієнтів із гострим інфарктом міокарда, накопичений у ННЦ «Інститут кардіології ім. академіка М.Д. Стражеска» за більше ніж 10-літній період. Необхідне проведення подальших досліджень із розв’язання усіх вищезазначених ключових питань, у першу чергу тих, що стосуються ведення пацієнтів у гострий період хвороби і їх подальшого спостереження, для підвищення рівня виживаності.
Достигнуты успехи в лечении острого инфаркта миокарда. Несмотря на использование реперфузии в ведении таких пациентов, частота острой сердечной недостаточности достигает 30 %. Накопленные данные показывают, что острая сердечная недостаточность является независимым фактором риска рецидива инфаркта миокарда и сердечно-сосудистой смерти. Наши данные свидетельствуют, что острая сердечная недостаточность только в течение первого года после инфаркта миокарда увеличивает риск сердечно-сосудистой смерти на 11,0 % (р < 0,001). Очень важны сведения о том, что время начала и продолжительность симптомов острой сердечной недостаточности играют важную роль в возникновении сердечно-сосудистых осложнений. В первые сутки острого инфаркта миокарда больные с острой сердечной недостаточностью и пациенты без этих осложнений имеют сходную выживаемость. Но продолжительность острой сердечной недостаточности более 5 дней ассоциируется с дополнительным увеличением сердечно-сосудистой смерти до 6 % (р < 0,05).
Другой вопрос — выживаемость пациентов с острой сердечной недостаточностью и сохраненной фракцией выброса левого желудочка. Прогноз этих больных схож с таковым у пациентов со сниженной фракцией выброса. Наши данные показали, что у больных с острым инфарктом миокарда и фракцией выброса ≥ 45 %, имеющих признаки острой сердечной недостаточности, риск сердечно-сосудистой смерти в течение первого года повышается в два раза (р < 0,023).
В этой статье обобщен опыт лечения пациентов с острым инфарктом миокарда, накопленный в ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» за более чем 10-летний период. Необходимо проведение дальнейших исследований по решению всех вышеуказанных ключевых вопросов, в первую очередь касающихся ведения пациентов в острый период болезни и их последующего наблюдения, для повышения уровня выживаемости.
We have improvements in the management of acute myocardial infarction. Despite of introduction in managements this patient’s reperfusion strategy, rate of acute heart failure account up to 30 %. Accumulated data suggest that acute heart failure is independent factor for risk of recurrent myocardial infarction and cardiovascular death. Our data show that acute heart failure only during first year after MI increase cardiovascular death on 11.0 % (p < 0.001). Very important findings that time of onset and duration of symptoms of acute heart failure play important role in rise cardiovascular complications. Patients with acute heart failure during first 24 hours of acute myocardial infarction have similar survival with patient without those complications. But durations acute heart failure more than 5 days association with additional increase in cardiovascular death up to 6 % (p < 0.05).
Another question is survival patients with acute heart failure and preserved ejection fraction of left ventricle. These patients have similar prognosis compare to patients with reduced ejection fraction. Our data demonstrated that acute myocardial infarction patient with ejection fraction ≥ 45 %, complicated by symptoms of acute heart failure, has two time increase in cardiovascular death during first year (p < 0.023).
This article summaries experience National scientific center «National Scientific Center «Institute of Cardiology named after M.D. Strazhesko» over period of 10 years. Future research is needed for all of above key questions first of all concerning management during acute phase and follow-up for improvement survival.
Статья опубликована на с. 28-34
За останні десятиліття в лікуванні гострого інфаркту міокарда (ГІМ) досягнуто значних успіхів, у першу чергу за рахунок застосування реперфузійних стратегій: фармакологічної — використання тромболітичних агентів, механічної — застосування балонної ангіопластики та стентування коронарних артерій (КА). У другу чергу — за рахунок оптимізації патогенетично обґрунтованої медикаментозної терапії. Це сприяло кращому виживанню хворих через відкриту інфаркт-залежну КА, менший розмір пошкодження міокарда. Тим не менше в частини хворих протягом госпітального періоду спостерігаються симптоми й ознаки серцевої недостатності (СН). Як відомо, СН у хворих на ГІМ асоціюється із суттєвим збільшенням ризику смерті та середньою тривалістю виживання близько 4 років [1].
На сьогодні є достатньо даних стосовно поширеності СН і тактики лікування, однак у хворих з ГІМ вона недостатньо вивчена. Крім того, у клінічних випробуваннях, реєстрах та епідеміологічних дослідженнях, у яких досліджувалась СН після ГІМ, були використані різні підходи та діагностичні критерії. Аналіз 4 основних досліджень фібринолітичної терапії Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries (GUSTO I), Global Use of Strategies to Open Occluded Coronary Arteries (GUSTO IIb та GUSTO III), Assessment of the Safety and Efficacy of a New Thrombolytic trial (ASSENT II) у хворих на ГІМ показав, що гостра СН (ГСН) на час надходження до стаціонару була присутня у 12,5 % з 61 041 учасника, а протягом усього госпітального періоду діагностована у 29,4 %. Частота ГСН була схожою в 15 078 пацієнтів, включених у дослідження Intravenous nPA for the Treatment of Infarcting Myocardium Early II study (InTime II), де вона становила 23 % [2–4].
Реєстри служать додатковим підтвердженням, що це ускладнення ГІМ є поширеним явищем. Так, у National Registry of MI (NRMI) — реєстрі, що включає 606 500 пацієнтів із ГІМ, ГСН визначено у 20,4 % пацієнтів на час госпіталізації, ще у 8,6 % СН розвинулася протягом госпітального періоду. У Valsartan in Acute Myocardial Infarction trial (VALIANT) — реєстрі, у якому було залучено 84 центри з 9 країн, серед 5566 пацієнтів із ГІМ симптоми ГСН були діагностовані у 23,1 % хворих на час госпіталізації та 24,5 % — на момент виписки. Ці клінічні випробування та реєстри, незважаючи на методологічні відмінності, підтверджують, що ГСН є досить поширеним явищем у хворих на ГІМ [1, 5].
В одному з останніх епідеміологічних досліджень серед хворих із ГІМ показано, що у Фремінгемській когорті в період з 1970 по 1999 рік ГСН становила 24 %. Це збігається з даними вищенаведених реєстрів та клінічних випробувань [2].
Протягом останнього часу кількість хворих на ГІМ з елевацією сегмента ST на ЕКГ зменшується, у той час як інші форми гострого коронарного синдрому (ГКС), такі як ГІМ без елевації сегмента ST на ЕКГ та нестабільна стенокардія, збільшуються. Global Registry of Acute Coronary Events (GRACE) показав, що частота СН схожа в обох типах ІМ і становить близько 18 %, натомість у хворих із нестабільною стенокардією вона була 10 %. Первинні черезшкірні коронарні втручання (ПЧКВ) стали методом вибору для лікування хворих на ГІМ, хоча стосовно частоти виникнення ГСН, за даними окремих досліджень, вони мають подібну до тромболітичної терапії частоту її реєстрації. Так, за даними дослідження Which Early ST-elevation Myocardial Infarction Therapy (WEST), частота СН протягом 30 днів після ІМ була вищою у тих хворих, у яких застосовувалась ПЧКВ (18 %) порівняно з тими, хто отримував сучасну фармакотерапію (15 %) або фібринолізис у поєднанні з ПЧКВ (14,4 %). Однак аналіз рутинних баз даних Канади (13 472 пацієнти з ГІМ) за допомогою matched-контролю показав, що в пацієнтів, яким проводили ПЧКВ, на відміну від хворих без втручання, була менша кількість випадків СН у стаціонарі (17 проти 24 %) і на час виписки (4 проти 7 %). Крім того, реєстр GRACE показав, що при лікуванні ГКС зі збільшенням частоти використання ПЧКВ у хворих на ГІМ як з елевацією ST, так і без неї, а також застосування фармакотерапії, заснованої на доказовій медицині, частота ГСН знизилася на 9 % у пацієнтів з ІМ з елевацією сегмента ST і на 6,9 % — в осіб без елевації ST. Незважаючи на ці обнадійливі результати, слід виділити 2 важливих факти. По-перше, ГСН у хворих на ГІМ досі є частим ускладненням, незважаючи на досягнутий прогрес у лікуванні ГКС. По-друге, намітилась тенденція до зниження частоти СН. Надалі необхідно продовжувати дослідження з метою розробки нових методів запобігання розвитку та прогресуванню ГСН у хронічну форму [6, 7].
Гостра серцева недостатність — клінічний синдром, що характеризується швидким виникненням симптомів, характерних для порушеної функції серця: знижений серцевий викид, недостатня перфузія тканин, підвищений тиск в легеневих капілярах, застій у тканинах. Пацієнти, у яких спостерігаються симптоматичні прояви застою в легенях протягом ГІМ, мають поганий як короткотривалий, так і віддалений прогноз. Так, реєстрація ГСН у хворих на ГІМ супроводжується збільшенням госпітальної летальності з 6 % (при збереженій функції ЛШ) до 80 % (при кардіогенному шоку), протягом 1 року летальність становить 30 %. При розвитку набряку легенів госпітальна летальність становить 12 %, річна летальність — 40 %. Згідно з сучасними уявленнями саме систолічна дисфункція є одним із найнесприятливіших прогностичних чинників [1].
Ускладнення інфаркту міокарда ГСН є результатом комплексу структурних, гемодинамічних, нейрогормональних та генетичних чинників. Раптова втрата кардіоміоцитів веде до контрактильної дисфункції, унаслідок чого виникають прояви ГСН, а динаміка підвищення кардіоспецифічних біомаркерів тісно корелює з прогнозом та ступенем функціонального відновлення. Велика зона некрозу міокарда та постішемічна лівошлуночкова систолічна дисфункція, що ведуть до ГСН, можуть бути результатом транзиторного оглушення міокарда (stunning) чи гібернації, які, у свою чергу, залежать від коронарної перфузії. Патологічне ремоделювання ЛШ має місце у хворих із великими за розміром порушеннями регіональної скоротливості, що також опосередковане коронарною перфузією. Індуковане ішемією порушення релаксації міокарда призводить до погіршення наповнення ЛШ, що врешті-решт призводить до порушення глобальної систолічної функції, а відповідно, і до ГСН. Крім того, у частини хворих ішемія може призводити до гострої мітральної регургітації, яка сприяє легеневому застою. Останнім часом отримано дані, що у хворих на ГСН реєструється активація процесів запрограмованої смерті клітин (апоптозу) як у зоні інфаркту, так і в періінфарктній зоні. Незважаючи на те, який процес домінує в окремого пацієнта, цілком зрозуміло, що ГСН у хворих на ГІМ залишається важливою проблемою і на сьогодні, коли все ширше застосовуються реперфузійні стратегії [8].
Покращити клінічні результати у хворих із ГСН можливо при ранній діагностиці та правильно вибраній тактиці лікування. Тому профілактика розвитку ГСН і поліпшення функції ЛШ є важливими чинниками підвищення виживання і поліпшення якості життя хворих із ГІМ.
У Державній установі «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска» Національної академії медичних наук України у відділі реанімації та інтенсивної терапії накопичено великий досвід із лікування хворих на ГІМ. Особлива увага приділяється хворим з ускладненим перебігом захворювання, зокрема зі складними порушеннями серцевого ритму, механічними ускладненнями, серцевою недостатністю. Протягом останніх 5 років проведено ретроспективно-проспективний аналіз клініко-анамнестичних характеристик та даних інструментальних обстежень понад 1100 хворих на ГІМ з елевацією сегмента ST на електрокардіограмі, які були госпіталізовані в установу. Вивчалися фактори ризику, основні патогенетичні чинники, які сприяли розвитку ГСН та її наслідки при тривалому спостереженні. Аналізувалися клінічний перебіг захворювання протягом госпітального періоду, показники кардіогемодинаміки, загальноклінічні, біохімічні та імунологічні лабораторні показники, неінвазивні електрофізіологічні показники (пізні потенціали шлуночків, варіабельність серцевого ритму, маркери деполяризації-реполяризації міокарда), навантажувальне тестування, генетичні методи досліджень.
Результати тривалого спостереження за обстеженими хворими оцінювалися через один та три роки від моменту ГІМ (хворі з кардіогенним шоком не включалися в аналіз). Аналізували жорстку кінцеву точку — кардіоваскулярну смерть. Отримані дані у вигляді кривих Каплана — Мейєра подані на рис. 1.
/30/30.jpg)
Наше дослідження показало, що ГСН, яка ускладнює ГІМ, є важливим фактором збільшення госпітальної летальності та смертності. Серед причин ГСН ІМ посідає друге місце після артеріальної гіпертензії з відносним ризиком до 34 % у чоловіків та до 13 % у жінок. Раніше проведені дослідження показали, що частота СН протягом ГІМ, до моменту виписки, становила 22 % у пацієнтів, які перенесли перший ІМ, і до 33 % у хворих із повторним ІМ [9].
Інші дослідження також демонструють, наскільки важливою проблемою є ГСН. За даними US National Registry of Myocardial Infarction (NRMI), частота СН становила близько 20 % під час госпіталізації хворих із ГІМ та ще в 9 % випадків розвивалася протягом госпітального періоду. У дослідженні French study частота СН становила до 38 % протягом перших 5 днів ГІМ. Звичайно, симптоми гострої СН є тимчасовими, і буває складно передбачити, яка частина трансформується у хронічну СН. Частіше за все симптоми ГСН проявляються на першу добу ГІМ із наступним піком на 4-ту добу. Наше дослідження підтверджує, що вагомими факторами появи симптомів ГСН є тривалий анамнез ІХС (як стабільна стенокардія, так і нестабільний перебіг її безпосередньо перед ГІМ), артеріальна гіпертензія та паління. Після виписки зі стаціонару СН зустрічається з частотою 2 % на рік протягом перших 10 років. До тромболітичної ери ці показники були втричі вищими. Рання діагностика ГСН та її лікування, а на нашу думку, навіть профілактика протягом госпітального періоду лікування є дуже важливими чинниками в плані покращення як короткотривалого, так і довготривалого прогнозу. Розуміння предикторів та можливих механізмів розвитку СН, таких як розмір зони некрозу, тривала ішемія чи оборотна ішемія міокарда, недіагностовані реоклюзії, повинно лягати в основу профілактики цього ускладнення [5].
Дуже важливе значення має проведення реперфузійної терапії, оскільки як системна ТЛТ, так і перкутанні коронарні втручання обмежують пошкодження міокарда. Розмір зони некрозу є інтегральною частиною в стратифікації ризику для всіх пацієнтів після ІМ. В нашому дослідженні частота реваскуляризації міокарда була досить високою і становить близько 64 %, а остаточна маса некротизованого міокарда була статистично більшою в пацієнтів із СН.
В ідеалі згідно з рекомендаціями у всіх пацієнтів із ГІМ повинна бути визначена систолічна функція лівого шлуночка шляхом проведення ехокардіографії, оскільки залежно від глобальної функції ЛШ підбирається адекватної медикаментозна терапія, а в окремих випадках, на нашу думку, необхідне проведення агресивної терапії, направленої на майбутній прогноз хворих із ГСН. До цієї категорії належать пацієнти похилого віку, з цукровим діабетом, тривалим анамнезом ІХС, передньою локалізацією теперішнього ІМ, новими блокадами ніжок пучка Гіса.
Думка щодо супутньої терапії ґрунтується на даних міжнародних багатоцентрових досліджень: на сьогодні цілком зрозуміло, що застосування блокаторів b-адренорецепторів, інгібіторів АПФ чи блокаторів рецепторів до ангіотензину ІІ у хворих на ГІМ є доцільним, а у хворих із проявами ГСН є просто необхідним.
Також клінічно доведена (у дослідженні EPHESUS) ефективність блокатора альдостерону еплеренону у хворих із лівошлуночковою недостатністю після ГІМ. Поглиблений аналіз цього дослідження показав, що чим раніше розпочинається лікування еплереноном, тим кращі результати стосовно попередження кардіоваскулярних подій та раптової кардіальної смерті [10].
При довготривалому спостереженні ризик СН у хворих на ІХС вірогідно знижується шляхом застосування вторинної профілактики за допомогою застосування таких препаратів, як статини та інгібітори АПФ.
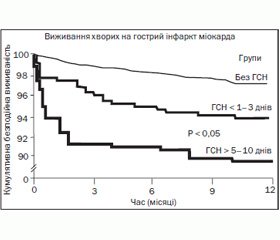
Важливою, за даними нашого аналізу, є залежність прогнозу від часу появи ГСН та її тривалості. Так, у хворих із тривалістю ГСН понад 5 діб протягом госпітального періоду вірогідно частіше виникали рецидиви ІМ, порушення ритму серця, рання післяінфарктна стенокардія та аневризми ЛШ. У хворих, у яких СН продовжувала персистувати на 5-ту добу і пізніше, була більш виражена ниркова дисфункція. Результати тривалого спостереження протягом одного року від часу розвитку ІМ у вигляді кривої Каплана — Мейєра наведені на рис. 2 [11].
Таким чином, СН яка персистує 5 та більше діб, має більш ускладнений госпітальний перебіг та віддалений прогноз, тоді як хворі з СН з 1-ї по 3-тю добу мали сприятливий перебіг. Це повинно мотивувати у таких хворих максимально активно призначати інгібітори АПФ, бета-блокатори, антагоністи альдостерону як в оптимальних дозах, так і в максимально ранні терміни.
На практиці, за даними реєстрів NRMI, GRACE, пацієнти з СН менше отримують аспірин, гепарин, бета-блокатори, фібринолітичну терапію чи перкутанні втручання [5–7].
ГСН у хворих на ГІМ зі зниженою ФВ ЛШ. Систолічна дисфункція ЛШ є частим і серйозним ускладненням ГІМ, що призводить до збільшення ризику раптової смерті та серцевої СН. З іншого боку, наявність зниженої ФВ ЛШ у хворих ГІМ (за даними різних авторів, від 40 до 45 %), не завжди супроводжується клінічними проявами гострої лівошлуночкової недостатності (ГЛШН), шо є незалежним фактором ризику несприятливих віддалених наслідків ГІМ. Відповідно до даних популяційних досліджень, систолічна дисфункція ЛШ у хворих на ГІМ ускладнюється ГСН у 30–40 % випадків. У 20–30 % пацієнтів з дисфункцією ЛШ вона зменшується чи повністю зникає, тоді як у половини — прогресує чи маніфестує в хронічну СН [12].
Протягом останнього десятиліття причини, механізми, діагностика та наслідки систолічної дисфункції ЛШ достатньо добре вивчені, але прогнозування розвитку систолічної дисфункції ЛШ у хворих на ГІМ усе ще знаходиться в процесі розробки і являє собою самостійне клінічне завдання.
Нами був проведений аналіз даних близько 500 хворих на ГІМ з елевацією сегмента ST на ЕКГ та ФВ ЛШ менше 45 % на першу добу ІМ. Симптоматичну ГСН (клас за Killip II–III) діагностовано у 35,0 % пацієнтів. Загалом, за даними всієї когорти пацієнтів нашого дослідження, симптоми ГСН відмічались у 30,8 % випадків [14].
Аналіз віддаленого прогнозу показав, що у хворих із систолічною дисфункцією ЛШ та ГСН ризик розвитку серцево-судинної смерті (ССС) протягом 3 років після ГІМ у 2,1 раза вищий, ніж при відсутності ГСН (ВР (95% ДІ) = 2,13 (1,14–4,01), р = 0,019.
За останні декілька десятиріч лікування хворих з ГІМ значно покращилось, що призвело до зниження летальності на 40 % протягом гострого періоду ІМ. Але пацієнти, які вижили, мають високий ризик інших кардіоваскулярних ускладнень, таких як аритмії, повторні ІМ, інсульти та розвиток СН. З іншого боку, наявність ГСН протягом гострої фази ІМ негативно впливає на частоту ускладнень як протягом госпітального періоду, так і при тривалому спостереженні. Однак на сьогодні невідомо, чи має значення час появи ознак ГСН, чому в одних пацієнтів з систолічною дисфункцією міокарда ЛШ розвиваються ГСН, а в інших — ні.
Старший вік, цукровий діабет є найбільш потужними предикторами розвитку СН та довготривалого виживання хворих з ІМ. Цей ризик вірогідно пов’язаний із раннім ремоделюванням не тільки серед пацієнтів із цукровим діабетом, а навіть із порушеною толерантністю до вуглеводів, що веде до порушення регіональної скоротливості, зменшення лівошлуночкової податливості (жорсткості міокарда) та раннього підвищення тиску наповнення, що призводить до появи симптомів СН. Взаємозв’язок між віком та порушеною толерантністю до вуглеводів споріднений з прискореним розвитком атеросклерозу та хронічною нирковою дисфункцією, що ми і спостерігаємо в обстежених хворих [15].
Ниркова дисфункція виявилася незалежним фактором ризику несприятливих наслідків як у хворих із ГІМ, так і з СН, причому незалежно від віку та ступеня порушення толерантності до глюкози [16].
Цей взаємозв’язок веде до подальшого погіршення функції нирок, до затримки рідини, активації ренін-ангіотензинової системи. Навіть мінімальна ниркова дисфункція асоціюється зі змінами гомеостазу, що включає збільшення прозапальних цитокінів та ендотеліальної дисфункції, та веде до збільшення частоти кардіоваскулярних ускладнень. Зниження функції нирок (швидкість клубочкової фільтрації < 60 мл/хв/1,73 м2) не асоціюється з такими маркерами тяжкості ІМ, як рівень піку КФК, поширеності зони інфаркту чи величини елевації сегмента ST, але асоціюється з обтяженим кардіоваскулярним анамнезом та погіршеною початковою функцією ЛШ.
Таким чином, функція нирок може бути розпізнавальним маркером субклінічної кардіальної дисфункції, прогностично важливої в ранньому післяінфарктному періоді. Також слід звернути увагу на те, що хворі з порушеною нирковою функцією вірогідно рідше отримують медикаментозну терапію в повному обсягу, зокрема бета-блокаторів та інгібіторів АПФ, терапії, яка зменшує смертність та СН.
За результатами ЕхоКГ у хворих з ознаками ГСН та зниженою ФВ спостерігалось патологічне ремоделювання ЛШ, що характеризувалось дилатацією порожнини ЛШ та вірогідним зниженням ФВ.
Під ремоделюванням серця слід розуміти експресію генів, молекулярні, клітинні та інтерстиціальні зміни, що клінічно характеризуються змінами розміру, форми та функції серця після пошкодження міокарда (ГІМ). Процес ремоделювання переважно залежить від гемодинамічного навантаження, нейрогормональної активації та інших факторів, що зараз активно вивчаються.
На сьогодні доведено, що процес ремоделювання ЛШ починається вже протягом перших годин від розвитку ІМ і може продовжуватися тривалий час, тому медикаментозне втручання повинно проводитись якомога раніше. На цій фазі ремоделювання характеризується дилатацією порожнини ЛШ, у результаті чого збільшується КСІ та знижується ФВ, що, з одного боку, веде до виникнення СН, а з іншого — виступає важливим маркером несприятливого віддаленого прогнозу [17].
Тому всім хворим із ГІМ необхідно проводити ехокардіогрфічне дослідження для контролю процесів ремоделювання, для визначення маркерів несприятливого прогнозу та для контролю адекватності лікування.
Прогноз у хворих із ГІМ, ускладненим ГСН, прямо залежить від ступеня СН, визначеного за класифікацією за T. Killip та J.T. Kimball. Порівнюючи к класом Killip І, пацієнти на ГІМ з Killip ІІ–ІІІ помирають більше ніж у 4 рази частіше, а пацієнти з кардіогенним шоком (Killip IV) — у 10 разів і більше. Проте навіть у пацієнтів, у яких ознаки ГСН були транзиторними, у більшості з них розвиваються повторні епізоди СН. Поєднання у хворих на ГІМ систолічної дисфункції та проявів ГСН являє собою проблему, що потребує цілого ряду заходів, від реперфузійної терапії до повної реваскуляризації міокарда, від своєчасної та адекватної діагностики до агресивного лікування згідно з рекомендаціями, корекції супутніх захворювань та ін.
Гостра серцева недостатність у хворих на ГІМ зі збереженою систолічною функцією ЛШ. У багатьох дослідженнях було показано, що хворі, які за наявності симптомів СН мають збережену функцію лівого шлуночка мають кращий прогноз, в порівняно з хворими зі зниженою функцією ЛШ. Однак останні реєстри показали, що пацієнти з ГСН мають приблизно однаковий прогноз незалежно від систолічної функції ЛШ, а при наявності рестриктивної форми порушення діастолічної функції ЛШ прогноз хворих із ГСН навіть гірший [18].
На противагу хворим із СН зі збереженою ФВ за останні три десятиліття прогрес у терапії хворих із систолічною СН значно покращив виживання, у результаті чого різниця в смертності між групами мінімізувалася.
Сьогодні тільки починаються розробки в галузі діагностики та комплексного лікування хворих із ГСН зі збереженою ФВ ЛШ. Більшість хворих із ГСН та збереженою ФВ ЛШ мають артеріальну гіпертензію, частіше в осіб жіночої статі, а також це хворі, які мають порушення серцевого ритму. У хворих зі збереженою систолічною функцією ЛШ ГСН частіше виявляється, коли є порушення діастолічної функції ЛШ з наявністю значної мітральної регургітації (зворотного току) та при сегментарних порушеннях міокарда ЛШ.
Проблема ГСН зі збереженою систолічною функцією ЛШ зараз знаходиться у процесі вивчення. Прийнято вважати, що ФВ ЛШ збережена при ФВ від 40 до 45 % та більше. ГСН у хворих зі збереженою функцією міокарда залежить від багатьох факторів: це периферичний судинний тонус, адекватність функції транспорту кисню до органів та тканин, збереження електролітного балансу, це достатня робота органів детоксикації, зокрема нирок та печінки [19].
З огляду на малу кількість рандомізованих клінічних досліджень лікування хворих на СН зі збереженою ФВ значною мірою є емпіричним і, за даними останнього керівництва ACC/AHA з лікування хворих із СН зі збереженою ФВ, головним чином зосереджується на симптоматичному підході, контролі артеріального тиску, контролі об’єму рідини, оптимізації наповнення міокарда в діастолу шляхом контролю ритму серця [20].
На даний час керівництво з лікування хворих із СН Європейського товариства кардіологів (зразка 2012 р.) рекомендує застосування сечогінних засобів (з метою полегшення ознак та симптомів застою), також є важливим адекватне лікування гіпертензії та ішемії міокарда, так само як і контроль ЧСС у хворих з фібриляцією передсердь [2].
/33/33.jpg)
Ми проаналізували дані близько 350 хворих із ГІМ з елевацією сегмента ST на ЕКГ та ФВ ЛШ понад 45 % на першу добу ІМ. При тривалому спостереженні хворих зі збереженою систолічною функцією ЛШ та ГСН ризик розвитку ССС протягом 1 року після ГІМ виявився вірогідно вищим порівняно з контрольною групою, ці результати збігаються з даними ряду досліджень, де підтверджено, що наявність симптомів ГСН навіть у хворих зі збереженою систолічною функцією ЛШ має негативний вплив на прогноз ГІМ. Тому такі хворі потребують агресивного медикаментозного лікування, повної реваскуляризації міокарда ЛШ та ретельного контролю у віддаленому періоді спостереження [13].
Висновки
Симптоми й ознаки гострої серцевої недостатності є досить частим ускладненням ГІМ і діагностуються у 30–35 % пацієнтів залежно від типу функції міокарда ЛШ. З огляду на рівень кардіоваскулярної смерті ГСН є серйозною проблемою в лікуванні хворих на ГІМ. Наявність ГСН має більш прогностичне значення, ніж рівень ФВ ЛШ.
Старший вік, тривалий анамнез ІХС, особливо перенесений раніше ІМ, артеріальна гіпертензія та передня локалізація пошкодження міокарда ЛШ є прогностичними факторами для розвитку ГСН у хворих на ГІМ.
Зусилля, направлені на обмеження пошкодження міокарда, шляхом застосування системної тромболітичної терапії та первинних коронарних втручань, сприяють зменшенню частоти виникнення СН.
Рання діагностика проявів ГСН та раннє агресивне лікування таких пацієнтів сприяє покращенню короткотривалого та віддаленого прогнозу.
1. Steg P.G., James S.K., Atar D. et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology // Eur. Heart J. — 2012 — Vol. 33(20). — P. 2569–619.
2. McMurray J.J., Adamopoulos S., Anker S.D. et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC // Eur. Heart J. — 2012. — Vol. 33. — P. 1787–1847.
3. Gheorghiade M., Peter S. Pang P.S. Acute Heart Failure Syndromes // J. Am. College of Cardiol. — 2009. — Vol. 53(7). — P. 557–573.
4. Santoro G.M., Carrabba N., Migliorini A. et al. Acute heart failure in patients with acute myocardial infarction treated with primary percutaneous coronary intervention // Eur. J. Heart Fail. — 2008. — Vol. 10(8). — P. 780–785.
5. Spencer F.A., Meyer T.E., Gore J.M. et al. Heterogeneity in the management and outcomes of patients with acute myocardial infarction complicated by heart failure: the National Registry of Myocardial Infarction // Circul. — 2002. — Vol. 105. — P. 2605–2610.
6. Fox K.A., Anderson F.A. Jr, Dabbous O.H. et al. Intervention in acute coronary syndromes: do patients undergo intervention on the basis of their risk characteristics? The Global Registry of Acute Coronary Events (GRACE) // Heart. — 2007. — Vol. 93(2). — P. 177–1782.
7. Medi C., Montalescot G., Budaj A. et al. Reperfusion in patients with renal dysfunction after presentation with ST-segment elevation or left bundle branch block: GRACE (Global Registry of Acute Coronary Events) // JACC Cardiovasc. Interv. — 2009. — Vol. 2(1). — P. 26–33.
8. Мойбенко А.А., Досенко В.Е., Пархоменко А.Н. Эндогенные механизмы кардиопротекции как основа патогенетической терапии заболеваний сердца. — К.: Наукова думка, 2008. — 520 с.
9. Пархоменко О.М., Кожухов С.М., Іркін О.І. Гостра серцева недостатність у хворих на інфаркт міокарда в умовах сучасного лікування: особливості перебігу, вплив на коротко- та довготривалий прогноз // Український кардіологічний журнал. — 2009. — № 5. — С. 17–24.
10. Pitt B., Remme W., Zannad F. et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction (EPHESUS) // N. Engl. J. Med. — 2003. — Vol. 348(14). — P. 1309–1321.
11. Пархоменко А.Н., Кожухов С.Н., Иркин О.И., Лутай Я.М. Гостра лівошлуночкова недостатність у хворих на гострий інфаркт міокарда: взаємозв`язок клінічного перебігу та прогнозу з тривалістю синдрому // Рациональная фармакотерапия. — 2009. — № 3/12. — С. 51–54.
12. Пархоменко О.М., Гур’єва О.С., Корнацький Ю.В., Кожухов С.М., Лутай Я.М., Іркін О.І. Перебіг захворювання у хворих із гострим коронарним синдромом із елевацією сегмента ST та збереженою фракцією викиду лівого шлуночка // Український медичний часопис. — 2012. — № 1/89. — С.118–123.
13. Кожухов С.М., Пархоменко О.М., Іркин О.І., Лутай Я.М., Шумаков О.В. Гостра серцева недостатність у хворих на інфаркт міокарда з елевацією сегмента ST та систолічною дисфункцією лівого шлуночка: дослідження частоти виникнення, клінічної і прогностичної значущості // Український кардіологічний журнал. — 2011. — № 3. — С. 12–18.
14. Кожухов С.М., Пархоменко О.М., Лутай Я.М. Клініко-прогностичне значення гострої серцевої недостатності у хворих з інфарктом міокарда, збереженою фракцією викиду та супутньою артеріальною гіпертензією // Український кардіологічний журнал. — 2012. — № 6. — С. 41–48.
15. Smith G.L., Masoudi F.A., Shlipak M.G. et al. Renal Impairment Predicts Long-Term Mortality Risk after Acute Myocardial Infarction // J. Am. Soc. Nephrol. — 2008. — Vol. 19(1). — P. 141–150.
16. Norhammar A., Tenerz A., Nilsson G. et al. Glucose metabolism in patients with acute myocardial infarction and no previous diagnosis of diabetes mellitus in prospective study // Lancet. — 2002. — Vol. 359. — P. 2140–2144.
17. Landmesser U., Wollert K.C., Drexler H. Potential novel pharmacological therapies for myocardial remodelling // Cardiovasc. Res. — 2009. — Vol. 81. — P. 519–527.
18. Owan T.E., Hodge D.O., Herges R.M. et al. Trends in prevalence and outcome of heart failure with preserved ejection fraction // N. Engl. J. Med. — 2006. — Vol. 355. — P. 251–259.
19. Metra M., Savina Nodari S., Parrinello G. et al. Worsening renal function in patients hospitalised for acute heart failure: Clinical implications and prognostic significance // Eur. J. Heart Fail. — 2008. — Vol. 10. — P. 188–195.
20. Jessup M., Abraham W.T., Casey D.E. Focused Update: ACCF/AHA Guidelines for the Diagnosis and Management of Heart Failure in Adults // Circ. — 2009. — Vol. 119. — P. 1977–2016.

/31/31.jpg)