Журнал «Медицина неотложных состояний» 6 (37) 2011
Вернуться к номеру
Послеоперационная боль и обезболивание: современное состояние проблемы
Авторы: Овечкин А.М. Московская медицинская академия им. И.М. Сеченова Cвиридов С.В. Российский государственный медицинский университет, г. Москва
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
Эпидемиология послеоперационной боли. Проблема лечения послеоперационной боли остается актуальной как в нашей стране, так и за рубежом. По данным литературы, от выраженного болевого синдрома в послеоперационном периоде страдают от 30 до 75 % пациентов (Овечкин А.М., 2000; Harmer M., Davies К., 1998; Neugebauer E., 1998; Carr D., Goudas L., 1999; Chauvin M., 1999; Dolin S., 2002; Seers К., 2004).
На IV Конгрессе европейских ассоциаций по изучению боли (Прага, сентябрь 2003 г.) было отмечено, что не менее 35 % пациентов, перенесших плановые и экстренные хирургические вмешательства, страдают от послеоперационной боли. В одном из наиболее крупных исследований (около 20 000 пациентов хирургических отделений Великобритании) послеоперационные болевые ощущения средней интенсивности были отмечены в 29,7 % случаев (26,4–33 %), высокой интенсивности — в 10,9 % случаев (8,4–13,4 %) (Dolin S., Cashman J., 2002).
В России подобные масштабные исследования пока не проводились, поэтому можно руководствоваться только отдельными разрозненными данными. В частности, результаты, полученные нами в 1998–1999 годах при опросе 1550 пациентов трех различных клиник (двух московских и одной областной), выявили, что 40,7 % пациентов, перенесших плановые и экстренные операции, выразили неудовлетворенность качеством послеоперационного обезболивания (Овечкин А.М. и др., 2001).
Клиническое значение послеоперационного болевого синдрома. Сами по себе послеоперационные болевые ощущения представляют только видимую часть айсберга, являясь первопричиной развития патологического послеоперационного синдромокомплекса (табл. 1).
Послеоперационная легочная дисфункция — одна из основных причин послеоперационной летальности, особенно в торакальной хирургии и при вмешательствах на верхнем этаже брюшной полости. Дисфункция легких после верхнеабдоминальных и торакальных операций обусловлена болевым синдромом, нарушением функции диафрагмы, повышением тонуса нижних межреберных мышц и мышц брюшной стенки при выдохе. Затруднение откашливания, вызванное послеоперационной болью, нарушает эвакуацию бронхиального секрета, что способствует ателектазированию с последующим развитием легочной инфекции. Наиболее важной характеристикой легочной дисфункции является снижение функциональной остаточной емкости легких, развивающееся спустя 14–16 часов после операции, достигающее пика в интервале 24–48 часов и сохраняющееся в течение 7–14 дней. При этом нарушаются нормальные вентиляционно-перфузионные соотношения, возрастает эластическое и неэластическое сопротивление дыханию.
Боль сопровождается гиперактивацией симпатической нервной системы, что клинически проявляется тахикардией, гипертензией и повышением периферического сосудистого сопротивления. На этом фоне у пациентов высокого риска, особенно страдающих недостаточностью коронарного кровообращения, высока вероятность резкого увеличения потребности миокарда в кислороде с развитием острого инфаркта миокарда. По мере развития ишемии дальнейшее увеличение ЧСС и повышение АД увеличивают потребность в кислороде и расширяют зону ишемии. При этом ишемия миокарда чаще всего развивается в отсутствие существенных гемодинамических нарушений (за исключением некоторого увеличения частоты сердечных сокращений).
Активация симпатических нервов сердца может сыграть роль триггера вышеуказанных механизмов за счет стимуляции a-адренорецепторов и последующего спазма крупных эпикардиальных коронарных артерий, а также вызвать парадоксальный вазоконстрикторный ответ на внутренние вазодилататоры. Следовательно, адекватное лечение болевого синдрома и торможение симпатической активности в интра- и послеоперационном периоде являются важными факторами профилактики кардиальных осложнений.
Активация симпатической системы сопровождается резким повышением плазменной концентрации катехоламинов, являющихся прокоагулянтами, что способствует развитию тромбоэмболических осложнений. Дополнительным фактором риска является длительная иммобилизация пациентов, обусловленная неадекватной анальгезией. В 2000 году A. Rogers et al. представили анализ причин послеоперационной летальности по данным 35 рандомизированных исследований (табл. 2). Очевидно, что недостаточная модуляция активности симпатоадреналовой системы в интра- и послеоперационном периоде, а также нарушения дренажа мокроты и ателектазирование оказывают существенное влияние на выживаемость пациентов в хирургии.

Активация симпатической нервной системы на фоне болевого синдрома повышает тонус гладкой мускулатуры кишечника со снижением перистальтической активности и развитием послеоперационного пареза. Парентеральное и эпидуральное введение морфина может усиливать и продлевать данный эффект, в то время как эпидуральное введение местных анестетиков способствует его разрешению.
И наконец, интенсивная ноцицептивная стимуляция сегментарных структур ЦНС может привести к расширению рецепторных полей спинальных нейронов и повышению чувствительности нейронов задних рогов спинного мозга. Результатом является формирование хронических послеоперационных нейропатических болевых синдромов, в основе которых лежат вышеупомянутые пластические изменения ЦНС.
Формирование хронического послеоперационного болевого синдрома. Хронический послеоперационный болевой синдром (ХПБС) является одним из вероятных нежелательных последствий хирургического вмешательства. Проблема ХПБС (по существу, являющегося ятрогенным страданием) впервые была поднята в 90-е годы XX века. Для того чтобы боль была классифицирована как хроническая послеоперационная, она должна отвечать следующим критериям:
— развиться после перенесенного хирургического вмешательства;
— длиться не менее 2 месяцев;
— должны быть исключены другие причины этой боли (новообразование, хроническое воспаление и т.д.).
Анализ баз данных с 1966 по 1998 год (Perkins F., Kehlet H., 2000) позволил сделать вывод о высокой частоте развития ХПБС у пациентов, перенесших плановые и экстренные хирургические операции. Подсчитано, что частота постторакотомического ХПБС приближается к 45 %, постмастэктомического — к 35–38 %, после «открытых» холецистэктомий ХБС развивается приблизительно в 25 % случаев, у пациентов, перенесших операции по поводу паховых грыж, так называемый генитофеморальный болевой синдром возникает в 10–12 % случаев и т.д. (Perkins F., Kehlet H., 2000).
Развитие послеоперационного ХБС является серьезной медико-социальной проблемой, имеющей, кроме всего прочего, большое экономическое значение. По некоторым подсчетам, стоимость лечения ХПБС, развившегося у 30-летнего пациента, к концу его жизни достигает 1 000 000 $. В связи с этим основная задача повышения эффективности послеоперационного обезболивания на современном этапе — профилактика хронизации острого ХПБС.
Краткая патофизиология острого послеоперационного болевого синдрома. Формирование многокомпонентного болевого ощущения обеспечивается многоуровневой ноцицептивной системой, включающей сеть периферических ноцицепторов и центральных нейронов, расположенных в различных структурах ЦНС и реагирующих на повреждающее воздействие.
Основные уровни формирования болевого синдрома включают в себя:
1) трансдукцию — повреждающее воздействие, вызывающее электрическую активацию свободных нервных окончаний афферентных аксонов, расположенных в тканях (т.е. формирование первичного ноцицептивного импульса);
2) трансмиссию — передачу ноцицептивных импульсов по афферентным аксонам из зоны повреждения в спинной мозг;
3) модуляцию — подавление интернейронами II пластины задних рогов спинного мозга высвобождения нейротрансмиттеров из ноцицептивных нейронов, т.е. препятствие активации нейронов 2-го порядка;
4) перцепцию — обработку ноцицептивной информации в коре головного мозга, формирование ощущений и эмоционально-аффективных компонентов боли.
Развитие болевого синдрома связано с формированием зон гиперальгезии, т.е. повышенной болевой чувствительности (зоны сниженных болевых порогов). Различают первичную и вторичную гиперальгезию. Первичная гиперальгезия быстро развивается в непосредственной близости от раны, в зоне поврежденных тканей. Патофизиологической основой первичной гиперальгезии является избыточное повышение чувствительности (сенситизация) болевых рецепторов (ноцицепторов). При повреждении тканей происходит активация синтеза метаболитов арахидоновой кислоты. Сенситизация периферических ноцицепторов обусловлена действием медиаторов боли (алгогенов), выделяющихся из плазмы крови, поврежденных клеток, а также из окончаний С-афферентных волокон.
В настоящее время большое значение в инициации периферических механизмов ноцицепции отводится брадикинину, который может оказывать как прямое, так и непрямое действие на ноцицепторы, стимулируя синтез медиаторов воспаления (в частности, простагландинов Е), в фибробластах, тучных клетках, макрофагах и других тканевых элементах. В свою очередь, простагландины существенно усиливают гиперальгезию, повышая чувствительность сенсорных нервных окончаний к действию медиаторов боли.
Позднее вне зоны повреждения формируется вторичная гиперальгезия. Область вторичной гиперальгезии располагается не только вокруг зоны повреждения, но и на удалении от нее. Она развивается в результате включения центральных механизмов сенситизации ноцицептивных нейронов, располагающихся в задних рогах спинного мозга. В частности, повышается их возбудимость, спонтанная электрическая активность и чувствительность к механической стимуляции. Одним из основных механизмов центральной сенситизации является развитие феномена «взвинчивания» активности ноцицептивных нейронов задних рогов спинного мозга, проявляющгося прогрессивным увеличением частоты потенциалов действия, генерируемых ноцицептивными нейронами в ответ на повторную стимуляцию С-афферентов.
При стимуляции С-волокон усиливается выработка возбуждающей аминокислоты — глутамата, воздействующей на рецепторы ноцицептивных нейронов. При продолжающейся стимуляции происходит гиперсекреция нейропептидов — субстанции Р, нейрокинина А, которые, действуя на соответствующие рецепторы, возбуждают ноцицептивные нейроны и потенцируют возбуждающее действие глутамата через N-метил-D-аспартат (NMDA-рецепторы). Нейрокинины деполяризуют клеточную мембрану, удаляя из ионных каналов NMDA-рецепторов блокирующие их ионы Mg2+. После этого глутамат воздействует на NMDA-рецепторы, увеличивая активное поступление ионов Са2+ в клетку и вызывая развитие длительной деполяризации. Введение антагонистов NMDA-рецепторов препятствует развитию центральной сенситизации.
«Расползание» зоны избыточной болевой чувствительности вокруг операционной раны обусловлено расширением рецептивных полей нейронов задних рогов спинного мозга. Данный процесс происходит на протяжении 12–18 часов, что в значительном проценте случаев обусловливает усиление интенсивности послеоперационных болевых ощущений ко 2-м суткам после операции.
Развитие вторичной гиперальгезии не только усиливает интенсивность острого болевого синдрома, но и является пусковым моментом для его хронизации. В настоящее время выявлены причинно-следственные связи между травматичностью операции, интенсивностью послеоперационного болевого синдрома и вероятностью формирования ХБС. В частности, известно, что раннее развитие ПБС (в течение первых 4 часов после операции), его интенсивный характер и длительное существование являются основными факторами риска развития ХПБС.
Задачи послеоперационного обезболивания:
— Повышение качества жизни пациентов в послеоперационном периоде.
— Ускорение послеоперационной функциональной реабилитации.
— Снижение частоты послеоперационных осложнений.
— Ускорение выписки пациентов из клиники.
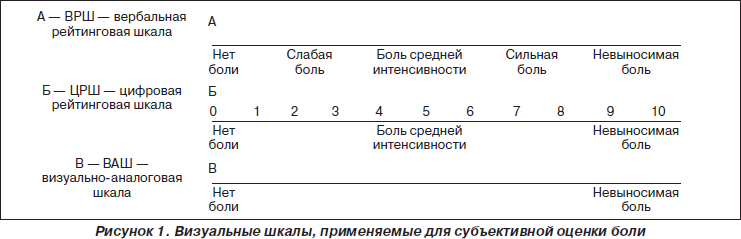
Оценка боли является важным элементом послеоперационного обезболивания. В повседневной клинической практике обычно используются визуальные шкалы (рис. 1), из которых наиболее распространенной является 10-балльная (или 100-балльная) визуально-аналоговая шкала (ВАШ). Эта шкала представляет собой отрезок длиной 10 см (100 мм), без делений и цифр, начало которого имеет обозначение «боли нет», а окончание — «невыносимая боль». Пациент делает отметку на этом отрезке в точке, которая отражает интенсивность его боли.
Принципы адекватной оценки боли:
— Исследование интенсивности боли обязательно осуществляется как в покое, так и при движениях пациента (подъем головы, кашель), что позволяет оценить его функциональный статус (табл. 3).
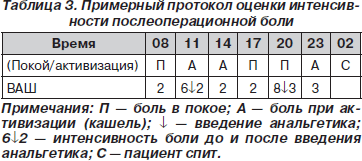
— Эффективность обезболивания определяется оценкой интенсивности боли до и после назначения каждого анальгетика или метода анальгезии.
— В хирургических ОРИТ и прочих подразделениях, где находятся пациенты с болью высокой интенсивности, оценка на начальном этапе лечения осуществляется каждые 30 минут, а затем, по мере снижения интенсивности, каждые 2 часа.
— В хирургических отделениях периодичность оценки интенсивности боли составляет 4–8 часов, что зависит как от выраженности боли, так и от эффективности обезболивания.
— При решении вопроса о необходимости обезболивания необходимо ориентироваться на критерии максимально допустимой интенсивности боли (пороги вмешательства). В частности, по 10-балльной визуально-рейтинговой шкале максимально допустима интенсивность боли 3 балла в покое и 4 балла при движениях (кашле).
— Внезапное усиление интенсивности боли, особенно связанное с появлением гипотензии, тахикардии, лихорадки, требует немедленной комплексной оценки состояния пациента, поскольку может быть связано с развитием хирургических осложнений, тромбоза глубоких вен и т.д.
Информирование пациентов. Успех обезболивания во многом зависит от степени информированности пациентов и их веры в компетентность врача. В связи с этим целесообразно предоставить пациентам детальную информацию о послеоперационной боли и способах борьбы с ней. Подобная информация обычно включает:
— сведения о важности лечения послеоперационной боли;
— доступные методы послеоперационного обезболивания;
— способы оценки боли.
Современные возможности лечения послеоперационной боли
В уже упоминавшемся исследовании, выполненном нами в конце 1990-х годов, было установлено, что 39,7 % пациентов после достаточно травматичных (в том числе открытых абдоминальных) операций получали в качестве анальгетика, и зачастую единственного (!), метамизол и метамизолсодержащие препараты. По данным опроса, проведенного независимой компанией в сентябре 2004 года среди врачей хирургических специальностей (313 человек) в ряде крупных городов России, наиболее часто назначаемым инъекционным анальгетиком для послеоперационного обезболивания является метамизол (34 %). Второе место по частоте назначения (20 %) занимает промедол. Для сравнения, аналогичный опрос, проведенный среди участников конгресса «Евроанестезия-2005» (Вена, июнь 2005 г.), дал следующие результаты: 1) морфин — частота назначения 73 %; 2) парацетамол для внутривенного введения — 61 %.
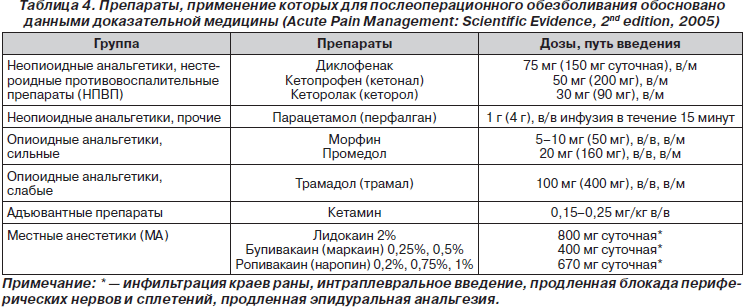
В большинстве развитых стран послеоперационное обезболивание осуществляется в соответствии с принятыми национальными и международными стандартами. По ряду причин они не могут быть полностью приняты на вооружение в Российской Федерации (приказы, ограничивающие назначения опиоидных анальгетиков, отсутствие разрешений на способы применения некоторых препаратов, отсутствие возможности широкого применения методов контролируемой пациентом анальгезии и т.д.). Тем не менее в определенной степени можно руководствоваться международными рекомендациями, в частности Acute Pain Management: Scientific Evidence (2005), суммировавшими данные доказательной медицины об эффективности различных средств и методов послеоперационной анальгезии, а также руководством Postoperative Pain Management — Good Clinical Practice (2005), переведенным на русский язык.
В настоящее время во многих клиниках внедрена формулярная система использования лечебных препаратов тех или иных групп, целесообразность применения которых подтверждена данными доказательной медицины, а также обусловлена потребностями и особенностями конкретного лечебного учреждения. Мы полагаем, что все хирургические подразделения, а также отделения анестезиологии, реанимации и интенсивной терапии должны иметь в своем арсенале только те анальгетики и анестетики, эффективность и безопасность назначения которых подтверждена доказательствами I (систематизированные обзоры и метаанализы) и II (рандомизированные контролируемые исследования с определенными результатами) уровня (табл. 4).
Опиоидная анальгезия и способы ее оптимизации
Традиционно системное введение опиоидных анальгетиков рассматривалось в качестве основы послеоперационного обезболивания. В то же время данные препараты не являются золотым стандартом лечения острой боли. По оценкам зарубежных специалистов, эффективность обезболивания при традиционном назначении опиоидов в качестве монотерапии не превышает 25–30 %. Проблема заключается в том, что эффективная анальгетическая доза зачастую близка к той, которая вызывает депрессию дыхания.
Наиболее эффективные попытки улучшения качества послеоперационной опиоидной анальгезии основаны на оптимизации способов введения препаратов. Самым современным методом является контролируемая пациентом анальгезия (КПА), в наибольшей степени ориентированная на индивидуальные потребности пациента в обезболивании. При необходимости, нажав на кнопку дистанционного устройства, пациент сам себе вводит дополнительный болюс анальгетика, что придает ему ощущение независимости и уверенности, а также облегчает работу среднего медперсонала.
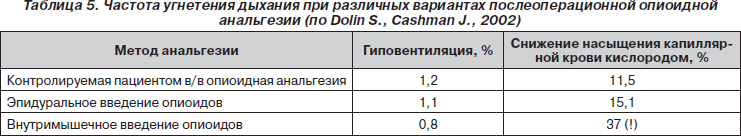
Надо сказать, что высокотехнологичные методы послеоперационного обезболивания, такие как КПА и ЭА, проводимая посредством непрерывной эпидуральной инфузии, в развитых странах в совокупности применяются у 35–50 % пациентов, перенесших хирургические вмешательства. Данные методы характеризуются высокой эффективностью и сравнительной безопасностью. В уже упоминавшемся крупном британском исследовании (Dolin S., Cashman J., 2002) была проанализирована частота депрессии дыхания при использовании опиоидов посредством внутривенной КПА, а также при их внутримышечном и эпидуральном введении (табл. 5).
Полученные данные свидетельствуют о том, что стандартом мониторинга при опиоидной анальгезии должна быть пульсоксиметрия, лучше в сочетании с капнографией.
Широкое развитие контролируемой пациентом опиоидной анальгезии в нашей стране ограничено: а) дефицитом инфузионных помп, имеющих модуль для КПА; б) проблемами учета и списывания опиоидных анальгетиков. Например, для проведения КПА промедолом шприц инфузионной помпы (50–60 мл) должен быть заполнен 100 мг препарата. При списывании 5 ампул промедола на одного больного в сутки могут возникнуть вопросы как у администрации клиники, так и у представителей структур, контролирующих расход наркотических анальгетиков в медицинских учреждениях.
В заключение данного параграфа приведем некоторые постулаты доказательной медицины, касающиеся послеоперационного назначения опиоидных анальгетиков (Acute Pain Management: Scientific Evidence, 2nd edition, 2005):
1. Частота клинически значимых побочных эффектов опиоидов имеет дозозависимый характер (доказательства II уровня).
2. У взрослых пациентов возраст в большей степени, чем масса тела, определяет требуемую дозу опиоидов (доказательства IV уровня).
3. Нарастание уровня седации является более ранним признаком угнетения дыхания опиоидами, чем снижение частоты дыхания.
Нестероидные противовоспалительные препараты
Важнейшая роль тканевого воспаления в механизмах центральной сенситизации, а следовательно, и в формировании хронической боли является показанием для обязательного включения в схему лечения послеоперационной боли НПВП. За счет подавления воспалительного ответа на хирургическую травму НПВП препятствуют развитию сенситизации периферических ноцицепторов. Можно утверждать, что НПВП являются средствами патогенетической терапии боли (Осипова Н.А., 1998; Овечкин А.М., 2000).
Из препаратов, имеющих форму для парентерального введения и подавляющих активность циклооксигеназы как 1-го, так и 2-го типа, наибольшее применение находят диклофенак, кеторолак и кетопрофен (табл. 4), включенные во все европейские рекомендации и протоколы послеоперационного обезболивания.
С точки зрения патофизиологии острой боли оптимальным считается введение 1-й дозы НПВП за 30–40 минут до кожного разреза (принцип предупреждающей анальгезии). Такая методика позволяет существенно снизить интенсивность боли и потребность в послеоперационном назначении опиоидных анальгетиков (Осипова Н.А. и др., 1999; Овечкин А.М., 2000).
Не так давно были получены данные о положительном влиянии НПВП на выживаемость пациентов, перенесших обширные хирургические вмешательства, в том числе и осложненные абдоминальной хирургической инфекцией. Простагландин Е2 способствует белковому распаду, причем этот эффект усиливается на фоне лихорадки и сепсиса. НПВП способны уменьшить потерю мышечной массы за счет подавления синтеза PGE2 и снижения деградации протеина. Оценивая потери азота в послеоперационном периоде у пациентов, которым проводилась длительная ЭА, установили, что комбинирование ЭА с НПВП позволяет снизить потери азота на 75–80 % в первые трое суток после операции по сравнению с контрольной группой, получавшей только ЭА (Asoh Т., 1987).
Не оправдались опасения того, что НПВП повышают риск образования эпидуральных гематом у пациентов с длительной ЭА. Исследование, включившее 2290 пациентов, которые получали в послеоперационном периоде максимальные дозы кеторолака (25 % от общего количества пациентов) и кетопрофена (85 %) на фоне длительной эпидуральной инфузии местных анестетиков, не выявило ни одного подобного осложнения (Bolivar M., 1999).
На протяжении длительного времени НПВП использовались для обезболивания преимущественно после внеполостных вмешательств (ортопедия и т.п.), поскольку их применение в абдоминальной хирургии считалось опасным в отношении развития геморрагических осложнений. Активное включение НПВП в схемы мультимодальной анальгезии после полостных операций стало возможным благодаря появлению новых безопасных препаратов.
Большие надежды были связаны с внедрением в клиническую практику селективных ингибиторов циклооксигеназы 2-го типа (ЦОГ-2). На сегодняшний день из препаратов данной группы доступны мелоксикам, нимесулид, целекоксиб, эторикоксиб и парекоксиб. Теоретически селективные ингибиторы ЦОГ-2 должны иметь клиническое преимущество перед другими НПВП. Сохраняя сопоставимый с ними анальгетический эффект, они не подавляют физиологическую продукцию простагландинов тканями, что должно сопровождаться снижением числа присущих НПВП побочных эффектов (ульцерогенное влияние на ЖКТ, нарушения тромбоцитарного звена гемостаза, нефротоксический эффект).
Тромбоциты продуцируют только ЦОГ-1, cледовательно, селективные ингибиторы ЦОГ-2 не оказывают влияния на их функцию. Данный факт подтвержден клинически снижением кровопотери в интра- и раннем послеоперационном периоде по сравнению с использованием неселективных НПВП. При этом надо отметить, что в большинстве контролируемых исследований не выявлено достоверного влияния неселективных НПВП на увеличение интраоперационной кровопотери. В связи с этим отсутствие антитромбоцитарного эффекта ингибиторов ЦОГ-2, очевидно, является основанием для их преимущественного использования у пациентов с геморрагическими диатезами, с параллельным назначением антикоагулянтов, нейроаксиальной анестезией, предполагаемой большой кровопотерей.
В последние годы неоднократно поднимался вопрос о крайне нежелательном тромбогенном потенциале селективных ингибиторов ЦОГ-2. Препараты этого типа угнетают продукцию эндотелиального простациклина, сохраняя при этом синтез тромбоксана тромбоцитами, а также их способность к агрегации. В ряде исследований был выявлен повышенный риск развития инфаркта миокарда у пациентов, получавших селективные НПВП.
В настоящее время селективные ингибиторы ЦОГ-2 являются предметом пристальных международных исследований, направленных на изучение безопасности их применения у пациентов с патологией сердечно-сосудистой системы (перенесших острый инфаркт миокарда, страдающих стенокардией, гипертонией и т.д.). Рофекоксиб был отозван компанией-производителем с рынка, использование вальдекоксиба временно приостановлено до получения дополнительных данных о частоте кардиоваскулярных осложнений, а также побочных воздействий препарата на кожу и слизистые оболочки. Парекоксиб, инъекционный селективный ингибитор ЦОГ-2, в настоящее время доступен в клинике и рекомендован для кратковременного применения с целью послеоперационного обезболивания. Все НПВП у пациентов с патологией сердечно-сосудистой системы должны использоваться с осторожностью.
Парацетамол
Из всех неопиоидных анальгетиков парацетамол является наиболее безопасным и характеризуется наилучшим соотношением «цена — качество».
Механизм действия парацетамола отличается от НПВП. По сравнению с опиоидами и НПВП соответственно, парацетамол не имеет эндогенных рецепторов и практически не подавляет активность циклооксигеназы на периферии. Появляется все больше доказательств центрального антиноцицептивного эффекта парацетамола. Вероятные механизмы его включают: а) подавление активности ЦОГ-2 в ЦНС (профилактика развития вторичной гиперальгезии); б) подавление активности ЦОГ-3 (существование которой предполагается и которая, видимо, обладает селективной чувствительностью к парацетамолу); в) усиление активности нисходящих тормозных серотонинергических путей. Парацетамол препятствует продукции простагландина на уровне клеточной транскрипции, т.е. независимо от уровня активности ЦОГ; является эффективным анальгетиком, потенциал которого лишь несколько уступает стандартным дозам морфина или НПВП.
Появление внутривенной формы парацетамола существенно повысило ценность и расширило показания к применению препарата в качестве базисного компонента мультимодальной послеоперационной анальгезии. Внутривенный парацетамол превосходит таблетированные формы по безопасности, поскольку характеризуется более предсказуемой плазменной концентрацией в раннем послеоперационном периоде. При пероральном назначении выявлены значительные колебания концентрации парацетамола в плазме в раннем послеоперационном периоде, в том числе достижение опасно высоких уровней, по сравнению с внутривенным применением (Petterson P., 2004).
В настоящее время в Европе парацетамол в послеоперационном периоде получают 90–95 % пациентов. Обычно препарат вводят внутривенно во время операции, примерно за 30 минут до ее окончания, что обеспечивает спокойное, безболезненное пробуждение. Как мы уже упоминали, отсутствие боли в течение первых 4–5 часов после операции положительно влияет на последующую динамику болевого синдрома. Повторно 1 г парацетамола вводят через 4 часа, а затем каждые 6 часов (максимальная доза — 4 г в сутки). Через 1–3 дня применения внутривенного парацетамола пациентов переводят на его пероральную форму, которая является основным анальгетиком, назначаемым при выписке из клиники.
В связи с вероятностью возникновения побочных эффектов при назначении как традиционных НПВП, так и селективных ингибиторов ЦОГ-2 пациентам с патологией сердечно-сосудистой системы можно полагать, что парацетамол в ближайшее время будет играть все большую роль в послеоперационном обезболивании (Hillis W., 2002).
Приведем некоторые данные доказательной медицины, касающиеся эффективности и целесообразности применения НПВП и парацетамола (Acute Pain Management: Scientific Evidence, 2nd edition, 2005):
1. Парацетамол является эффективным препаратом для лечения острой боли (доказательства I уровня, Кокрановская база данных).
2. Сочетание НПВП с парацетамолом повышает эффективность обезболивания (доказательства I уровня).
3. НПВП и селективные ингибиторы ЦОГ-2 являются эквипотенциальными эффективными анальгетиками для лечения острой боли (доказательства I уровня, Кокрановская база данных).
4. Ингибиторы ЦОГ-2 и НПВП оказывают равное побочное действие на функцию почек (доказательства I уровня).
5. Парацетамол, НПВП и ингибиторы ЦОГ-2 являются важнейшими компонентами мультимодальной анальгезии (доказательства II уровня).
6. Риск негативного влияния НПВП и ингибиторов ЦОГ-2 повышается у пациентов с исходной почечной недостаточностью различной степени, гиповолемией, гипотензией, параллельным назначением прочих нефротоксичных препаратов.
Антагонисты NMDA-рецепторов
Кетамин является уникальным внутривенным анестетиком, обладающим свойствами анальгетика. Известные побочные эффекты кетамина привели к тому, что в конце 1980-х годов он «впал в немилость». В то же время необходимо знать, что использование малых доз кетамина (0,1–0,2 мг/кг в/в) характеризуется опиоидсберегающим эффектом, повышением качества обезболивания и минимумом побочных эффектов (Kohrs R., Direux M., 1998). В ряде исследований описано успешное применение малых доз кетамина в сочетании с регионарной и/или опиоидной анальгезией. Болюсное введение одной дозы кетамина (0,1–0,15 мг/кг в/в) во время операции вызывает отчетливый опиоидсберегающий эффект в послеоперационном периоде у пациентов, перенесших ортопедические и абдоминальные операции (Fu E., 1997; Menigaux С., 2001).
Интересно отметить, что средние дозы кетамина (250 мкг/кг) в послеоперационном периоде способны повысить качество обезболивания у пациентов, резистентных к опиоидным анальгетикам. Как известно, при использовании значительных доз опиоидов короткого действия (фентанил, суфентанил) может остро развиться стойкая опиоидиндуцированная гиперальгезия. Для профилактики данного состояния используют повторные введения малых доз кетамина (Laulin J., 2002).
Целесообразность использования кетамина в схеме послеоперационного обезболивания подтверждена данными доказательной медицины (Acute Pain Management: Scientific Evidence, 2nd edition, 2005):
1. Кетамин оказывает опиоидсберегающий эффект при назначении в послеоперационном периоде, но не снижает частоту индуцированных опиоидами побочных эффектов (доказательства I уровня).
2. Кетамин, как антагонист NMDA-рецепторов, может оказывать эффект предупреждающей анальгезии (доказательства I уровня).
3. Кетамин повышает качество обезболивания у пациентов с интенсивной послеоперационной болью, резистентной к назначению опиоидов (доказательства II уровня).
Прочие неопиоидные анальгетики
Болюсное внутривенное введение 50 мг/кг магнезии в процессе индукции анестезии повышает качество обезболивания, обеспечивает комфортное состояние и снижает потребность в опиоидных анальгетиках у пациентов, перенесших большие ортопедические операции (Levaux С., 2003). В то же время не удалось выявить опиоидсберегающего эффекта после внутривенного введения магнезии 50 мг/кг у пациентов, перенесших открытые холецистэктомии.
Габапентин (структурный аналог гамма-аминомасляной кислоты) является антиконвульсантом, достаточно широко используемым для лечения хронической нейропатической боли. Может использоваться в качестве адъювантного препарата и в комплексной терапии острой послеоперационной боли. В частности, пероральное назначение 1,2 г габапентина в качестве премедикации позволяет достоверно снизить послеоперационную потребность в анальгетиках (Dirks J., 2002).
Двухвалентный катион магния также обладает антиноцицептивными свойствами. Установлено, что болюсное внутривенное введение магния в дозе 30 мг/кг с последующей послеоперационной инфузией со скоростью 0,5 г/ч приводит к существенному снижению потребности в анальгетиках у пациенток, перенесших абдоминальную гистерэктомию (Kara H., 2002).
Имеются доказательные данные (Acute Pain Management: Scientific Evidence, 2nd edition, 2005) о том, что периоперационное назначение габапентина снижает интенсивность послеоперационной боли и потребность в опиоидных анальгетиках (доказательства I уровня).
Регионарная анальгезия
Важнейшей задачей мультимодальной анальгезии является прерывание афферентного потока ноцицептивных стимулов от периферических болевых рецепторов в органах и тканях к сегментарным структурам ЦНС (задним рогам спинного мозга). Эта задача может быть успешно решена при помощи различных методов регионарной анальгезии (РА). Все более широкое внедрение методов РА в схемы обезболивания обусловлено в первую очередь осознанием специалистами их положительного влияния на патофизиологию раннего послеоперационного периода, а также возросшим уровнем безопасности их применения. Огромную роль в расширении применения методов РА сыграло появление современных местных анестетиков (МА), а также одноразовых средств их доставки к органам и тканям.
В последние 2–3 года были суммированы и проанализированы данные доказательной медицины, характеризующие целесообразность применения тех или иных вариантов РА для послеоперационного обезболивания в различных областях хирургии.
Эпидуральная анальгезия занимает ключевую позицию среди всех регионарных методов послеоперационного обезболивания. В глобальном масштабе эффективность ЭА как метода послеоперационного обезболивания достаточно хорошо подтверждена данными мультицентровых контролируемых исследований. Метаанализ результатов исследований, представленных в базе данных Medline с 1966 по 2002 год, свидетельствует о более высокой эффективности продленной послеоперационной ЭА по сравнению с системным введением опиоидных анальгетиков (Block В., 2003; Werawatganon Т., Charuluxanum S., 2004; в обоих случаях доказательства I уровня, Кокрановская база данных). В частности, средняя интенсивность послеоперационной боли составляет 1,94 балла (по 10-балльной визуально-аналоговой шкале) на фоне ЭА и 2,94 балла на фоне системного введения опиоидов.
У пациентов, которым проводилась послеоперационная ЭА в течение не менее 24 часов, выявлено снижение частоты послеоперационных тромбозов глубоких вен на 44 %, тромбоэмболии легочной артерии — на 50 %, легочных инфекционных осложнений — на 39 %, потребности в гемотрансфузии — на 50 % (Rogers A. et al., 2000; доказательства I уровня).
Годом позже Н. Kehlet и К. Holte (2001) представили убедительные данные о положительном влиянии послеоперационной ЭА на частоту осложнений послеоперационного периода в целом (доказательства I уровня).
Поясничная ЭА (ПЭА) широко используется для обезболивания после ортопедических, урологических операций, вмешательств на сосудах нижних конечностей и т.д. У пациентов, перенесших операции протезирования крупных суставов, она обеспечивает лучшее качество обезболивания по сравнению с парентеральным введением опиоидных анальгетиков, особенно при их активизации (Choi P. et al., 2003; доказательства I уровня, Кокрановская база данных).
В сосудистой хирургии ПЭА улучшает результаты хирургического лечения за счет снижения частоты тромбозов аутовенозных шунтов (Christopherson et al., 1993; доказательства II уровня).
Грудная ЭА (ГЭА) широко используется для обезболивания после обширных абдоминальных и торакальных операций. В одном из исследований, выполненных в Австралии, было отмечено, что 10 из 12 клиник, выполнявших более 100 торакотомий в год, используют высокую ЭА в качестве рутинного метода послеоперационного обезболивания (Cook Т., Riley R., 1997). В том же исследовании было установлено, что чаще всего ГЭА выполняется на среднегрудном уровне (> 90 %); в 95 % случаев используется комбинация МА и опиоидов (фентанил); основным методом ЭА является непрерывная инфузия (в 100 % случаев), длительность которой в 80 % случаев превышает 3 суток. Добавление фентанила к растворам МА достоверно повышает качество обезболивания в покое на протяжении 24 часов после операции, а при активизации пациентов — в течение 72 часов после операции.
На фоне грудной ЭА достоверно повышается РаО2 и снижается частота послеоперационных легочных осложнений по сравнению с пациентами, которым обезболивание проводилось при помощи системного введения опиоидов (Ballantyne J., 1998; доказательства I уровня).
Грудная ЭА в сочетании с внутривенным или внутримышечным введением нестероидных противовоспалительных препаратов и адекватной нутритивной поддержкой снижает послеоперационные потери белка в сравнении с внутривенной опиоидной анальгезией, сочетающейся с нутритивной поддержкой (Barratt S., 2000; доказательства II уровня).
В тех случаях, когда ГЭА продлевается на срок более 24 часов, проявляется ее дополнительное преимущество — снижение частоты острой ишемии миокарда в послеоперационном периоде (Beattie W., 2001; доказательства I уровня).
У пациентов с множественными переломами ребер ГЭА достоверно снижает риск развития нозокомиальной пневмонии, а также потребность в проведении искусственной вентиляции легких (ИВЛ) (Bulger E. et al., 2004; доказательства II уровня).
ГЭА у пациентов, перенесших аортокоронарное шунтирование, позволяет в ранние сроки экстубировать больных, снизить интенсивность послеоперационной боли как в покое, так и при активизации, а также уменьшить частоту нарушений ритма, легочных осложнений по сравнению с внутривенной опиоидной анальгезией. При этом она не оказывает достоверного влияния на частоту послеоперационных острых инфарктов миокарда и летальность (Liu S. et al., 2004; доказательства I уровня).
Суммировать преимущества ЭА в послеоперационном периоде с точки зрения доказательной медицины (Acute Pain Management: Scientific Evidence, 2nd edition, 2005) можно следующим образом:
1. При всех типах хирургических операций ЭА обеспечивает более высокое качество обезболивания в сравнении с парентеральным введением опиоидов (доказательства I уровня, Кокрановская база данных).
2. ЭА улучшает показатели газообмена и снижает частоту послеоперационных легочных осложнений по сравнению с опиоидной анальгезией (доказательства I уровня).
3. Грудная ЭА, достигнутая введением местных анестетиков, ускоряет восстановление функции желудочно-кишечного тракта после абдоминальных операций (доказательства I уровня).
4. Грудная ЭА, пролонгированная на срок более 24 часов, снижает частоту послеоперационных инфарктов миокарда (доказательства I уровня).
5. ЭА не повышает частоту несостоятельности анастомозов у пациентов, оперированных на желудочно-кишечном тракте (доказательства I уровня).
6. Грудная ЭА снижает частоту пневмоний и потребность в переводе на ИВЛ у пациентов с множественными переломами ребер (доказательства II уровня).
7. Сочетанное применение ЭА местными анестетиками и нутритивной поддержки снижает послеоперационные потери белка у пациентов, оперированных на органах верхнего этажа брюшной полости (доказательства II уровня).
8. Поясничная ЭА снижает частоту тромбозов аутовенозных шунтов при реваскуляризирующих операциях на нижних конечностях (доказательства II уровня).
При послеоперационной ЭА введение МА осуществляется небольшими болюсами (5–7 мл 0,5% бупивакаина или 0,75–1% ропивакаина) в режиме «шаг за шагом» с ориентацией на анальгетический эффект, гемодинамические показатели и т.д. или же в режиме непрерывной инфузии (ропивакаин 0,2%, бупивакаин 0,125–0,25%) со скоростью 4–10 мл МА в час.
Преимущества эпидуральной инфузии МА по сравнению с болюсным режимом введения:
— Стабильный уровень анальгезии.
— Отсутствие выраженных изменений гемодинамики.
— Меньшая выраженность моторной блокады или ее полное отсутствие.
— Минимальный риск инфицирования эпидурального катетера.
Блокады периферических нервов и сплетений
Блокады периферических нервов и сплетений обеспечивают прекрасный анальгетический эффект, не оказывая влияния на уровень сознания, не угнетая дыхание и гемодинамику. Кроме того, они выгодны с экономической точки зрения.
Наибольшее применение имеют блокады плечевого сплетения после операций на верхней конечности, блокады бедренного и седалищного нервов после операций на нижних конечностях, а также интраплевральная блокада.
Имеются доказательные данные о том, что продленная блокада плечевого сплетения из межлестничного доступа характеризуется более высоким качеством анальгезии и удовлетворенности пациентов после операции на плече и плечевом суставе по сравнению с внутривенным введением опиоидных анальгетиков (Borgeat et al., 2000; Klein et al., 2000; доказательства II уровня).
Наряду с этим в настоящий момент нет доказательных данных об эффективности продленной послеоперационной блокады плечевого сплетения из подмышечного доступа у пациентов, перенесших операций на дистальной части верхней конечности.
Продленная блокада бедренного нерва (часто именуемая как блок 3 в 1, поскольку при введении катетера в фасциальный футляр бедренного нерва появляется возможность одновременно блокировать боковой кожный нерв бедра и запирательный нерв) обеспечивает более высокое качество анальгезии и создает оптимальные условия для ранней реабилитации пациентов по сравнению с внутривенным введением морфина (Syndelin et al., 1998; доказательства II уровня). Полагают, что эффективность данной методики сопоставима с эффективностью продленной ЭА у пациентов, перенесших операции тотального эндопротезирования коленного сустава (Capdevila et al., 1999; доказательства II уровня), а также тотального эндопротезирования тазобедренного сустава (Syndelin, Gouverneur, 1999; доказательства III уровня). Она характеризуется меньшей частотой тошноты и рвоты по сравнению с внутривенной опиоидной анальгезией, а также меньшим влиянием на показатели центральной гемодинамики и способностью к самостоятельному мочеиспусканию по сравнению с ЭА.
У пациентов, перенесших операции тотального эндопротезирования коленного сустава, сочетанное применение блокады седалищного и бедренного нервов в послеоперационном периоде не имеет преимуществ по сравнению с изолированной блокадой бедренного нерва (Allen et al.; доказательства II уровня). Однако после операций на голени и стопе продленная блокада седалищного нерва в подколенной ямке обеспечивает более высокое качество обезболивания и минимум побочных эффектов по сравнению с анальгезией опиоидами (White et al., 2003; доказательства II уровня).
В настоящее время нет данных доказательной медицины, свидетельствующих о более высоком качестве интерплевральной анальгезии по сравнению с грудной эпидуральной анальгезией у пациентов, перенесших торакотомии (Mehta et al., 1998; доказательства II уровня). Продленная ЭА по эффективности превосходит блокаду межреберных нервов у пациентов, перенесших торакотомии (Debreceni et al., 2003; доказательства II уровня).
Прочие методы регионарной анальгезии. Внутрисуставное введение анестетиков и анальгетиков
Имеются доказательные данные о недостаточной эффективности внутрисуставного введения местных анестетиков для обезболивания после операций по восстановлению связочного аппарата коленного сустава (Moiniche et al., 1999; доказательства I уровня). Блокада бедренного нерва является более эффективным по сравнению с внутрисуставным введением МА методом обезболивания у пациентов, перенесших артроскопические реконструктивные операции (Iskendar et al., 2003; доказательства II уровня).
У пациентов, перенесших артроскопические операции на коленном суставе, умеренный анальгетический эффект (длительностью до 24 часов) может быть достигнут внутрисуставным введением опиоидных анальгетиков, в частности морфина в дозе не менее 5 мг (Kalso et al., 2002; доказательства I уровня). Внутрисуставное введение опиоидов не обеспечивает адекватной анальгезии у пациентов, перенесших тотальное эндопротезирование коленного сустава (Klassen et al., 1999).
Инфильтрация и орошение краев раны растворами МА
Инфильтрация краев раны МА длительного действия удлиняет время первого требования анальгетика в послеоперационном периоде. Данная методика особенно эффективна при операциях по поводу паховых грыж, когда безболевой период может достигать 7 часов.
Длительная инфузия растворов МА в течение 24–48 часов через катетер, установленный в ране, малоэффективна в абдоминальной хирургии, однако способна повысить качество обезболивания и снизить потребность в опиоидных анальгетиках у пациентов, перенесших операции на плечевом суставе, позвоночнике, связочном аппарате коленного сустава, а также после стернотомии (Dowling et al., 2003; White et al., 2003; Bianconi et al., 2003; во всех случаях доказательства II уровня).
Инфузия ропивакаина в зоне забора трансплантата из гребня подвздошной кости обеспечивает более высокое качество обезболивания в раннем послеоперационном периоде по сравнению с внутривенным введением опиоидов, кроме того, существенно снижает интенсивность боли в послеоперационной ране при активных движениях в течение первых 3 месяцев после операции (Blumenthal et al., 2005; доказательства II уровня).
Местные анестетики, используемые для послеоперационной регионарной анальгезии
Использование МА для послеоперационного обезболивания предусматривает их введение в болюсном режиме или в виде непрерывной инфузии в течение 24–72 часов, а иногда и в течение более длительного периода. При этом в плазме могут создаваться достаточно высокие концентрации препаратов. В частности, при повторном введении бупивакаина в дозе 2 мг/кг для блокады межреберных нервов с интервалом 6 часов вторичная пиковая концентрация препарата в плазме будет на 10 % превышать первичную. При длительной межлестничной инфузии 0,25% бупивакаина со скоростью 6–10 мл/ч (обезболивание после операций на верхней конечности) общая концентрация препарата в плазме на 2-е сутки увеличится приблизительно на 20 % по сравнению с 1-ми.
В данной ситуации особенно значимым является правильный выбор МА и режимов их дозирования, для того чтобы избежать проявления системных токсических эффектов, присущих данным препаратам. Системная токсичность МА проявляется негативным воздействием на ЦНС (судороги, потеря сознания) и функции миокарда (угнетение синтеза АТФ в митохондриях, нарушения ритма, прямая депрессия миокарда, асистолия).
Лидокаин из всех МА обладает наиболее выраженным прямым нейротоксическим эффектом (вакуолизация и разрушение мембран нейронов, гибель шванновских клеток), выраженность которого усиливается при удлинении экспозиции (увеличении времени контакта препарата с нервом). Кроме того, низкая способность лидокаина связываться с белками плазмы (64 % по сравнению с 95,6 % бупивакаина и 94 % ропивакаина) обусловливает высокую концентрацию его свободной (несвязанной) фракции, ответственной за системную токсичность. Использование лидокаина в болюсном режиме достаточно быстро приводит к формированию тахифилаксии, что требует увеличения доз препарата.
Бупивакаин и ропивакаин являются МА длительного действия, чаще всего применяемыми для послеоперационной анальгезии. Следует помнить, что бупивакаин — анестетик с наиболее выраженным кардиотоксическим эффектом, проявляющимся при случайном внутрисосудистом введении препарата. Блокада Nа+-каналов, обусловленная бупивакаином, очень стойкая, что существенно снижает эффективность реанимационных мероприятий при желудочковой фибрилляции. Индуцированная ропивакаином миокардиальная депрессия и аритмия менее выражены, чем аналогичный эффект бупивакаина, при этом 10-кратное увеличение концентрации ропивакаина существенно не усиливает его кардиотоксическое действие. В экспериментальных условиях установлено, что ропивакаин подавляет синтез АТФ в митохондриях миокарда в меньшей степени, чем бупивакаин.
В целом ропивакаин является примерно на 40 % менее кардиотоксичным и примерно на 30 % менее нейротоксичным, чем бупивакаин, не уступая ему в свойствах местного анестетика. Кроме того, при использовании в низких концентрациях — от 0,2 % и ниже — ропивакаин в большей степени блокирует сенсорные, чем моторные волокна, т.е. обеспечивает анальгезию без ограничения двигательной активности пациентов. В связи с этим ропивакаин при проведении послеоперационного обезболивания считается МА выбора.
ЭА при помощи комбинированного введения МА и опиоидов по эффективности достоверно превышает анальгетический эффект использования данных препаратов в отдельности (Curatolo M., 1998; доказательства I уровня). Большинство специалистов рекомендует использовать в данной ситуации фентанил, поскольку гидрофильный морфин после эпидурального введения быстро попадает в спинномозговую жидкость, накапливаясь в клинически значимых концентрациях в боковых желудочках головного мозга, что создает реальную опасность угнетения дыхания. Кроме того, эпидуральное введение морфина достаточно часто сопровождается возникновением интенсивного кожного зуда.
Целесообразность эпидурального введения опиоидов в чистом виде ограничена, в частности, при инъекции данных препаратов в эпидуральное пространство на грудном уровне не выявлено преимуществ перед их системным введением, за исключением некоторого снижения частоты послеоперационных ателектазов (Ballantyne J., 1998; доказательства I уровня). Не было выявлено положительного влияния ЭА опиоидами на скорость восстановления функции ЖКТ (Jorgensen Н., 2001; доказательства I уровня). Анализ опубликованных работ, соответствующих требованиям доказательной медицины, позволяет сделать вывод, что преимущества эпидурального введения опиоидных анальгетиков в абдоминальной хирургии не перевешивают риска осложнений более инвазивного метода обезболивания по сравнению с парентеральным назначением аналогичных препаратов (Wheatley R. et al., 2001).
Мультимодальная анальгезия
В настоящее время не существует идеального анальгетика или метода лечения острой послеоперационной боли.
Приблизиться к решению проблемы адекватности послеоперационного обезболивания можно лишь, реализуя в клинике концепцию мультимодальной анальгезии, предусматривающей одновременное назначение двух и более анальгетиков и/или методов обезболивания, обладающих различными механизмами действия и позволяющих достичь адекватной анальгезии при минимуме побочных эффектов.
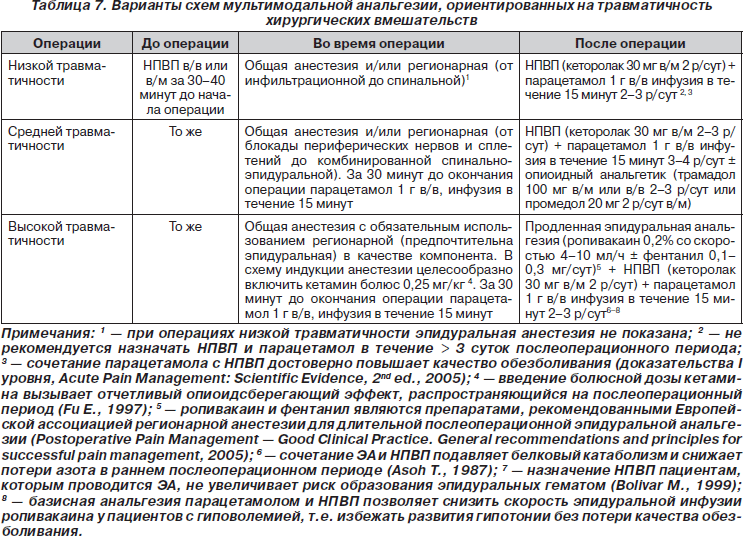
Мультимодальная анальгезия в настоящее время является методом выбора послеоперационного обезболивания. Ее базис — назначение неопиоидных анальгетиков (НПВП и парацетамол), которое у пациентов с болями средней и высокой интенсивности сочетается с использованием опиоидных анальгетиков и методов регионарной анальгезии.
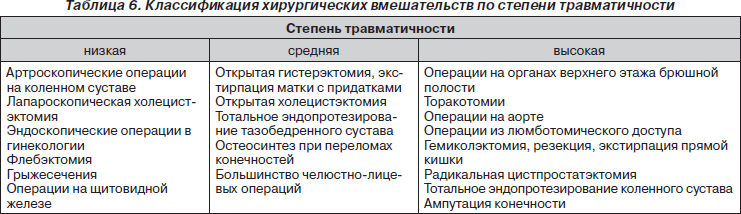
Выбор той или иной схемы мультимодальной анальгезии определяется травматичностью хирургического вмешательства (табл. 6 и 7).
Заключение
Анализируя современные тенденции послеоперационного обезболивания, можно выделить следующие:
1. Все более широкое применение неопиоидных анальгетиков (НПВП и парацетамол), являющихся базисом схем мультимодальной анальгезии.
2. Широкое применение высокотехнологичных методов обезболивания, в частности продленной эпидуральной анальгезии посредством непрерывной инфузии местных анестетиков и опиоидов.
3. Мультимодальный характер послеоперационного обезболивания, т.е. одновременное назначение нескольких препаратов и методов обезболивания, способных воздействовать на различные механизмы формирования болевого синдрома, с использованием минимальных доз и минимизацией риска побочных эффектов.
4. Разработка национальных стандартов и протоколов послеоперационного обезболивания позволит приблизиться к решению проблемы его адекватности.
1. Овечкин A.M. Профилактика послеоперационного болевого синдрома. Патогенетические основы и клиническое применение: Автореф. дис... д-ра мед. наук. — М., 2000. — 42 с.
2. Овечкин A.M., Морозов Д.В., Жарков И.П. Обезболивание и седация в послеоперационном периоде: реалии и возможности // Вестник интенсивной терапии. — № 4. — 2001. — С. 47-60.
3. Осипова Н.А. Антиноцицептивные компоненты общей анестезии и послеоперационной аналгезии // Анест. и реаниматол. — 1998. — № 5. — С. 11-15.
4. Осипова Н.А., Петрова В.В., Береснев В.А. и др. Профилактическая анальгезия — новое направление в анестезиологии. Рождение и развитие идеи в работах МНИОИ им. П.А. Герцена // Анест. и реаниматол. — 1999. — № 6. — С. 13-18.
5. Acute Pain Management: Scientific Evidence. Australian and New Zeland College of Anaesthetists, 2nd edition, 2005 (endorsed Royal College of Anaesthetists, UK). — 31 OS.
6. Asoh T., Shirasaka C., Uchido I., Tsuji H. Effects of indomethacin on endocrine responses and nitrogen loss after surgery // Ann. Surg. — 1987. — V. 206. — P. 770-776.
7. Ballantyne J., Carr D., de Ferranti S. The comparative effects of postoperative analgesic therapies on pulmonary outcome: cumulative meta-analyses of randomized controlled trials // Anesth. Analg. — 1998. — V. 86. — P. 598-612.
8. Barratt S., Smith R., Kee J. Multimodal analgesia and intravenous nutrition preserves total body protein following major abdominal surgery // Red. Anesth. Pain. Med. — 2000. — V. 27. — P. 15-22.
9. Beattie W., Badner N., Choi P. Epidural analgesia reduces postoperative myocardial infarction: a meta-analysis // Anesth. Analg. — 2001. — V. 93. — P. 853-858.
10. Block В., Liu S., Rowlingson A. Efficacy of postoperative epidural analgesia: a meta-analysis // JAMA. — 2003. — V. 290. — P. 2455-2463.
11. Bolivar M., Bolivar A., Vargas G. Multimodal postoperative analgesia with nonsteroidal anti-inflammatory drugs and the epidural
hematoma «myth» // Book Abstr. 9th World Congress on Pain. — Vienna, Austria, 1999. — P. 439.
12. Bulger E., Edwards Т., Klotz P. Epidural analgesia improves outcome after multiple rib fractures // Surgery. — 2004. — V. 136. — P. 426-430.
13. Choi P., Bhandari M., Scott J. Epidural analgesia for pain relief follow knee or hip replacement // The Cochrane Database of Systemic Reviews. — Issue 3, Art. No: CD003071. DOI: 10.1002/14651858. CD003071.
14. Christopherson R., Beattie C., Frank S. Perioperative morbidity in patients randomized to epidural or general anesthesia for lower extremity vascular surgery. Perioperative Ischemia Randomized Anesthesia Trial Study Group // Anesthesiology. — 1993. — V. 79. — P. 422-434.
15. Cook Т., Riley R. Analgesia following thoracotomy: a survey of Australian practice // Anaesth. Intens. Care. — 1997. — V. 25. — P. 520-524.
16. Curatolo M., Petersen-Felix S., Scaramozzino P. Epidural fentanyl, adrenaline and clonidine as adjuvants to local anesthetics for surgical analgesia: meta-analysis and side effects // Acta Anaesth. Scand. — 1998. — V. 42. — P. 910-920.
17. Dirks J., Fredensborg В., Christensen D. A randomized study of the effects of single-dose gabapentin versus placebo on postoperative pain and morphine consumption after mastectomy // Anesthesiology. — 2002. — V. 97. — P. 560-564.
18. Dolin S., Cashman J., Bland J. Effectiveness of acute postoperative pain management: I. Evidence from published data // Br. J. Anaesth. — 2002. — V. 89. — P. 409-423.
19. Fu E., Miguel R., Scharf J. Preemptive ketamine decreases postoperative narcotic requirements in patients undergoing abdominal surgery // Anesth. Analg. — 1997. — V. 84. — P. 1086-1090.
20. Hillis W. Area of emerging interest in analgesia: cardiovascular complications // Am. J. Ther. — 2002. — V. 9. — P. 259-269.
21. Jorgensen H., Wetterslev J., Moiniche S. Epidural local anesthetics versus opioid-based analgesic regimens for postoperative gastrointestinal paralysis // The Cochrane Database of Systemic Reviews. — 2001. — Issue 1, Art. No: CD00 1893.DOI: 10.1002/14651858. CD001893.
22. Kara H., Sahin N., Ulusan V. Magnesium infusion reduces perioperative pain // Eur. J. Anaesthesiol. — 2002. — V. 19. — P. 52-56.
23. Kehlet H., Holte K. Effect of postoperative analgesia on surgical outcome // Br. J. Anaesth. — 2001. — V. 87. — P. 62-72.
24. Kohrs R., Direux M. Ketamine: teaching an old drug new tricks // Anesth. Analg. — 1998. — V. 87. — P. 1186-1193.
25. Laulin J., Maurette P., Corcuff J. The role of ketamine in preventing f entanyl-induced hyperalgesia and subsequent acute morphine tolerance // Anesth. Analg. — 2002. — V. 94. — P. 1263-1269.
26. Levaux C., Bonhomme V., Dewandre P. Effect of intraoperative magnesium sulfate on pain relief and patient comfort after major lumbar orthopaedic surgery // Anaesthesia. — 2003. — V. 58. — P. 131-135.
27. Liu S., Block В., Wu С. Effects of perioperative central neuroaxial analgesia on outcome after coronary artery bypass surgery: a meta-analysis // Anesthesiology. — 2004. — 101. — P. 153-161.
28. Menigaux C., Guignard В., Fletcher D. Intraoperative small-dose ketamine enhances analgesia after outpatient knee arthroscopy // Anesth. Analg. — 2001. — V. 93. — P. 606-612.
29. Perkins F., Kehlet H. Chronic pain as an outcome of surgery. A review of predictive factors // Anesthesiology. — 2000. — V. 93. — P. 1123-1133.
30. Pettersson P., Owall A., Jakobsson J. Early bioavailability of paracetamol after oral or intravenous administration // Acta Anaesth. Scand. — 2004. — V. 48. — P. 867-870.
31. Postoperative Pain Management — Good Clinical Practice. General recommendations and principles for successful pain management. Produced with the consultations with the Europeans Society of Regional Anaesthesia and Pain Therapy. Project chairman N. Rawal, 2005. — 57S.
32. Rodgers A., Walker N., Schug S. Reduction of postoperative mortality and morbidity with epidural or spinal anesthesia: results from overview of randomized trials // BMJ. — 2000. — V. 321. — P. l-12.
33. Werawatganon T., Charuluxanum S. Patient-controlled intravenous opioid analgesia versus continuos epidural analgesia for pain after intra-abdominal surgery // The Cochrane Database of Systemic Reviews. — 2004. — Issue 3, Art. No: CD004088.DOI: 10.1002/14651858. CD004088. pub2.
34. Wheatley R., Schug S., Watson D. Safety and efficacy of postoperative epidural analgesia // Br. J. Anaesth. — 2001. — V. 87. — P. 47-61