Международный эндокринологический журнал 6 (38) 2011
Вернуться к номеру
Инкретины: новая веха в лечении сахарного диабета 2-го типа. Bозможности ситаглиптина в достижении компенсации сахарного диабета 2-го типа
Авторы: Панькив В.И., Отдел профилактики эндокринных заболеваний Украинского НПЦ эндокринной хирургии, трансплантации эндокринных органов и тканей МЗ Украины, г. Киев
Рубрики: Эндокринология
Версия для печати
Позитивное действие инкретинов в отношении секреции инсулина является глюкозозависимым (т.е. по потребности) в отличие от такового секретагогов, которые стимулируют секрецию инсулина вне зависимости от концентрации глюкозы в крови пациента. Кроме того, агонисты рецепторов глюкагоноподобного пептида-1 (ГПП-1) снижают секрецию глюкагона альфа-клетками поджелудочной железы и значительно замедляют эвакуацию пищи из желудка. В результате происходит восстановление первой фазы секреции инсулина и снижение постпрандиальной гипергликемии. Какие долгосрочные эффекты будут оказывать инкретины на бета-клетку, еще не известно. Тем не менее появляются все новые и новые данные в пользу того, что инкретины приводят к увеличению массы бета-клеток за счет стимуляции их пролиферации и к снижению апоптоза.
Таким образом, наиболее важным аспектом является потенциальная способность аналогов ГПП-1 и ингибиторов дипептидилпептидазы-4 (ДПП-4) оказывать протективное действие на бета-клетку. Проблема заключается в том, что еще не было проведено ни одного исследования, посвященного профилактике развития сахарного диабета (СД) 2-го типа с использованием инкретинов, хотя такой потенциал заложен в механизме их действия. Терапия, основанная на инкретинах, дает надежду радикально помочь пациентам, отчасти сохранив функцию их собственных бета-клеток.
Для пожилых пациентов препараты инкретинового ряда представляются наиболее удобными и безопасными, поскольку они не вызывают риска развития гипогликемических состояний, не требуют постоянного мониторинга гликемии, не приводят к резкой декомпенсации в случае пропуска одной дозы препарата. Поэтому для пожилых больных с впервые выявленным СД 2-го типа инкретины можно рассматривать как препараты первого ряда выбора.
Опасений при использовании инкретинов у пациентов с осложнениями СД на данный момент нет. Тем не менее, когда мы говорим о пациентах с серьезными осложнениями, то часто имеем в виду больных с длительно текущим диабетом. И если у таких больных не удается достичь целевого значения гликемии при приеме инкретинов, то вполне оправдана комбинация ингибиторов ДПП-4 с другими сахароснижающими препаратами.
Введение
Отсутствие идеального препарата для лечения больных сахарным диабетом (СД) 2-го типа, который сможет обеспечить не только качественный и постоянный контроль уровня гликемии без увеличения массы тела, риска развития гипогликемии, без негативного влияния на сердце, почки, печень, но и сохранение секреторной функции b-клеток, заставило ученых продолжить поиски новых возможностей воздействия на причину возникновения и прогрессирование этой болезни. В поисках оптимального метода лечения СД 2-го типа научные исследования были направлены на изучение принципиально нового механизма регуляции гомеостаза глюкозы посредством гормонов желудочно-кишечного тракта (ЖКТ), называемых инкретинами.
Инкретины — это гормоны желудочно-кишечного тракта, вырабатываемые в ответ на прием пищи и вызывающие стимуляцию секреции инсулина.
Известно, что при пероральной нагрузке глюкозой инсулин секретируется в гораздо большем количестве, чем в ответ на внутривенное введение глюкозы, несмотря на достижение одинакового уровня гликемии. Разницу в секреции инсулина в ответ на пероральную и внутривенную нагрузки глюкозой называют инкретиновым эффектом.
История открытия инкретинов уходит в прошлое более чем на 100 лет. В 1902 году Bayliss и Starling обнаружили, что кишечная слизь содержит гормон, стимулирующий экзокринную секрецию поджелудочной железы, и назвали его «секретин». Четырьмя годами позже, в 1906 году, В. Moore опубликовал статью под названием «Лечение сахарного диабета при помощи экстракта слизистой двенадцатиперстной кишки». В своей статье ученый предположил, что «секретин» может воздействовать не только на экзокринную, но и на эндокринную часть поджелудочной железы. Для подтверждения своей гипотезы B. Moore выделил экстракт слизистой двенадцатиперстной кишки и использовал его в практике лечения пациентов с глюкозурией. Само же название «инкретин» было предложено La Barre в 1932 году для гормона, выделенного из слизи верхнего отдела кишечника и способного вызывать гипогликемию.
Доказательства существования инкретинов были подтверждены в 1960-х годах, когда обнаружили, что секреция инсулина в ответ на пероральную нагрузку глюкозой в 1,5–2 раза превышает таковую в ответ на внутривенную инфузию глюкозы при одинаковом уровне гликемии. Это открытие натолкнуло авторов на мысль, что вещества, секретирующиеся в кишечнике, могут быть вовлечены в постпрандиальную регуляцию секреции инсулина. Так был открыт феномен инкретинового эффекта. Первый гормон с инкретиновой активностью выделили из экстракта дуоденальной слизи свиньи. Благодаря свойству ингибировать секрецию соляной кислоты желудка пептид был назван желудочным ингибиторным полипептидом и отнесен к классу энтерогастронов. Позже выяснилось, что главным биологическим эффектом этого вновь открытого пептида является глюкозозависимая стимуляция секреции инсулина. Поэтому в 1973 году учеными J.C. Brown и J. Dupre было предложено переименовать его в глюкозозависимый инсулинотропный полипептид (ГИП). Местом его синтеза являются К-клетки слизистой кишечника, в основном двенадцатиперстной и тощей кишки.
В 1983 году Bell и соавт. из гена проглюкагона хомяка выделили последовательность двух глюкагоноподобных пептидов, которые впоследствии были названы «глюкагоноподобный пептид-1» (ГПП-1) и глюкагоноподобный пептид-2». Высвобождение ГПП-1 и ГИП зависит от пищевых, неврогенных и гормональных стимулов и происходит сразу же вслед за приемом пищи: значительное увеличение концентрации инкретинов отмечается через 10–15 мин. Результаты исследований показали, что секреция ГПП-1 и ГИП стимулируется всасыванием жиров и углеводов, а также белков (только для ГПП-1). Более того, простого контакта этих нутриентов со слизистой кишечника достаточно для высвобождения инкретиновых гормонов из К- и L-клеток, что приводит к быстрому подъему уровня инсулина в крови.
Общим недостатком обоих инкретинов является то, что они быстро (ГПП-1 — в течение 2 минут, ГИП — в течение 6 минут) подвергаются расщеплению ферментом дипептидилпептидазой 4-го типа (ДПП-4).
ГПП-1 разрушается, еще не покинув кишечника, так как ДПП-4 присутствует на поверхности эндотелиальных клеток капилляров его слизистой. Поскольку ДПП-4 экспрессируется во многих органах и тканях, включая поджелудочную железу, печень, почки, легкие и желудочно-кишечный тракт, то этот фермент имеет и другие субстраты действия: нейропептиды, цитокины и др.
Детальное изучение эффектов ГПП-1 показало его непосредственное влияние не только на синтез инсулина поджелудочной железой, но и на ткань печени, желудка, мозга, сердечной мышцы.
ГПП-1 обладает множественным влиянием на эндокринную часть поджелудочной железы, но его принципиальным действием является потенцирование глюкозозависимой секреции инсулина. Увеличенные уровни внутриклеточного циклического аденозинмонофосфата (цАМФ) стимулируют протеинкиназу А, что приводит к экзоцитозу инсулиновых гранул из b-клеток. Повышение уровня цАМФ, таким образом, является первичным медиатором ГПП-1-индуцированной секреции инсулина. Самое важное, что инсулинотропный эффект ГПП-1 носит глюкозозависимый характер. Это означает, что ГПП-1 стимулирует секрецию инсулина только при высоких значениях гликемии. Как только уровень глюкозы плазмы снижается до нормального уровня (приблизительно до 4,5 ммоль/л), инсулинстимулирующий эффект ГПП-1 исчезает.
В экспериментальных работах показано, что ГПП-1 воздействует на массу b-клеток, стимулируя их пролиферацию и неогенез и блокируя апоптоз. Рецепторы к ГПП-1 (рГПП-1) в большом количестве обнаруживаются в протоковых эпителиальных клетках поджелудочной железы, являющихся предшественниками b-клеток. Поэтому у экспериментальных животных активация рГПП-1 может способствовать b-клеточной пролиферации и увеличению массы b-клеток.
Подавление секреции глюкагона под воздействием ГПП-1 также носит глюкозозависимый характер. Как только гликемия достигает нормы, уровень глюкагона вновь возрастает до исходных значений. Это говорит о том, что ГПП-1 не нарушает контррегуляторного ответа организма на состояние гипогликемии.
ГПП-1 вызывает глюкозозависимую стимуляцию секреции инсулина и глюкозозависимое подавление секреции глюкагона, являющихся механизмами защиты от развития гипогликемических состояний.
Стимуляция рГПП-1 в подвздошной кишке обеспечивает снижение моторики ЖКТ, замедление опорожнения желудка и всасывания глюкозы. В результате наблюдается снижение постпрандиальной гипергликемии. Этот эффект носит название «кишечный тормоз». Суть феномена заключается в том, что пища, попавшая в дистальные отделы кишечника, способна затормозить моторику и секреторную активность верхних отделов кишечника и желудка. Механизм этого феномена связан с активацией афферентных волокон блуждающего нерва и торможением прохождения импульса по эфферентным. Исследование на здоровых добровольцах показало, что внутривенное введение ГПП-1 вызывает дозозависимое снижение скорости опорожнения желудка. В результате постпрандиальный уровень глюкозы в крови снижается вплоть до базального уровня. Предполагают, что снижение постпрандиальной концентрации глюкозы при введении ГПП-1 достигается преимущественно за счет торможения опорожнения желудка (возможно, путем вовлечения блуждающего нерва), а не только благодаря увеличению синтеза инсулина поджелудочной железой.
ГПП-1-зависимое снижение моторики желудка и всасывания глюкозы после еды является важным механизмом регуляции постпрандиальной гипергликемии.
Поскольку рГПП-1 были найдены в ядрах гипоталамуса, отвечающих за процесс насыщения, то воздействие на эти рецепторы может влиять на пищевое поведение. У крыс введение ГПП-1 в желудочки мозга способствовало уменьшению времени приема пищи и ее количества, в то время как противоположный эффект наблюдался при назначении антагонистов ГПП-1. Последующие испытания показали, что центральное введение агонистов ГПП-1 вызывает уменьшение кратковременных приемов пищи и воды, что впоследствии приводит к снижению веса. Аналогичные результаты были получены и в клинических испытаниях агонистов ГПП-1 у здоровых людей, больных СД и лиц с ожирением, когда периферическое подкожное введение этих препаратов приводило к быстрому наступлению насыщения, уменьшению количества потребленной пищи и снижению веса.
ГПП-1, воздействуя на ядра гипоталамуса, способствует быстрому наступлению насыщения, уменьшению количества потребляемой пищи и, как следствие, снижению массы тела.
ГПП-1 обладает дополнительным сахароснижающим эффектом, не связанным с влиянием на поджелудочную железу и желудок. В печени ГПП-1 ингибирует продукцию глюкозы, в жировой и мышечной тканях — способствует усвоению глюкозы. Однако эти эффекты вторичны по отношению к регуляции секреции инсулина и глюкагона.
ГПП-1 устраняет инсулинорезистентность периферических тканей (мышцы, жировая ткань) и снижает продукцию глюкозы печенью.
В эксперименте показано, что ГПП-1 контролирует процесс резорбции костной ткани. В отсутствие рГПП-1 у мышей наблюдалась кортикальная остеопения, увеличение числа остеокластов и маркеров резорбции кости. Эти эффекты устранялись в присутствии кальцитонина, что свидетельствовало о том, что протективное воздействие ГПП-1 на костную ткань осуществляется посредством кальцитонинзависимого механизма.
ГПП-1 препятствует развитию остеопороза и остеопении.
У больных СД 2-го типа, у лиц с ожирением и инсулинорезистентностью наблюдается значительное снижение инкретинового эффекта, т.е. снижение секреции инсулина в ответ на пероральную нагрузку глюкозой при сохранной его секреции в ответ на внутривенную нагрузку глюкозой.
Снижение инкретинового эффекта приводит к нарушению инсулинового ответа на прием углеводов и, соответственно, к увеличению уровня глюкозы в крови.
При изучении причины снижения инкретинового ответа у больных СД 2-го типа установили, что это связано с более низкой секрецией ГПП-1 (при сохранной секреции ГИП). На стадиях предиабета (т.е. у лиц с нарушенной толерантностью к глюкозе) также отмечается снижение секреции ГПП-1, однако менее выраженное, чем у больных СД 2-го типа.
Из представленных данных следует, что сниженный инкретиновый эффект у пациентов с СД 2-го типа является скорее следствием, а не причиной развития СД 2-го типа.
Современные препараты, основанные на действии инкретинов
Учитывая более благоприятный спектр действия ГПП-1 по сравнению с ГИП и его экономный инсулинотропный эффект у больных СД 2-го типа, фармацевтические компании направили свои усилия на создание препаратов, поддерживающих или имитирующих действие именно ГПП-1, с целью оказания безопасного сахароснижающего эффекта. В результате были созданы 2 группы препаратов:
— вещества, имитирующие действие ГПП-1 (миметики и аналоги ГПП-1);
— вещества, пролонгирующие действие эндогенного ГПП-1 (ингибиторы ДПП-4).
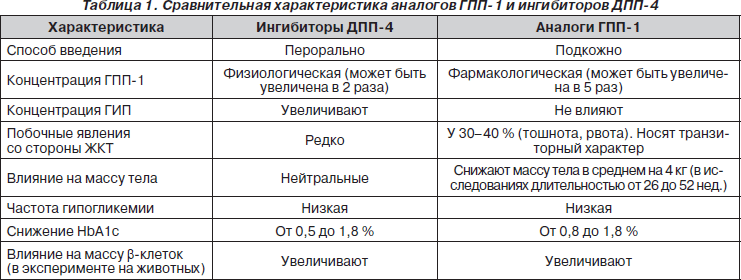
Основным путем преодоления разрушающего действия фермента ДПП-4 было создание его ингибиторов. Фермент ДПП-4 (известный как CD26) существует как в форме, ассоциированной с мембранами клеток (в том числе эндотелиальных клеток, иммунокомпетентных Т- и В-клеток и др.), так и в растворимой форме, циркулирующей в плазме. Обе формы ДПП-4 имеют высокую ферментативную активность. Данные препараты вводятся перорально и обеспечивают физиологическую стимуляцию нативного ГПП-1. Сравнительная характеристика двух групп препаратов представлена в табл. 1.
Ингибиторы ДПП-4 различаются по своей молекулярной структуре и фармакологическим свойствам.
Ситаглиптин относится к химическому классу b-фенэтиламинов-1, и его ингибирующая концентрация (IC50) в отношении ДПП-4 составляет 9,96 ± 1,03 нM. Период его полувыведения равен приблизительно 12,4 часа.
Вилдаглиптин относится к химическому классу цианопирролидинов-4, и его ингибирующая концентрация в отношении ДПП-4 составляет 5,28 ± 1,04 нM. Период его полувыведения равен приблизительно 2–3 часам.
Саксаглиптин также относится к химическому классу цианопирролидинов-6, и его IC50 в отношении ДПП-4 составляет 3,37 ± 0,90 нM. Период полувыведения саксаглиптина и его активного метаболита равен 2,5 и 3,1 часа соответственно.
Фармакокинетические показатели ингибиторов ДПП-4 варьируют в пределах терапевтического класса.
Ситаглиптин имеет время всасывания (tmax), равное 1–4 часам, и биодоступность приблизительно 87 %. Период его полувыведения (t1/2) составляет 12,4 часа, он на 38 % связывается с белком и почти не метаболизируется. Выводится ситаглиптин почками (79 % в неизмененном виде).
Вилдаглиптин имеет tmax, равное 1,7 часа, и биодоступность 85 %. Его t1/2 приблизительно составляет 2–3 часа, он на 9,3 % связывается с белком, и 69 % его метаболизируется почками (неактивный метаболит). Вилдаглиптин также выводится почками (85 %; 23 % в неизмененном виде).
Саксаглиптин имеет tmax, равное 2 часам (4 часа для активных метаболитов), и биодоступность > 75 %, t1/2 исходного препарата составляет 2,5 часа (3,1 часа для активного метаболита), он имеет низкую степень связывания с белком и метаболизируется печенью (ферментом CYP3A4/5). Саксаглиптин выводится почками (24 % в виде исходного препарата, 36 % в виде активного метаболита).
Избирательные фармакодинамические свойства ингибиторов ДПП-4. Ситаглиптин имеет пиковое ингибирование ДПП-4, равное приблизительно 97 %, и ингибирующую концентрацию для ДПП-4, равную 9,96 ± 1,03 нM. Его IC50 для ДПП-8 составляет 26 800 ± 3000 нM (2700 нM для ДПП-8/ДПП-4), для ДПП-9 — 48 500 ± 5700 нM (4900 нM для ДПП-9/ДПП-4).
Вилдаглиптин имеет пиковое ингибирование ДПП-4 приблизительно 95 % и IC50 для ДПП-4,равную 5,28 ± 1,04 нM. Его IC50 для ДПП-8 составляет 1112 ± 50 нM (210 нM для ДПП-8/ДПП-4), для ДПП‑9 — 66,2 ± 7,3 нM (13 нM для ДПП-9/ДПП-4).
Саксаглиптин имеет пиковое ингибирование ДПП‑4 приблизительно 80 % и IC50 для ДПП-4, равную 3,37 ± 0,90 нM. Его IC50 для ДПП-8 составляет 244 ± 8 нM (72 нM для ДПП-8/ДПП-4), для ДПП-9 — 104 ± 7 нM (31 нM для ДПП-9/ДПП-4).
Последствия различий в протеазной селективности, если таковые имеются, не установлены. Все ингибиторы ДПП-4, разрешенные к использованию на данный момент, считаются селективными ингибиторами ДПП-4.
Различия в фармакологических свойствах еще не говорят о наличии каких-либо различий в клинической эффективности либо безопасности, для выявления которых необходимо проведение сравнительных клинических исследований.
Ситаглиптин (Янувия)
Ситаглиптин (Янувия) является высокоселективным ингибитором ДПП-4, разработанным корпорацией Мерк и Ко (США), и первым одобренным к применению препаратом из группы ингибиторов ДПП-4. Препарат предназначен к применению у больных СД 2-го типа в виде монотерапии в сочетании с диетой и физическими упражнениями, а также в комбинации с метформином, глитазонами, препаратами сульфонилмочевины (СМ) или в тройной комбинации препаратов СМ и метформина.
Механизм действия
Ситаглиптин ингибирует активность ДПП-4 в течение 24 ч, а его действие начинается через 30 мин после приема препарата. При этом уровень интактных (то есть биологически активных) ГПП-1 и ГИП возрастает в 2–3 раза. Ингибирование активности ДПП-4 при приеме препарата приводит к повышению как тощакового, так и постпрандиального уровня инкретинов (ГПП-1 и ГИП). В результате его действия происходит глюкозозависимое увеличение синтеза и высвобождения инсулина из b-клеток поджелудочной железы и снижение секреции глюкагона a-клетками.
Период полувыведения ситаглиптина достигает 12,4 ч в отличие от аналогичного показателя вилдаглиптина (2–3 ч) и саксаглиптина: 2,5 ч (исходный) и 3,1 ч (метаболит).
Форма выпуска и режим дозирования
Препарат выпускается в таблетированной форме и зарегистрирован в дозах 25, 50 и 100 мг. Рекомендуемой дозой является 100 мг/сут однократно независимо от времени суток и приема пищи. Доза 100 мг/сут применяется как при монотерапии, так и в комбинации с метформином. При легкой почечной недостаточности (скорость клубочковой фильтрации (СКФ) более 50 мл/мин, креатинин сыворотки менее 1,7 мг/дл у мужчин и 1,5 мг/дл у женщин) коррекции дозы ситаглиптина не требуется. При среднетяжелой почечной недостаточности (СКФ 30–50 мл/мин, креатинин сыворотки 1,7–3,0 мг/дл у мужчин и 1,5–2,5 мг/дл у женщин) доза ситаглиптина составляет 50 мг 1 раз в сутки; при тяжелой почечной недостаточности (СКФ менее 30 мл/мин, креатинин сыворотки более 3 мг/дл у мужчин и 2,5 мг/дл у женщин) — 25 мг 1 раз в сутки.
Коррекции дозы у пожилых лиц не требуется, за исключением случаев снижения СКФ. Данных о применении препарата у лиц моложе 18 лет и в педиатрической практике нет. Поэтому у данной категории лиц использование препарата не рекомендуется.
Ситаглиптин повышает уровни активных ГПП-1 и ГИП более чем на 24 часа.
При проведении фармакокинетического исследования однократной дозы у пациентов с СД 2-го типа ситаглиптин повышал уровни активных инкретинов после проведения глюкозотолерантного теста, с введением глюкозы через 2 и 25 часов после однократного перорального приема 25 либо 200 мг ситаглиптина.
При проведении 2-часового глюкозотолерантного теста после приема препарата обе дозы ситаглиптина повышали уровень активного ГПП-1 приблизительно в 2 раза по сравнению с плацебо. При проведении глюкозотолерантного теста через 24 часа после приема ситаглиптина в дозе 25 и 200 мг уровень активного ГПП-1 повышался приблизительно в 1,3 и 1,9 раза соответственно по сравнению с плацебо.
При проведении 2-часового глюкозотолерантного теста после приема препарата обе дозы ситаглиптина повышали уровень активного ГИП приблизительно в 2 раза по сравнению с плацебо. При проведении глюкозотолерантного теста через 24 часа после приема ситаглиптина в дозе 25 и 200 мг уровень активного ГИП повышался приблизительно в 1,4 и 2 раза соответственно по сравнению с плацебо.
Обоснование влияния однократной ежедневной дозы ситаглиптина на ингибирование ДПП-4. Установлена зависимость среднего уровня плазменного ингибирования ДПП-4 от времени после однократной пероральной дозы ситаглиптина 100 мг у здоровых лиц. Средний уровень ингибирования ДПП-4 в течение 24 часов после приема 100 мг ситаглиптина составлял 97 %.
Сахароснижающий эффект ситаглиптина
Монотерапия. Эффективность ситаглиптина при использовании в качестве монотерапии была показана во многих плацебо-контролируемых исследованиях. В частности, в исследовании, проведенном G. Herman и соавт., было продемонстрировано среднее снижение НbА1с на 0,8 % через 3 мес. терапии ситаглиптином в дозе 100 мг/сут. Необходимо отметить, что наибольшее снижение уровня НbА1с было отмечено у больных с его относительно более высоким исходным уровнем. У больных с исходным значением НbА1с < 8 % на фоне терапии ситаглиптином отмечено его снижение на 0,6 %, тогда как у больных с НbА1с > 9,0 % — на 1,4 %.
Комбинация с метформином. С учетом современных рекомендаций клинической практики особое внимание привлекает возможность комбинации ситаглиптина с наиболее часто используемым антигипергликемическим препаратом — метформином, который влияет на инсулинорезистентность и печеночный глюконеогенез. Комбинация препаратов с различными взаимодополняющими механизмами действия потенциально обещает усиление сахароснижающего эффекта. Сочетание метформина и ситаглиптина предполагает воздействие на все основные патогенетические механизмы СД 2-го типа: инсулинорезистентность, повышенную продукция глюкозы печенью и нарушенный ответ b-клеток поджелудочной железы.
С целью изучения эффективности ситаглиптина при добавлении его к уже имеющейся терапии метформином В. Chardonnell и соавт. было проведено 24-недельное исследование, включившее 701 пациента. В результате при сочетанной терапии ситаглиптином и метформином в сравнении с плацебо уровень НbА1с дополнительно снизился на 0,65 % и значительно большее число пациентов достигло показателя НbА1с < 7 % (47 против 18,3 соответственно). Кроме того, было выявлено достоверное снижение как гликемии натощак, так и постпрандиальной гликемии в группе лиц, получавших ситаглиптин вместе с метформином.
Ситаглиптин в сравнении с метформином при сахарном диабете 2-го типа: ситаглиптин обладает не меньшей результативностью, чем метформин.
Снижение уровня HbA1c на 24-й неделе наблюдалось в группах лечения как ситаглиптином, так и метформином (0,43 и 0,55 % соответственно).
Хотя метформин и продемонстрировал более выраженное в цифровом значении снижение уровня HbA1c на 24-й неделе, существенной разницы между группами лечения в отношении изменения уровня HbA1c от исходного в обозначенной протоколом популяции не отмечалось (разница между группами — 0,14 %; 95% доверительный интервал (ДИ) 0,06; 0,21).
Результаты говорят о том, что для первичной конечной точки эффективности ситаглиптин обладал не меньшей результативностью, чем метформин (заранее обозначенный предел не меньшей результативности (noninferiority) — 0,40 %).
Комбинация с пиоглитазоном. J. Rosenstock и соавт. выполнили 24-недельное многоцентровое рандомизированное исследование, в котором ситаглиптин получали 175 человек и 178 — плацебо. Исходный средний уровень HbA1c был сопоставим и составил 8,1 % в группе ситаглиптина и 8,0 % в группе плацебо. По окончании исследования в группе терапии ситаглиптином и пиоглитазоном отмечалось достоверное снижение НbА1с на 0,9 % в сравнении с группой пиоглитазона и плацебо. 45,4 % пациентов достигли уровня НbА1с < 7,0 % при лечении ситаглиптином в сравнении с 23,0 % в группе плацебо.
Комбинация с препаратами СМ. Hermansen и соавт. было проведено 24-недельное рандомизированное двойное слепое исследование по оценке эффективности ситаглиптина в дополнение к метформину и/или препаратам СМ у 441 больного СД 2-го типа с неудовлетворительным гликемическим контролем (НbА1с > 7,5 % и < 10,5 %). В результате применение ситаглиптина привело к снижению НbА1с на 0,74 % по сравнению с плацебо. В подгруппе пациентов, получавших глимепирид + метформин, при добавлении ситаглиптина уровень НbА1с понизился на 0,89 % относительно плацебо, а в подгруппе, принимавшей глимепирид без метформина, — на 0,57 %. Добавление ситаглиптина уменьшало показатели глюкозы плазмы натощак в среднем на 1,1 ммоль/л. Добавление ситаглиптина в данном исследовании в целом переносилось хорошо в сравнении с плацебо, однако характеризовалось большей частотой как общих нежелательных явлений (60 vs. 47 %), так и нежелательных явлений, связанных с приемом лекарств (15 vs. 7 %). Частота нежелательных явлений в группе ситаглиптина была выше из-за большего количества случаев гипогликемии (12 vs. 2 % соответственно). Эпизоды гипогликемии развивались при комбинированном применении с препаратом СМ. Поэтому в случае сочетания ситаглиптина с препаратами сульфонилмочевины для снижения риска развития гипогликемии может потребоваться уменьшение дозы последних.
Влияние ситаглиптина на массу и функцию b-клеток
В исследовании В. Chardonnell и соавт. было выявлено, что в группе ситаглиптина отмечалось достоверное повышение уровня С-пептида натощак, улучшение соотношения проинсулин/инсулин, а также показателя НОМА-В (гомеостатическая модель оценки функции b-клеток). В исследовании Hermansen и соавт. добавление ситаглиптина увеличивало НОМА-В на 12 % относительно плацебо. По данным исследования J. Mu и соавт., ситаглиптин восстанавливал массу b-клеток и уменьшал гипертрофию a-клеток, тем самым нормализуя морфологию островков Лангерганса в исследованиях in vivo.
Безопасность применения и побочные эффекты
В большинстве исследований ситаглиптин как в виде монотерапии, так и в качестве дополнительного препарата к другим антигипергликемическим средствам, включая метформин и тиазолидиндионы, имел профиль переносимости, сходный с плацебо.
D. Williams-Hermann и соавт. провели анализ безопасности применения ситаглиптина в дозе 100 мг/день по данным 19 больших двойных слепых исследований длительностью от 18 недель до 2 лет. Сравнивалось применение ситаглиптина в дозе 100 мг и других режимов терапии (плацебо, метформин, сульфонилмочевина, сульфонилмочевина + метформин). Анализ включал данные 6139 пациентов (из них 3415 получали ситаглиптин 100 мг/сут и 2724 — иную терапию). Средний возраст пациентов составил 55 лет, средняя длительность диабета — 5,5 года и средний уровень НbА1с — 8,2 %. В группе ситаглиптина 1343 пациента получали лечение не менее 1 года, из них 356 — 2 года. По завершении наблюдения было сделано заключение о том, что частота развития нежелательных побочных эффектов, серьезных нежелательных явлений и случаев прекращения приема препарата из-за нежелательных явлений была сопоставима в обеих группах. Применение ситаглиптина при сопоставлении с группой сравнения характеризовалось меньшей частотой развития гипогликемии. Статистически значимых различий в динамике лабораторных показателей, частоте побочных явлений, связанных с эпизодами ишемии либо кардиальной патологией, в двух группах также получено не было.
Наиболее частыми побочными явлениями при длительном применении препарата являлись инфекции верхних дыхательных путей, назофарингит, головная боль, диарея (табл. 2). Все указанные побочные эффекты при приеме ситаглиптина по частоте не превышали аналогичных, наблюдаемых при приеме плацебо.
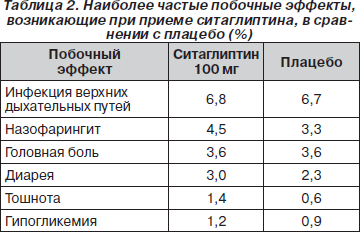
Следует еще раз подчеркнуть, что в большинстве исследований частота развития гипогликемии при лечении ситаглиптином была сходна с таковой плацебо, что объясняется глюкозозависимым действием инкретинов. Гипогликемии главным образом были зафиксированы при совместном применении с препаратами СМ, что диктует необходимость уменьшения их дозы при комбинации с ситаглиптином.
При применении ситаглиптина отмечены отдельные реакции гиперчувствительности к препарату, включая анафилаксию, ангионевротический отек и синдром Стивенса — Джонсона, поэтому применение ситаглиптина у лиц с такими реакциями противопоказано.
Также внимания требуют пациенты с отягощенным анамнезом по панкреатитам, так как имеются отдельные сообщения о случаях развития острых панкреатитов, возможно связанных с приемом ситаглиптина. В половине случаев развитие панкреатита ассоциировалось с наличием СД, ожирения, высокого уровня холестерина и триглицеридов. При более детальном анализе исследований с участием более 6 тыс. пациентов в течение 2 лет частота развития панкреатита в целом составила 0,1 % в группе ситаглиптина по сравнению с 0 % в группе плацебо/других препаратов. В связи с этим рекомендуется более тщательно наблюдать пациентов с риском развития панкреатита после инициации или усиления терапии.
Следует отметить, что сам по себе СД 2-го типа является потенциально опасным с точки зрения развития панкреатита. Хорошо известно, что острый панкреатит развивается в 2–3 раза чаще у больных СД 2-го типа, чем в здоровой популяции.
Что касается миметиков/аналогов ГПП-1, то имеются сообщения о развитии случаев острого панкреатита в следующих исследованиях:
— при испытании эксенатида — 6 случаев острого панкреатита (из них 2 — со смертельным исходом);
— при испытании лираглутида — 6 случаев;
— при испытании саксаглиптина — 8 случаев;
— при применении ситаглиптина — 88 случаев (в постмаркетинговых исследованиях).
Все эпизоды острого панкреатита не превышали 1,6 случая на 1000 человеко-лет, что не выходит за рамки ожидаемой частоты этих осложнений в целом в популяции больных СД 2-го типа. У пациентов, принимающих ситаглиптин, в период с 16 октября 2006 года по 9 февраля 2009 года FDA было зарегистрировано 88 случаев острого панкреатита, выявленных в период постмаркетингового применения, включая два случая геморрагического или некротизирующего панкреатита. В марте 2009 года компания Merck добавила панкреатит в раздел «Нежелательные явления, выявленные в период постмаркетингового применения» инструкции по медицинскому применению препарата Янувия. В ходе доклинических или клинических исследований продолжительностью до 2 лет с участием более 6000 пациентов не было обнаружено связи между приемом ситаглиптина и повышением частоты развития панкреатита.
Тем не менее при назначении всех инкретинов необходимо информировать больных о том, что острая боль в животе, сопровождающаяся рвотой, может быть проявлением острого панкреатита. В этом случае прием препарата необходимо немедленно прекратить до установления причин подобной симптоматики. При отсутствии подтвержденного панкреатита (по уровню липазы, амилазы крови) прием препарата можно будет возобновить.
Противопоказания: гиперчувствительность к компонентам препарата; СД 1-го типа; диабетический кетоацидоз; беременность и период грудного вскармливания.
Пациенты, которым наиболее показана терапия ситаглиптином:
— с впервые диагностированным СД 2-го типа — в качестве монотерапии или в комбинации с метформином;
— имеющие относительно небольшую длительность СД 2-го типа, так как потенциально существует возможность сохранения пула оставшихся b-клеток;
— с СД 2-го типа, принимающие препараты метформина и не достигшие при этом терапевтических целей (имеющие уровень НbА1с более 7 %);
— имеющие проблемы с избыточным весом, для которых актуально отсутствие прибавки массы тела;
— пациенты, для которых принципиальное значение имеет снижение риска развития гипогликемии (нерегулярно питающиеся, пожилые, имеющие профессиональные риски, требующие концентрации внимания, — высотные работы или работы, связанные со сложными механизмами, конвейером и т.д.).
Сравнение ситаглиптина с препаратом вилдаглиптин
В исследовании R. Marfella и соавт. производилось прямое сравнение двух препаратов из группы ингибиторов ДПП-4: вилдаглиптина и ситаглиптина. В исследование были включены пациенты с СД 2-го типа, не достигшие удовлетворительного контроля гликемии при монотерапии метформином в средней суточной дозе 3000 мг. Вилдаглиптин назначался в дозе 50 мг 2 раза в сутки, ситаглиптин — 100 мг 1 раз в сутки в течение 3 месяцев. Основным параметром исследования явился показатель средней амплитуды колебаний гликемии (Mean Amplitude of Glycemic Excursions — MAGE), который оценивался в ходе непрерывного мониторинга гликемии (НМГ). НМГ проводился всем пациентам в течение 48 ч до начала исследования и по окончании 3 мес. терапии.
Результаты исследования показали, что основные маркеры контроля гликемии — НbА1с, глюкозы плазмы натощак (ГПН) и постпрандиальной гликемии — оказались практически одинаковыми в обеих группах терапии, без достоверной разницы.
Ингибирующий эффект вилдаглиптина в отношении ДПП-4 измерялся в одноцентровом рандомизированном открытом плацебо-контролируемом 7-периодном перекрестном исследовании с участием 16 пациентов с диабетом 2-го типа, диагностированным не позже чем за 3 месяца до этого. Каждый день исследования после ночного голодания (≥ 10 часов) пациент пропускал завтрак и получал однократную пероральную дозу плацебо либо вилдаглиптина (10–400 мг). Через 30 минут после приема исследуемого препарата пациент получал пероральную нагрузку 75 г глюкозы. Плазменная активность ДПП-4 определялась на заранее установленных временных отрезках в течение 24 часов после пероральной глюкозной нагрузки.
Через 12,5 часа после приема витаглиптин в дозе 50 мг ингибировал активность ДПП-4 до 79 %. Степень ингибирования активности ДПП-4 продолжала снижаться и доходила до < 40 % через 24 часа после принятия дозы препарата. Это свидетельствует в пользу приема вилдаглиптина в дозе 50 мг два раза в день.
Таким образом, Янувия имеет самый большой период полувыведения, а это значит, что контроль гликемии сохраняется в течение суток в отличие от вилдаглиптина и саксаглиптина.
Сравнение ситаглиптина с препаратом саксаглиптин
Прямое сравнительное исследование показало не меньшую результативность (noninferiority) саксаглиптина с сравнении с ситаглиптином.
Исследование фазы 3b, международное, 18-недельное, многоцентровое, рандомизированное, по двойному слепому методу, активно контролируемое, с участием параллельных групп, сравнивающее ситаглиптин с саксаглиптином, было проведено при участии 801 взрослого пациента с СД 2-го типа с неадекватным контролем гликемии на фоне лечения метформином.
После скрининга пациентов возрастом ≥ 18 лет с исходным уровнем HbA1c 6,5–10 % случайным образом распределяли для получения ситаглиптина 100 мг один раз в день (n = 398) либо саксаглиптина 5 мг один раз в день (n = 403) в качестве дополнительной терапии к открыто назначаемому метформину (≥ 1500 мг/день) в течение 18 недель. Средний возраст пациентов составил 58 лет. Средняя продолжительность диабета 2-го типа составляла 6,3 года, а средний исходный уровень HbA1c — 7,7 %.
Первичной целью данного исследования было оценить, обладает ли саксаглиптин в дозе 5 мг один раз в день, добавленный к метформину, не меньшей результативностью, чем ситаглиптин в дозе 100 мг один раз в день, добавленный к метформину, в отношении изменения уровня HbA1c от исходного к 18 неделям у пациентов с диабетом 2-го типа с неадекватным контролем гликемии на фоне приема ≥ 1500 мг/день метформина в виде монотерапии.
Первичной конечной точкой данного исследования являлось изменение по сравнению с исходным уровнем скорректированного среднего значения HbA1c на 18-й неделе. Средний исходный уровень HbA1c составлял 7,69 % для ситаглиптина 100 мг плюс метформин и 7,68 % для саксаглиптина 5 мг плюс метформин. Заранее обозначенный предел не меньшей результативности был равен 0,30 % (для достижения конечной точки не меньшей результативности требовалась числовая разница в снижении уровня HbA1c < 0,3 % для верхней границы 95% доверительного интервала).
Результаты исследования показали, что саксаглиптин 5 мг плюс метформин обладал не меньшей результативностью, чем ситаглиптин 100 мг плюс метформин; однако ситаглиптин характеризовался более высоким снижением уровня HbA1c на 18-й неделе. Применение ситаглиптина 100 мг с метформином приводило к снижению уровня HbA1c на 0,62 % от исходного по сравнению с 0,52 % при приеме саксаглиптина 5 мг с метформином в популяции, обозначенной протоколом (разница по сравнению с ситаглиптином и метформином 0,09; 95% ДИ –0,01; 0,20).
Не меньшая результативность саксаглиптина, чем ситаглиптина, была подтверждена на полной популяции когортного анализа. В данной популяции, однако, большее снижение уровня HbA1c от исходного наблюдалось в группе ситаглиптина 100 мг плюс метформин по сравнению с группой саксаглиптина 5 мг плюс метформин и 95% ДИ разницы между группами не включал в себя ноль (разница по сравнению с ситаглиптином и метформином 0,17%; 95% ДИ 0,06; 0,28).
Ситаглиптин приводил к большему снижению уровня ГПН, чем саксаглиптин, на 18-й неделе.
Средний исходный уровень ГПН составлял 8,89 ммоль/л в группе ситаглиптина и 8,86 ммоль/л в группе саксаглиптина. Лечение ситаглиптином 100 мг и метформином приводило к большему снижению уровня ГПН по сравнению с таковым при лечении саксаглиптином 5 мг и метформином на 18-й неделе (–0,90 ммоль/л по сравнению с –0,60 ммоль/л). Разница между группами на 18-й неделе составляла –0,30 ммоль/л (95% ДИ –0,08; –0,53). Количество лиц с эпизодами гипогликемии было низким и одинаковым для обеих групп лечения. Большинство эпизодов имело легкую степень, хотя у одного пациента в группе ситаглиптина наблюдался эпизод выраженной гипогликемии. Отмечено небольшое среднее снижение массы тела (среднее изменение от исходного — 0,4 кг) в обеих группах лечения. Таким образом, у пациентов с СД 2-го типа с неадекватным контролем гликемии при монотерапии метформином добавление саксаглиптина в дозе 5 мг обладало почти такой же результативностью, как и ситаглиптина в дозе 100 мг, в отношении снижения уровня HbA1c на 18-й неделе, а добавление ситаглиптина в дозе 100 мг приводило к большему снижению скорректированного среднего значения ГПН от исходного уровня, чем саксаглиптина в дозе 5 мг.
В исследовании COSMETIC Study (S. Lim et al., 2011) определены факторы, обусловливающие терапевтическую эффективность комбинированного лечения ситаглиптином (100 мг 1 раз в сутки) и метформином (500 мг 2 раза в сутки) у 150 больных с впервые выявленным СД 2-го типа (средний возраст 54,9 ± 12,5 года) в течение 52 недель. Начальный уровень гликозилированного гемоглобина составлял от 7,0 до 10,0 %. Для оценки параметров терапевтической эффективности был проведен многофакторный анализ уровня глюкозы натощак, инсулина, C-пептида, глюкагона, показателей HOMA-IR и HOMA-B. Через 52 недели достигнуто достоверное (р < 0,01) снижение средних уровней HbA1c (с 8,7 ± 1,4 % до 7,2 ± 1,3 %), гликемии натощак (с 9,2 ± 3,0 ммоль/л до 7,2 ± 1,8 ммоль/л) и постпрандиальной гликемии (с 17,5 ± 5,1 ммоль/л до 10,9 ± 3,6 ммоль/л). При этом индекс HOMA-B (улучшение функции бета-клеток) достоверно увеличился от 50,3 ± 33,5 до 75,1 ± 32,8. В течение исследования никаких тяжелых неблагоприятных событий не наблюдалось. Результаты исследования подтверждают необходимость раннего начала комбинированной терапии ситаглиптином и метформином у больных с впервые выявленным сахарным диабетом 2-го типа со сниженной функцией бета-клеток.
В другом двойном слепом рандомизированном плацебо-контролируемом исследовании (S.L. Ellis и соавт., 2011) изучалось влияние ситаглиптина (100 мг в сутки) на гликемический контроль у 20 взрослых больных СД 1-го типа в течение 8 недель. Данные постоянного мониторинга гликемии показали достоверное улучшение гликемического контроля: средний уровень гликемии снизился на 0,6 ммоль/л (р = 0,012), время нахождения в эугликемическом состоянии (4,4–7,8 ммоль/л) увеличилось до 0,4 ± 0,2 ч (р = 0,046). Наблюдалось также достоверное уменьшение показателя HbA1c и дозы инсулина на фоне приема ситаглиптина. Таким образом, дополнительный прием ситаглиптина позволяет значительно улучшить гликемический контроль у взрослых больных СД 1-го типа, достоверно снижая потребность в экзогенном инсулине. Безусловно, в этом направлении необходимы дальнейшие клинические исследования на большем контингенте больных СД 1-го типа.
Современные международные рекомендации по применению инкретинов (2008–2011 гг.)
Современная диабетология развивается столь быстрыми темпами, что появляющиеся ежегодно новые международные рекомендации, консенсусы и руководства, касающиеся наиболее оптимального алгоритма лечения больных СД 2-го типа, не успевают отразить всех достижений мировой практики по использованию инновационных средств.
Класс инкретиновых препаратов лишь недавно вошел в общемировую диабетологическую практику. В «Алгоритмах специализированной медицинской помощи больным сахарным диабетом», 4-й выпуск (Москва, 2009), препараты из группы миметиков ГПП-1 и ингибиторов ДПП-4 упоминаются как препараты второго ряда при лечении СД 2-го типа вследствие пока еще небольшого опыта их применения.
В отличие от объединенного консенсуса ADA/EASD рекомендации Канадской диабетической ассоциации (CDA, декабрь 2008 г.) отражают официальное мнение этой организации и отвечают всем требованиям, предъявляемым к подобным документам, основанным на результатах доказательной медицины.
Принципиальным отличием рекомендаций CDA является то, что в них не дискриминируется тот или иной ряд препаратов в отношении их первостепенной или второстепенной значимости. Эксперты CDA согласны, что препаратом, оптимальным для инициации сахароснижающей терапии, является метформин (на фоне обязательного соблюдения здорового образа жизни). Однако при неэффективности монотерапии метформином к нему на втором этапе терапии в равной степени (зависящей от индивидуальных нужд и рисков, имеющихся у больного) могут быть добавлены: ингибиторы ДПП-4, препараты СМ или меглитиниды, инсулины, ингибиторы альфа-глюкозидазы, средства, снижающие вес. Специалисты CDA справедливо считают, что некомпенсированные пациенты, принимающие метформин, имеют право на гораздо больший выбор терапевтических возможностей, чем традиционное назначение препаратов СМ и/или инсулина, как это предложено в консенсусе ADA/EASD.
В мае 2008 г. Национальный институт здоровья Великобритании (NICE) издал рекомендации по лечению больных СД 2-го типа, в которых основное внимание было уделено алгоритму назначения миметиков ГПП-1 (экзенатид) и ингибиторов ДПП-4. В этом документе предложено назначать экзенатид в качестве третьего препарата при неэффективности контроля гликемии (НbА1с > 7,5 %) при комбинированной терапии метформином и препаратами СМ. То есть экзенатид рассматривается как альтернатива инсулину (при психологической или иной непереносимости инсулина или при проблемах, связанных с прибавкой массы тела). Ингибиторы ДПП-4 предложено добавлять на втором этапе терапии либо к метформину, либо к препаратам СМ (если имеются противопоказания или непереносимость метформина) при неэффективности монотерапии этими препаратами (при НbА1с > 6,5 %). Ингибиторы ДПП-4 имеют преимущества у тех пациентов, которые входят в группу высокого риска гипогликемии, имеют работу, требующую высокой концентрации внимания (высотные работы, работа со сложными механизмами и т.д.), а также у одиноких и пожилых лиц.
Ассоциация британских клинических диабетологов (ABCD) в заявлении, опубликованном в июне 2009 г. (Practical Diab. Int. — 2009. — Vol. 26. — P. 191-194), уточнила и расширила показания к применению миметиков/аналогов ГПП-1 и ингибиторов ДПП-4. Показания к применению ингибиторов ДПП-4 (глиптинов) у больных СД 2-го типа:
— рекомендуются пациентам, у которых при терапии метформином и препаратами СМ не достигнут контроль гликемии и наблюдаются частые гипогликемические состояния. В этом случае препараты СМ могут быть заменены на глиптины;
— пациентам с неудовлетворительным контролем гликемии при комбинации метформина и препаратов СМ;
— отменить глиптины при снижении СКФ < 50 мл/мин;
— перед назначением вилдаглиптина следует оценить уровень печеночных трансаминаз. При превышении их уровня в 3 раза препарат отменить;
— продолжить лечение глиптинами, если уровень НbА1с снизился более чем на 0,5 % за 6 месяцев терапии.
Алгоритм Американской ассоциации клинических эндокринологов и Американского колледжа эндокринологов (ААСЕ/АСЕ, октябрь 2009 г.) имеет наиболее четкую позицию в отношении старта и интенсификации сахароснижающей терапии у больных СД 2-го типа в зависимости от исходного уровня НbА1с, обнаруженного при первом обращении больного. Согласно этим рекомендациям ингибиторы ДПП-4 (равно как метформин и акарбоза) могут быть назначены в качестве монотерапии в дебюте заболевания при уровне НbА1с 6,5–7,5 %. При ее неэффективности назначается комбинированная терапия, основанная на сочетании препаратов, устраняющих инсулинорезистентность (метформин), с инкретинами или секретагогами (СМ/глиниды). На третьем этапе назначается комбинация из трех препаратов, и, наконец, при неэффективности этой терапии рекомендуется инсулинотерапия. Переход от одного этапа к другому предполагается через 2–3 месяца лечения.
При выявлении в дебюте заболевания уровня НbА1с от 7,6 до 9,0 % рекомендации ААСЕ/АСЕ предлагают сразу начинать с комбинированной терапии двумя препаратами, один из которых метформин, а другой — либо инкретин (ГПП-1 или ингибитор ДПП-4), либо секретагог. Наконец, при уровне НbА1с > 9 % в дебюте заболевания рекомендуется либо сразу начинать с инсулинотерапии, либо попытаться применить комбинированную терапию метформина в сочетании с инкретинами или секретагогами.
Таким образом, новые рекомендации ААСЕ/АСЕ предлагают на всех этапах развития болезни, начиная с дебюта СД, пробовать компенсировать больных инкретинами (в монотерапии или в составе комбинированной терапии), поскольку эти препараты обладают наиболее физиологичным механизмом стимуляции секреции инсулина «по потребности», не вызывая гиперинсулинемии и не провоцируя развития гипогликемии.
1. Holst J.J., Gromada J. Role of incretin hormones in the regulation of insulin secretion in diabetic and nondiabetic humans // Am. J. Physiol. Endocrinol. Metab. — 2004. — Vol. 287. — P. 199-206.
2. Drucker D.J., Nauck M.A. The incretin system: glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in type 2 diabetes // Lancet. — 2006. — Vol. 368. — P. 1696-1705.
3. Drucker D.J. The biology of incretin hormones // Cell. Metab. — 2006. — Vol. 3. — P. 153-165.
4. Sinha A., Rajan M., Hoerger T., Pogach L. Costs and consequences associated with newer medications for glycemic control in type 2 diabetes // Diabetes Care. — 2010. — Vol. 33. — P. 695-700.
5. Elashoff M., Matveyenko A.V., Gier B. et al. Pancreatitis, pancreatic, and thyroid cancer with glucagon-like peptide-1-based therapies // Gastroenterology. — 2011. — Vol. 141. — P. 150-156.
6. Vigersky R.A. An overview of management issues in adult patients with type 2 diabetes mellitus // J. Diabetes Sci. Technol. — 2011. — Vol. 5. — P. 245-250.
7. Buse J.B., Nauck M.A., Forst T. et al. Efficacy and safety of exenatide once weekly versus liraglutide in subjects with type 2 diabetes (DURATION-6): a randomised, open-label study. Program and abstracts of the 47th Annual Meeting of the European Association for the Study of Diabetes, September 13–16, 2011, Lisbon, Portugal. Abstract 75.
8. Neumiller J.J. Differential chemistry (structure), mechanism of action, and pharmacology of GLP-1 receptor agonists and DPP-4 inhibitors // J. Am. Pharm. Assoc. — 2009. — Vol. 49, Suppl. 1. — S. 16-29.
9. McConell L., Malloy J., Huang W. et al. Safety and efficacy of once monthly exenatide administration over 20 weeks in patients with type 2 diabetes. Program and abstracts of the 47th Annual Meeting of the European Association for the Study of Diabetes, September 13–16, 2011, Lisbon, Portugal. Abstract 76.
10. Kielgast U., Krarup T., Holst J.J., Madsbad S. Four weeks treatment with liraglutide reduces insulin dose without loss of glycaemic control in type 1 diabetic patients with and without residual beta cell function. Program and abstracts of the 47th Annual Meeting of the European Association for the Study of Diabetes, September 13–16, 2011, Lisbon, Portugal. Abstract 74.
11. Christensen M., Knop F.K., Holst J.J., Vilsboll T. Lixisenatide, a novel GLP-1 receptor agonist for the treatment of type 2 diabetes mellitus // Drugs. — 2009. — Vol. 12. — P. 503-513.
12. Bolli G.B., Munteanu M., Dotsenko S. et al. Efficacy and safety of lixisenatide once-daily versus placebo in patients with type 2 diabetes mellitus insufficiently controlled on metformin (GetGoal-F1). Program and abstracts of the 47th Annual Meeting of the European Association for the Study of Diabetes, September 13–16, 2011, Lisbon, Portugal. Abstract 784.
13. Ratner R.E., Hanefeld M., Shamanna P. et al. Efficacy and safety of lixisenatide once-daily versus placebo in patients with type 2 diabetes mellitus insufficiently controlled on sulfonylurea ± metformin (GetGoal-S). Program and abstracts of the 47th Annual Meeting of the European Association for the Study of Diabetes, September 13–16, 2011, Lisbon, Portugal. Abstract 785.
14. Lim S., An J.H., Shin H. et al. Factors predicting therapeutic efficacy of combination treatment with sitagliptin and metformin in type 2 diabetic patients: the COSMETIC Study // Clinical Endocrinology. — 2011. — № 9.
15. Ellis S.L., Moser E.G., Snell-Bergeon J.K. et al. Effect of sitagliptin on glucose control in adult patients with Type 1 diabetes: a pilot, double-blind, randomized, crossover trial // Diabetic Medicine. — 2011. — Vol. 28, № 10. — P. 1176-1181.