Журнал «Медицина неотложных состояний» 3(10) 2007
Вернуться к номеру
Роль калікреїн-кінінової системи у розвитку патологічних станів в організмі людини
Авторы: І.Г. Палій, С.В. Заїка, Д.В. Палій Вінницький національний медичний університет ім. М.І. Пирогова
Рубрики: Медицина неотложных состояний, Кардиология
Разделы: Справочник специалиста
Версия для печати
Калікреїн-кінінова, ренін-ангіотензин-альдостеронова, симпатоадреналова та ендотеліальна системи відіграють важливу роль у забезпеченні регуляторних функцій людського організму. Калікреїн-кінінова система, зокрема, бере участь у механізмах регуляції артеріального тиску і мікроциркуляції, а саме призводить до зниження артеріального тиску та збільшення проникності судинних стінок, гематоенцефалічного бар’єра, пригнічення активності ренін-альдостеронової системи [21]. Важливу роль відіграє калікреїн-кінінова система в процесах згортання крові та фібринолізу, функціонуванні системи комплементу, контролі тонусу гладкої мускулатури деяких органів. Крім того, вона контролює різні стадії реакцій імунної відповіді, розвиток запалення, шоку різної етіології, тромбозів, геморагій, формування больового синдрому [6, 7, 24, 26].
Розуміння шляхів активації та інгібіції калікреїн-кінінової системи зможе допомогти клініцисту в лікуванні багатьох патологічних станів, пов’язаних із надмірною активацією цієї системи.
Калікреїн-кінінова система: компоненти, шляхи активації, біологічні ефекти
Калікреїн-кінінова система складається з кініногенів, прокалікреїну, які після активації перетворюються відповідно на брадикінін та калікреїн. Брадикінін реалізує свої фізіологічні ефекти шляхом взаємодії з відповідними рецепторами (рецептори брадикініну) [14, 16].
Кініногени є поліфункціональними глікопротеїнами, що синтезуються переважно в печінці і наявні в організмі людини у вигляді 2 форм: високомолекулярний кініноген, що має масу більшу за молекулярну, і циркулює переважно в плазмі крові, та низькомолекулярний кініноген, що характеризується меншою молекулярною масою та циркулює здебільшого в тканинах і судинах мікроциркуляторного русла [24, 25].
Кініногени можуть зворотно зв’язуватись із тромбоцитами, зменшуючи їх адгезію; нейтрофілами, збільшуючи звільнення вільних радикалів кисню, гранулоцитарної еластази та лактоферину; ендотеліоцитами, прискорюючи швидкість утворення брадикініну, що стимулює продукції NO і простацикліну, впливаючи тим самим на антитромботичну активність та вазодилатацію [9, 24, 25].
Активація кінінів з утворенням брадикініну відбувається під впливом калікреїну.
Калікреїн розподіляється на калікреїн плазми (локалізується в плазмі крові) та тканинний (локалізується в тканинах слинних залоз та підшлункової залози та їх секретах, стінці кишок, нирках і сечі, у статевих і потових залозах).
Калікреїн плазми утворюється з прекалікреїну шляхом взаємодії з активованим XII фактором згортання крові. Тканинний калікреїн утворюється як результат впливу внутрішньоклітинних протеїназ на тканинний прекалікреїн [13, 18, 25, 26].
Калікреїн має широкий спектр регуляторних функцій, а саме:
1. Перетворює високомолекулярний кініноген на брадикінін.
2. Активує систему фібринолізу шляхом активації плазміногену та проурокінази.
3. Стимулює вивільнення цитокінів (інтерлейкіну?1, фактора некрозу пухлин), які відіграють провідну роль у розвитку запалення.
4. Стимулює активацію лейкоцитів із наступним вивільненням гранулоцитарної еластази та активацію латентної колагенази.
Всі ці властивості калікреїну плазми забезпечують участь ферменту в розвитку таких важливих процесів в організмі людини, як гемокоагуляція, фібриноліз, лізис клітин, регуляція артеріального тиску. За певних обставин ці властивості визначають розвиток багатьох патологічних процесів, а саме: гострого та хронічного запалення, шоку різної етіології, алергії, тромбогеморагічних порушень, у тому числі й синдрому дисемінованого внутрішньосудинного згортання крові (ДВЗ-синдром), онкологічних захворювань [7, 22, 24, 26]. Патогенетичні ефекти калікреїну особливо демонстративно проявляють себе при нестачі таких його інгібіторів, як a2-макроглобулін, антитромбін ІІІ та інактиватор протеїну С [22, 26].
Брадикінін є кінцевим продуктом калікреїн-кінінової системи і має різноманітні фізіологічні ефекти: призводить до розширення коронарних та периферичних судин; знижує артеріальний тиск; збільшує проникну здатність капілярів; скорочує гладку мускулатуру бронхів та інших органів; стимулює діапедез лейкоцитів, вивільнює гістамін із базофілів; змінює стан гематоенцефалічного бар’єра; стимулює синтез та вивільнення прозапальних простагландинів Е2 та Е2a і фактора некрозу пухлин; модулює передачу нервових імпульсів у ЦНС та периферичній нервовій системі й відіграє важливу роль у формуванні больового синдрому шляхом активації В1- та В2-рецепторів, особливо при виникненні больового синдрому, пов’язаного з запаленням; стимулює захоплення глюкози периферичними тканинами; сприяє репарації тканин шляхом стимуляції фібробластів [11, 14–16, 19, 20, 25].
Аналіз функціонування калікреїн-кінінової системи дозволяє відзначити, що пусковими (тригерними) механізмами в активації діяльності цієї системи є активований XII фактор згортання крові та внутрішньоклітинні протеїнази (рис. 1). За умов надмірного утворення тригерних факторів виникає патологічна активація калікреїн-кінінової системи, що служить додатковим несприятливим фактором перебігу захворювання з виникненням загрозливих для життя станів, таких як ДВЗ-синдром, важкокерована артеріальна гіпотензія, значний больовий синдром та інші.
Захворювання, що призводять до надмірної активації
калікреїн-кінінової системи
калікреїн-кінінової системи
Інфекційно-токсичний шок. Екзотоксини бактерій, взаємодіючи з XII фактором згортання крові, призводять до його активації. Подальший запуск калікреїн-кінінової системи відбувається за плазмовим механізмом (рис. 1). Активація комплементу призводить до розвитку анафілактоїдних реакцій і активації комплементарних білків, що збільшують судинну проникність, забезпечують лейкотаксис, лейкоаглютинацію та потенціюють запалення [7]. Синергічна дія анафілотоксинів, брадикініну, ендорфінів та простациклінів зменшує загальний периферичний опір судин і викликає тяжку гіпотонію, що сприяє виникненню інфекційно-токсичного шоку [4].
Синдром тривалого стискання. Внаслідок стискання великих м’язових масивів тіла людини відбувається руйнація клітин із наступним виходом у міжтканинний простір та системний кровотік великої кількості внутрішньоклітинних протеїназ. Активація калікреїн-кінінової системи відбувається за тканинним та плазмовим механізмами (рис. 1) [4, 7, 26]. Наслідком такої активації є зменшення проникності судин мікроциркуляторного русла та загального периферичного опору судин, падіння артеріального тиску, активація систем згортання та фібринолізу. За відсутності відповідного лікування можливе виникнення синдрому дисемінованого внутрішньосудинного згортання крові [7, 26].
Опікова хвороба. Внаслідок опіків шкіри відбувається руйнація клітин із наступним виходом у міжтканинний простір та системний кровотік великої кількості внутрішньоклітинних протеїназ. Одночасні гемоліз еритроцитів та руйнація тромбоцитів призводять до активації калікреїн-кінінової системи за тканинним і плазмовим механізмами (рис. 1) [4, 5, 9, 25, 26]. Втрата плазми через опікову поверхню та збільшення проникності судин мікроциркуляторного русла за рахунок брадикініну сприяють згущенню крові, гемоліз еритроцитів і руйнація тромбоцитів активують систему згортання крові, а калікреїн виступає в ролі активатора фібринолізу, що за відсутності відповідної фармакологічної корекції є пусковим механізмом розвитку синдрому дисемінованого внутрішньосудинного згортання крові [4, 25, 26].
Гострий панкреатит та загострення хронічного паренхіматозного панкреатиту зі збереженою секреторною функцією. В основі патогенезу захворювання лежить феномен «ухилу» активованих панкреатичних ферментів із потраплянням їх у системний кровотік і відповідною активацією калікреїну плазми. Одночасно відбувається активація тканинного калікреїну, що локалізується в паренхімі підшлункової залози. Калікреїн плазми крові та тканинний калікреїн активують процеси згортання крові та фібринолізу, за рахунок ефектів брадикініну збільшується проникніть судин мікроциркуляторного русла (рис. 1). Це призводить до прогресування набряку підшлункової залози, зменшення об’єму циркулюючої крові, що є одним із ключових механізмів виникнення панкреатичного шоку з його термінальним проявом — синдромом дисемінованого внутрішньосудинного згортання крові [2, 3, 6, 8, 12, 18].
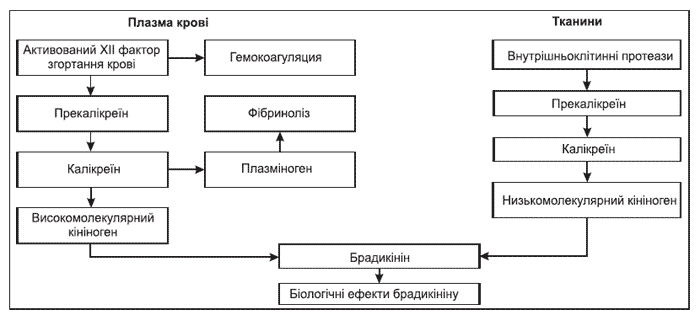
Травматичне пошкодження печінки та підшлункової залози. В печінці та підшлунковій залозі знаходиться велика кількість тканинного калікреїну [4, 8, 12, 18, 26]. Внаслідок травми цих органів вивільняється велика кількість протеїназ, які призводять до активації тканинного калікреїну і запуску тканинного механізму активації калікреїн-кінінової системи з відповідними наслідками у вигляді збільшення проникності судин мікроциркуляторного русла, зменшення об’єму циркулюючої крові, активації згортання крові й фібринолізу, що сприяє погіршенню перебігу геморагічного шоку і можливому виникненню синдрому дисемінованого внутрішньосудинного згортання крові.
Роль калікреїн-кінінової системи у виникненні та прогресуванні бронхоспазму. Результатом взаємодії алергенів та антитіл на поверхні слизової оболонки бронхів є руйнація бронхіального епітелію, що призводить до виділення внутрішньоклітинних протеаз і запуску механізму тканинної активації калікреїн-кінінової системи (рис. 1). В результаті цього утворюється брадикінін, який самостійно призводить до посилення бронхоконстрикції, а також сприяє синтезу простагландинів Е2 та Е2a. Утворені простагландини, у свою чергу, посилюють бронхоконстрикцію та сприяють притоку лейкоцитів у слизову оболонку бронхів і є факторами підтримування запального процесу в бронхах. Існуючий у хворих на бронхіальну астму дефіцит ферментів, що гідролізують калікреїн та брадикінін, призводить до посилення ефектів брадикініну [1, 11, 17].
Роль калікреїн-кінінової системи у виникненні болю при хронічному запаленні. Хронічний запальний процес у різних тканинах організму призводить до вивільнення внутрішньоклітинних протеїназ і запуску тканинного механізму активації калікреїн-кінінової системи (рис. 1). Результатом цього є утворення брадикініну, який, з одного боку, шляхом активації специфічних до нього рецепторів В1 та В2 призводить до виникнення болю, а з іншого — запускає каскад механізмів (стимулює синтез прозапальних простагландинів Е2 та Е2a, збільшує проникність судин і відповідно призводить до прогресування набряку, стимулює роботу енкефаліназ, зменшуючи у такий спосіб кількість ендогенного енкефаліну та ендорфіну), що посилюють вже існуючі больові відчуття [10, 20, 23].
Підсумовуючи вищесказане, слід відзначити, що активний фармакологічний вплив на калікреїн-кінінову систему призведе до суттєвого покращення перебігу багатьох захворювань.
Шляхи фармакологічного впливу
на калікреїн-кінінову систему
на калікреїн-кінінову систему
Серед фізіологічних інгібіторів калікреїн-кінінової системи виділяють ангіотензинперетворюючий фермент, що інактивує брадикінін; a2-макроглобулін, антитромбін ІІІ, інактиватор протеїну С, які інактивують плазмовий калікреїн та плазміноген.
Інгібітори калікреїн-кінінової системи в клінічній практиці не використовуються через їх відсутність у вигляді лікарських форм. Єдиним виключенням є антитромбін ІІІ, який теж не набув достатнього поширення. З метою блокування калікреїн-кінінової системи в сучасній фармакотерапії широко використовуються природні інгібітори протеаз, до яких належить апротинін [2–4, 8, 22].
Апротинін — природний інгібітор протеолітичних ферментів, який отримують з легенів великої рогатої худоби. Його активність вимірюється в антитрипсинових одиницях (АТО) або калікреїнінгібуючих одиницях (КІО); 1 АТО відповідає 1,33 КІО.
Назва фармакологічної групи, до якої входить апротинін, — «інгібітори протеаз» — на сьогодні має суто історичне значення. На момент виділення апротиніну вважалося, що цей препарат буде мати антипротеазну активність щодо ферментів, які проникають у системний кровотік при гострому панкреатиті. На сьогодні відомо, що організм людини має потужну ендогенну антипротеазну систему і в більшості випадків немає потреби у використанні зовнішніх інгібіторів протеаз [2].
Подальше вивчення апротиніну показало, що ця фармакологічна група має найбільший інгібуючий вплив на калікреїн-кінінову систему і препарати цієї групи розглядаються саме як інгібітори калікреїну [2, 3].
До основних фармакологічних ефектів апротиніну, представленого на українському фармацевтичному ринку у вигляді препарату Гордокс, слід віднести [2, 18, 23 ]:
— взаємодію з плазміном, що призводить до інактивації останнього і, відповідно, блокування процесів фібринолізу;
— інгібіцію утворення калікреїну, що зумовлює антифібринолітичний та антибрадикініновий ефекти Гордоксу;
— блокаду як плазмового, так і тканинного шляхів активації калікреїн-кінінової системи, що забезпечується завдяки добрій проникності в позаклітинний простір;
— блокаду дії енкефаліназ, що збільшує кількість ендогенного енкефаліну;
— незначну антипротеазну активність.
Місце Гордоксу
в схемах фармакотерапії
в схемах фармакотерапії
Інфекційно-токсичний шок. Призначення апротиніну у хворих з інфекційно-токсичним шоком буде призводити до блокування плазмового механізму активації калікреїну та викликати інгібіцію плазміну. Ці ефекти забезпечать профілактику синдрому дисемінованого внутрішньосудинного згортання крові.
Зменшуючи синтез брадикініну, Гордокс забезпечує зменшення проникності судинних стінок, завдяки чому відбувається профілактика неконтрольованого падіння артеріального тиску за умови інфекційно-токсичного шоку.
Синдром тривалого стискання. Опікова хвороба. Призначення Гордоксу забезпечить блокаду тканинного механізму активації калікреїну і, відповідно, буде запобігати виникненню синдрому дисемінованого внутрішньосудинного згортання крові.
Припинення синтезу брадикініну зменшить проникність судинних стінок та набряк тканин, зупинить певною мірою втрату плазми і, як наслідок, забезпечить контроль над зниженням артеріального тиску.
Гострий панкреатит та загострення хронічного паренхіматозного панкреатиту зі збереженою секреторною функцією. Травматичне пошкодження печінки та підшлункової залози. Призначення апротиніну в таких клінічних ситуаціях забезпечує блокаду тканинних механізмів активації калікреїну, що обумовлює зменшення набряку органу і, відповідно, сповільнення некрозу підшлункової залози та зменшення больового синдрому. Блокада плазмового механізму активації калікреїну буде сприяти профілактиці неконтрольованого падіння артеріального тиску і виникнення ДВЗ-синдрому.
Лікування тяжкого нападу бронхіальної астми. Гордокс доцільно використовувати у лікуванні тяжкого нападу бронхіальної астми в тих випадках, коли інші фармакологічні препарати недостатньо ефективні. Позитивний ефект апротиніну в цьому разі обумовлений блокуванням тканинного механізму активації калікреїну і, відповідно, зменшенням активності брадикініну з його бронхоконстриктивними та прозапальними ефектами.
Лікування болю при хронічному запаленні. При хронічному запаленні апротинін блокує утворення тканинного калікреїну і брадикініну. У такий спосіб зменшується подразнення В1- та В2-рецепторів, що відповідають за больові відчуття, зменшуються проникність судин та набряк ураженої ділянки. Завдяки зниженню під дією Гордоксу утворення прозапальних простагландинів відбувається зменшення тривалості больового синдрому.
Лікування болю при оперативних втручаннях. У науковій літературі, присвяченій вивченню проблем знеболення, велика увага приділяється профілактичній анальгезії взагалі та використанню апротиніну (Гордоксу) для зменшення наслідків операційної травми та післяопераційного больового синдрому зокрема. Внаслідок операційного втручання відбувається травматизація тканин і, відповідно, активація внутрішньоклітинних протеїназ, що призводить до тканинного механізму активації калікреїн-кінінової системи і маніфестації небажаних ефектів брадикініну. Блокування активації калікреїну зменшить подразнення В1- та В2-рецепторів, що відповідають за створення больового відчуття, знизить проникність судин, завдяки чому зменшиться набряк ураженої ділянки.
Лікування абстинентного синдрому при наркотичній залежності. При абстинентному синдромі, пов’язаному із вживанням наркотичних речовин, призначення Гордоксу забезпечує блокування активності енкефаліназ. За рахунок такого ефекту збільшується кількість ендогенного енкефаліну та ендорфіну, що дозволяє хворим із наркотичною залежністю легше і швидше перенести абстинентний синдром, пов’язаний із відміною наркотиків [10, 23].
Схеми призначення Гордоксу
для лікування захворювань, пов’язаних з активацією
калікреїн-кінінової системи
для лікування захворювань, пов’язаних з активацією
калікреїн-кінінової системи
Під час проведення фармакотерапії Гордоксом лікування починають з максимально можливих доз. Така терапія повинна тривати не менше 2–3 діб.
Терапевтична доза Гордоксу становить не менше 1 000 000 КІО (10 ампул) на добу. Початкова доза становить 500 000 КІО. Препарат вводиться внутрішньовенно крапельно з максимальною швидкістю введення 5 мл/хв. Надалі інфузії повторюють кожні 4–6 год по 200 000 КІО. Дітям добову дозу Гордоксу визначають із розрахунку 200 000 КІО на 1 кг маси тіла. Добову дозу розподіляють на 3–4 введення.
Особливістю Гордоксу є можливість його введення в порожнини, наприклад черевну порожнину для проведення перитонеального лаважу або грудну клітку, без попереднього розведення. З цією метою використовуються дози до 15 000 000 КІО (залежно від захворювання та стану хворого) [12].
Апротинін (Гордокс) можна використовувати місцево за допомогою гальванізації. За даними Iftodii та співавт., такий шлях введення при гострому панкреатиті зменшує активність протеолізу в 3–6 разів [18].
Слід пам’ятати, що Гордокс виводиться нирками і при зниженні клубочкової фільтрації необхідне проведення корекції дози препарату.
Список литературы
1. Абросимов В.Н., Порядин В.Г. Воспаление и гиперреактивность дыхательных путей при бронхиальной астме // Терапевтический архив. — 1994. — № 11. — С. 60-64.
2. Губергриц Н.Б., Агапова Н.Г. Купирование боли при хроническом панкреатите // Сучасна гастроентерологія. — 2004. — № 4 (18). — С. 13-24.
3. Губергриц Н.Б., Христич Т.Н. Клиническая панкреатология. — Донецк: Лебедь, 2000. — 416 с.
4. Дубицкий А.Е., Семенов И.А., Чепкий Л.П. Медицина катастроф. — Киев: Здоров’я, 1993. — 462 с.
5. Кадышев Ю.Г., Левицкий А.П., Литвинов П.Г. и др. Применение ингибиторов протеиназ для лечения ожоговых ран // Клин. хирургия. — 1992. — № 3. — С. 42-44.
6. Криворучко И.А., Тищенко А.М., Климова Е.М. Синдром полиорганной дисфункции при остром панкреатите // Вісн. мор. медицини. — 1999. — № 2. — С. 78-80.
7. Лычев В.Г. Диагностика и лечение диссеминированного внутрисосудистого свертывания крови. — 2-е изд. — Н. Новгород: НГМА, 1998. — 191 с.
8. Шалимов А.А., Крыжевский В.В., Ничитайло М.Е., Лечение острого панкреатита // Клін. хірургія. — 2000. — № 4. — С. 5-9.
9. Adam A., Albert A., Calay G., Closset J., Damas J., Franchimont P. Human kininogens of low and high molecular mass // Clin. Chem. — 1985. — № 31. — P. 423- 426.
10. Almeida O.F.X., Shippenberg T.S. A brief history of opiate // Neurobiology of Opioids. Springer Verlag. — Berlin. — 1991. — P. 75-88.
11. Barnes P.J. Airway inflammation and autonomic control // Eur. J. Respir. Dis. — 1986. — № 69 (Suppl. 147). — P. 80-87.
12. Berling R., Borgstrom A., Ohlsson K. Peritoneal lavage with aprotinin in patients with severe acute pancreatitis. Effects on plasma and peritoneal levels of trypsin and leukocyte proteases and their major inhibitorsи // Int. J. Pancreatol. — 1998. — № 24 (1). — Р. 9-17.
13. Brady A., MacDonald R.J. The expression of two kallikrein gene family members in the rat kidney // Arch. Biochem. Biophys. — 1990. –№ 278. — P. 342-349.
14. Drummond G.R., Cocks T.M. Endothelium-dependent relaxation to the b1 kinin receptor agonist des-Arg9-bradykinin in human coronary arteries // Brit. J. Pharmacology. — 1995. — Vol. 76. — P. 13E-18E.
15. Ellis E.F. New-Trends in Lipid Mediators Research — Basel: Karger, 1990. — Р. 129-145.
16. Farmer S.G., Burch R.M. Pharmacology of bradykinin receptors in bradykinin antagonists: basic and clinical research. — N.Y.: Marcel Dekker Inc., 1991. — P. 1‑32.
17. Frossard N., Rhoden K.J., Barnes P.J. Influence of epithelium removal on guinea pig airway responses to tachykinins: role of endopeptidase and cyclooxygenase // J. Pharmacol. Exp. Ther. — 1989. — № 248. — P. 292-297.
18. Iftodii A. Effects of constant-current electric field on tissue and plasma proteolysis in acute pancreatitis // Klin. Khir. — 1998. — № 2. — Р. 34-36.
19. Lopes-Martins R.A.B., Antunes E., Oliva M.L., Sampaio C., Burton J., de Nucci G. Pharmacological characterization of rabbit corpus cavernosum relaxation // Br. J. Pharmacol. — 1994. — № 113. — P. 81-86.
20. Marceau F. B1 receptors: A review // Immunopharmacology. — 1995. — № 30. — P. 1-26.
21. Mombouli J.V., Illiano S., Nagao T. et al.Potentiation of endothelium-dependent relaxation to bradykinin by angiotensin-I converting enzyme inhibitors in canine coronary artery involves both endothelium-derived relaxing and hyperpolarizing factors // Circul. Res. — 1992. — Vol. 71. — P. 137-144.
22. Nagase H., Salveseu G. Innovation in Proteases and Their Inhibitors. — New York: Walter de Gruyter, 1993. — P. 315-332.
23. Pinsky C., Dua A.K., LaBella F.S. Peptidase inhibitors reduce opiate narcotic // Brain Research. — 1982. — № 234. — P. 301-307.
24. Regoli D., Barabe J. Pharmacology of bradykinin and related kinins // Pharm. Rev. — 1980. — № 32. — P. 1‑46.
25. Regoli D., Barabe J. The Kallikrein-Kinin System in Health and Disease // Munich; Limbach: Verlag Braunschweig. — 1989. — P. 374.
26. Rodell T.C. The kallikrein / kinin system and kinin antagonists in trauma // Immunopharmacology. — 1996. — № 33. — P. 279-283.
