Журнал «Медицина неотложных состояний» 3(34) 2011
Вернуться к номеру
Клинический случай проведения дифференциальной диагностики у пациента с подозрением на острый инфаркт миокарда
Авторы: Пархоменко А.Н., Лутай Я.М., Кушнир С.П., Иркин О.И. ННЦ «Институт кардиологии имени академика Н.Д. Стражеско»
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
Пациентка 63 лет переведена в отдел реанимации и интенсивной терапии ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» из стационара по месту жительства с диагнозом «ишемическая болезнь сердца (ИБС): острый инфаркт миокарда (ИМ) без зубца Q в области передне-перегородочно-верхушечных отделов с распространением на боковую стенку левого желудочка (ЛЖ)». Заболела остро. После умеренной физической нагрузки почувствовала нарастающее сердцебиение, боли в области сердца, одышку. Отмечалась потеря сознания продолжительностью до 5 минут. Госпитализирована в стационар, где был поставлен предварительный диагноз острого коронарного синдрома. Несмотря на проводимую терапию (аспирин, нефракционированный гепарин, метопролол, эналаприл, нитраты), у пациентки сохранялись одышка, боли за грудиной и в области сердца. На 3-й день после госпитализации развилась кратковременная (до 1 минуты) потеря сознания. На 4-е сутки пациентка отметила заложенность носа, однократное повышение температуры тела (до 38,4 °С), кашель, что было расценено как острое респираторное заболевание с явлениями бронхита и перибронхита. Начата антибиотикотерапия цефалоспорином. У пациентки в анамнезе гипертоническая болезнь II ст., дислипидемия, варикозное расширение вен нижних конечностей, хронический гастрит. ИБС в семейном анамнезе. Переведена в отдел на 7-е сутки от развития заболевания в связи с невозможностью стабилизации состояния.
При поступлении жалобы на одышку пароксизмального характера, давящие боли за грудиной при незначительной физической нагрузке, периодически в покое. Общее состояние средней степени тяжести. Повышенного питания. Кожные покровы телесной окраски, слизистые оболочки с цианотичным оттенком. АД 130/70 мм рт.ст., ЧСС 70 ударов в минуту. Деятельность сердца ритмичная, тоны приглушены. В легких дыхание жесткое, ослаблено в нижних отделах справа, в проекции средней доли правого легкого крепитация, которая исчезает после форсированного дыхания. Живот безболезненный, мягкий. Нижний край печени чувствительный, на 4 см ниже края реберной дуги. Варикозное расширение вен нижних конечностей, больше справа. Пастозность голеней, больше справа. Стул и мочеиспускание — нормальные.
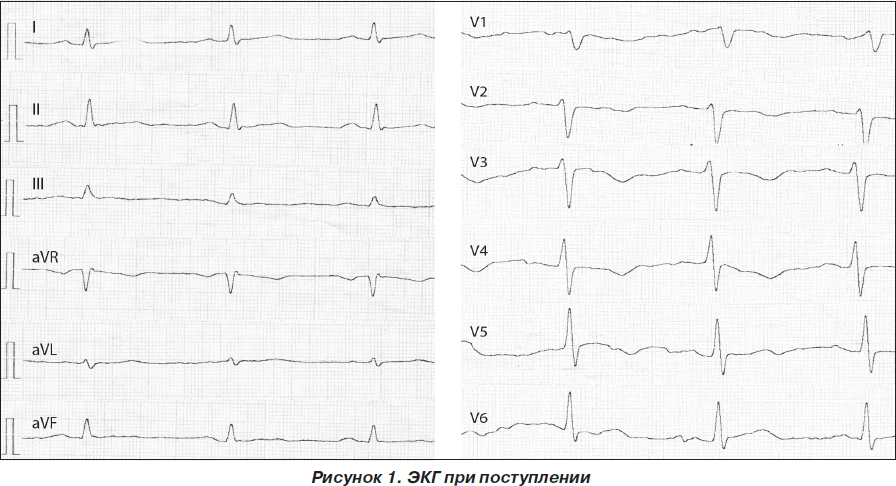
Электрокардиограмма (ЭКГ) и лабораторные данные при поступлении представлены на рис. 1 и в табл. 1–3.
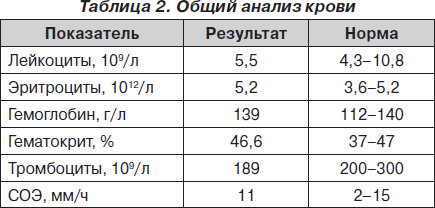
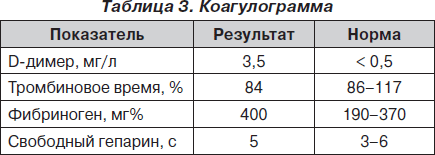
На основании данных анамнеза, клинической картины заболевания, данных ЭКГ и лабораторных исследований при поступлении было принято решение о проведении дифференциальной диагностики между острым ИМ и развитием ранней постинфарктной стенокардии и рецидивирующей тромбоэмболией легочной артерии (ТЭЛА). Уровень D-димера (один из продуктов расщепления фибрина/фибриногена) при поступлении в стационар был значительно повышен и составил 3,5 мг/л, что свидетельствовало о вероятности массивного тромбообразования с активацией фибринолиза у данной пациентки. Учитывая тот факт, что при этом содержание фибриногена не было сниженным, можно было предположить отсутствие системной активации фибринолиза (как это имеет место при синдроме диссеминированного внутрисосудистого свертывания крови). Рост D-димера мог быть обусловлен преимущественным тканевым его компонентом на фоне локального тромбообразования.
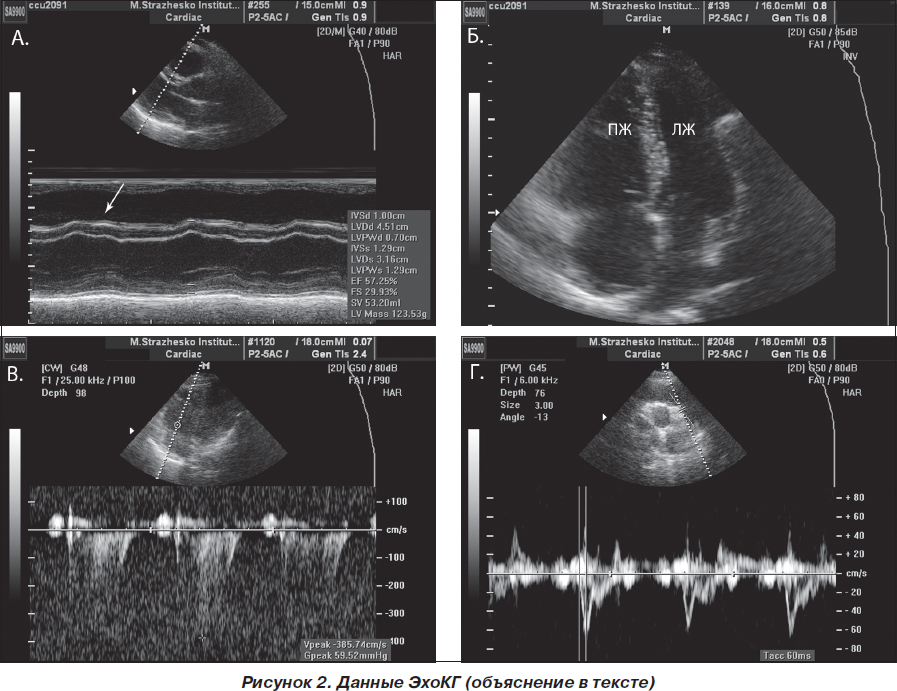
В качестве первого этапа диагностики было проведено ЭхоКГ-исследование, в ходе которого выявлено: КДО — 75 мл, ФВ — 58 %. Сократительная способность ЛЖ сохранена. Парадоксальное движение межжелудочковой перегородки (МЖП) (рис. 2А, указано стрелкой). Выраженная дилатация правых отделов сердца (правый желудочек (ПЖ) до 4,3 см в поперечнике) (рис. 2Б). Гипокинезия свободной стенки ПЖ (рис. 2А), гиперкинезия верхушки ПЖ. Трикуспидальная недостаточность 2+. Градиент давления — 55–60 мм рт.ст. (рис. 2В). Легочная артерия расширена в поперечнике. АссTime в легочной артерии — 50–60 мс (рис. 2Г), что свидетельствует о выраженной легочной гипертензии.
Отсутствие нарушений сократительной способности ЛЖ в совокупности с дилатацией и дисфункцией правых отделов сердца на фоне выраженной легочной гипертензии, по данным эхокардиографии (ЭхоКГ), свидетельствовало в пользу ТЭЛА. Для подтверждения диагноза была проведена мультиспиральная компьютерная томография с контрастированием магистральных сосудов.
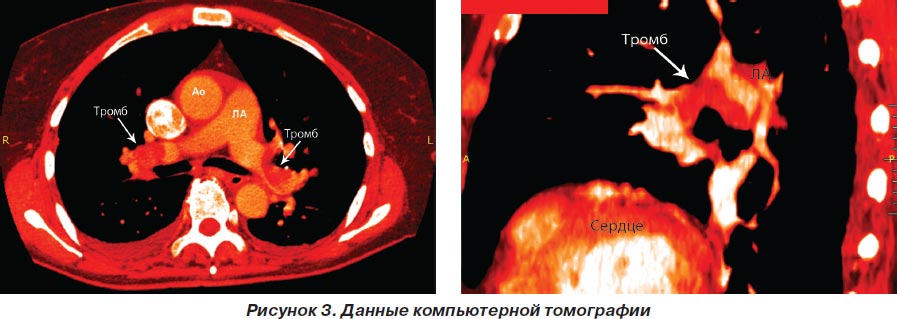
По данным компьютерной томографии с внутривенным введением контрастного вещества выявлены признаки тромбоэмболии основных ветвей правой и левой легочных артерий. Тень сердца расширена преимущественно за счет правых отделов (рис. 3).
Таким образом, после проведения дополнительных диагностических исследований пациентке выставлен заключительный диагноз ТЭЛА. Для дальнейшего лечения пациентка была переведена в кардиохирургический центр, где ей оперативным путем были удалены два массивных тромба в правой и левой ветвях легочной артерии. Ультразвуковое исследование глубоких вен нижних конечностей не выявило тромботических образований. Больная была выписана из стационара с существенным улучшением, с умеренно выраженным одышечным синдромом.
Особенностью данного случая является то, что клинические проявления заболевания носили маскообразный характер, что вместе с наличием семейного анамнеза, «очаговой» графикой ЭКГ, гиперхолестеринемией, отсутствием предшествующего тромбофлебита на фоне варикозной болезни привело к ошибочной диагностике острого коронарного синдрома. Вместе с тем назначение гепарина (стандартный подход к лечению этой категории больных) могло способствовать стабилизации клинической картины при ТЭЛА (или локальном тромбообразовании) с отсутствием типичной ЭКГ-картины перегрузки правых отделов сердца, традиционной тахикардии (больная получала бета-блокатор), тахипноэ свыше 28 в минуту, цианоза верхней половины туловища и набухших шейных вен. Такое течение ТЭЛА встречается при субмассивных тромбообразованиях, когда отсутствует полное перекрытие легочной артерии и правый желудочек еще компенсирует остро возникшую легочную гипертензию. Повторная волна тромбообразования, по-видимому, вызвала острую перегрузку правых отделов сердца с возможным развитием аритмии (чаще фибрилляция предсердий) или кратковременной гипотензии с коллаптоидным состоянием. Последующая гипертермическая реакция в ответ на нарушение легочного кровообращения была расценена как проявление респираторной инфекции, и только отсутствие эффекта от проводимой терапии заставило продолжить поиски причин плохого состояния.
В проведении дифференциальной диагностики большую помощь оказали клиническая настороженность врачей в отношении возможности тромбообразования в системе легочной артерии с вторичной легочной гипертензией. В дальнейшем сработал алгоритм, принятый в отделе и являющийся международным стандартом, — измерение уровня D-димера (это не традиционное исследование, и для его ургентного проведения необходима постоянная лабораторная готовность), проведение ультразвукового исследования сердца и особенно правых его отделов с измерением давления в легочной артерии (пока это не делается повсеместно и не все ургентные отделения оснащены современной ультразвуковой техникой). На основании результатов этих исследований вероятность наличия у нашей больной рецидивирующей ТЭЛА очень возросла.
Как вы обратили внимание, в данном случае не было проведено рентгенологическое исследование. К сожалению, наличие клиновидной тени, описанное в прежних пособиях, в настоящее время встречается довольно редко, в более поздние сроки ТЭЛА и поэтому имеет низкую диагностическую значимость. Для выявления же небольших изменений легочного и сосудистого рисунка должна использоваться современная цифровая рентгенография. Мы даже не упоминаем о возможности применения в ургентных условиях вентиляционно-перфузионной сцинтиграфии легких, которая способна выявить даже небольшие дефекты кровотока в системе легочной артерии. По-прежнему стандартом диагностики ТЭЛА можно считать ангиопульмонографию, которая возможна только в хирургических клиниках. Мы использовали доступный в нашем институте метод томографии органов грудной клетки. Именно данные мультиспиральной компьютерной томографии с контрастированием сосудов позволили подтвердить этот диагноз и явились основанием для перевода больной в специализированный стационар хирургического профиля. Следует отметить, что вся процедура дифференциальной диагностики от поступления в наш отдел до проведения оперативного вмешательства заняла менее 24 часов.
Краткий обзор современного состояния проблемы
ТЭЛА является одной из главных причин госпитализации, смертности и потери трудоспособности. Истинная распространенность ТЭЛА неизвестна, так как заболевание трудно диагностируется и часто не распознается. Согласно имеющимся статистическим данным, частота выявления новых случаев ТЭЛА среди госпитализированных пациентов в США превышает 600 000 в год, а распространенность ТЭЛА в Великобритании и Франции составляет примерно 6 случаев на 10 000 населения в год. Большинство случаев ТЭЛА возникает в стационарах, при этом 70–80 % приходится на долю терапевтических пациентов. Смертность от ТЭЛА составляет около 15 % в реальной клинической практике, а при несвоевременной диагностике и отсутствии терапии — превышает 30 %. В то же время от 27 до 68 % этих смертей потенциально предотвратимы и адекватная антикоагулянтная терапия позволяет достичь значительного снижения показателя летальности (до 2–8 %). ТЭЛА не является самостоятельным заболеванием — зачастую она является осложнением различных болезней, травм и оперативных вмешательств [3]. ТЭЛА наиболее часто развивается у стационарных больных, причем около 70–80 % случаев у пациентов терапевтического профиля.
Причиной ТЭЛА является окклюзия основного ствола или ветвей легочной артерии частичками тромба, которые формируются в венах большого круга кровообращения или полостях правых отделов сердца. Иногда очень сложно отличить тромбоэмболию и локальный тромбоз в системе легочной артерии, потому их рассматривают как единый симптомокомплекс.
Клиническая картина заболевания неспецифична и характеризуется полиморфизмом признаков — от выраженных гемодинамических нарушений и развития острой правожелудочковой недостаточности до бессимптомного течения. При жизни заболевание диагностируется в 50–70 % наблюдений, гипердиагностика имеет место в 65 % случаев.
Огромное значение в своевременной диагностике ТЭЛА имеет настороженность врача, основанная на оценке факторов риска и клинических симптомов заболевания (табл. 4).
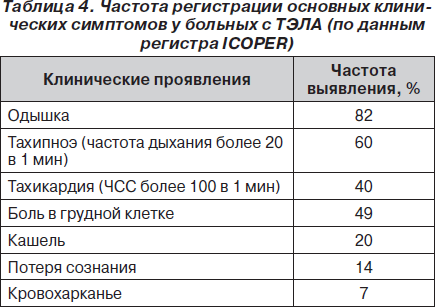
Выраженный полиморфизм клинических симптомов, отсутствие специфических признаков заболевания при общедоступных исследованиях (ЭКГ, рентгенография, лабораторные показатели) определяют необходимость проведения дифференциальной диагностики с целым рядом заболеваний.
Заболевания, с которыми приходится дифференцировать ТЭЛА:
— инфаркт миокарда, нестабильная стенокардия;
— пневмония, бронхит, обострение хронической обструктивной болезни легких;
— сердечная недостаточность;
— бронхиальная астма;
— перикардит;
— первичная легочная гипертензия;
— пневмоторакс, перелом ребра;
— синдром Титце, артралгия и миалгия.
При проведении дифференциальной диагностики принимают во внимание данные лабораторных (D-димер) и инструментальных (ЭКГ, рентгенография, ЭхоКГ, мультиспиральная КТ, вентиляционно-перфузионная сцинтиграфия, ангиопульмонография, ультразвуковое исследование вен нижних конечностей) методов исследования.
Увеличение концентрации D-димера при ТЭЛА свидетельствует о спонтанной активации фибринолитической системы крови в ответ на тромбообразование. Этот показатель характеризуется высокой чувствительностью (95–96 %) и отрицательной предсказательной ценностью (95–99 %), однако низкой специфичностью (около 40–50 %). Таким образом, низкий уровень D-димера (менее 500 мкг/л или 0,5 мг/л) позволяет с высокой вероятностью исключить развитие ТЭЛА, в то же время повышение его уровня может наблюдаться при многих тромботических состояниях (сепсис, острый инфаркт миокарда, злокачественные новообразования, воспаление, после оперативных вмешательств и др.) и не является специфичным для ТЭЛА.
ЭКГ-признаки ТЭЛА не являются специфичными, а в 20–25 % случаев изменения на ЭКГ вообще могут отсутствовать. Наиболее часто встречаются и коррелируют с тяжестью ТЭЛА остро возникшие изменения на ЭКГ, отражающие острую перегрузку правых отделов сердца и легочную гипертензию.
ЭКГ-изменения при ТЭЛА:
— появление зубца Q в III отведении, одновременное увеличение амплитуды зубца S в I отведении и отрицательного зубца Т в III отведении (синдром McGinn — White);
— появление отрицательных симметричных зубцов Т в отведениях V1–V3;
— подъем сегмента ST в отведениях III, aVF, aVR и V1–V3;
— блокада правой ножки пучка Гиса;
— Р-pulmonale;
— смещение переходной зоны влево к отведениям V5–V6;
— синусовая тахикардия и/или другие нарушения ритма (фибрилляция/трепетание предсердий, экстрасистолия и др.).
В большинстве случаев ТЭЛА сопровождается появлением на рентгенограмме непостоянных и малоспецифичных рентгенологических признаков. Наиболее часто выявляют симптомы острого легочного сердца: увеличение правых отделов сердца, расширение верхней полой вены, выбухание легочного конуса по левому контуру сердечной тени, характерно также высокое и малоподвижное стояние купола диафрагмы, наличие дисковидных ателектазов или инфильтратов легочной ткани. Довольно редко можно обнаружить классические признаки инфаркта легкого — клиновидную тень в легочном поле, основанием обращенную к плевре (симптом Хемптона).
ЭхоКГ-исследование при ТЭЛА имеет большую информативность. С одной стороны, позволяет оценить степень легочной гипертензии и перегрузки правых отделов сердца, характерных для ТЭЛА, с другой — исключить ряд заболеваний, которые имеют сходную клиническую симптоматику. ЭхоКГ-признаками ТЭЛА являются: гипокинезия и дилатация правого желудочка, парадоксальное движение межжелудочковой перегородки, трикуспидальная регургитация, отсутствие/уменьшение инспираторного спадения нижней полой вены, дилатация легочной артерии, признаки легочной гипертензии, тромб в полости правого предсердия и желудочка. Особенностью дисфункции ПЖ при ТЭЛА является выраженное нарушение сократимости свободной стенки ПЖ (базальные и средние сегменты) при сохраненной или незначительно нарушенной сократимости верхушки ПЖ (признак Мак-Конелла). Высокой специфичностью для ТЭЛА характеризуется признак «60/60» (время ускорения AccT в ЛА < 60 мс и градиент давления недостаточности трехстворчатого клапана Ј 60, но > 30 мм рт.ст.). ЭхоКГ может также применяться для оценки эффективности терапии при ТЭЛА. Однако этот метод имеет и ряд ограничений, поэтому его роль в диагностике не следует переоценивать (чувствительность метода — 60–70 %).
В последние годы в диагностике ТЭЛА все чаще используют спиральную КТ с внутривенным введением рентгеноконтрастного препарата. Мультиспиральная (мультидетекторная) КТ благодаря высокой информативности и безопасности в настоящее время заменила ангиопульмонографию в качестве золотого стандарта диагностики ТЭЛА. Она позволяет адекватно визуализировать легочные артерии до сегментарного уровня. Данные клинических исследований свидетельствуют, что обнаружение тромба в легочных артериях по данным односпиральной или мультиспиральной КТ является достаточным основанием для постановки диагноза ТЭЛА.
В течение длительного времени ангиопульмонография была эталоном диагностики ТЭЛА, так как метод дает возможность получить максимальную информацию об анатомическом и функциональном состоянии сосудов легких, а его чувствительность и специфичность превышают 95 %. Однако ангиопульмонография является инвазивной процедурой и характеризуется целым рядом осложнений, особенно у гемодинамически нестабильных больных. Поэтому этот метод диагностики в настоящее время используется при недоступности и/или недостаточной информативности других неинвазивных методов.
Диагностические стратегии
Ни один из лабораторных и инструментальных методов, применяемых по отдельности, не обладает достаточно высокой чувствительностью и специфичностью при диагностике ТЭЛА. Поэтому, помимо клинических проявлений, которые могут свидетельствовать о низкой, умеренной или высокой вероятности наличия ТЭЛА, в большинстве случаев для подтверждения или исключения данного диагноза необходимо провести ряд исследований. Ангиопульмонография остается пока эталоном диагностики ТЭЛА. Однако это дорогостоящий метод исследования, связанный с риском осложнений, а его результаты иногда трудно интерпретировать, особенно при поражении мелких ветвей ЛА. Поэтому необходимо провести комплекс лабораторных и неинвазивных инструментальных исследований, который позволит уменьшить показания для проведения ангиографии и в то же время будет достаточно надежен в диагностике этого тяжелого заболевания.
В клинической практике необходимо определить, каким пациентам какие исследования и в какой последовательности проводить. От полученных результатов зависят объем неотложных лечебных мероприятий и дальнейшая тактика ведения пациентов.
Современный алгоритм диагностики ТЭЛА базируется преимущественно на использовании ЭхоКГ и мультиспиральной компьютерной томографии. Этот алгоритм состоит из последовательности действий, каждое из которых позволяет четко и быстро отбирать пациентов, избегая лишних и дорогостоящих методов исследования. Он помогает уверенно и в кратчайший срок установить диагноз и своевременно начать лечение. В то же время результаты последних исследований свидетельствуют, что несоблюдение этого алгоритма диагностики приводит к задержке назначения антикоагулянтной терапии и увеличению риска внезапной смерти.
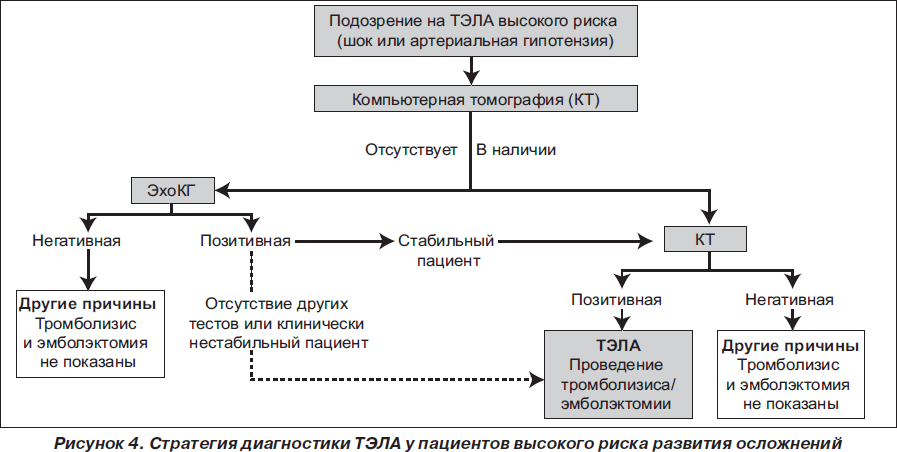
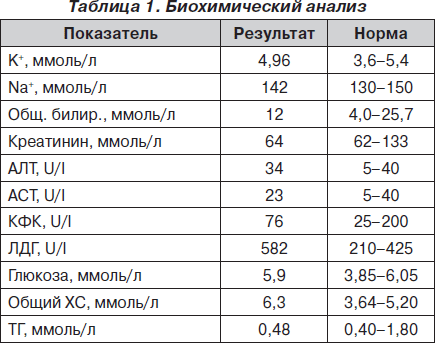
Стратегия диагностики ТЭЛА определяется степенью риска развития осложнений у гемодинамически стабильных и нестабильных пациентов (рис. 4, 5).
У гемодинамически нестабильных пациентов с подозрением на ТЭЛА наиболее целесообразным методом для начала диагностики является ЭхоКГ, которая в большинстве случаев позволяет обнаружить непрямые признаки легочной гипертензии и перегрузки правого желудочка, а также исключить другие причины нестабильности (острый ИМ, расслаивающая аневризма аорты, перикардит). Положительные результаты ЭхоКГ могут быть основанием для постановки диагноза ТЭЛА и начала тромболитической терапии при отсутствии других методов диагностики и невозможности быстрой стабилизации состояния пациента. Во всех других случаях необходимо проведение компьютерной томографии. Ангиография не рекомендована в связи с высоким риском летальности у гемодинамически нестабильных пациентов и повышением риска кровотечений при проведении тромболитической терапии.
Диагностическая стратегия у пациентов со стабильной гемодинамикой начинается с определения вероятности этого заболевания на основании клинических данных. С этой целью целесообразно использовать правило P.S. Wells и Женевский счет. Такой подход в комбинации с определением уровня D-димера позволяет исключить диагноз ТЭЛА примерно у 30 % пациентов. У пациентов с повышением уровня D-димера рекомендовано проведение мультиспиральной компьютерной томографии, на основании результатов которой делают вывод о целесообразности проведения специфической терапии. У пациентов с высокой клинической вероятностью ТЭЛА, а также у пациентов, которые были госпитализированы на момент развития симптоматики заболевания, компьютерная томография должна быть первым шагом диагностического алгоритма. В случае негативного результата мультиспиральной КТ диагноз ТЭЛА может быть исключен. Для исключения ТЭЛА при использовании односпиральной КТ необходимо также сканирование вен нижних конечностей.