Журнал «Медицина неотложных состояний» 3(34) 2011
Вернуться к номеру
Симпозиум: Тромбоэмболия легочной артерии: алгоритмы диагностики и лечения
Авторы: Пархоменко А.Н., Иркин О.И., Лутай Я.М. Национальный научно-исследовательский центр «Институт кардиологии им. акад. Н.Д. Стражеско», г. Киев
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
Проводит: Донецкий национальный медицинский университет им. М. Горького
Рекомендован: врачам скорой помощи, анестезиологам, реаниматологам, хирургам, терапевтам, семейным врачам, акушерам-гинекологам, кардиологам
Тромбоэмболия легочной артерии (ТЭЛА) — окклюзия ствола или основных ветвей легочной артерии частичками тромба, сформировавшимися в венах большого круга кровообращения или правых камерах сердца и занесенными в легочную артерию с током крови. ТЭЛА является одной из основных причин госпитализации, смертности и потери трудоспособности. ТЭЛА занимает третье место в ряду наиболее частых причин смерти, второе — в ряду причин внезапной смерти и является наиболее частой причиной госпитальной летальности. Ежегодно от ТЭЛА умирает 0,1 % населения.
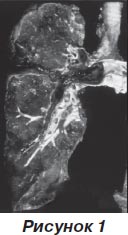 Истинная распространенность ТЭЛА неизвестна, так как диагностика заболевания затруднена и часто ТЭЛА выявляется при вскрытии, предположительно составляет 1–2 случая на 1000 человек в год, при возрасте старше 75 лет — до 10 случаев на 1000 человек в год. Согласно имеющимся статистическим данным, частота выявления новых случаев ТЭЛА среди госпитализированных пациентов в США превышает 600 000 случаев в год, а распространенность по Англии и Шотландии — 65 000 случаев, во Франции регистрируется 100 000 случаев ТЭЛА в год. В Украине отсутствует достоверная статистика по ТЭЛА, однако гипотетически должно наблюдаться до 50 000–100 000 случаев в год. Большинство случаев ТЭЛА возникает в стационарах, при этом 70–80 % приходится на долю терапевтических пациентов. Смертность от ТЭЛА составляет около 15 % в реальной клинической практике, а при несвоевременной диагностике и отсутствии терапии превышает 30 %.
Истинная распространенность ТЭЛА неизвестна, так как диагностика заболевания затруднена и часто ТЭЛА выявляется при вскрытии, предположительно составляет 1–2 случая на 1000 человек в год, при возрасте старше 75 лет — до 10 случаев на 1000 человек в год. Согласно имеющимся статистическим данным, частота выявления новых случаев ТЭЛА среди госпитализированных пациентов в США превышает 600 000 случаев в год, а распространенность по Англии и Шотландии — 65 000 случаев, во Франции регистрируется 100 000 случаев ТЭЛА в год. В Украине отсутствует достоверная статистика по ТЭЛА, однако гипотетически должно наблюдаться до 50 000–100 000 случаев в год. Большинство случаев ТЭЛА возникает в стационарах, при этом 70–80 % приходится на долю терапевтических пациентов. Смертность от ТЭЛА составляет около 15 % в реальной клинической практике, а при несвоевременной диагностике и отсутствии терапии превышает 30 %.
В то же время от 27 до 68 % этих смертей потенциально предотвратимы, и адекватная антикоагулянтная терапия позволяет достичь значительного снижения показателя летальности (до 2–8 %). ТЭЛА не является самостоятельным заболеванием — зачастую она представляет собой осложнение различных болезней, травм и оперативных вмешательств.
Иногда очень сложно различить тромбоэмболию и локальный тромбоз в системе легочной артерии, поэтому их рассматривают как единый симптомокомплекс.
Клиническая картина заболевания неспецифична и характеризуется полиморфизмом признаков — от выраженных гемодинамических нарушений и развития острой правожелудочковой недостаточности до бессимптомного течения. При жизни заболевание диагностируется в 50–70 % наблюдений, гипердиагностика имеет место в 65 % случаев.Огромное значение в своевременной диагностике ТЭЛА имеет настороженность врача, основанная на оценке факторов риска и клинических симптомов заболевания.
 Основным в подозрении на ТЭЛА является знание факторов риска ее развития. В настоящее время принято рассматривать ТЭЛА и тромбоз глубоких вен (ТГВ) как проявления одного заболевания. Еще в 1856 году Рудольф Вирхов описал триаду факторов, которые приводят к внутрисосудистому тромбообразованию: 1) повреждение сосудистой стенки; 2) повышенная свертываемость крови; 3) замедление кровотока. Говоря о возможных факторах риска развития ТЭЛА, сразу необходимо провести деление на первичные (генетически заложенные) и вторичные (приобретенные при определенной патологии или ее осложнениях) факторы риска.
Основным в подозрении на ТЭЛА является знание факторов риска ее развития. В настоящее время принято рассматривать ТЭЛА и тромбоз глубоких вен (ТГВ) как проявления одного заболевания. Еще в 1856 году Рудольф Вирхов описал триаду факторов, которые приводят к внутрисосудистому тромбообразованию: 1) повреждение сосудистой стенки; 2) повышенная свертываемость крови; 3) замедление кровотока. Говоря о возможных факторах риска развития ТЭЛА, сразу необходимо провести деление на первичные (генетически заложенные) и вторичные (приобретенные при определенной патологии или ее осложнениях) факторы риска.
Наиболее известными первичными факторами риска являются фактор V Лейдена и мутация протромбина 20210. Замена аргинина на глутамин в положении 506 (Arg506 ® Gln) — фактор V Лейдена — наиболее распространенная генетическая коагулопатия, в США встречается у 5 % европеоидной популяции. Фактор V Лейдена повышает риск венозного тромбоза в 3–8 раз. Протромбин G ® A 20210 мутация. Мутация протромбина 20210 — второе наиболее распространенное генетическое нарушение. Около 2 % всего населения являются гетерозиготами с этой мутацией.
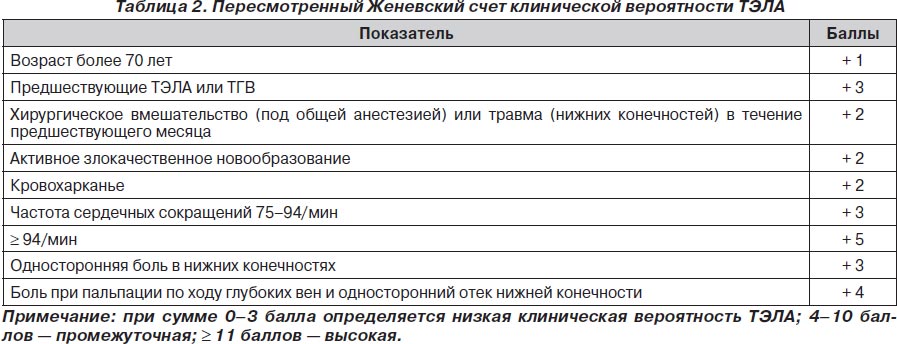
Наличие вторичных факторов риска развития ТЭЛА соответствует риску развития тромбоза глубоких вен (ТГВ), который напрямую связан с развитием ТЭЛА. Риск развития ТГВ и ТЭЛА в большей степени связан с обездвижением больного — как при хирургической патологии (травмы и переломы, наличие катетера в центральной вене, хроническая венозная недостаточность, хирургические вмешательства, иммобилизация, злокачественные новообразования), так и при сердечной недостаточности, развитии инсульта, ожирении и просто пожилом возрасте. С целью более адекватной диагностики ТЭЛА были предложены различные шкалы для подтверждения вероятности ее развития. Одной из наиболее используемых из этих шкал был Женевский счет клинической вероятности ТЭЛА. В данной шкале все факторы риска развития ТЭЛА распределялись по баллам, а суммарное количество баллов говорило о величине вероятности развития ТЭЛА у конкретного пациента.
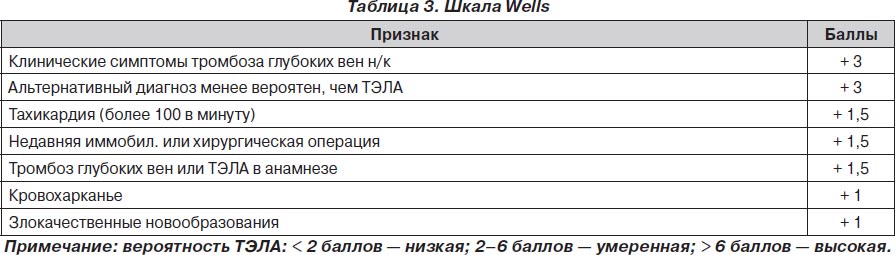
Наиболее показательным было сравнение Женевского счета и счета Wells, так как они оказались самыми прогностически точными подсчетами в диагностике ТЭЛА. Сравнение этих двух таблиц показало, что при низкой (6 против 9 %) и средней (23 против 26 %) вероятности развития ТЭЛА данные шкалы риска не различались. При диагностике с высокой вероятностью развития ТЭЛА Женевский счет превосходил счет Wells почти в два раза — 49 против 76 %.
Патогенез ТЭЛА
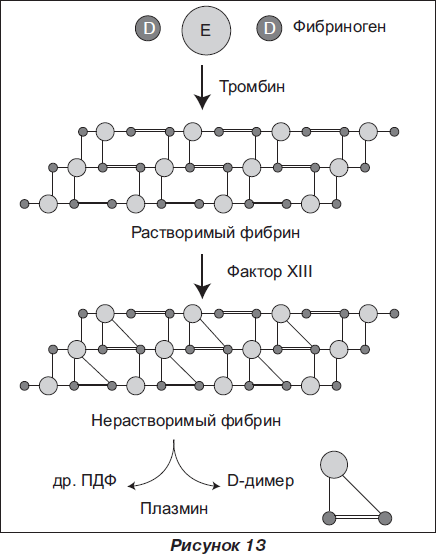
Начальным этапом тромбогенеза в большинстве случаев является повреждение эндотелия стенки сосудов. Известно, что эндотелий имеет мощное влияние на состояние коагуляционного гемостаза. В норме клетки эндотелия синтезируют эндотелин, простациклин, оксид азота — вещества, предупреждающие спазм сосудов, тормозящие адгезию и агрегацию тромбоцитов и предупреждающие тромбообразование. Кроме того, эндотелиальные клетки выделяют тканевый активатор плазминогена, который инициирует фибринолиз в ответ на тромбообразование. При повреждении, наряду с угнетением защитного влияния эндотелия на свертывающие свойства крови, происходит высвобождение в кровоток прокоагулянтных веществ, в частности фактора Виллебрандта, который образует мостик между тромбоцитами и коллагеном, а также микрофибриллами субэндотелия. Кроме того, обнаженный субэндотелиальный слой сосудов сам становится мощным стимулятором адгезии и агрегации тромбоцитов, из которых высвобождается ряд биологически активных веществ (АДФ, серотонин, фактор 3, тромбопластин и другие). Активация тромбоцитов стимулирует запуск коагуляционного каскада с участием всех факторов свертывания крови с образованием тромбина, превращением фибриногена в фибрин и приводит к формированию фибрин-тромбоцитарного тромба.
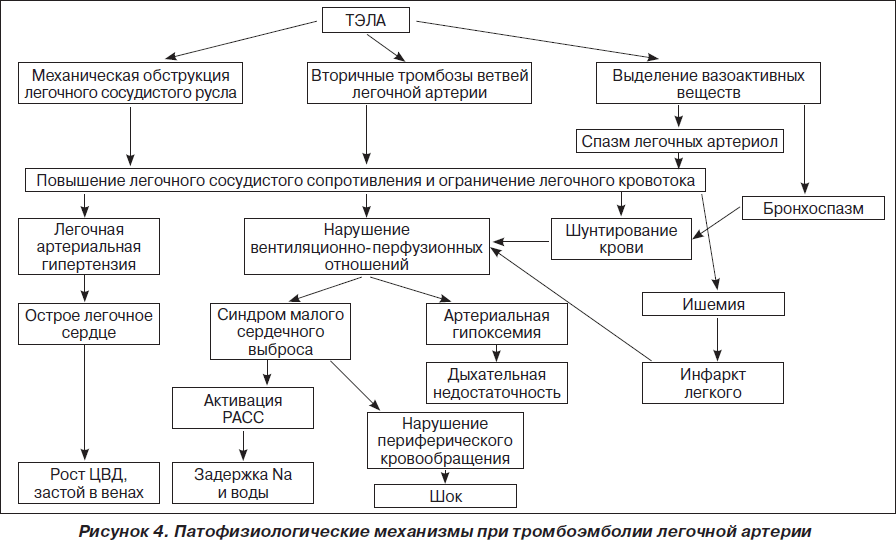
В генезе респираторных и гемодинамических расстройств, выраженности клинических проявлений и степени тяжести заболевания при ТЭЛА ведущее значение имеют механическая обструкция артериального русла легких и нейрогуморальная реакция. Тромб от места возникновения переносится с током крови в правый желудочек (ПЖ), где частично разрушается и в виде отдельных фрагментов попадает в малый круг кровообращения. Поэтому в большинстве случаев имеют место множественные окклюзии нескольких ветвей легочной артерии (ЛА) различного калибра, часто двусторонняя — немассивная ТЭЛА. В более редких случаях происходит массивная тромбоэмболия главных ветвей или ствола ЛА, которая сопровождается острым развитием тяжелой клинической картины тромбоэмболии, в частности быстро наступающей внезапной сердечной смертью. При субмассивной ТЭЛА эмболизируются долевые и сегментарные ветви ЛА. Действие гуморальных факторов не зависит от размеров тромба, поэтому эмболия даже мелкой ветви ЛА может привести к значительным нарушениям гемодинамики. Это объясняет частое несоответствие между объемом эмболической окклюзии легочных сосудов и тяжестью клинической картины ТЭЛА.
Гемодинамические расстройства
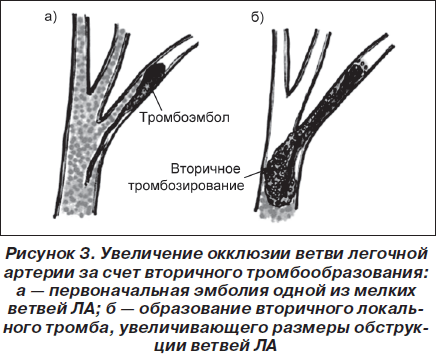
Вследствие частичной или полной механической обструкции легочно-артериального русла тромбоэмболом происходит резко выраженный генерализованный спазм артериол малого круга (прекапиллярная гипертензия) за счет барорефлекса и высвобождение вазоконстрикторных субстанций (тромбоксана А2, серотонина, гистамина и других) из тромбоцитов, которые оседают на поверхности тромбоэмболов. В результате легочное сосудистое сопротивление значительно возрастает, развивается легочная гипертензия. У больных без сопутствующих заболеваний сердца и легких острая гипертензия малого круга кровообращения возникает при обструкции 40–50 % легочного артериального русла. Окклюзия 60–75 % легочной циркуляции является критической и приводит к острой правожелудочковой недостаточности и резкому снижению объема циркулирующей крови. Необходимо отметить, что при ТЭЛА степень окклюзии просвета сосуда со временем может увеличиваться за счет присоединения вторичного местного тромбоза, который увеличивает размеры тромбоэмбола, распространяясь против тока крови. Нередко это приводит к трансформации немассивной ТЭЛА в массивную. При первом эпизоде субмассивная и даже массивная ТЭЛА не приводит к внезапной смерти, систолическое давление в ЛА часто относительно невысокое (40–50 мм рт.ст.). Негипертрофированный ПЖ не может обеспечить систолическое давление более 70 мм рт.ст. Высокие значения систолического давления в ПЖ свидетельствуют о постепенном формировании легочной гипертензии в результате нескольких эпизодов ТЭЛА или о наличии хронической легочной гипертензии другого генеза. Рост легочного сосудистого сопротивления сопровождается увеличением напряжения в стенке ПЖ и его дилатацией, в результате чего межжелудочковая перегородка выпячивается в левый желудочек и сужает его просвет, а сжатие правой коронарной артерии вызывает ишемию, а иногда и инфаркт миокарда ПЖ.
Повышение легочного сосудистого сопротивления и чрезмерная нагрузка на ПЖ (увеличение постнагрузки) на фоне значительного уменьшения емкости артериального русла (уменьшение преднагрузки) приводит к значительному ограничению венозного возврата крови в левые отделы сердца и развитию синдрома малого сердечного выброса. Происходит уменьшение минутного объема, сердечного индекса, уровня АД, нарушение кровоснабжения жизненно важных органов (головного мозга, сердца, почек). Нарушения центральной гемодинамики при ТЭЛА могут быть разной степени выраженности: от умеренной дилатации ПЖ с компенсаторной гиперфункцией и без существенного уменьшения сердечного выброса в состоянии покоя до обструктивного кардиогенного шока с высоким центральным венозным давлением и пониженным АД вследствие нарушения наполнения ЛЖ в диастолу. Это может привести к уменьшению коронарного кровотока и ухудшить перфузию миокарда, преимущественно ПЖ.
В некоторых случаях возможно возникновение острого отека легких, имеющего сложный патофизиологический механизм. Одной из причин может быть резкая дилатация ПЖ, приводящая к сдавливанию левого желудочка и повышению давления в левом предсердии, что углубляет легочную гипертензию. Кроме того, имеет значение увеличение легочного кровотока по неокклюзированным ветвям ЛА.
Респираторные расстройства
Полное или частичное прекращение легочного кровотока в результате ТЭЛА приводит к выраженному нарушению вентиляционно-перфузионного соотношения, в результате чего развиваются дыхательная недостаточность и артериальная гипоксемия. В результате прекращения кровотока в хорошо вентилируемых альвеолах происходит увеличение внутрилегочного «мертвого пространства» и ухудшение газообмена. Нарушение вентиляционно-перфузионных отношений усиливается выраженным бронхоспазмом, связанным с действием на гладкую мускулатуру мелких бронхов биологически активных веществ, выделяемых из тромбоцитов (тромбоксан А2, серотонин и другие). Кроме того, в результате ишемии альвеол, обусловленной их недостаточной перфузией, нарушается не только их вентиляция, но и выработка сурфактанта, что уже через 1–2 суток после тромбоэмболии может привести к развитию ателектазов. Вследствие недостаточности кровоснабжения альвеол может развиться инфаркт легкого. Кроме того, снижение вентиляции альвеол с сохраненной перфузией еще больше нарушает газообмен в легких и приводит к усилению артериальной гипоксемии. Наконец, в результате повышения давления проксимальнее места окклюзии открываются артериоло-венозные анастомозы и происходит шунтирование крови из артериол в вены, что также увеличивает артериальную гипоксемию.
При альвеолярно-интерстициальном отеке легких происходит стимуляция юкстакапиллярных рецепторов в альвеолярно-капиллярной мембране. Это приводит к повышению вагусной афферентной активности с последующей стимуляцией респираторных нейронов продолговатого мозга, в результате чего возникает гипервентиляция и гиперкапния. Следует подчеркнуть, что далеко не всегда при ТЭЛА присутствуют все описанные нарушения гемодинамики и альвеолярной вентиляции. Это зависит прежде всего от массивности тромбоэмболии, локализации тромбоэмболий и исходящего кардиопульмонального статуса больного. Рецидивирующая окклюзия крупных легочных артерий вызывает развитие тяжелой гипертензии малого круга кровообращения и развитие хронического легочного сердца. Степень выраженности хронической легочной гипертензии зависит от многих факторов: полноты спонтанного или медикаментозного лизиса тромба, рецидивирования ТЭЛА, образования тромбов вокруг участка первичной тромбоэмболии, процессов организации и внутрисосудистого ремоделирования тромбов, перестройки микроциркуляторного русла легких.
Классификация ТЭЛА
Международная классификация, разработанная Европейским кардиологическим обществом в 2000 году, предусматривает выделение 2 основных групп ТЭЛА — массивной и немассивной.
ТЭЛА расценивается как массивная, если у пациентов развиваются явления кардиогенного шока и/или гипотензия (снижение систолического АД ниже 90 мм рт.ст. или снижение на 40 мм рт.ст. и более от исходного уровня, которое длится более 15 минут и не связано с гиповолемией, сепсисом, аритмией). Массивная ТЭЛА развивается при обструкции сосудистого русла легких более 50 %.
Немассивная ТЭЛА диагностируется у пациентов со стабильной гемодинамикой без выраженных признаков правожелудочковой недостаточности. Немассивная ТЭЛА развивается при обструкции сосудистого русла легких менее 50 %.
Среди пациентов с немассивной ТЭЛА при условии выявления признаков гипокинезии правого желудочка (при проведении эхокардиографии) и стабильной гемодинамики выделяется подгруппа — субмассивная ТЭЛА. Субмассивная ТЭЛА развивается при обструкции сосудистого русла легких не менее 30 %.
По остроте развития выделяют следующие формы ТЭЛА:
— острая — внезапное начало, боль за грудиной, одышка, снижение артериального давления, признаки острого легочного сердца, возможно развитие обструктивного шока;
— подострая — прогрессирование дыхательной и правожелудочковой недостаточности, признаки тромбинфарктной пневмонии;
— хроническая, рецидивирующая — повторные эпизоды одышки, признаки тромбинфарктной пневмонии, появление и прогрессирование хронической сердечной недостаточности с периодами обострений, появление и прогрессирование признаков хронического легочного сердца.
Основные клинические синдромы при тромбоэмболии легочной артерии
Кардиальный синдром:
— острая недостаточность кровообращения;
— обструктивный шок (20–58 %);
— синдром острого легочного сердца;
— подобная стенокардии боль;
— тахикардия.
Легочно-плевральный синдром:
— одышка;
— кашель;
— кровохарканье;
— гипертермия.
Церебральный синдром:
— потеря сознания;
— судороги.
Почечный синдром:
— олигоанурия.
Абдоминальный синдром:
— боль в правом подреберье.
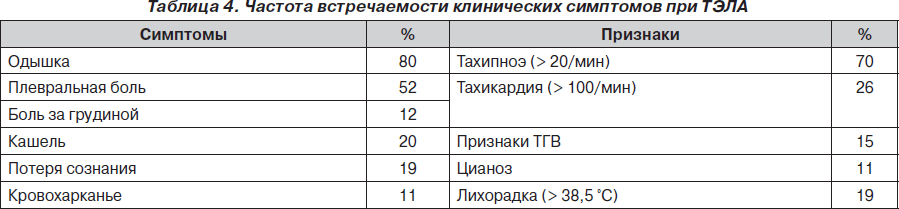
Клиническая симптоматика ТЭЛА имеет огромный полиморфизм, проявления ее многогранны и могут имитировать патологию различных органов и систем. При этом основные клинические симптомы ТЭЛА, такие как боль в грудной клетке и кровохарканье, встречаются не так уж и часто. Наиболее распространенные симптомы ТЭЛА — одышка и тахипноэ — могут сопровождать множество самых распространенных заболеваний, таких как пневмония, сердечная недостаточность, плеврит, опухоль легких или просто паническое состояние и многие другие.
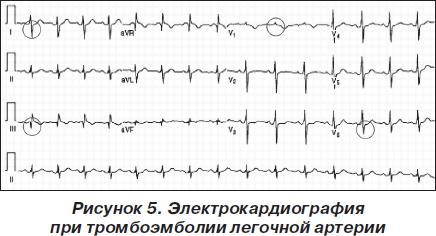
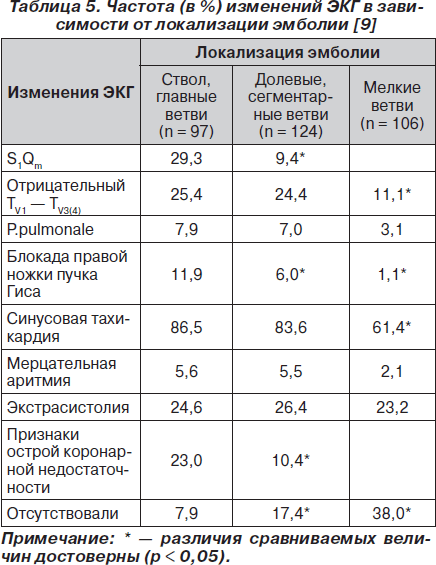
Клиническую картину можно подкрепить инструментальными исследованиями, первое из них — электрокардиография (ЭКГ). Изменения ЭКГ неспецифичны у большинства больных (75–80 %), классические признаки — S1 Q3 T3 (синдром McGinn — White), блокада ПНПГ (полная, неполная), P — pulmonale, правограмма, элевация ST (III, aVF, aVR и V1 — V3). Ниже (рис. 5, табл. 5) представлена частота встречаемости ЭКГ-критериев ТЭЛА.
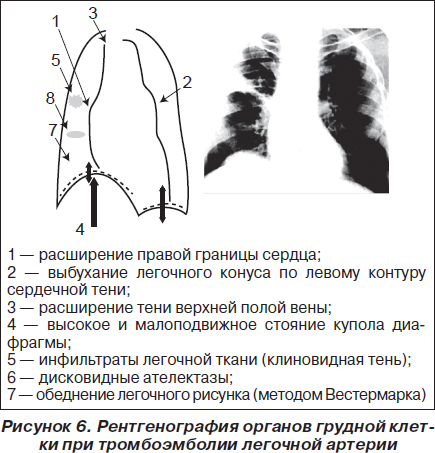
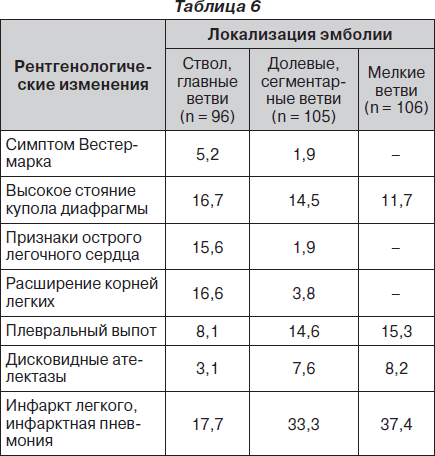
Рентгенография органов грудной клетки имеет свои диагностические возможности. Критериями ТЭЛА по рентгенограмме являются расширение правой границы сердца, выбухание легочного конуса по левому контуру сердечной тени, расширение тени верхней полой вены, высокое и малоподвижное стояние купола диафрагмы, инфильтраты легочной ткани (клиновидная тень), дисковидные ателектазы, обеднение легочного рисунка (симптом Вестермарка). Частота появления рентгенологических признаков достаточно низкая и составляет от 2 % (симптом Вестермарка) до максимальных 37,5 % (инфаркт, пневмония при эмболизации мелких ветвей легочной артерии). В настоящее время в рекомендациях и алгоритмах диагностики ТЭЛА рентгенография отсутствует.
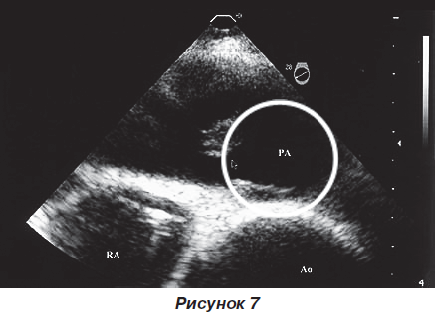
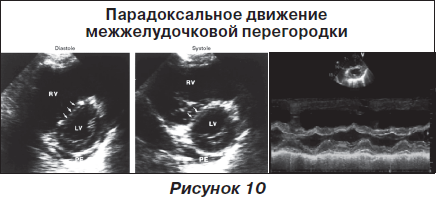
Следующим достаточно информативным и доступным неинвазивным методом обследования является проведение эхокардиографии (ЭхоКГ). По данным ЭхоКГ можно с высокой точностью предполагать или отрицать наличие ТЭЛА. ЭхоКГ-обследование имеет множество достаточно специфичных симптомов диагностики ТЭЛА. В пользу присутствия ТЭЛА свидетельствуют: расширение правых отделов сердца, выбухание межжелудочковой перегородки в сторону левых отделов, парадоксальное движение межжелудочковой перегородки в диастолу, непосредственная локация тромба в легочной артерии, выраженная регургитация на трикуспидальном клапане, признак 60/60.
Признаки перегрузки ПЖ:
1) тромб в правых отделах сердца;
2) диаметр ПЖ > 30 мм (парастернальная позиция) или соотношение ПЖ/ЛЖ > 1;
3) систолическое сглаживание МЖП;
4) время ускорения (АссТ) < 90 мс или градиент давления недостаточности трехстворчатого клапана > 30 мм рт.ст. при отсутствии гипертрофии ЛЖ.
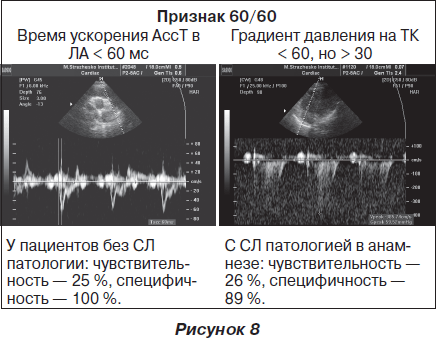
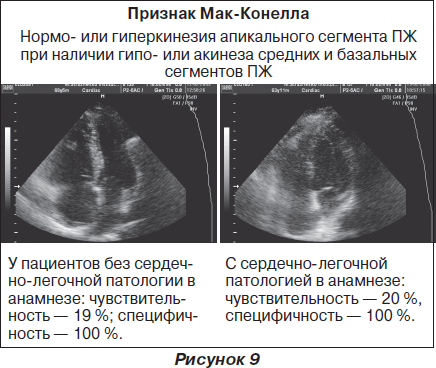
У пациентов без сердечно-легочной патологии в анамнезе: чувствительность — 81 %, специфичность — 78 %.
С сердечно-легочной патологией в анамнезе: чувствительность — 80 %, специфичность — 21 %.
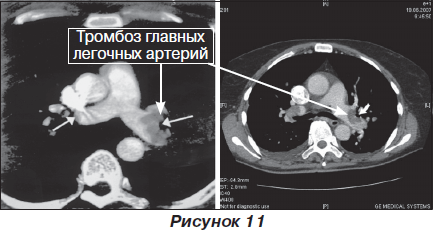
Прямая локация тромба в легочной артерии
Наиболее часто используемым методом диагностики ТЭЛА является компьютерная томография с контрастированием легочных артерий. В настоящее время спиральная компьютерная томография с контрастированием — это стандарт неинвазивной диагностики ТЭЛА ввиду простоты проведения и высокой чувствительности и специфичности. Однодетекторная спиральная компьютерная томография имеет чувствительность 70 % и специфичность 90 %, а мультидетекторная спиральная компьютерная томография — чувствительность 83 % и специфичность 96 %.
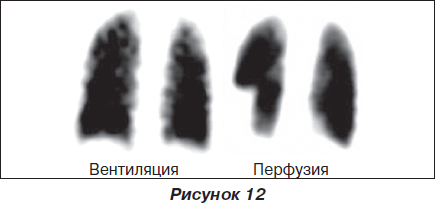
Вентиляционно-перфузионная сцинтиграфия легких при ТЭЛА — еще один точный метод исключения данной патологии. При внутривенном введении микросфер альбумина, меченных 99mTc, и вдыхании ксенона-133 или аэрозоля с 99mTc определяется дефект перфузии и проводится сравнение с наличием дефекта вентиляции. Интерпретация результатов: отсутствие ТЭЛА (норма), низкая, средняя и высокая вероятность ТЭЛА. При этом нормальный результат полностью исключает развитие ТЭЛА, недиагностические данные вентиляционно-перфузионной сцинтиграфии легких; низкая клиническая вероятность также исключает возможность развития ТЭЛА.
Позитивный результат вентиляционно-перфузионной сцинтиграфии легких подтверждает ТЭЛА, однако требует дополнительных методов исследования при низкой клинической вероятности.
Лабораторные методы исследования, используемые в диагностике ТЭЛА, ограничиваются определением уровня D-димера и в целях стратификации риска тяжести течения — определением тропонина и proBNP. У большинства больных с венозным тромбозом наблюдается эндогенный фибринолиз, который вызывает разрушение определенного количества фибрина с образованием продукта распада перекрестно связанного фибрина — D-димера. Увеличение концентрации D-димера более 500 мкг/л свидетельствует о спонтанной активации фибринолитической системы крови в ответ на тромбообразование в венозной системе. Чувствительность уровня D-димера составляет 96–99 %, отрицательная предсказательная ценность близка к идеалу — 99,6 % и специфичность — около 50 %. Повышение уровня D-димера возможно также при остром инфаркте миокарда, септическом состоянии, при оперативном вмешательстве, злокачественном новообразовании и системных заболеваниях.
Золотым стандартом диагностики ТЭЛА, безусловно, является катетеризация правых отделов сердца с проведением прямого измерения давления в полостях сердца и легочной артерии и контрастированием всего бассейна легочной артерии — ангиопульмонографией. При проведении ангиопульмонографии существует множество высокоспецифичных и неспецифичных критериев ТЭЛА.
Специфические ангиографические критерии:
1. Дефект наполнения в просвете сосуда — наиболее характерный ангиографический признак ТЭЛА. Дефекты могут иметь цилиндрическую форму и большой диаметр, что свидетельствует о первичном формировании их в илиокавальном сегменте.
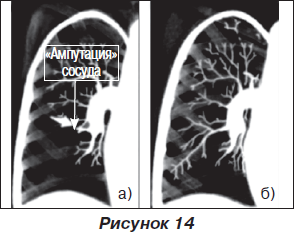
2. Полная обструкция сосуда («ампутация» сосуда, обрыв его контрастирования). При массивной ТЭЛА этот симптом на уровне долевых артерий наблюдается в 5 % случаев, чаще (в 45 %) его обнаруживают на уровне долевых артерий, дистальнее тромбоэмбола, расположенного в главной легочной артерии.
Неспецифические ангиографические критерии:
1. Расширение главных легочных артерий.
2. Уменьшение числа контрастированных периферических ветвей (симптом мертвого, или подрезанного, дерева).
3. Деформация легочного рисунка.
4. Отсутствие или задержка венозной фазы контрастирования.
Возможно при проведении катетеризации легочной артерии выполнение ультразвукового внутрисосудистого исследования с визуализацией тромба, особенно неокклюзирующего, и определение дальнейшей тактики лечения больного с ТЭЛА. Визуализация тромба в легочной артерии и его структуры может определить необходимость и возможность оперативного лечения, а также правильную методику лечения.
Общие диагностические стратегии
Ни один из лабораторных и инструментальных методов, применяемых по отдельности, не обладает достаточно высокой чувствительностью и специфичностью при диагностике ТЭЛА. Поэтому, помимо клинических проявлений, которые могут свидетельствовать о низкой, умеренной или высокой вероятности наличия ТЭЛА, в большинстве случаев для подтверждения или исключения данного диагноза необходимо провести ряд исследований. Ангиопульмонография остается пока эталоном диагностики ТЭЛА. Однако это дорогостоящий метод исследования, связанный с риском осложнений, а его результаты иногда трудно интерпретировать, особенно при поражении мелких ветвей ЛА. Поэтому необходимо провести комплекс лабораторных и неинвазивных инструментальных исследований, который позволит уменьшить показания для проведения ангиографии и в то же время будет достаточно надежен в диагностике этого серьезного заболевания.
В клинической практике необходимо определить, каким пациентам какие исследования и в какой последовательности проводить. От полученных результатов зависит объем неотложных лечебных мероприятий и дальнейшая тактика ведения пациентов.
 Современный алгоритм диагностики ТЭЛА базируется преимущественно на использовании ЭхоКГ и мультиспиральной компьютерной томографии. Этот алгоритм состоит из последовательности действий, каждое из которых позволяет четко и быстро отбирать пациентов, избегая лишних и дорогостоящих методов исследования. Он помогает уверенно и в кратчайшие сроки установить диагноз и своевременно начать лечение. В то же время результаты последних исследований свидетельствуют, что несоблюдение этого алгоритма диагностики приводит к задержке назначения антикоагулянтной терапии и увеличению риска внезапной смерти.
Современный алгоритм диагностики ТЭЛА базируется преимущественно на использовании ЭхоКГ и мультиспиральной компьютерной томографии. Этот алгоритм состоит из последовательности действий, каждое из которых позволяет четко и быстро отбирать пациентов, избегая лишних и дорогостоящих методов исследования. Он помогает уверенно и в кратчайшие сроки установить диагноз и своевременно начать лечение. В то же время результаты последних исследований свидетельствуют, что несоблюдение этого алгоритма диагностики приводит к задержке назначения антикоагулянтной терапии и увеличению риска внезапной смерти.
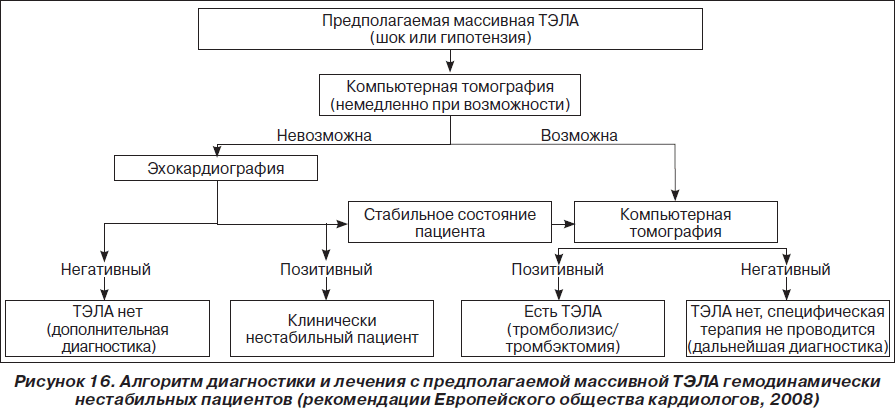
Стратегия диагностики ТЭЛА определяется степенью риска развития осложнений у гемодинамически стабильных и нестабильных пациентов.
У гемодинамически нестабильных пациентов с подозрением на ТЭЛА наиболее целесообразным методом для начала диагностики является ЭхоКГ, которая в большинстве случаев позволяет обнаружить непрямые признаки легочной гипертензии и перегрузки правого желудочка, а также исключить другие причины нестабильности (острый ИМ, расслаивающая аневризма аорты, перикардит). Положительные результаты ЭхоКГ могут быть основанием для постановки диагноза ТЭЛА и начала фибринолитической терапии при отсутствии других методов диагностики и невозможности быстрой стабилизации состояния пациента. Во всех других случаях необходимо проведение компьютерной томографии. Ангиография не рекомендована в связи с высоким риском летальности у гемодинамически нестабильных пациентов и повышением риска кровотечений при проведении фибринолитической терапии.
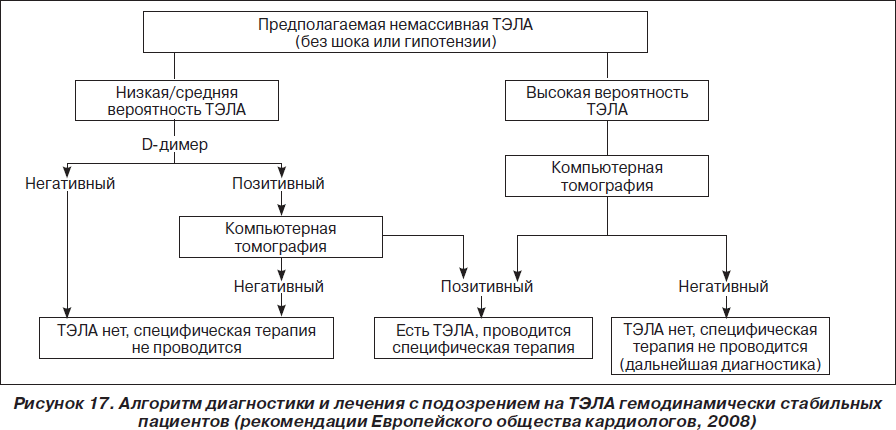
Диагностическая стратегия у пациентов со стабильной гемодинамикой начинается с определения вероятности этого заболевания на основании клинических данных. С этой целью целесообразно использовать правило Wells и Женевский счет. Такой подход в комбинации с определением уровня D-димера позволяет исключить диагноз ТЭЛА примерно у 30 % пациентов. У пациентов с повышением уровня D-димера рекомендовано проведение мультиспиральной компьютерной томографии, на основании результатов которой делают вывод о целесообразности проведения специфической терапии. У пациентов с высокой клинической вероятностью ТЭЛА, а также у больных, которые были госпитализированы на момент развития симптоматики заболевания, компьютерная томография должна быть первым шагом диагностического алгоритма. В случае негативного результата мультиспиральной КТ диагноз ТЭЛА может быть исключен. Для исключения ТЭЛА при использовании односпиральной КТ необходимо также сканирование вен нижних конечностей.
Лечебная тактика при ТЭЛА
Терапия больных с ТЭЛА должна проводиться в соответствии с клиническим статусом пациента, объемом эмболизации, наличием сопутствующей сердечно-легочной патологии, уровнем маркеров некроза миокарда (тропонин), а также со степенью дисфункции правых отделов сердца, которая оценивается на основании физикального обследования, ЭКГ и ЭхоКГ. Пациенты высокого риска развития неблагоприятных событий нуждаются в проведении фибринолитической терапии или эмболэктомии для восстановления проходимости магистральных легочных артерий на фоне введения гепарина для профилактики повторной эмболизации. В то же время пациенты низкого риска нуждаются только в проведении адекватной антикоагулянтной терапии. Чрескожные катетерные вмешательства (интервенционные процедуры) могут являться альтернативой хирургической эмболэктомии у пациентов высокого риска развития осложнений или у больных с противопоказаниями для фибринолитической терапии.
Фибринолитическая терапия
Фибринолитическая терапия позволяет спасти жизнь больным с кардиогенным шоком на фоне ТЭЛА. Физическое растворение тромба, закрывающего просвет магистральных легочных артерий, приводит к предотвращению быстропрогрессирующего развития правожелудочковой недостаточности и уменьшению высвобождения серотонина и других нейрогуморальных факторов, которые способствуют усилению легочной гипертензии. У больных с легочной гипертензией и низким сердечным выбросом на фоне ТЭЛА проведение фибринолитической терапии сопровождается 30% снижением среднего давления в легочной артерии и 15% повышением сердечного индекса уже через 2 часа от ее начала. Через 72 часа повышение сердечного индекса достигает уже 80 %, а снижение среднего давления в ЛА — 40 %. Отмечено также существенное уменьшение конечно-диастолического размера ПЖ через 3 часа от начала фибринолитической терапии. В то же время самостоятельное назначение гепарина не приводит к изменению вышеуказанных параметров. Системная фибринолитическая терапия также способствует растворению тромбов в малом тазу и/или глубоких венах нижних конечностей, которые могут являться источниками рецидивирования ТЭЛА.
Идеальный лекарственный препарат должен обеспечивать максимальную клиническую эффективность при минимальном риске побочных явлений. В клинических исследованиях проведено тестирование нескольких фибринолитических препаратов (альтеплаза, стрептокиназа, урокиназа) для лечения больных с ТЭЛА. Несмотря на некоторые различия между различными препаратами и режимами их введения в отношении влияния на показатели центральной гемодинамики в ранние сроки, не было продемонстрировано достоверных различий между отдельными режимами по влиянию на летальность. По данным последних исследований, введение альтеплазы (100 мг в течение 2 часов) позволяет быстрее достигнуть фибринолитического и гемодинамического эффекта, чем введение урокиназы (4400 МЕ ґ кг/час в течение 12–24 часов), стрептокиназы (1,5 млн МЕ в течение 2 часов) или альтеплазы (0,6 мг/кг в течение 15 мин). При этом различия между режимами достоверны только в течение первого часа от начала терапии.
В отличие от инфаркта миокарда терапевтическое «окно» для эффективного проведения фибринолитической терапии у больных с ТЭЛА намного шире и составляет до 14 дней от развития симптомов заболевания. Такая эффективность, вероятно, обусловлена существованием коллатерального бронхиального кровообращения. Таким образом, больные с подозрением на ТЭЛА должны рассматриваться в качестве потенциальных кандидатов для проведения фибринолитической терапии при развитии новых симптомов заболевания в течение 2 недель, предшествующих госпитализации.
Проведено несколько рандомизированных контролируемых клинических исследований, которые оценивали эффективность и безопасность тромболи тической терапии на фоне назначения гепарина по сравнению с самостоятельным введением гепарина у больных с острой ТЭЛА.
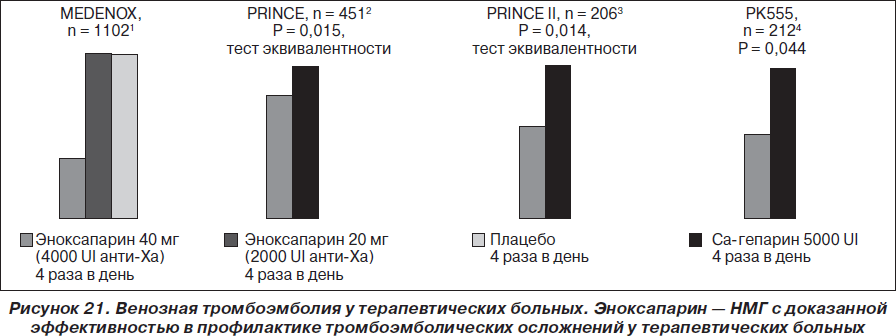
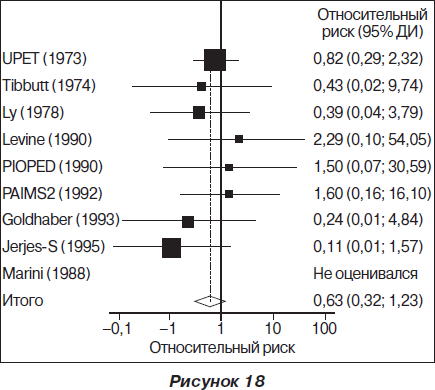
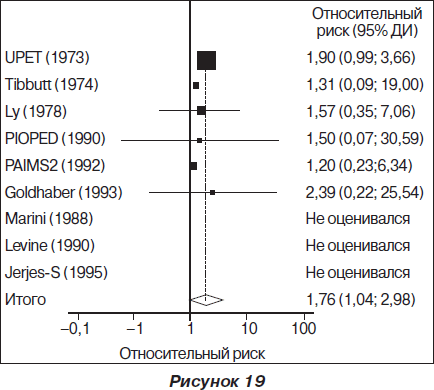
Метаанализ 9 из них (суммарно включен 461 больной) не выявил в общей группе больных с ТЭЛА достоверного снижения летальности (рис. 18, 19) или повторной эмболизации легочной артерии при применении фибринолитических агентов. Строгие показания к проведению тромболитической терапии при ТЭЛА определены для больных c массивной ТЭЛА (гемодинамическая нестабильность и дисфункция ПЖ). Небольшое исследование, в которое было включено 8 больных с массивной ТЭЛА и шоком, является на сегодняшний день единственным, показавшим достоверное снижение летальности при применении фибринолитических препаратов. Это исследование было прекращено по этическим соображениям, после того как 4 больных, которым проводили фибринолитическую терапию (стрептокиназа в дозе 1 500 000 ЕД внутривенно в течение 1 часа на фоне антикоагулянтной терапии гепарином), остались живы, а 4 больных, получавших только гепарин, умерли. В 2004 году опубликован анализ 5 исследований, включавших больных с массивной ТЭЛА, в котором было показано, что применение фибринолитической терапии сопровождалось снижением риска развития смерти или повторной эмболизации на 55 %.
Исследования по применению фибринолитиков в группе гемодинамически стабильных больных с ТЭЛА и перегрузкой ПЖ (субмассивная ТЭЛА) показали неоднозначные результаты, и только проведение большого рандомизированного контролированного исследования может окончательно решить этот вопрос. Применение фибринолитических агентов у гемодинамически стабильных больных без признаков перегрузки ПЖ не приводит к улучшению клинического течения заболевания и поэтому считается необоснованным.
У каждого больного перед проведением фибринолитической терапии проводится оценка степени риска геморрагических осложнений. Это также обусловлено тем, что большинство больных с ТЭЛА имеют целый ряд сопутствующих заболеваний. В целом вероятность кровотечения у больных с массивной ТЭЛА является высокой независимо от того, проводится ли антикоагулянтная или совместно антикоагулянтная и фибринолитическая терапия. Вероятность кровотечений увеличивается с возрастом больного. Было показано, что каждый год жизни увеличивает вероятность кровотечения примерно на 4 процента. Повышение (индекс массы тела более 30 кг/м2) или снижение (вес менее 70 кг) массы тела, женский пол, артериальная гипертензия и проведение ангиографии также являются независимыми факторами риска геморрагий.
Абсолютные и относительные противопоказания к проведению фибринолитической терапии у больных с ТЭЛА:
Абсолютные противопоказания:
— активное внутреннее кровотечение;
— внутричерепное кровоизлияние.
Относительные противопоказания:
— большое хирургическое вмешательство, родоразрешение, органная биопсия или пункция неприжимаемого сосуда в течение ближайших 10 дней;
— ишемический инсульт в течение ближайших 2 месяцев;
— желудочно-кишечное кровотечение в течение ближайших 10 дней;
— травма в течение 15 дней;
— нейро- или офтальмологическое хирургическое вмешательство в течение ближайшего месяца;
— неконтролируемая артериальная гипертензия (систолическое АД > 180 мм рт.ст.; диастолическое АД > 110 мм рт.ст.);
— проведение сердечно-легочной реанимации;
— количество тромбоцитов < 100 000/мм3, протромбиновое время менее 50 %;
— беременность;
— бактериальный эндокардит;
— диабетическая геморрагическая ретинопатия.
Достоверные преимущества различных фибринолитических агентов при ТЭЛА отсутствуют. Однако риск прогрессирования гипотензии при использовании стрептокиназы делает применение альтеплазы и урокиназы предпочтительным. Введение альтеплазы (100 мг в течение 2 часов) позволяет достигнуть фибринолитического и гемодинамического эффекта быстрее, чем проведение других режимов тромболитической терапии. Единственным фибринолитическим режимом, одобренным FDA (Food and Drug Administration) для использования у больных с массивной ТЭЛА, является введение альтеплазы (тканевый активатор плазминогена) в дозе 100 мг в течение 2 часов.
По существующим рекомендациям перед введением альтеплазы инфузия гепарина должна быть прекращена. После окончания фибринолитической терапии определяется аЧТВ. При его значении менее 80 секунд возобновляется инфузия гепарина без предварительного болюсного введения, а при аЧТВ более 80 секунд антикоагулянтная терапия не проводится. При этом аЧТВ повторно определяется через 4 часа. В подавляющем большинстве случаев повторный анализ позволяет возобновить терапию гепарином (аЧТВ менее 80 секунд).
Относительно новым фибринолитическим препаратом, который может использоваться у больных с ТЭЛА, является тенектеплаза (TNK-tPA). Этот препарат имеет ряд существенных преимуществ перед своими предшественниками, которые заключаются в большей фибриноспецифичности, резистентности к инактивации, а также возможности болюсного введения (за 5–10 секунд) и дозирования на килограмм массы тела больного. Болюсное введение тенектеплазы на фоне гепаринотерапии по сравнению с самостоятельным назначением гепарина в настоящее время тестировано в проспективном рандомизированном двойном слепом плацебо-контролируемом исследовании (Tenecteplase Italian Pulmonary Embolism Study) у гемодинамически стабильных больных с субмассивной ТЭЛА. Исследование показало преимущества введения тенектеплазы перед плацебо в виде уменьшения дисфункции правых отделов при отсутствии увеличения количества осложнений.Таким образом:
1) терапевтическое «окно» для проведения тромболитической терапии у больных с ТЭЛА составляет до 14 дней от развития симптомов;
2) тромболитическая терапия показана всем больным с массивной ТЭЛА;
3) большинство противопоказаний для проведения тромболитической терапии при массивной ТЭЛА являются относительными;
4) с учетом эффективности и безопасности предпочтительным режимом тромболитической терапии при ТЭЛА является системное введение 100 мг альтеплазы в течение 2 часов;
5) использование тромболитических препаратов у больных с субмассивной ТЭЛА (гипокинезия ПЖ) является сомнительным;
6) тромболитическая терапия не показана гемодинамически стабильным больным без признаков перегрузки/дисфункции ПЖ.
Хирургическая эмболэктомия
По данным регистра MAPPET (Management Strategies and Prognosis in Patients with Pulmonary Embolism), 40 % больных с ТЭЛА, которым проводилась фибринолитическая терапия, имели хотя бы одно относительное противопоказание. Около трети пациентов с массивной ТЭЛА имеют абсолютные противопоказания для проведения фибринолитической терапии. В регистре ICOPER из 304 больных, которым проводилась тромболитическая терапия, у 66 (21,7 %) отмечались большие, а у 9 (3 %) — внутричерепные кровотечения. Эти данные способствовали возрождению методов хирургической коррекции.
В настоящее время хирургическая эмболэктомия является методом лечения больных с массивной ТЭЛА при неэффективности тромболитической терапии и наличии противопоказаний.
В настоящее время используется несколько методик эмболэктомии из легочных артерий. Эмболэктомия в условиях временной окклюзии полых вен не требует сложного технического обеспечения, и ее может в случае экстренной необходимости успешно выполнить опытный хирург общего профиля. Одним из наиболее опасных этапов подобного вмешательства является вводный наркоз, когда может наступить брадикардия, гипотензия и асистолия. К сожалению, подобная операция сопровождается очень высокой летальностью.
Проводится также эмболэктомия в условиях искусственного кровообращения, с использованием чресстернального доступа. Вспомогательную веноартериальную перфузию проводят на первом этапе оперативного вмешательства (до вводного наркоза) путем канюлирования бедренных сосудов. Искусственное кровообращение позволяет в значительной степени обезопасить проведение эмболэктомии у больных с тяжелейшими гемодинамическими расстройствами. Все же летальность после подобных вмешательств достигает от 20 до 50 %.
Проведение оперативного вмешательства на работающем сердце без пережатия аорты, с экстракцией только видимого тромба из основных ветвей легочной артерии позволяло снизить летальность до 11 %.
Чрескожная эмболэктомия, катетерная фрагментация и тромбэктомия
Альтернативным методом лечения в таком случае является чрескожная катетерная тромбэктомия.
Идеальный катетер для проведения чрескожной тромбэктомии при ТЭЛА должен обладать следующими свойствами:
1) высокой маневренностью, которая позволит быстрый пассаж по правым отделам сердца с последующей постановкой в магистральные легочные артерии;
2) высокой эффективностью в удалении обтурирующего тромба из магистральных легочных артерий, что позволит быстро улучшить гемодинамику, устранить недостаточность ПЖ и кардиогенный шок;
3) высокой безопасностью, которая заключается в отсутствии повреждающего действия на структуры сердца или легочных артерий.
В настоящее время разработан целый ряд различных катетеров для лечения ТЭЛА. Некоторые предназначены для извлечения, другие — для фрагментации, третьи — для аспирации тромба.
Большинство доступных на сегодняшний день катетеров не устраняют тромб полностью, а разбивают его на «осколки», которые мигрируют в более мелкие разветвления легочных артерий. Поперечное сечение периферических сосудов малого круга кровообращения примерно в два раза больше, чем магистральных легочных артерий. Таким образом, перераспределение большого центрального тромба по дистальным сосудам может быстро улучшить гемодинамику с существенным увеличением общего легочного кровотока и улучшением функции правого желудочка.
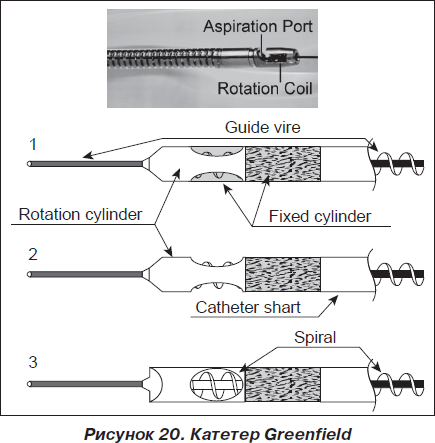
Первым катетером, разработанным для лечения массивной ТЭЛА, является катетер Greenfield. Он предназначен для удаления неорганизованных «свежих» тромбов ручным способом при помощи большого шприца.
Другие механические устройства для тромбэктомии в долевых и сегментарных ветвях легочных артерий изучались в небольших клинических исследованиях. Высокоэффективным устройством для механической катетерной тромбэктомии при массивной ТЭЛА является устройство Aspirex. Основной частью катетера является защищенный вращающийся с большой скоростью змеевик, через L-образное отверстие в наконечнике которого происходит аспирация, мацерация и удаление тромба. Механическая фрагментация тромба при помощи баллонной ангиопластики, проводимая одновременно с фармакологическим тромболизисом (урокиназа 80–100 тыс. МЕ/час на протяжении 8–24 часов) у больных с массивной ТЭЛА, показала себя достаточно эффективной. В отдельных случаях применяется также стентирование легочных артерий. При проведении катетерных процедур, и в частности катетерной тромбэктомии, возможно развитие целого ряда осложнений, которые включают в себя перфорацию или диссекцию центральных сосудов и стенок сердца, гемотампонаду перикарда, легочное кровотечение и эмболизацию сосудов большого круга кровообращения. Для снижения риска перфорации или диссекции тромбэктомию следует проводить только в основных и долевых легочных артериях и не применять данную методику в сегментарных артериях. Процедуру следует прекращать при достижении адекватного гемодинамического эффекта независимо от результатов ангиографии.
Антикоагулянтная терапия
Антикоагулянтная терапия служит основным методом лечения больных с ТЭЛА уже более 40 лет, со времени опубликования результатов исследования Barrit и Jordan (1960). Нефракционированный гепарин связывается с антитромбином III и повышает активность последнего, что предотвращает тромбообразование и способствует растворению уже сформировавшихся тромбов путем активации эндогенных фибринолитических механизмов. Таким образом, гепаринотерапия при ТЭЛА в основном направлена на источник тромбоэмболии, а не на тромбоэмбол в легочной артерии, а основной ее целью является профилактика повторных тромбозов и, таким образом, повторной эмболизации. Актуальность такой профилактики объясняется тем, что при отсутствии антикоагулянтной терапии у больных, перенесших эпизод ТЭЛА, вероятность повторной эмболии с летальным исходом колеблется от 18 до 30 %.
В рекомендациях Европейского общества кардиологов приведена схема введения нефракционированного гепарина при ТЭЛА (табл. 7).
У больных с массивной ТЭЛА рекомендуют для болюсного введения использовать дозу не менее 10 тыс. ед, а целевой уровень аЧТВ при инфузионной терапии должен составлять не менее 80 с. Гепаринотерапия должна проводиться в течение 7–10 дней, поскольку именно в эти сроки происходит лизис и/или организация тромба.
В последние годы для лечения больных с ТЭЛА успешно используются низкомолекулярные гепарины (НМГ). Они имеют ряд преимуществ перед НФГ. НМГ имеют также более предсказуемый антикоагулянтный эффект, так как в меньшей мере, чем НФГ, связываются с белками плазмы крови. НМГ назначаются на килограмм массы тела больного, и отсутствует необходимость лабораторного контроля.
В 2004 году был проведен метаанализ нескольких рандомизированных исследований, в которых проводилось сравнение безопасности и эффективности применения НФГ и НМГ у больных с ТЭЛА. Не было показано существенных различий между двумя видами терапии по частоте развития повторных симптоматических венозных тромбоэмболических осложнений и смерти как на момент прекращения лечения, так и по результатам 3-месячного наблюдения. Таким образом, применение НМГ как минимум столь же эффективно и безопасно для лечения немассивной ТЭЛА, как и прием НФГ.
Одновременно с применением гепарина больным с ТЭЛА назначают непрямые антикоагулянты, механизм действия которых заключается в нарушении нормального метаболизма витамина К в печени. Учитывая, что первые несколько дней приема непрямые антикоагулянты могут вызывать парадоксальное состояние гиперкоагуляции, исходя из необходимости 4–5-дневного периода до достижения адекватного антикоагулянтного эффекта, прием непрямых антикоагулянтов следует начинать уже с первых дней гепаринотерапии.
Из препаратов этой группы в Украине зарегистрированы варфарин, аценокумарол (синкумар) и фениндион (фенилин). Период полувыведения для варфарина составляет 42 часа, для аценокумарола — 9 часов, фениндиона — 5 часов. Длительность действия варфарина позволяет назначать препарат один раз в день и обеспечивает незначительные колебания его антикоагулянтного эффекта. Поэтому именно варфарин получил наиболее широкое распространение в мировой клинической практике и успешно используется на протяжении уже более 50 лет.
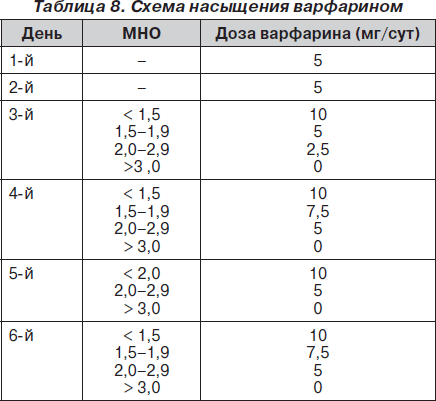
Существуют различные схемы насыщения варфарином, при этом наибольшее распространение получила схема, представленная в табл. 8.
На протяжении всего периода клинического применения непрямых антикоагулянтов основным методом контроля является определение протромбинового времени (ПВ). Единый показатель результатов определения ПВ получил название «Международное нормализующее отношение» (МНО). Для проверки уровня гипокоагуляции стали применяться референтные плазмы, как приготовленные искусственно, так и полученные из крови больных, принимающих непрямые антикоагулянты. Определенные в процессе стандартизации тромбопластинов калибровочные константы, так называемый Международный индекс чувствительности (МИЧ), дали возможность сравнивать результаты ПВ независимо от используемого тромбопластина. Как правило, в инструкции к тромбопластину сейчас указывается МИЧ, с помощью которого по формуле можно определить МНО:
МНО = (ПВ больного/ПВ донора)МИЧ.
После насыщения варфарином дальнейшая коррекция дозы осуществляется в зависимости от уровня МНО, которое должно оставаться на уровне 2,0–3,0.
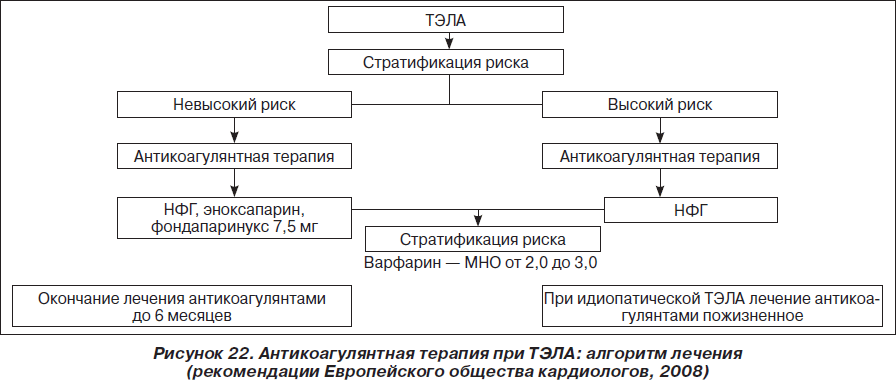
Общая продолжительность лечения непрямыми антикоагулянтами должна составлять не менее 3 месяцев. В некоторых случаях, например у больных с отчетливо выраженным гиперкоагуляционным синдромом, непрямые антикоагулянты принимают в течение года и более. Схема проведения антикоагулянтной терапии у больных с ТЭЛА представлена на рис. 22
Рекомендации лечения ТЭЛА:
1. Для большинства пациентов с ТЭЛА не рекомендуется системная фибринолитическая терапия (степень 1A). Предлагается ограничить применение системного тромболизиса только для пациентов с нестабильной гемодинамикой (степень 2B), при дисфункции правого желудочка возможно введение тенектеплазы.
(В конце 2007 года начато проспективное рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование PEITHO (Pulmonary Embolism International Thrombolysis Study), в котором изучается эффективность терапии тенектеплазой у больных с субмассивной ТЭЛА. Результаты этого исследования позволят решить вопрос применения тенектеплазы у данной категории больных, результаты ожидаются к 2012 году).
2. Не использовать локальную чрескатетерную фибринолитическую терапию (степень 1C).
3. У пациентов с ТЭЛА, которые получают фибринолитическую терапию, предлагается отдавать предпочтение кратковременным фибринолитическим режимам (степень 2C).
4. У большинства пациентов с ТЭЛА не рекомендуется эмболэктомия из легочной артерии (степень 1C). У некоторых пациентов, находящихся в критическом состоянии, которое не оставляет достаточно времени для фибринолитической терапии, показана легочная эмболэктомия (степень 2C).
5. У пациентов с противопоказаниями или осложнениями антикоагулянтной терапии, а также с рецидивирующей тромбоэмболией, несмотря на адекватную антикоагулянтную терапию, рекомендуется установка нижнего кава-фильтра (степень 2C).
Рекомендации для длительной профилактики ТЭЛА:
1. Для пациентов с первым эпизодом ТЭЛА с обратимыми факторами риска рекомендуется долговременное лечение непрямыми антикоагулянтами в течение 6 месяцев (степень 1A).
2. Для пациентов с первым эпизодом идиопатической ТЭЛА рекомендуется лечение непрямыми антикоагулянтами не менее 12 месяцев, но необходимо пожизненное применение (степень 1A). Цель терапии непрямыми антикоагулянтами — поддержание INR (МНО) на уровне 2,5 (диапазон 2,0–3,0) (степень 1A).
3. Не рекомендуется режим высокой интенсивности терапии непрямыми антикоагулянтами (INR диапазон от 3,1 до 4,0) (степень 1A). Не рекомендуется терапия непрямыми антикоагулянтами низкой интенсивности (INR диапазон от 1,5 до 1,9) (степень 1A).
1. Geerts W.H. et al. Prevention of venous thromboembolism // Chest. — 2001. — 119. — 132S-175S.
2. Tromboembolic Risc Factors (THRIFT) Consensus Group // BMJ. — 1992. — 305. — 567-74.
3. Task Force Report. Guidelines on diagnosis and management of acute pulmonary embolism. European Society of Cardiology // Europ. Heart J. — 2000. — Vol. 21. — P. 1301-1336.
4. Goldhaber S.Z., Visani L., De Rosa M. for ICOPER. Acute pulmonary embolism: Clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER) // Lancet. — 1999. — 353. — 1386.
5. Wells P.S., Anderson D.R., Rodger M. et al: Derivation of a simpleclinical model to categorize patients probability of pulmonary embolism: Increasing the models utility with the SimpliRED D-dimer // Thromb Haemost. — 2000. — 83. — 416.
6. Le Gal G., Righini M., Roy P.-M. et al. Prediction of Pulmonary Embolism in the Emergency Department: The Revised Geneva Score // Ann. Intern. Med. — Feb. 7 2006. — 144. — 165-171.
7. Le Gal G., Righini M., Roy P.-M. et al. Value of D-Dimer Testing for the Exclusion of Pulmonary Embolism in Patients With Previous Venous Thromboembolism // Arch. Intern. Med. — Jan. 23 2006. — 166. — 176-180.
8. C. Gregory Elliott, Samuel Z. Goldhaber, Luigi Visani and Marisa DeRosa. Chest Radiographs in Acute Pulmonary Embolism: Results From the International Cooperative Pulmonary Embolism Registry // Chest. — 2000. — 118. — 33-38.
9. The PIOPED investigators: value of the ventilation/per/ fusion scan in acute pulmonary embolism // JAMA. — 1990. — Vol. 263. — P. 2753-275.
10. The PISA-PED Investigators. Value of perfusion lung scan in the diagnosis of pulmonary embolism: results of the prospective study of acute pulmonary embolism diagnosis (PISA-PED) // Am. J. Respir. Crit. Care Med. — 1996. — 154. — 1387-93.
11. Lesser B.A., Leeper K.V., Stein P.D. et al. The diagnosis of acute pulmonary embolism in patients with chronic obstructive pulmonary disease // Chest. — 1992. — 102. — 17-22 (COPD).
12. Stein P., Athanasoulis C., Alavi A., Greenspan R., Hales C. Complications and Validity of PulmonaryAngiography in Acute Pulmonary Embolism // Circulation. — 1992. — 85. — 462-468.
13. Greenspan R.H. Pulmonary angiography and the diagnosis of pulmonary embolism // Prog. cardiovasc. dis. — 1994. — Vol. 37, № 2. — P. 93-106.
14. Van Strijen M.J., de Monye W., Schiereck J. et al. Single-detector helical computed tomography as the primary diagnostic test in suspectednary embolism: a multicenter clinical management study of 510 patients // Ann. Intern. Med. — 2003. — 138. — 307-314.
15. Wells P.S., Hirsh J., Anderson D.R. et al. Accuracy of clinical assessment of deep/vein thrombosis // Lancet. — 1995. — Vol. 345. — Р. 1326-1330.
16. Kucher N., Rossi E., De Rosa M., Goldhaber S.Z. Massive Pulmonary Embolism // Circulation. — Jan. 31 2006. — 113. — 577-582.
17. Lobo J.L., Zorrilla V., Aizpuru F. et al. Clinical Syndromes and Clinical Outcome in Patients With Pulmonary Embolism. Findings From the RIETE Registry // Chest. — December 2006. — 130. — 1817-1822.
18. Wicki J., Perrier A., Perneger T.V. et al. Predicting adverse outcome in patients with acute pulmonary embolism: A risk score // Thromb. Haemost. — 2000. — 84. — 548.
19. Grifoni S., Vanni S., Magazzini S. et al. Association of Persistent Right Ventricular Dysfunction at Hospital Discharge After Acute Pulmonary Embolism With Recurrent Thromboembolic Events // Arch. Intern. Med. — October 23 2006. — 166. — 2151-2156.
20. Kucher N., Rossi E., De Rosa M., Goldhaber S.Z. Prognostic Role of Echocardiography Among Patients With Acute Pulmonary Embolism and a Systolic Arterial Pressure of 90 mm Hg or Higher // Arch. Intern. Med. — August 8 2005. — 165. — 1777-1781.
21. Ribeiro A., Lindmarker P., Johnsson H., Juhlin-Dannfelt A., Jorfeldt L. Pulmonary embolism: one-year follow-up with echocardiography doppler and five-year survival analysis // Circulation. — 1999. — 99. — 1325-30.
22. Kucher N., Goldhaber S.Z. Cardiac biomarkers for risk stratification of patients with acute pulmonary embolism // Circulation. — 2003. — 108. — 2191-4.
23. Becattini C., Agnelli G., Salvi A., Grifoni S., Pancaldi L.G., Enea I., Balsemin F., Campanini M., Ghirarduzzi A., Casazza F. TIPES Study Group. Bolus tenecteplase for right ventricle dysfunction in hemodynamically stable patients with pulmonary embolism // Thromb. Res. — 2010. — 125 (3). — 82-6.
24. Gianluigi Ferretti, Emilio Bria, Diana Giannarelli, Paolo Carlini, Alessandra Felici, Mario Mandala, Paola Papaldo, Alessandra Fabi, Mariangela Ciccarese, Federica Cuppone, Fabiana Letizia Cecere, Carmen Nuzzo, Edmondo Terzoli and Francesco Cognetti. Is Recurrent Venous Thromboembolism After Therapy Reduced by Low-Molecular-Weight Heparin Compared With Oral Anticoagulants? // Chest. — 2006. — 130. — 1808- 1816.
25. National Institute for Clinical Excelence. Venous thromboembolism: reducing the risk of venous thromboembolism (deep vein thrombosis and pulmonary embolism) in patients admitted to hospital. Produced by the National Clinical Guideline Centre — Acute and Chronic Conditions (formerly the National Collaborating Centre for Acute Care) // Methods, Evidence & Guidance. — 2009. — P. 511.
26. Jack Hirsh, Gordon Guyatt, Gregory W. Albers, MD; Robert Harrington, and Holger J. Schunemann. Antithrombotic and Thrombolytic Therapy. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition) // Chest. — 2008. — 133. — 110S-112S.
27. Task Force Report Guidelines on diagnosis and management of acute pulmonary embolism.
28. Core Writing Group: A. Torbicki (Chairman), E.J.R. van Beek (Editor), B. Charbonnier, G. Meyer, M. Morpurgo, A. Palla and A. Perrier Members: N. Galie, G. Gorge, C. Herold, S. Husted, V. Jezek, W. Kasper, M. Kneussl, A.H. Morice, D. Musset, M. M. Samama, G. Simonneau, H. Sors, M. de Swiet and M. Turina Internal reviewers: G. Kronik, J. Widimsky. Task Force on Pulmonary Embolism, European Society of Cardiology // European Heart Journal. — 2000. — 21. — 1301-1336.