Журнал «Медицина неотложных состояний» 1-2(32-33) 2011
Вернуться к номеру
Современные подходы к периоперационной аналгезии в различных областях хирургии с доказательных позиций
Авторы: Кобеляцкий Ю.Ю. Днепропетровская государственная медицинская академия, Кафедра анестезиологии и интенсивной терапии
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
В статье нашли отражение вопросы стратегии выбора метода периоперационной аналгезии в зависимости от области хирургии на основании многокомпонентных доказательных протоколов при оперативных вмешательствах в ортопедии, гинекологии, торакальной и абдоминальной хирургии.
Актуальность. Анестезиология в настоящее время постепенно превращается в периоперационную медицину, и рассмотрение анестезиологического пособия в отрыве от предоперационного и послеоперационного периода представляется неоправданным с позиций конечного результата лечения. Результаты лечения во многом зависят от качества послеоперационной аналгезии. Не существует одного универсального метода послеоперационного обезболивания, применяемого во всех областях хирургии. Такое разнообразие оперативных вмешательств предполагает единообразный методический подход, который заключается в обязательном планировании метода послеоперационной аналгезии на этапе предоперационного осмотра больного и выборе метода интраоперационной анестезии с учетом вида послеоперационного обезболивания.
Целью данной публикации являлось обобщение современных подходов к периоперационной аналгезии в различных областях хирургии на основе доказательных принципов лечения острой боли и данных международной группы PROSPECT (www.postoppain.org).
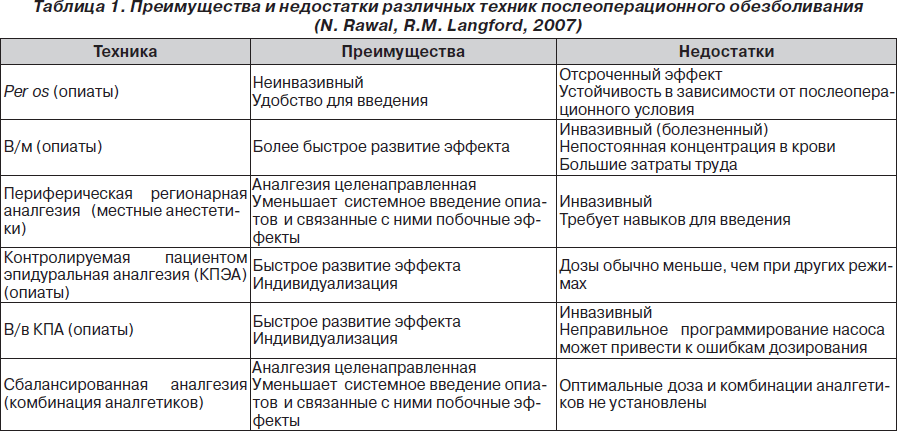
Арсенал техник аналгезии, которые могут использоваться для периоперационного обезболивания, постоянно расширяется. Основные из них представлены в табл. 1.
К сожалению, доминирующим методом послеоперационного обезболивания остается внутримышечное введение опиатов «по требованию», что не соответствует уровню современных требований и не позволяет начать реабилитационный процесс сразу после окончания оперативного вмешательства.
Для ознакомления с современными возможностями периоперационной аналгезии нами приводятся основные каноны выбора метода послеоперационного обезболивания в тесной связи с анестезиологическим пособием во время операции.
Доказательные принципы использования различных техник и препаратов для аналгезии (Australian and New Zealand College of Anaesthetists and Faculty of Pain Medicine ACUTE PAIN MANAGEMENT: SCIENTIFIC EVIDENCE SECOND EDITION UPDATES Last update: DECEMBER 2007). Доказательная медицина на сегодня предлагает обобщенные результаты применения основных препаратов и техник обезболивания на основании анализа работ соответствующего дизайна. Широкое использование этих данных в практической работе позволит значительно повысить эффективность и безопасность реабилитации пациентов после оперативных вмешательств в различных областях хирургии.
В настоящее время широко применяются для периоперационной аналгезии три класса препаратов: опиатные аналгетики (ОА), нестероидные противовоспалительные препараты (НСПВП) и местные анестетики (МА). В последние годы произошли большие сдвиги в понимании роли и, главное, места каждого из этих классов в отдельности и при их совместном использовании.
В рациональном выборе и сочетании основных классов препаратов и использовании соответствующих техник и состоит главная задача анестезиолога в периоперационном периоде для достижения максимального клинического результата оперативного вмешательства.
Опиаты
Традиционно в течение долгого времени опиаты являлись единственным выбором для послеоперационной аналгезии, несмотря на свои многочисленные негативные побочные эффекты. Системные отрицательные эффекты опиатов хорошо известны (респираторная депрессия, угнетение моторной функции желудочно-кишечного тракта, кожный зуд, задержка мочи и т.д.).
Системно вводимые опиаты
1. Трамадол эффективен в лечении нейропатической боли (Level I [Cochrane Review]).
2. Дроперидол, дексаметазон и ондансетрон равно эффективны в профилактике послеоперационной тошноты и рвоты (Level I).
3. Налоксон, налтрексон, налбуфин и дроперидол эффективны в лечении зуда вследствие введения опиатов (Level I).
4. В лечении острой боли один опиат не имеет преимущества над другим, но некоторые опиаты лучше у определенной группы пациентов (Level II).
5. Частота клинически значимых побочных эффектов у опиатов является дозозависимой (Level II).
6. Трамадол имеет более низкий риск респираторной депрессии и нарушения моторной функции желудочно-кишечного тракта, чем другие опиаты в эквивалентных дозировках (Level II).
7. Подача кислорода в послеоперационном периоде повышает оксигенацию и снижает частоту тахикардий и миокардиальных ишемий (Level II).
8. У взрослых возраст больного является лучшим предиктором потребности в опиатах, чем вес, хотя существует большая вариабельность между пациентами (Level IV).
9. Нарушение функции почек и пероральный путь введения приводят к более высоким уровням метаболитов морфина (морфина-3-глюкуронида и морфина-6-глюкуронида (Level IV).
10. Оценка уровня седации является более надежным путем определения ранней вызванной опиатами респираторной депрессии, чем снижение частоты дыханий (Level III-3).
Достаточно важным новшеством в последние годы стало понимание роли нейроаксиально вводимых опиатов как эффективного метода послеоперационного обезболивания. По Фармакопее Украины нейроаксиально можно вводить только морфина гидрохлорид. С учетом рострального распространения гидрофильного морфина гидрохлорида и реальной потенциально летальной опасностью отсроченной респираторной депрессии назрела необходимость оценки возможности введения липофильных опиатов интратекально.
Доказательные принципы нейроаксиального использования опиатов при острой боли (уровни доказательности)
1. Интратекальное введение морфина вызывает лучшую послеоперационную аналгезию после кесарева сечения в сравнении с фентанилом (Level I).
2. Комбинация опиатов с местными анестетиками эпидурально повышает качество аналгезии и снижает дозировки обоих препаратов (Level I).
Морфин при использовании однократной дозы во внутрисуставное пространство вызывает аналгезию, которая длится до 24 часов (Level I).
3. Доказательства клинической эффективности периферических опиатных эффектов во внесуставных местах, включая периневрально, являются неокончательными (Level II)
4. Эпидуральное введение петидина обеспечивает лучшую аналгезию и меньшую седацию в сравнении с системным внутривенным его использованием после кесарева сечения (Level II).
5. Не отмечено нейротоксичности при нормальных интратекальных дозировках морфина, фентанила и суфентанила (Ц).
6. Нейроаксиальное введение болюсов гидрофильных опиатов повышает риск отсроченной седации и респираторной депрессии в сравнении с липофильными опиатами (Ц).
Использование профилактически морфина нейроаксиально имеет преимущества над использованием КПА изолированно [54]. Добавление морфина к спинальной анестезии в дозе < 0,3 мг приводит к учащению тошноты, рвоты и кожного зуда. При дозе 0,3 мг и более повышен только риск зуда. В целом интратекальное введение морфина не повышает риск респираторной депрессии. Однако при более высоких дозировках риск депрессии дыхания выше. Риск побочных эффектов невысок. При низкой дозировке морфина (< 0,3 мг) отмечено не больше эпизодов респираторной депрессии в сравнении с системным использованием опиатов [12].
В работах, посвященных сравнению КПА опиатами без базовой инфузии и традиционной опиатной аналгезией, показано, что КПА обеспечивала лучший контроль боли и удовлетворение больного, однако в этой группе был больший расход опиатов и более высокий уровень зуда. Количество других побочных эффектов не отличалось между собой. Не отмечено разницы в сроках пребывания в стационаре. Все вышесказанное позволило авторам сделать вывод о том, что КПА является эффективной альтернативой традиционной системной аналгезии для контроля послеоперационной боли [39]. Сравнение традиционной опиатной аналгезии и КПА показывает, что КПА опиатами в сравнении с традиционным подходом улучшают аналгезию и снижают риск легочных осложнений. Пациенты отдают предпочтение технике КПА [86].
НСПВП
Последние годы ознаменовались широким использованием в анестезиологической практике нестероидных противовоспалительных препаратов, которые прочно вошли в арсенал мультимодальных техник как патогенетически обоснованное лекарственное средство.
Доказательные положения по использованию парацетамола, НСПВП и селективных ингибиторов ЦОГ-2 (уровни доказательности)
1. Парацетамол — эффективный аналгетик для устранения острой боли; частота побочных эффектов сравнима с плацебо (Level I [Cochrane Review]).
2. НСПВП и ИЦОГ-2 являются эффективными аналгетиками для устранения острой боли (Level I [Cochrane Review]).
3. НСПВП, добавленные к парацетамолу, улучшают аналгезию (Level I).
4. При тщательном отборе и мониторинге частота вызванных НСПВП периоперационных ренальных нарушений низкая (Level I [Cochrane Review]).
5. Аспирин и некоторые НСПВП повышают риск периоперационного кровотечения после тонзиллэктомии, за исключением педиатрических пациентов (Level I [Cochrane Review]).
6. НСПВП в дополнение к КПА опиатами снижают потребление опиатов и частоту тошноты, рвоты и седации (Level I).
7. Периоперационное использование НСПВП повышает риск тяжелых кровотечений в сравнении с плацебо (Level I).
8. Периоперационное использование ИЦОГ-2 уменьшает послеоперационную боль, снижает потребление опиатов и повышает удовлетворение больных (Level I).
9. Парекоксиб и/или вальдекоксиб в сравнении с плацебо не повышают риск сердечно-сосудистых побочных эффектов при некардиальных операциях (Level I).
10. ИЦОГ-2 и НСПВП имеют сходный риск побочных кардиоваскулярных эффектов, в особенности ИМ; напроксен может быть связан с меньшим риском, чем другие НСПВП (Level I).
11. ИЦОГ-2 не нарушают функцию тромбоцитов; это ведет к снижению периоперационной кровопотери в сравнении с НСПВП (Level II).
12. Кратковременное использование ИЦОГ-2 не влияет на заживление кости при спинальных операциях (Level II).
13. Серьезные сердечно-сосудистые осложнения были отмечены с использованием ИЦОГ-2 в некоторых исследованиях, и применение этих препаратов в настоящее время оценивается; рекомендаций по их использованию нельзя дать до получения дополнительных доказательств (Ц).
Лорноксикам в дозе 8 мг при пероральном применении является эффективным для послеоперационной аналгезии после удаления третьего моляра у взрослых [36]. Аналогичные данные были продемонстрированы после челюстно-лицевых, ортопедических, гинекологических и абдоминальных операций для кетопрофена (25–100 мг), ибупрофена (400 мг), диклофенака (50 мг) с длительностью действия 5 часов. Декскетопрофен эффективен в дозе 10–25 мг. Все препараты хорошо переносились при однократном приеме [10]. НСПВП (лорноксикам, диклофенак, кеторолак и эторикоксиб) наряду с налбуфином, седацией в сознании, общей анестезией и прослушиванием музыки имели позитивный эффект при прерывании беременности в первом триместре в сроке менее 14 недель. Данные же по парацервикальной блокаде не явились убедительными [65]. Аналогичные данные приводятся в отношении парацервикального введения местных анестетиков, которые не показали определенных преимуществ над альтернативными техниками аналгезии (утеросакральным и внутрицервикальным блоками, а также внутриматочной инстилляцией препаратов) [77]. Высокую эффективность продемонстрировало внутримышечное и внутривенное введение парекоксиба в отношении спасительной медикации в первые сутки после оперативных вмешательств [48]. Диклофенак калия показал свою большую эффективность в течение первых 4–6 часов в сравнении с диклофенаком натрия с количеством побочных эффектов, не отличающихся от плацебо [21]. В то же время пероральное введение напроксена в дозах, эквивалентных 500 и 400 мг, обеспечивало эффективную и безопасную аналгезию в течение 9 часов [20]. Высокую эффективность показывают комбинированные препараты, содержащие ацетаминофен (парацетамол) и кодеин в дозах 300 мг + 30 мг и 600–650 мг + 60 мг соответственно. О дозировке 1000 мг парацетамола + 60 мг кодеина пока мало данных [80]. Хотя в другом метаанализе получены негативные данные в отношении использования комбинации НСПВП и парацетамола [45]. Возможен вариант и изолированного использования парацетамола перорально. Однократная доза парацетамола обеспечивает у половины больных эффективную аналгезию в течение 4 часов [81]. Нуждается в дальнейшем исследовании использование нефопама [28]. При кардиоторакальных операциях у пациентов в возрасте менее 70 лет добавление к опиатам НСПВП снижает интенсивность боли и потребность в наркотиках в первые сутки [6]. Добавление НСПВП к внутривенной КПА морфином значительно сокращало частоту послеоперационной тошноты и рвоты — на 30 %, тошноты — на 12 %, рвоты — на 32 %, седации — на 29 %. Потребление морфина коррелировало с частотой тошноты и рвоты. Зуд, частота задержки мочи и депрессия дыхания незначительно снижались на фоне НСПВП [51]. При совместном использовании ацетаминофена с внутривенной КПА морфином отмечен значительный опиатсберегающий эффект морфина, однако количество побочных эффектов морфина не изменилось [64]. Существуют данные, что при использовании НСПВП после тонзиллэктомии повышается риск кровотечения и вследствие этого повторной операции [56].
Регионарная аналгезия
Развитие регионарной анестезии и аналгезии позволило при многих клинических ситуациях считать эти техники сегментарного блока методиками выбора, которые позволяют их использовать в интраоперационном периоде и продлевать благодаря катетерной технике в послеоперационном периоде. Следует сказать, что среди всех регионарных техник в настоящее время отдается предпочтение спинальной анестезии, что не согласуется с международными доказательными рекомендациями, которые преимущественно используют эпидуральную аналгезию как значительно более гибкий метод, позволяющий его применять у пациентов с тяжелой сопутствующей патологией. На сегодня может быть постулатом тезис о том, что чем соматически тяжелее больной, тем более показана ему эпидуральная анестезия и аналгезия (ЭА).
Доказательные принципы использования эпидуральной аналгезии (уровни доказательности)
1. Для всех типов хирургических вмешательств ЭА (за исключением ЭА с использованием только гидрофильных опиатов) обеспечивает лучшее послеоперационное обезболивание в сравнении с парентеральным (включая КПА) использованием опиатов (Level I).
2. Эпидуральное введение МА улучшает оксигенацию и снижает частоту легочных инфекций и других легочных осложнений в сравнении с парентеральным использованием опиатов (Level I).
3. Торакальная ЭА (ТЭА) с использованием МА улучшает восстановление кишечника после абдоминальных операций (включая колоректальные операции); после открытых абдоминальных операций на аорте длительность эндотрахеальной интубации и механической вентиляции снижается, как и частота инфаркта миокарда (ИМ), острой дыхательной недостаточности, желудочных осложнений и почечной недостаточности (Level I [Cochrane Review]).
4. ТЭА снижает частоту пневмонии и потребность в вентиляции у пациентов с множественными переломами ребер (Level II).
5. Комбинация ТЭА с МА и нутритивной поддержкой приводит к сохранению общего количества белка после операции на верхнем этаже брюшной полости (Level II).
6. Поясничная ЭА снижает частоту окклюзии трансплантатов после периферических сосудистых операций (Level II).
7. Комбинация низких концентраций МА и опиатов обеспечивает лучшую аналгезию, чем любой из компонентов отдельно (Level II).
Оценке эффективности использования регионарной анестезии, в частности ЭА, при общей анестезии было посвящено большое исследование. ЭА снижала частоту аритмий, время до экстубации, сроки пребывания в отделении интенсивной терапии, интенсивность боли в покое и движении, максимальный уровень адреналина, норадреналина в крови, кортизола и глюкозы, потребление морфина в первые сутки после операции, увеличивала объем форсированной жизненной емкости легких в первые 24 часа. ТЭА с МА сокращала частоту ОПИН. Таким образом, ЭА имеет существенные преимущества над другими техниками послеоперационной аналгезии [38]. После операций на брюшной аорте ЭА в отношении боли в движении была эффективной до 3-го дня независимо от уровня расположения катетера и вводимых препаратов. Сокращались сроки интубации и механической вентиляции на 20 %. Общее количество сердечно-сосудистых осложнений, ИМ, острой дыхательной недостаточности (потребность в продленной искусственной вентиляции легких), гастроинтестинальных осложнений и острой почечной недостаточности было ниже особенно при использовании ТЭА. Однако эти доказательства не подтверждают положительный эффект ЭА на послеоперационную летальность и другие виды осложнений [41]. Важным представляется сравнение внутривенной КПА опиатами и продленной эпидуральной инфузией после абдоминальных операций. Отмечено, что регионарная техника обеспечивала лучший аналгетический эффект в первые 72 часа после операции, но в этот период наблюдалось больше случаев кожного зуда [87]. При использовании в комплексе анестезиологической защиты при аортокоронарном шунтировании нейроаксиальных блокад не установлено их влияние на летальность и частоту возникновения ИМ. Отмечено улучшение в виде более быстрой экстубации, снижения частоты легочных осложнений, сердечных аритмий и интенсивности боли [47]. Спинальная и эпидуральная техники анестезии при коронарном синдроме обеспечивали эффективную анестезию при среднем уровне удовлетворения пациенток. Спинальная анестезия (СА) имела более короткий период развития блока, но чаще сопровождалась гипотензией. В связи с низким количеством интраоперационных побочных эффектов и послеоперационных осложнений заключение о преимуществах того или иного метода сделать не представляется возможным [58]. ЭА вне зависимости от аналгетика, расположения катетера и времени оценки боли обеспечивает лучшую послеоперационную аналгезию в сравнении с парентеральными опиатами [14]. Наиболее используемым в последнее время препаратом является ропивакаина гидрохлорид, который в комбинации с опиатами обеспечивает хорошую аналгезию. Снижение количества пациентов с моторной блокадой и более безопасный токсикологический профиль делают этот препарат альтернативой бупивакаину для послеоперационной эпидуральной аналгезии [71].
В последние годы появляются публикации по эффективности использования антиконвульсантов в комплексе мультимодальной аналгезии [32, 42]. Традиционно рассматривается вопрос эффективности включения в схемы аналгезии и блокаторов NMDA-рецепторов. Если декстрометорфан не показал убедительной эффективности [26], то кетамин в субанестетических дозировках не только способствовал снижению потребления опиатов, но и снижал частоту послеоперационной тошноты и рвоты при незначительном количестве побочных эффектов [11]. Опережающие режимы использования аналгетиков остаются противоречивой проблемой. При сравнении ЭА, инфильтрации раны МА, системного использования антагонистов NMDA-рецепторов, НСПВП и опиатов первичный исход оценивался по шкалам интенсивности боли, потреблению и времени первого требования аналгетика. Самой эффективной оказалась ЭА, менее эффективными проявили себя инфильтрация раны и НСПВП. Наименьшую эффективность показали NMDA-антагонисты и опиоиды [60].
Однако сегодня нельзя ограничиваться только большими нейроаксиальными техниками, которые имеют свои существенные побочные эффекты и ограничения применения с учетом волемического статуса больного, наличия сопутствующей инфекции, малого количества тромбоцитов и т.д. Другие регионарные техники во многих клинических ситуациях позволяют получить адекватный клинический результат.
Доказательные принципы использования других регионарных и местных техник аналгезии (уровни доказательности)
1. Внутрисуставное введение МА лишь в минимальной степени снижает послеоперационную боль (Level I).
2. Mорфин, введенный внутрисуставно после артроскопии коленного сустава, не улучшает аналгезию в сравнении с плацебо при введении после операции (Level I).
3. Инфильтрация раны длительными МА обеспечивает более эффективную аналгезию после операции по поводу паховой грыжи и лапароскопической холецистэктомии (ХЭ), но не открытой холецистэктомии или гистерэктомии (Level I).
4. Продленная инфузия МА в рану снижает интенсивность боли (в покое и при движении), потребность в опиатах, частоту послеоперационной тошноты и рвоты и сокращает пребывание больного в клинике; удовлетворение больного выше без разницы в частоте раневых инфекций (Level I).
5. В сравнении с опиатной аналгезией продленная блокада периферических нервов (независимо от расположения катетера) обеспечивает лучшую послеоперационную аналгезию и приводит к снижению использования опиатов, а также тошноты, рвоты, зуда и седации (Level I).
6. В сравнении с торакальной ЭА продленная торакальная паравертебральная блокада дает сходный уровень аналгезии, но имеет лучший профиль в отношении безопасности (реже — задержки мочи, гипотензия, тошнота и рвота), чем ЭА, приводит к меньшей частоте послеоперационных респираторных осложнений (Level I).
7. Интраперитонеальное использование МА после лапароскопической ХЭ улучшает послеоперационное обезболивание (Level I).
Растет частота использования периферических техник при кесаревом сечении. Инфильтрация раны местными анестетиками и блокада абдоминальных нервов как дополнительные мероприятия к регионарной и общей аналгезии позволяют снизить потребление морфина. НСПВП могут обеспечить дополнительное обезболивание [10]. При длительном использовании инфузии местных анестетиков показана ее эффективность [37]. Однократная инъекция МА при торакальной паравертебральной аналгезии в отличие от инфильтрации раны является эффективной при операциях на грудной железе и снижает частоту послеоперационной тошноты и рвоты [40]. Продленная периневральная аналгезия обеспечивает лучшую аналгезию в сравнении с опиатами при любых локализациях и временных периодах. Тошнота, рвота, седация и зуд чаще отмечены при использовании опиатов [66].
Использование адъювантов в периоперационном обезболивании является широко обсуждаемым вопросом. Так, клонидин при добавлении к однократным блокам периферических нервов и сплетений показал способность удлинять блок на 2 часа, но повышенный риск гипотензии и седации может ограничить его полезность. Дозозависимые эффекты клонидина остаются не до конца выясненными [62]. После тонзиллэктомии местные анестетики показали равную эффективность при инфильтрационной и местной поверхностной анестезии в виде умеренного устранения боли. Последний метод с учетом безопасности модно считать методом выбора [21]. Psoas compartment блок (ПКБ) является противоречивой техникой при операциях на бедре и колене. Показано его преимущество над опиатами после операций на бедре в течение 8 часов. Продлить аналгезию возможно с использованием катетера. В сравнении с техникой Winnie 3 в 1 ПКБ более надежно блокирует запирательный нерв. ПКБ является альтернативой нейроаксиальным техникам для послеоперационной аналгезии. Пока недостаточно данных, чтобы рекомендовать данный блок вместе с блоком бедренного нерва для небольших операций на коленном суставе. Требуются дополнительные данные по оценке преимущества этого блока в отношении гемодинамической стабильности и кровопотери [22].
Дифференцированные схемы периоперационного обезболивания
На сегодняшний день разработаны основные подходы, которые нами представлены в виде схем периоперационного ведения пациентов с акцентом на качество послеоперационного обезболивания. В табл. 2 приведены рекомендации по тотальному эндопротезированию тазобедренного сустава. Преимущественным методом в настоящее время является спинальная анестезия с добавлением морфина интратекально. Данный метод позволяет добиться хорошей мышечной релаксации, что создает оптимальные условия работы ортопедам. Однако продление этой техники невозможно, а значит, и невозможна ранняя реабилитация больного. Предпочтительной, на наш взгляд, является комбинированная спинально-эпидуральная анестезия/аналгезия (КСЭА), которая сочетает преимущества обеих техник. В последние годы все чаще звучит мнение о том, что спинальная анестезия при тотальном эндопротезировании тазобедренного сустава не является безопасной техникой, особенно у возрастных пациентов, которые составляют основной контингент оперирующихся. Следует шире использовать у этих пациентов и блоки (в том числе и продленные) периферических нервов и сплетений для послеоперационной аналгезии. Обращает на себя внимание и непосредственное влияние некоторых компонентов хирургической техники на интенсивность послеоперационной боли.
ЭА может быть полезной для послеоперационного обезболивания после эндопротезирования крупных суставов нижних конечностей. Однако польза может быть ограничена ранним (до 4–6 часов) послеоперационным периодом. Эпидуральная инфузия местного анестетика или его комбинации с опиатом может быть эффективнее в сравнении с одним опиатом. Эффективность аналгезии необходимо сопоставлять с частотой побочных эффектов. В настоящее время недостаточно доказательств для заключения о частоте редких осложнений после ЭА, заболеваемости и летальности, функциональных исходах, длительности пребывания в стационаре [16]. Рассматриваются вопросы интраартикулярного введения морфина. Эта техника имеет слабый аналгетический эффект, который может быть дозозависимым. Нельзя полностью исключить и системные эффекты морфина [35].
Блоки периферических нервов с блоком бедренного нерва обеспечивают послеоперационную аналгезию, сравнимую с эпидуральной аналгезией, но с улучшенным профилем безопасности и менее вероятным развитием тяжелых нейроаксиальных осложнений [30].
Особенностью периоперационного ведения пациентов с открытой гистерэктомией является эквивалентность использования общей и спинальной анестезии как равнозначных методов у больных без сопутствующей патологии (табл. 3). У пациенток высокого риска предполагается использование эпидуральной анестезии и аналгезии как базового компонента анестезиологического пособия и послеоперационного ведения пациенток.
Важным представляется и разделение трех потоков больных после операций в зависимости от интенсивности боли, что предполагает выбор соответствующих стратегий обезболивания.
Наиболее часто выполняемые оперативные вмешательства в торакальной (табл. 4) и абдоминальной (табл. 5–7) хирургии имеют свои особенности в отношении выбора техник аналгезии.
Методом выбора периоперационной аналгезии при торакотомии является эпидуральная и паравертебральная аналгезия, а в случае необходимости альтернативы выполняется межреберная анестезия/аналгезия.
Большое значение в настоящее время уделяется эффективности эпидуральной аналгезии, в частности, в отношении системы дыхания после абдоминальных и торакальных операций. В период 1971–2006 годов частота пневмонии с использованием ЭА составляла 8 %, а при общей анестезии снизилась с 34 до 12 %. ЭА сократила потребность в продленной вентиляции и повторной интубации, улучшении легочной функции и оксигенации крови, хотя сохраняется повышенный риск гипотензии, задержки мочи и зуда. Технические неудачи составили 7 %. Таким образом, ЭА профилактирует пневмонию после абдоминальных и торакальных операций, хотя в последние 35 лет этот эффект уменьшился вследствие снижения базового риска [23]. Сравнительная оценка торакальной эпидуральной аналгезии и паравертебральной аналгезии (ПВА) после торакальных операций рассмотрена R.G. Davies с соавт., которые показали, что разница в интенсивности боли в периоды 4–8, 24 и 48 часов отсутствовала. Легочные осложнения, задержка мочи, гипотензия и неудачный блок реже имели место в группе паравертебральной блокады (ПВБ). Таким образом, ПВБ сравнима с ТЭА по аналгетической эффективности с лучшим профилем безопасности, поэтому она может быть рекомендована при торакальной хирургии [49]. ЭА при ее начале до торакотомии позволяет лучше контролировать острую боль, а также не влияет на частоту возникновения хронической постторакотомической боли [15]. Практически без исключения ЭА вне зависимости от препарата, аналгетика, эпидурального режима, вида и времени оценки боли обеспечивала лучшую аналгезию в сравнении с внутривенной КПА [88]. Было показано, что при ПВБ для аналгезии после торакотомии большие дозировки МА (бупивакаина) 890–990 мг в сравнении с 325–472,5 мг в сутки имели позитивный эффект до 48 часов наблюдения, что имело положительное влияние на восстановление легочных функций к 72 часам. Продленная инфузия была лучше перемежающихся болюсов в течение 2 суток. Добавление клофелина и фентанила не имело преимуществ [43].
Cравнительная оценка парентерального введения опиатов и эпидуральной аналгезии в колоректальной хирургии показала, что ЭА, несмотря на повышение эффективности обезболивания и сокращение времени динамической непроходимости, имела некоторые побочные эффекты (зуд, задержка мочи и гипотензия), а также не сокращала сроки пребывания больных в отделении после колоректальных операций [35].
Лапароскопическая техника резекции кишечника и ректосигмоидного рака имела дополнительные преимущества в отношении снижения интенсивности боли на 12,6 % и потребления наркотиков на 30,7 % [44]. На сегодня нет убедительных данных о влиянии ЭА с местными анестетиками на несостоятельность анастомоза [40].
Хотя и в настоящее время недостаточно данных по оценке влияния служб острой боли на исход операций у взрослых пациентов [52], однако этот подход представляется оправданным для повышения эффективности ведения пациентов в послеоперационном периоде. Так, в работе S.J. Dolon c соавт. (2003) была проведена оценка эффективности послеоперационного обезболивания в Великобритании при сильной боли после больших абдоминалных операций с использованием 3 техник: внутримышечного введения опиатов, КПА и ЭА. Было отмечено, что за период 1973–1999 на 1,9 % в год сокращалось количество пациентов с выраженной послеоперационной болью на основании стандартов, предложенных Национальной комиссией по аудиту (1997). Однако эти техники могут не быть достаточно эффективными во всех случаях. Поэтому внедрение служб острой боли должно помочь расширить спектр техник аналгезии [25].
Таким образом, в результате проведенного исследования необходимо отметить следующие положения, которые касаются периоперационного обезболивания:
1. Выбор метода анестезии и аналгезии при оперативных вмешательствах зависит от области хирургии.
2. При планировании анестезии обязательно необходимо сразу разработать тактику послеоперационного обезболивания.
3. Включение регионарных техник (особенно эпидуральной аналгезии) в комплекс многокомпонентой аналгезии позволяет оптимизировать качество интра- и послеоперационного обезболивания.
4. Разделение после операции пациентов в зависимости от интенсивности боли позволит разработать более адекватный подход к аналгезии.
5. НСПВП являются важной составной частью многокомпонентной аналгезии.
6. Компоненты операционной техники имеют непосредственное влияние на интенсивность боли после операции.
7. Адекватная послеоперационная аналгезия — результат совместных усилий анестезиолога и хирурга.
Список метаанализов по послеоперационному обезболиванию из базы PabMed
Abraham N.S., Young J.M., Solomon M.J. Meta-analysis of short-term outcomes after laparoscopic resection for colorectal cancer // Br. J. Surg. 2004 Sep; 91(9): 1111-24. PubMed PMID: 15449261.
Anderson B.J., Pons G., Autret-Leca E., Allegaert K., Boccard E. Pediatric intravenous paracetamol (propacetamol) pharmacokinetics: a population analysis // Paediatr. Anaesth. 2005 Apr; 15(4): 282-92. PubMed PMID: 15787918.
Armand S., Langlade A., Boutros A., Lobjoit K., Monrigal C., Ramboatiana R., Rauss A., Bonnet F. Meta-analysis of the efficacy of extradural clonidine to relieve postoperative pain: an impossible task // Br. J. Anaesth. 1998 Aug; 81(2): 126-34. PubMed PMID: 9813509.
Averbuch M., Katzper M. A search for sex differences in response to analgesia // Arch. Intern. Med. 2000 Dec 11–25; 160(22): 3424-8. PubMed PMID: 11112235.
Bainbridge D., Martin J.E., Cheng D.C. Patient-controlled versus nurse-controlled analgesia after cardiac surgery-a meta-analysis // Can. J. Anaesth. 2006 May; 53(5): 492-9. Review. PubMed PMID: 16636035.
Bainbridge D., Cheng D.C., Martin J.E., Novick R. Evidence-Based Perioperative Clinical Outcomes Research (EPiCOR) Group. NSAID-analgesia, pain control and morbidity in cardiothoracic surgery // Can. J. Anaesth. 2006 Jan; 53(1): 46-59. PubMed PMID: 16371609.
Ballantyne J.C., Carr D.B., deFerranti S., Suarez T., Lau J., Chalmers T.C., Angelillo I.F., Mosteller F. The comparative effects of postoperative analgesic therapies on pulmonary outcome: cumulative meta-analyses of randomized, controlled trials // Anesth. Analg. 1998 Mar; 86(3): 598-612. PubMed PMID: 9495424.
Ballantyne J.C., Carr D.B., Chalmers T.C., Dear K.B., Angelillo I.F., Mosteller F. Postoperative patient-controlled analgesia: meta-analyses of initial randomized control trials // J. Clin. Anesth. 1993 May — Jun; 5(3): 182-93. PubMed PMID: 8318237.
Bamigboye A.A., Hofmeyr G.J. Local anaesthetic wound infiltration and abdominal nerves block during caesarean section for postoperative pain relief // Cochrane Database Syst. Rev. 2009 Jul 8; (3): CD006954. Review. PubMed PMID: 19588413.
Barden J., Derry S., McQuay H.J., Moore R.A. Single dose oral ketoprofen and dexketoprofen for acute postoperative pain in adults // Cochrane Database Syst. Rev. 2009 Oct 7; (4): CD007355. Review. PubMed PMID: 19821407.
Bell R.F., Dahl J.B., Moore R.A., Kalso E. Perioperative ketamine for acute postoperative pain // Cochrane Database Syst. Rev. 2006 Jan 25; (1): CD004603. Review. PubMed PMID: 16437490.
Bell R.F., Dahl J.B., Moore R.A., Kalso E. Peri-operative ketamine for acute post-operative pain: a quantitative and qualitative systematic review (Cochrane review) // Acta Anaesthesiol. Scand. 2005 Nov; 49(10): 1405-28. Review. PubMed PMID: 16223384.
Bjordal J.M., Johnson M.I., Ljunggreen A.E. Transcutaneous electrical nerve stimulation (TENS) can reduce postoperative analgesic consumption. A meta-analysis with assessment of optimal treatment parameters for postoperative pain // Eur. J. Pain. 2003; 7(2): 181-8. PubMed PMID: 12600800.
Block B.M., Liu S.S., Rowlingson A.J., Cowan A.R., Cowan J.A. Jr., Wu C.L. Efficacy of postoperative epidural analgesia: a meta-analysis // JAMA. 2003 Nov 12; 290(18): 2455-63. Review. PubMed PMID: 14612482.
Bong C.L., Samuel M., Ng J.M., Ip-Yam C. Effects of preemptive epidural analgesia on post-thoracotomy pain // J. Cardiothorac. Vasc. Anesth. 2005 Dec; 19(6): 786-93. PubMed PMID: 16326309.
Choi P.T., Bhandari M., Scott J., Douketis J. Epidural analgesia for pain relief following hip or knee replacement // Cochrane Database Syst. Rev. 2003; (3): CD003071. Review. PubMed PMID: 12917945.
Collins S.L., Edwards J., Moore R.A., Smith L.A., McQuay H.J. Seeking a simple measure of analgesia for mega-trials: is a single global assessment good enough? // Pain. 2001 Mar; 91(1–2): 189-94. PubMed PMID: 11240091.
Cyna A.M., Middleton P. Caudal epidural block versus other methods of postoperative pain relief for circumcision in boys // Cochrane Database Syst. Rev. 2008 Oct 8; (4): CD003005. Review. PubMed PMID: 18843636.
Davies R.G., Myles P.S., Graham J.M. A comparison of the analgesic efficacy and side-effects of paravertebral vs epidural blockade for thoracotomy-a systematic review and meta-analysis of randomized trials // Br. J. Anaesth. 2006 Apr; 96(4): 418-26. Epub 2006 Feb 13. Review. Erratum // Br. J. Anaesth. 2007 Nov; 99(5): 768. PubMed PMID: 16476698.
Derry C., Derry S., Moore R.A., McQuay H.J. Single dose oral naproxen and naproxen sodium for acute postoperative pain in adults // Cochrane Database Syst. Rev. 2009 Jan 21; (1): CD004234. Review. PubMed PMID: 19160232.
Derry P., Derry S., Moore R.A., McQuay H.J. Single dose oral diclofenac for acute postoperative pain in adults // Cochrane Database Syst. Rev. 2009 Apr 15; (2): CD004768. Review. PubMed PMID: 19370609.
Desjardins P.J., Mehlisch D.R., Chang D.J., Krupa D., Polis A.B., Petruschke R.A., Malmstrom K., Geba G.P. The time to onset and overall analgesic efficacy of rofecoxib 50 mg: a meta-analysis of 13 randomized clinical trials // Clin. J. Pain. 2005 May — Jun; 21(3): 241-50. PubMed PMID: 15818076.
Dhiwakar M., Clement W.A., Supriya M., McKerrow W.S. Antibiotics to reduce post-tonsillectomy morbidity // Cochrane Database Syst. Rev. 2008 Apr 16; (2): CD005607. Review. PubMed PMID: 18425926.
Dhiwakar M., Eng C.Y., Selvaraj S., McKerrow W.S. Antibiotics to improve recovery following tonsillectomy: a systematic review // Otolaryngol. Head Neck Surg. 2006 Mar; 134(3): 357-64. Review. PubMed PMID: 16500427.
Dolin S.J., Cashman J.N., Bland J.M. Effectiveness of acute postoperative pain management: I. Evidence from published data // Br. J. Anaesth. 2002 Sep; 89(3): 409-23. Review. PubMed PMID: 12402719.
Duedahl T.H., Rшmsing J., Mшiniche S., Dahl J.B. A qualitative systematic review of peri-operative dextromethorphan in post-operative pain // Acta Anaesthesiol. Scand. 2006 Jan; 50(1): 1-13. PubMed PMID: 16451144.
Ernst E., Pittler M.H. The effectiveness of acupuncture in treating acute dental pain: a systematic review // Br. Dent. J. 1998 May 9; 184(9): 443-7. PubMed PMID: 9617000.
Evans M.S., Lysakowski C., Tramиr M.R. Nefopam for the prevention of postoperative pain: quantitative systematic review // Br. J. Anaesth. 2008 Nov; 101(5): 610-7. Epub 2008 Sep 15. Review. PubMed PMID: 18796441.
Fowler S.J., Symons J., Sabato S., Myles P.S. Epidural analgesia compared with peripheral nerve blockade after major knee surgery: a systematic review and meta-analysis of randomized trials // Br. J. Anaesth. 2008 Feb; 100(2): 154-64. Review. PubMed PMID: 18211990.
Gaskell H., Derry S., Moore R.A., McQuay H.J. Single dose oral oxycodone and oxycodone plus paracetamol (acetaminophen) for acute postoperative pain in adults // Cochrane Database Syst. Rev. 2009 Jul 8; (3): CD002763. Review. PubMed PMID: 19588335.
Gehling M., Tryba M. Risks and side-effects of intrathecal morphine combined with spinal anaesthesia: a meta-analysis // Anaesthesia. 2009 Jun; 64(6): 643-51. Review. PubMed PMID: 19462494.
Gilron I. Review article: the role of anticonvulsant drugs in postoperative pain management: a bench-to-bedside perspective // Can. J. Anaesth. 2006 Jun; 53(6): 562-71. Review. PubMed PMID: 16738290.
Grainger J., Saravanappa N. Local anaesthetic for post-tonsillectomy pain: a systematic review and meta-analysis // Clin. Otolaryngol. 2008 Oct; 33(5): 411-9. Review. PubMed PMID: 18983373.
Guay J. The benefits of adding epidural analgesia to general anesthesia: a metaanalysis // J. Anesth. 2006; 20(4): 335-40. Review. PubMed PMID: 17072704.
Gupta A., Bodin L., Holmstrцm B., Berggren L. A systematic review of the peripheral analgesic effects of intraarticular morphine // Anesth. Analg. 2001 Sep; 93(3): 761-70. PubMed PMID: 11524353.
Hall P.E., Derry S., Moore R.A., McQuay H.J. Single dose oral lornoxicam for acute postoperative pain in adults // Cochrane Database Syst. Rev. 2009 Oct 7; (4): CD007441. Review. PubMed PMID: 19821419.
Hartrick C.T., Hartrick K.A. Extended-release epidural morphine (DepoDur): review and safety analysis // Expert Rev. Neurother. 2008 Nov; 8(11): 1641-8. Review. PubMed PMID: 18986234.
Ho K.M., Ismail H. Use of intrathecal midazolam to improve perioperative analgesia: a meta-analysis // Anaesth. Intensive Care. 2008 May; 36(3): 365-73. Review. PubMed PMID: 18564797.
Ho K.M., Ismail H., Lee K.C., Branch R. Use of intrathecal neostigmine as an adjunct to other spinal medications in perioperative and peripartum analgesia: a meta-analysis // Anaesth. Intensive Care. 2005 Feb; 33(1): 41-53. Review. PubMed PMID:15957690.
Holte K., Kehlet H. Epidural analgesia and risk of anastomotic leakage // Reg. Anesth. Pain Med. 2001 Mar — Apr; 26(2): 111-7. PubMed PMID: 11251133.
Hudcova J., McNicol E., Quah C., Lau J., Carr D.B. Patient controlled opioid analgesia versus conventional opioid analgesia for postoperative pain // Cochrane Database Syst. Rev. 2006 Oct 18; (4): CD003348. Review. PubMed PMID: 17054167.
Hurley R.W., Cohen S.P., Williams K.A., Rowlingson A.J., Wu C.L. The analgesic effects of perioperative gabapentin on postoperative pain: a meta-analysis // Reg. Anesth. Pain Med. 2006 May — Jun; 31(3): 237-47. PubMed PMID: 16701190.
Kotzй A., Scally A., Howell S. Efficacy and safety of different techniques of paravertebral block for analgesia after thoracotomy: a systematic review and metaregression // Br. J. Anaesth. 2009 Nov; 103(5): 626-36. Review. PubMed PMID:19837806.
Lan P., Wu X., Zhou X., Wang J., Zhang L. The safety and efficacy of stapled hemorrhoidectomy in the treatment of hemorrhoids: a systematic review and meta-analysis of ten randomized control trials // Int. J. Colorectal. Dis. 2006 Mar; 21(2): 172-8. Epub 2005 Jun 22. Review. PubMed PMID: 15971065.
Lange H., Kranke P., Steffen P., Steinfeldt T., Wulf H., Eberhart L.H. [Combined analgesics for postoperative pain therapy. Review of effectivity and side-effects] // Anaesthesist. 2007 Oct; 56(10): 1001-16. Review. German. PubMedPMID: 17763976.
Liu S.S., Richman J.M., Thirlby R.C., Wu C.L. Efficacy of continuous wound catheters delivering local anesthetic for postoperative analgesia: a quantitative and qualitative systematic review of randomized controlled trials // J. Am. Coll. Surg. 2006 Dec; 203(6): 914-32. Epub 2006 Oct 25. Review. PubMed PMID: 17116561.
Liu S.S., Block B.M., Wu C.L. Effects of perioperative central neuraxial analgesia on outcome after coronary artery bypass surgery: a meta-analysis // Anesthesiology. 2004 Jul; 101(1): 153-61. PubMed PMID: 15220785.
Lloyd R., Derry S., Moore R.A., McQuay H.J. Intravenous or intramuscular parecoxib for acute postoperative pain in adults // Cochrane Database Syst. Rev. 2009 Apr 15; (2): CD004771. Review. PubMed PMID: 19370610.
Marret E., Remy C., Bonnet F.; Postoperative Pain Forum Group. Meta-analysis of epidural analgesia versus parenteral opioid analgesia after colorectal surgery // Br. J. Surg. 2007 Jun; 94(6): 665-73. Review. PubMed PMID: 17514701.
Marret E., Vigneau A., Salengro A., Noirot A., Bonnet F. [Effectiveness of analgesic techniques after breast surgery: a meta-analysis] // Ann. Fr. Anesth. Reanim. 2006 Sep; 25(9): 947-54. Epub 2006 Aug 22. French. PubMed PMID: 16926089.
Marret E., Kurdi O., Zufferey P., Bonnet F. Effects of nonsteroidal antiinflammatory drugs on patient-controlled analgesia morphine side effects: meta-analysis of randomized controlled trials // Anesthesiology. 2005 Jun; 102(6): 1249-60. PubMed PMID: 15915040.
McDonnell A., Nicholl J., Read S.M. Acute pain teams and the management of postoperative pain: a systematic review and meta-analysis // J. Adv. Nurs. 2003 Feb; 41(3): 261-73. Review. PubMed PMID: 12581114.
McQuay H.J., Moore R.A. Postoperative analgesia and vomiting, with special reference to day-case surgery: a systematic review // Health Technol. Assess. 1998; 2(12): 1-236. PubMed PMID: 10103349.
Mhuircheartaigh R.J., Moore R.A., McQuay H.J. Analysis of individual patient data from clinical trials: epidural morphine for postoperative pain // Br. J. Anaesth. 2009 Dec; 103(6): 874-81. Epub 2009 Nov 4. PubMed PMID: 19889750.
Moore R.A., McQuay H.J. Single-patient data meta-analysis of 3453 postoperative patients: oral tramadol versus placebo, codeine and combination analgesics // Pain. 1997 Feb; 69(3): 287-94. PubMed PMID: 9085303.
Mшiniche S., Rшmsing J., Dahl J.B., Tramиr M.R. Nonsteroidal anti-inflammatory drugs and the risk of operative site bleeding after tonsillectomy: a quantitative systematic review // Anesth. Analg. 2003 Jan; 96(1): 68-77, table of contents. Review. PubMed PMID: 12505926.
Nabi G., Cook J., N’Dow J., McClinton S. Outcomes of stenting after uncomplicated ureteroscopy: systematic review and meta-analysis // BMJ. 2007 Mar 17; 334(7593): 572. Epub 2007 Feb 20. Review. PubMed PMID: 17311851; PubMed Central PMCID: PMC1828345.
Ng K., Parsons J., Cyna A.M., Middleton P. Spinal versus epidural anaesthesia for caesarean section // Cochrane Database Syst. Rev. 2004; (2): CD003765. Review. PubMed PMID: 15106218.
Nishimori M., Ballantyne J.C., Low J.H. Epidural pain relief versus systemic opioid-based pain relief for abdominal aortic surgery // Cochrane Database Syst. Rev. 2006 Jul 19; 3: CD005059. Review. PubMed PMID: 16856074.
Ong C.K., Lirk P., Seymour R.A., Jenkins B.J. The efficacy of preemptive analgesia for acute postoperative pain management: a meta-analysis // Anesth. Analg. 2005 Mar; 100(3): 757-73, table of contents. PubMed PMID: 15728066.
Panchal S.J., Damaraju C.V., Nelson W.W., Hewitt D.J., Schein J.R. System-related events and analgesic gaps during postoperative pain management with the fentanyl iontophoretic transdermal system and morphine intravenous patient-controlled analgesia // Anesth. Analg. 2007 Nov; 105(5): 1437-41, table of contents. PubMed PMID: 17959979.
Pцpping D.M., Elia N., Marret E., Wenk M., Tramиr M.R. Clonidine as an adjuvant to local anesthetics for peripheral nerve and plexus blocks: a meta-analysis of randomized trials // Anesthesiology. 2009 Aug; 111(2): 406-15. Review. PubMed PMID: 19602964.
Pцpping D.M., Elia N., Marret E., Remy C., Tramиr M.R. Protective effects of epidural analgesia on pulmonary complications after abdominal and thoracic surgery: a meta-analysis // Arch. Surg. 2008 Oct; 143(10): 990-9; discussion 1000. Review. PubMed PMID: 18936379.
Remy C., Marret E., Bonnet F. Effects of acetaminophen on morphine side-effects and consumption after major surgery: meta-analysis of randomized controlled trials // Br. J. Anaesth. 2005 Apr; 94(4): 505-13. Epub 2005 Jan 28. Review. PubMed PMID: 15681586.
Renner R.M., Jensen J.T., Nichols M.D., Edelman A. Pain control in first trimester surgical abortion // Cochrane Database Syst. Rev. 2009 Apr 15; (2): CD006712. Review. PubMed PMID: 19370649.
Richman J.M., Liu S.S., Courpas G., Wong R., Rowlingson A.J., McGready J., Cohen S.R., Wu C.L. Does continuous peripheral nerve block provide superior pain control to opioids? A meta-analysis // Anesth. Analg. 2006 Jan; 102(1): 248-57. PubMed PMID: 16368838.
Roy Y.M., Derry S., Moore R.A. Single dose oral lumiracoxib for postoperative pain // Cochrane Database Syst. Rev. 2007 Oct 17; (4): CD006865. Review. PubMed PMID: 17943921.
Sauro M.D., Greenberg R.P. Endogenous opiates and the placebo effect: a meta-analytic review // J. Psychosom. Res. 2005 Feb; 58(2): 115-20. PubMed PMID: 15820838.
Schier R., Guerra D., Aguilar J., Pratt G.F., Hernandez M., Boddu K., Riedel B. Epidural space identification: a meta-analysis of complications after air versus liquid as the medium for loss of resistance // Anesth. Analg. 2009 Dec; 109(6): 2012-21. Review. PubMed PMID: 19923534.
Seib R.K., Paul J.E. Preoperative gabapentin for postoperative analgesia: a meta-analysis // Can. J. Anaesth. 2006 May; 53(5): 461-9. PubMed PMID: 16636030.
Senard M., Joris J. [Use of ropivacaine for peridural postoperative analgesia] // Ann. Fr. Anesth. Reanim. 2002 Nov; 21(9): 713-24. French. PubMed PMID: 12494805.
Standing J.F., Savage I., Pritchard D., Waddington M. Diclofenac for acute pain in children // Cochrane Database Syst. Rev. 2009 Oct 7; (4): CD005538. Review. PubMed PMID: 19821348.
Strшmskag K.E., Minor B., Steen P.A. Side effects and complications related to interpleural analgesia: an update // Acta Anaesthesiol. Scand. 1990 Aug; 34(6): 473-7. PubMed PMID: 2146854.
Sumida S., Lesley M.R., Hanna M.N., Murphy J.D., Kumar K., Wu C.L. Meta-analysis of the effect of extended-release epidural morphine versus intravenous patient-controlled analgesia on respiratory depression // J. Opioid. Manag. 2009 Sep — Oct; 5(5): 301-5. Review. PubMed PMID: 19947071.
Sun Y., Gan T.J., Dubose J.W., Habib A.S. Acupuncture and related techniques for postoperative pain: a systematic review of randomized controlled trials // Br. J. Anaesth. 2008 Aug; 101(2): 151-60. Epub 2008 Jun 2. Review. PubMed PMID: 18522936.
Taddio A., Ohlsson A., Einarson T.R., Stevens B., Koren G. A systematic review of lidocaine-prilocaine cream (EMLA) in the treatment of acute pain in neonates // Pediatrics. 1998 Feb; 101(2): E1. PubMed PMID: 9445511.
Tangsiriwatthana T., Sangkomkamhang U., Lumbiganon P., Laopaiboon M. Paracervical local anaesthesia for cervical dilatation and uterine intervention // Cochrane Database Syst. Rev. 2009 Jan 21; (1): CD005056. Review. PubMed PMID: 19160245.
Tirunagari S.K., Derry S., Moore R.A., McQuay H.J. Single dose oral etodolac for acute postoperative pain in adults // Cochrane Database Syst. Rev. 2009 Jul 8; (3): CD007357. Review. PubMed PMID: 19588426.
Tjandra J.J., Chan M.K. Systematic review on the short-term outcome of laparoscopic resection for colon and rectosigmoid cancer // Colorectal Dis. 2006 Jun; 8(5): 375-88. Review. Erratum in: Colorectal Dis. 2008 Mar; 10(3): 305-6. PubMed PMID: 16684081.
Toms L., Derry S., Moore R.A., McQuay H.J. Single dose oral paracetamol (acetaminophen) with codeine for postoperative pain in adults // Cochrane Database Syst. Rev. 2009 Jan 21; (1): CD001547. Review. PubMed PMID: 19160199.
Toms L., McQuay H.J., Derry S., Moore R.A. Single dose oral paracetamol (acetaminophen) for postoperative pain in adults // Cochrane Database Syst. Rev. 2008 Oct 8; (4): CD004602. Review. PubMed PMID: 18843665.
Touray S.T., de Leeuw M.A., Zuurmond W.W., Perez R.S. Psoas compartment block for lower extremity surgery: a meta-analysis // Br. J. Anaesth. 2008 Dec; 101(6): 750-60. Epub 2008 Oct 22. Review. PubMed PMID: 18945717.
Verspyck E., Sentilhes L., Roman H., Sergent F., Marpeau L. [Episiotomy techniques] // J. Gynecol. Obstet. Biol. Reprod. (Paris). 2006 Feb; 35(1 Suppl): 1S40-1S51. Review. French. PubMed PMID: 16495826.
Viscusi E.R., Gambling D.R., Hughes T.L., Manvelian G.Z. Pharmacokinetics of extended-release epidural morphine sulfate: pooled analysis of six clinical studies // Am. J. Health Syst. Pharm. 2009 Jun 1; 66(11): 1020-30. PubMed PMID: 19451613.
Viscusi E.R., Siccardi M., Damaraju C.V., Hewitt D.J., Kershaw P. The safety and efficacy of fentanyl iontophoretic transdermal system compared with morphine intravenous patient-controlled analgesia for postoperative pain management: an analysis of pooled data from three randomized, active-controlled clinical studies // Anesth. Analg. 2007 Nov; 105(5): 1428-36, table of contents. PubMed PMID: 17959978.
Walder B., Schafer M., Henzi I., Tramиr M.R. Efficacy and safety of patient-controlled opioid analgesia for acute postoperative pain. A quantitative systematic review // Acta Anaesthesiol. Scand. 2001 Aug; 45(7): 795-804. PubMed PMID: 11472277.
Werawatganon T., Charuluxanun S. Patient controlled intravenous opioid analgesia versus continuous epidural analgesia for pain after intra-abdominal surgery // Cochrane Database Syst. Rev. 2005 Jan 25; (1): CD004088. Review. PubMed PMID: 15674928.
Wu C.L., Cohen S.R., Richman J.M., Rowlingson A.J., Courpas G.E., Cheung K., Lin E.E., Liu S.S. Efficacy of postoperative patient-controlled and continuous infusion epidural analgesia versus intravenous patient-controlled analgesia with opioids: a meta-analysis // Anesthesiology. 2005 Nov; 103(5): 1079-88; quiz 1109-10. PubMed PMID: 16249683.