Журнал «Здоровье ребенка» Том 20, №7, 2025
Вернуться к номеру
Предиктори розвитку та прогресування діабетичної периферичної полінейропатії в дітей із цукровим діабетом 1-го типу
Авторы: H.O. Lezhenko, M.S. Spilnik
Zaporizhzhia State Medical and Pharmaceutical University, Zaporizhzhia, Ukraine
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
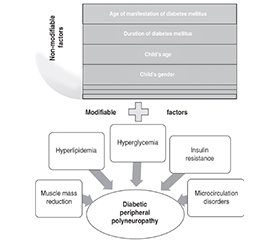
Актуальність. На сьогодні немає єдиної стратегії запобігання діабетичній периферичній полінейропатії (ДПН) або її лікуванняу дітей, тому визначення факторів ризику розвитку та прогресування цього ускладнення є підґрунтям для розробки лікувально-профілактичних заходів. Мета: встановити предиктори розвитку та прогресування ДПН у дітей, хворих на цукровий діабет 1-го типу, за результатами факторного та кластерного аналізів. Матеріали та методи. Під спостереженням знаходилося 103 пацієнти з цукровим діабетом 1-го типу віком від 10 до 17 років: 1-ша група (n = 50) — діти без ознак нейропатії, 2-га група (n = 53) — діти з діабетичною периферичною полінейропатією. Для визначення патогенетичних факторів, що найбільше впливають на розвиток ДПН у дітей із цукровим діабетом 1-го типу, проведений факторний аналіз методом головних компонент та ієрархічний кластерний аналіз з використанням методу міжгрупових зв’язків. Результати. У результаті проведеного факторного аналізу виділено 4 фактори, що визначають розвиток ДПН у дітей, хворих на цукровий діабет 1-го типу. Внесок цих факторів у загальну дисперсію становив 82,52 %. Було визначено провідні механізми розвитку ДПН у цій когорті, серед яких найбільш значущими були хронічна гіперглікемія з глікемічним контролем з високим ризиком для життя, інсулінорезистентність, вік дитини, порушення периферичного кровообігу, тривалість перебігу та вік маніфестації цукрового діабету, розвиток діабетичної міопатії. Означені фактори становили 3 кластери, які логічно доповнювали один одного та підтверджували їх роль у розвитку ДПН у дітей, хворих на цукровий діабет 1-го типу. Висновки. За результатами проведеного аналізу показано багатофакторну етіологію ДПН у дітей із цукровим діабетом 1-го типу. Прогнозування розвитку ДПН у дітей повинно базуватися на визначенні як немодифікованих (вік маніфестації та тривалість перебігу захворювання, вік і стать пацієнта), так і модифікованих факторів (гіперліпідемія, інсулінорезистентність, зменшення скелетної м’язової маси й порушення мікроциркуляції).
Background. Currently, unified strategy for preventing or treating diabetic peripheral polyneuropathy (DPN) in children has not yet been identified. Therefore, establishing risk factors for the development and progression of this complication is the basis of treatment and preventive measures. The purpose was to determine predictors of the development and progression of DPN in children with type 1 diabetes mellitus using factor and cluster analyses. Materials and methods. The study involved 103 children with type 1 diabetes mellitus aged 10 to 17 years who were divided into 2 groups: group 1 (n = 50) without signs of DPN, group 2 (n = 53) with DPN. In order to identify the pathogenetic factors that most determine the development of DPN in children with type 1 diabetes, factor analysis was performed using the principal component method and hierarchical cluster analysis was conducted using the method of intergroup relations. Results. As a result of the factor analysis, 4 factors were identified that determine the development of DPN in children with type 1 diabetes. The contribution of these factors to the total variance was 82.52 %. The leading mechanisms of DPN development in this cohort mellitus were identified, among which the priority contribution was made by chronic hyperglycemia with glycemic control with a high risk to life, insulin resistance, child’s age, impaired peripheral circulation, duration of the course and age of manifestation of diabetes mellitus, development of diabetic myopathy. The specified factors formed 3 clusters, which logically complemented each other and confirmed their role in the development of DPN in children with type 1 diabetes. Conclusions. The results of the analysis demonstrate the multifactorial etiology of DPN in children with type 1 diabetes mellitus. Prediction of DPN in pediatric patients should be based on the identification of both non-modifiable (age of manifestation and duration of the disease, age and gender of the child) and modifiable factors (hyperlipidemia, development of insulin resistance, reduction in skeletal muscle mass, and impaired microcirculation).
цукровий діабет; неврологічний стан; діабетична нейропатія; фактори ризику; факторний аналіз; кластерний аналіз; діти
diabetes mellitus; neurological condition; diabetic neuropathies; risk factors; factor analysis; cluster analysis; children
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Feldman EL, Callaghan BC, Pop-Busui R, Zochodne DW, Wright DE, et al. Diabetic neuropathy. Nat Rev Dis Primers. 2019;5(1):1-18. doi: 10.1038/s41572-019-0092-1.
- Hansen CS, Määttä LL, Andersen ST, Charles MH. The epidemiology of diabetic neuropathy. In: Tesfaye S, Gibbons CH, Malik RA, Veves A, eds. Diabetic neuropathy. Contemporary Diabetes. Cham: Springer; 2023. 5-36. doi: 10.1007/978-3-031-15613-7_2.
- Ang L, Mizokami-Stout K, Eid SA, Elafros M, Callaghan B, et al. The conundrum of diabetic neuropathies — past, present, and future. J Diabetes Complications. 2022;36(11):108334. doi: 10.1016/j.jdiacomp.2022.108334.
- Türkyilmaz H, Güzel O, Edizer S, Ünalp A. Evaluation of polyneuropathy and associated risk factors in children with type 1 diabetes mellitus. Turk J Med Sci. 2017;47(3):942-946. doi: 10.3906/sag-1601-183.
- Zakon.rada.gov.ua. Ministry of Health of Ukraine. Standards of medical care “Diabetes mellitus in children”. Kyiv; 2023. Available from: https://moz.gov.ua/uploads/8/44300-dn_413_28022023_dod.pdf.
- Valk GD, Nauta JJP, Strijers RLM, Bertelsmann FW. Clinical examination versus neurophysiological examination in the diagnosis of diabetic polyneuropathy. Diabet Med. 1992;9(8):716-721. doi: 10.1111/j.1464-5491.1992.tb01879.x.
- Gilchrist LS, Tanner L. The pediatric-modified total neuropathy score: a reliable and valid measure of chemotherapy-induced peripheral neuropathy in children with non-CNS cancers. Support Care Cancer. 2012;21(3):847-856. doi: 10.1007/s00520-012-1591-8.
- Peters AM, Snelling HLR, Glass DM, Bird NJ. Estimation of lean body mass in children. Br J Anaesth. 2011;106(5):719-723. doi: 10.1093/bja/aer057.
- Boer P. Estimated lean body mass as an index for normalization of body fluid volumes in humans. Am J Physiol Renal Physiol. 1984;247(4):632-636. doi: 10.1152/ajprenal.1984.247.4.F632.
- Janssen I, Heymsfield SB, Ross R. Low relative skeletal muscle mass (sarcopenia) in older persons is associated with functional impairment and physical disability. J Am Geriatr Soc. 2002;50:889-896. doi: 10.1046/j.1532-5415.2002.50216.x.
- Elbarbary NS, Ismail EAR, El-Hilaly RA, Ahmed FS. Role of neopterin as a biochemical marker for peripheral neuropathy in pediatric patients with type 1 diabetes: relation to nerve conduction studies. Int Immunopharmacol. 2018;59:68-75. doi: 10.1016/j.intimp.2018.03.026.
- Dikaiakou E, Vlachopapadopoulou EA, Paschou SA, Athanasouli F, Panagiotopoulos I, et al. Triglycerides-glucose (TyG) index is a sensitive marker of insulin resistance in Greek children and adolescents. Endocrine. 2020;70(1):58-64. doi: 10.1007/s12020-020-02374-6.
- Sánchez-Escudero V, Lacalle CG, Vergaz AG, Mateo LR, Cabrero AM. The triglyceride/glucose index as an insulin resistance marker in the pediatric population and its relation to eating habits and physical acti–vity. Endocrinología, Diabetes y Nutrición (English ed.). 2021;68(5):296-303. doi: 10.1016/j.endien.2020.08.015.
- Bondar A, Popa AR, Papanas N, Popoviciu M, Vesa CM, et al. Diabetic neuropathy: a narrative review of risk factors, classification, screening and current pathogenic treatment options. Exp Ther Med. 2021;22(1):690. doi: 10.3892/etm.2021.1012.
- Wang W, Ji Q, Ran X, Li C, Kuang H, Yu X, Zhu D. Prevalence and risk factors of diabetic peripheral neuropathy: a population-based cross-sectional study in China. Diabetes Metab Res Rev. 2023;39(8):e3702. doi: 10.1002/dmrr.3702.
- O’Brien PD, Guo K, Eid SA, Rumora AE, Hinder LM, et al. Integrated lipidomic and transcriptomic analyses identify altered nerve triglycerides in mouse models of prediabetes and type 2 diabetes. Dis Model Mech. 2020;13(2):dmm042101. doi: 10.1242/dmm.042101.
- Jaiswal M, Divers J, Urbina EM, Dabelea D, Bell RA, Pettitt DJ; SEARCH for Diabetes in Youth Study Group. Cardiovascular autonomic neuropathy in adolescents and young adults with type 1 and type 2 diabetes: The SEARCH for Diabetes in Youth Cohort Study. Pediatr Diabetes. 2018;19(4):680-689. doi: 10.1111/pedi.12633.
- Tu Z, Du J, Ge X, Peng W, Shen L, et al. Triglyceride glucose index for the detection of diabetic kidney disease and peripheral neuropathy in hospitalized patients with type 2 diabetes. Diabetes Ther. 2024;15(8):1799-1810. doi: 10.1007/s13300-024-01609-3.
- Bjornstad P, Eckel RH. Pathogenesis of lipid disorders in insulin resistance: a brief review. Curr Diab Rep. 2018;18(12):127. doi: 10.1007/s11892-018-1101-6.
- Lezhenko HO, Pashkova OYe, Chudova NI. The association between the skeletal muscle state, lipid metabolism disorders and insulin resistance in children with type 1 diabetes mellitus. Zaporozhye Med J. 2022;24(6):687-694. doi: 10.14739/2310-1210.2022.6.261182 (in Ukrainian).
- Kobayashi M, Zochodne DW. Diabetic neuropathy and the sensory neuron: new aspects of pathogenesis and their treatment implications. J Diabetes Investig. 2018;9(6):1239-1254. doi: 10.1111/jdi.12833.
- Galicia-Garcia U, Benito-Vicente A, Jebari S, Larrea-Sebal A, Siddiqi H, et al. Pathophysiology of type 2 diabetes mellitus. Int J Mol Sci. 2020;21(17):6275. doi: 10.3390/ijms21176275.
- Pek SLT, Lim SC, Ang K, Kwan PY, Tang WE, et al. Endothelin-1 predicts incident diabetic peripheral neuropathy in type 2 diabetes: a cohort study. Eur J Endocrinol. 2020;182(4):429-438. doi: 10.1530/eje-19-0523.
- Oh TJ, Song Y, Moon JH, Choi SH, Jang HC. Diabetic peri–pheral neuropathy as a risk factor for sarcopenia. Ann Geriatr Med Res. 2019;23(4):170. doi: 10.4235/agmr.19.0039.
- Kim JH, Lim S, Choi SH, Kim KM, Yoon JW, Kim KW. Sarcopenia: an independent predictor of mortality in community-dwelling older Korean men. J Gerontol: Series A. 2014;69(10):1244-1252. doi: 10.1093/gerona/glu050.
- Pashkova OYe, Chudova NI. The role of peripheral circular disorders in the development of diabetic myopathy in children with diabetes. Curr Probl Mod Med. 2021;8:69-78. doi: 10.26565/2617-409x-2021-8-07 (in Ukrainian).
- Zhang Y, Shen X, He L, Zhao F, Yan S. Association of sarcopenia and muscle mass with both peripheral neuropathy and nerve function in patients with type 2 diabetes. Diabetes Res Clin Pract. 2020;162:108096. doi: 10.1016/j.diabres.2020.108096.
- Wang L, Lin X, Huang H, Wang Y, Liang X, et al. Low rectus fe–moris mass index is closely associated with diabetic peripheral neuropathy. Front Endocrinol. 2023;14:1148093. doi: 10.3389/fendo.2023.1148093.
- Henderson AD, Johnson AW, Rasmussen LG, Peine WP, Symons SH, et al. Early-stage diabetic neuropathy reduces foot strength and intrinsic but not extrinsic foot muscle size. J Diabetes Res. 2020;2020:9536362. doi: 10.1155/2020/9536362.
- Morales PE, Bucarey JL, Espinosa A. Muscle lipid metabolism: role of lipid droplets and perilipins. J Diabetes Res. 2017;2017:1789395. doi: 10.1155/2017/1789395.
- Lee JH, Lee HS, Cho AR, Lee YJ, Kwon YJ. Relationship between muscle mass index and LDL cholesterol target levels: analysis of two studies of the Korean population. Atherosclerosis. 2021;325:1-7. doi: 10.1016/j.atherosclerosis.2021.01.016.
- Zhang H, Chen Y, Zhu W, Niu T, Song B, et al. The mediating role of HbA1c in the association between elevated low-density lipoprotein cholesterol levels and diabetic peripheral neuropathy in patients with type 2 diabetes mellitus. Lipids Health Dis. 2023;22(1):102. doi: 10.1186/s12944-023-01865-5.
- Iqbal Z, Bashir B, Ferdousi M, Kalteniece A, Alam U, et al. Li–pids and peripheral neuropathy. Curr Opin Lipidol. 2021;32(4):249-257. doi: 10.1097/mol.0000000000000770.
- Redondo MJ, Hagopian WA, Oram R, Steck AK, Vehik K, et al. The clinical consequences of heterogeneity within and between different diabetes types. Diabetologia. 2020;63:2040-2048. doi: 10.1007/s00125-020-05211-7.
- Hao W, Gitelman S, DiMeglio LA, Boulware D, Greenbaum CJ; Type 1 Diabetes TrialNet Study Group. Fall in C-peptide during first 4 years from diagnosis of type 1 diabetes: variable relation to age, HbA1c, and insulin dose. Diabetes Care. 2016;39(10):1664-1670. doi: 10.2337/dc16-0360.
- Lachin JM, McGee P, Palmer JP; DCCT/EDIC Research Group. Impact of C-peptide preservation on metabolic and clinical outcomes in the Diabetes Control and Complications Trial. Diabetes. 2014;63(2):739-748. doi: 10.2337/db13-0881.
- Akinci G, Savelieff MG, Gallagher G, Callaghan BC, Feldman EL. Diabetic neuropathy in children and youth: new and emer–ging risk factors. Pediatr Diabetes. 2021;22(2):132-147. doi: 10.1111/pedi.13153.
- Jaiswal M, Divers J, Dabelea D, Isom S, Bell RA, et al. Prevalence of and risk factors for diabetic peripheral neuropathy in youth with type 1 and type 2 diabetes: SEARCH for diabetes in youth study. Diabetes Care. 2017;40(9):1226-1232. doi: 10.2337/dc17-0179.
- Sales Luis M, Alcafache M, Ferreira S, Fitas AL, Simões Pereira J, et al. Children with type 1 diabetes of early age at onset — immune and metabolic phenotypes. J Pediatr Endocrinol Metab. 2019;32(9):935-941. doi: 10.1515/jpem-2019-0103.
- Ciarambino T, Crispino P, Leto G, Mastrolorenzo E, Para O, Giordano M. Influence of gender in diabetes mellitus and its complication. Int J Mol Sci. 2022;23(16):8850. doi: 10.3390/ijms23168850.
- Mauvais-Jarvis F. Role of sex steroids in β-cell function, growth, and survival. Trends Endocrinol Metab. 2016;27:844-855. doi: 10.1016/j.tem.2016.08.008.
- Nishioka Y, Noda T, Okada S, Myojin T, Kubo S, et al. Incidence and seasonality of type 1 diabetes in Japan: a population-based 3-year cohort study using the National Database in Japan. BMJ Open Diabetes Res Care. 2020;8:e001262. doi: 10.1136/bmjdrc-2020-001262.
- Elliott J, Sloan G, Stevens L, Selvarajah D, Cruccu G, Gandhi RA; EURODIAB Prospective Complications Study Group. Female sex is a risk factor for painful diabetic peripheral neuropathy: the EURODIAB prospective diabetes complications study. Diabetologia. 2024;67(1):190-198. doi: 10.1007/s00125-023-06025-z.