Резюме
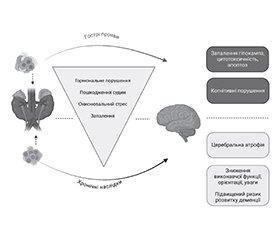
Як відомо, порушення когнітивних функцій є однією з причин інвалідизації населення, а кількість пацієнтів, що потребують тривалої реабілітації, спрямованої на відновлення психічного здоров’я, збільшується. Останнім часом помітно зростає інтерес лікарів різних спеціальностей до вивчення проблеми взаємозв’язку між соматичною і нервовою системами організму та клінічних особливостей ураження нервової системи при вісцеральних захворюваннях. Зокрема, актуальними залишаються питання вивчення нефрогенних уражень нервової системи, які призводять до зниження якості життя пацієнтів і значних фінансових затрат та зумовлюють актуальність даної медичної і соціальної проблеми. Когнітивні зниження діагностуються вже на ранніх стадіях захворювань і прогресують паралельно зі зниженням функції нирок. Окиснювальний стрес, ендотеліальна дисфункція, прискорений артеріосклероз і уремічне запальне середовище впливають як на центральну, так і на периферичну нервову систему. Розуміння взаємодії між нирками та головним мозком є міждисциплінарною проблемою в науковій галузі. У цій роботі проаналізовані сучасні літературні джерела баз даних Scopus, Web of Science, MedLine, PubMed, NCBI стосовно нейропсихологічних розладів у пацієнтів із захворюванням нирок, представлені найбільш відомі реногенні нейропсихологічні розлади, особливості їх патогенезу та клінічна характеристика. Для аналізу використано бібліографічний, аналітичний методи дослідження та методику системного підходу. Пацієнти на всіх стадіях хронічної хвороби нирок (ХХН) мають вищий ризик розвитку деменції та когнітивних порушень, а нещодавні епідеміологічні дослідження показали, що гостре пошкодження нирок (ГПН) пов’язане з ризиком подальшого інсульту та деменції. Публікація має на меті завдяки вивченню сучасних літературних джерел узагальнити наукові дані стосовно реногенних нейропсихологічних розладів, продемонструвати важливість вивчення діагностичних критеріїв та клінічних особливостей, звернути увагу лікарів на своєчасну діагностику, етіопатогенетичне лікування та профілактику даної патології. З огляду на проведений аналіз сучасних літературних джерел встановлено, що дисрегуляція нирково-мозкової осі є причиною нейропсихологічних розладів, а недостатньо вивчений складний патогенетичний взаємозв’язок та точний механізм модуляції між нирковими і когнітивними порушеннями потребує подальшого аналізу, оскільки слід очікувати подальшого зростання нейропсихологічних розладів у популяції.
Impaired cognitive function is known to be one of the leading causes of disability among the population, and the number of patients in need of long-term rehabilitation aimed at restoring mental health is increasing. Recently, there has been a marked increase in the interest of doctors of various specialties in studying the relationship between the somatic and nervous systems of the body and the clinical features of nervous system damage in visceral diseases. In particular, the study of nephrogenic nervous system lesions, which lead to a decrease in the quality of life of patients and significant financial costs, remains relevant and determines the importance of this medical and social problem. Cognitive impairment is diagnosed in the early stages of the disease and progresses in parallel with the decline in renal function. Oxidative stress, endothelial dysfunction, accelerated arteriosclerosis and uremic inflammatory environment affect both the central and peripheral nervous system. Understanding the interaction between the kidneys and the brain is an interdisciplinary problem in the scientific field. This paper analyses the current literature sources from the Scopus, Web of Science, MedLine, PubMed, NCBI databases on neuropsychological disorders in patients with kidney disease, presents the most well-known renogenic neuropsychological disorders, their pathogenesis and clinical characteristics. The bibliographic, analytical research methods and the methodology of the systematic approach were used in the study. Patients at all stages of chronic kidney disease are at higher risk of developing dementia and cognitive impairment, and recent epidemiological studies have shown that acute kidney injury is associated with the risk of subsequent stroke and dementia. The publication aims to summarize the existing scientific data on renogenic neuropsychological disorders, demonstrate the importance of evaluating diagnostic criteria and clinical features, and draw the attention of physicians to timely diagnosis, etiopathogenetic treatment and prevention of this pathology based on the study of modern literature. Given the latter, it was found that dysregulation of the renal-brain axis is the cause of neuropsychological disorders, and the poorly studied complex pathogenetic relationship and the exact mechanism of modulation between renal and cognitive disorders requires further analysis, as growth of neuropsychological disorders in the population should be expected.
Список литературы
1. Seliger SL, Wendell CR, Waldstein SR, Ferrucci L, Zonderman AB. Renal function and long-term decline in cognitive function: the Baltimore Longitudinal Study of Aging. Am J Nephrol. 2015;41(4-5):305-12. https://doi.org/10.1159/000430922.
2. Zhao Q, Yan T, Chopp M, Venkat P, Chen J. Brain-kidney interaction: Renal dysfunction following ischemic stroke. J Cereb Blood Flow Metab. 2020 Feb;40(2):246-262. https://doi.org/10.1177/0271678X19890931.
3. Dulam V, Katta S, Nakka VP. Stroke and Distal Organ Damage: Exploring Brain-Kidney Crosstalk. Neurochem Res. 2024 Jul;49(7):1617-1627. https://doi.org/10.1007/s11064-024-04126-8.
4. Ghoshal S. Renal and Electrolyte Disorders and the Nervous System. Continuum (Minneap Minn). 2023 Jun 1;29(3):797-825. https://doi.org/10.1212/CON.0000000000001286.
5. Prince M, Wimo A, Guerchet M, Ali GC, Wu Y-T, Prina M. World Alzheimer Report 2015, The Global Impact of Dementia: An analysis of prevalence, incidence, cost and trends. Alzheimer’s Dis Int ADI Lond. 2015;87. https://www.researchgate.net/publication/281555306_World_Alzheimer_Report_2015_The_Global_Impact_of_Dementia_An_Analysis_of_Prevalence_Incidence_Cost_and_Trends.
6. Alzheimer’s Association. 2018 Alzheimer’s disease facts and figures. Alzheimers Dement J Alzheimers Assoc. 2018;14:367-429. https://doi.org/10.1016/j.jalz.2018.02.001.
7. Mllers T, Stocker H, Wei W, Perna L, Brenner H. Length of hospital stay and dementia: a systematic review of observational studies. Int J Geriatr Psychiatry. 2019;34:8-21. https://doi.org/10.1002/gps.4993.
8. Kuo YT, Li CY, Sung JM, Chang CC, Wang JD, Sun CY. Risk of dementia in patients with end-stage renal disease under maintenance dialysis — a nationwide population-based study with consideration of competing risk of mortality. Alzheimers Res Ther. 2019 Apr 9;11(1):31. https://doi.org/10.1186/s13195-019-0486-z.
9. Orlova OV, Boiko DI, Bodnar LA, Zhyvotovska LV. Cognitive dysfunction and disturbed daily activities of people with dementia impact the psychological stress in family caregivers depending on their anxiety and depression severity. Health psychology open. 2024;11:20551029241305549. https://doi.org/10.1177/20551029241305549.
10. Ortiz A, Mattace-Raso F, Soler MJ, Fouque D. Ageing meets kidney disease. Age Ageing. 2022;51:afac157. https://doi.org/10.1093/ageing/afac157.
11. Chen YC, Su YC, Lee CC, Huang YS, Hwang SJ. Chronic kidney disease itself is a causal risk factor for stroke beyond traditional cardiovascular risk factors: a nationwide cohort study in Taiwan. PLoS One. 2014;7(4):e36332. https://doi.org/10.1371/journal.pone.0036332.
12. Zuoquan Xiea, Siyu Tongb, Xingkun Chub, Teng Fengb, Meiyu Genga. Chronic Kidney Disease and Cognitive Impairment: The Kidney-Brain Axis. Kidney Dis. 2022;8:275-285. https://doi.org/10.1159/000524475.
13. Kryvchun AM, Lytvynenko NV, Pinchuk VA, Sylenko GY, Gladka VM. Signifuing resident of the city Poltava at the expense of signs stroke, risk factors and urgent measures (according to medico-social survey). Wiad Lek. 2018;71(3 pt 2):695-698. Ukrainian. PMID: 29783250.
14. Ekblad LL, Toppala S, Johansson JK, Koskinen S, Sundvall J, Rinne JO. Albuminuria and microalbuminuria as predictors of cognitive performance in a general population: an 11-year follow-up study. J Alzheimers Dis. 2018;65(3):1053-4. https://doi.org/10.3233/JAD-170972.
15. Dziak LA. Cognitive and neurosensory deficits of different ge–nesis: how not to miss the main thing. Ukr. Med. Chas. 2021;4(144):8-13. https://doi.org/10.32471/umj.1680-3051.144.214545.
16. Delva II, Delva MY, Poltorapavlov VA. Clinical factors related to post-stroke fatigue within the first 3 month after acute cerebrovascular events. Wiadomosci lekarskie (Warsaw, Poland. 1960). 2017;70(3 pt 2):581-585.
17. Tan S, Chen W, Kong G, Wei L, Xie Y. Peripheral inflammation and neurocognitive impairment: correlations, underlying mechanisms, and therapeutic implications. Front Aging Neurosci. 2023 Nov 29;15:1305790. https://doi.org/10.3389/fnagi.2023.1305790.
18. Chillon JM, Massy ZA, Stengel B. Neurological complications in chronic kidney disease patients. Nephrol Dial Transplant. 2016 Oct;31(10):1606-14. https://doi.org/10.1093/ndt/gfv315.
19. Tanaka S, Okusa MD. Crosstalk between the nervous system and the kidney. Kidney Int. 2020 Mar;97(3):466-476. https://doi.org/10.1016/j.kint.2019.10.032.
20. Watanabe K, Watanabe T, Nakayama M. Cerebro-renal interactions: impact of uremic toxins on cognitive function. Neurotoxico–logy. 2014;44:184-93. https://doi.org/10.1016/j.neuro.2014.06.014.
21. Kielstein H, Suntharalingam M, Perthel R, et al. Role of the endogenous nitric oxide inhibitor asymmetric dimethylarginine (ADMA) and brain-derived neurotrophic factor (BDNF) in depression and behavioural changes: clinical and preclinical data in chronic kidney disease. Nephrol Dial Transplant. 2015;30(10):1699-705. https://doi.org/10.1093/ndt/gfv253.
22. Skrypnyk I, Maslova G, Lymanets T, Gusachenko I. L-arginine is an effective medication for prevention of endothelial dysfunction, a predictor of anthracycline cardiotoxicity in patients with acute leukemia. Exp Oncol. 2017 Dec;39(4):308-311. https://doi.org/10.31768/2312-8852.2017.39(4):308-311.
23. Marebwa BK, Adams RJ, Magwood GS, et al. Fibroblast growth factor23 is associated with axonal integrity and neural network architecture in the human frontal lobes. PLoS One. 2018;13(9):e0203460. https://doi.org/10.1371/journal.pone.0203460.
24. Chekalina NI, Kazakov YM, Mamontova TV, Vesnina LE, Kaidashev IP. Resveratrol more effectively than quercetin reduces endothelium degeneration and level of necrosis factor in patients with coronary artery disease. Wiad Lek. 2016;69(3 pt 2):475-479. PMID: 28478409.
25. Zewinger S, Speer T, Kleber ME, et al. HDL cholesterol is not associated with lower mortality in patients with kidney dysfunction. J Am Soc Nephrol. 2014;25(5):1073-82. https://doi.org/10.1681/ASN.2013050482.
26. Talash VV, Tkachenko LA, Yarmola TI, et al. Peculiarities of diagnostics of nervous system lesions in patients with chronic kidney disease undergoing programme haemodialysis at the Centre for Nephrology and Dialysis ‘Poltava Regional Clinical Hospital named after M.V. Sklifosovsky of the Poltava Regional Council’. Bulletin of problems in biology and medicine. 2019;2(151):167-172. http://nbuv.gov.ua/UJRN/Vpbm_2019_2%282%29__40.
27. Tang X, Han YP, Chai YH, et al. Association of kidney function and brain health: A systematic review and meta-analysis of cohort studies. Ageing Res Rev. 2022 Dec;82:101762. https://doi.org/10.1016/j.arr.2022.101762.
28. Wang H, Huang L, Wu G, et al. Regional cerebral grey matter atrophy is associated with cognitive impairment in haemodialysis patients: a morphological MRI study of transverse and longitudinal voxel-based imaging. Brain Imaging Behaviour. 2022;16:1284-1293. https://doi.org/10.1007/s11682-021-00602-9.
29. Yeh YC, Kuo YT, Huang MF, et al. Association of brain white matter lesions and atrophy with cognitive function in chronic kidney disease. Int J Geriatr Psychiatry. 2019 Dec;34(12):1826-1832. https://doi.org/10.1002/gps.5198.
30. Cogley C, Bramham J, Bramham K, et al. High rates of psychological distress, mental health diagnoses and suicide attempts in people with chronic kidney disease in Ireland. Nephrol Dial Transplant. 2023 Sep 29;38(10):2152-2159. https://doi.org/10.1093/ndt/gfad021.
31. Boiko DI, Shkodina AD, Hasan MM, et al. Melatonergic Receptors (Mt1/Mt2) as a Potential Additional Target of Novel Drugs for Depression. Neurochem Res. 2022 Oct;47(10):2909-2924. https:/doi.org/10.1007/s11064-022-03646-5.
32. Aggarwal HK, Jain D, Bhavikatti A. Cognitive Dysfunction in Patients with Chronic Kidney Disease. Saudi J Kidney Dis Transpl. 2020 Jul-Aug;31(4):796-804. https://doi.org/10.4103/1319-2442.292313.
33. Gupta A, Mahnken JD, Bernal J, et al. Changes in Cognitive Function After Kidney Transplantation: A Longitudinal Cohort Study. Am J Kidney Dis. 2024 Jul;84(1):28-37.e1. https://doi.org/10.1053/j.ajkd.2023.12.022.
34. Pires LA, Almeida ALM, Parazo MA, et al. Cross-sectional assessment of mild cognitive impairment in pre-dialysis chronic kidney disease and its association with inflammation and changes seen on MRI: what the eyes cannot see. J Bras Nefrol. 2022 Jul-Sep;44(3):336-348. https://doi.org/10.1590/2175-8239-JBN-2021-0194.
35. Makris K, Spanou L. Acute kidney injury: Definition, pathophysiology and clinical phenotypes. Clin Biochem Rev. 2016;37:85-98. PMID: 28303073; PMCID: PMC5198510.
36. Zorrilla-Vaca A, Ziai W, Connolly ES Jr, et al. Acute kidney injury following acute ischemic stroke and intracerebral hemorrhage: A meta-analysis of prevalence rate and mortality risk. Cerebrovasc Dis. 2018;45:1-9. https://doi.org/10.1159/000479338.
37. Wu VC, Wu PC, Wu CH, et al. National Taiwan University Study Group on Acute Renal Failure (NSARF) Group. The impact of acute kidney injury on the long-term risk of stroke. J Am Heart Assoc. 2014 Jul 15;3(4):e000933. https://doi.org/10.1161/JAHA.114.000933.
38. Tsai HH, Yen RF, Lin KL, Kao C. Increased risk of dementia in patients hospitalised with acute kidney injury: a nationwide population-based cohort study. PLoS One. 2017;12(2):e0171671. https://doi.org/10.1371/journal.pone.0171671.
39. Doi K, Ishizu T, Tsukamoto-Sumida M, et al. The high-mobility group protein B1-Toll-like receptor 4 pathway contributes to the acute lung injury induced by bilateral nephrectomy. Kidney Int. 2014;86(2):316-26. https://doi.org/10.1038/ki.2014.62.
40. Chan MJ, Liu KD. Acute Kidney Injury and Subsequent Cardiovascular Disease: Epidemiology, Pathophysiology, and Treatment. Semin Nephrol. 2024 Mar;44(2):151515. https://doi.org/10.1016/j.semnephrol.2024.151515.