Международный неврологический журнал Том 21, №3, 2025
Вернуться к номеру
Роль прозапальних та протизапальних факторів у формуванні полінейропатій у пацієнтів з цукровим діабетом 2-го типу
Авторы: Сушецька Д.А., Товажнянська О.Л.
Харківський національний медичний університет, м. Харків, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
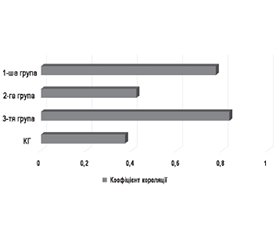
Актуальність. Поширеність периферичної полінейропатії (ПНП) серед пацієнтів з цукровим діабетом (ЦД) за останні 5 років становить від 6 до 51 %. Найбільш частим видом ПНП у хворих з ЦД 2-го типу є дистальна симетрична сенсомоторна полінейропатія (ДСП). ДСП потрібно диференціювати з іншими ПНП, а саме з хронічною запальною демієлінізуючою полінейропатією. При такому виді ураження ключову роль відіграють місцеві та системні запальні процеси, а саме взаємодія про- та протизапальних цитокінів (IL-6 та IL-10). Мета: виявлення взаємозв’язку між рівнями IL-6 та IL-10 і клінічними особливостями перебігу периферичних ПНП на тлі ЦД 2-го типу. Матеріали та методи. Було обстежено 96 пацієнтів з діагнозом ЦД 2-го типу, ускладненого периферичною ПНП. Усім пацієнтам було проведено електронейроміографічне дослідження, за результатами якого сформовано 3 групи: 1 — аксональний тип ураження периферичних нервів (n = 37); 2 — демієлінізуючий тип (n = 29); 3 — змішаний тип (n = 30). Також було проведено кількісне визначення рівнів IL-6 та IL-10 у сироватці крові пацієнтів. Усі пацієнти були протестовані за допомогою опитувальників та шкал: PainDetect, MNSI, TSS, NIS-LL. Результати. Рівень IL-6 у всіх досліджуваних групах був вищим, ніж у контрольній групі, усі р < 0,05. Найвище значення було зафіксовано у представників 3-ї групи (16,40 ± 2,89 пг/мл), а найнижче — у хворих з аксональним типом ПНП (7,44 ± 0,52 пг/мл). Рівні IL-10 у 1-й групі виявились порівнянними з контрольною групою та значно нижчими за значення у представників 2-ї та 3-ї груп, обидва р < 0,005. Було виявлено вищі рівні кореляції між значеннями IL-6 та IL-10 у пацієнтів з аксональною дегенерацією: r = 0,77 для 1-ї групи та r = 0,83 для 3-ї групи, обидва р < 0,005. Інтенсивність симптомів за шкалами MNSI, TSS, NIS-LL була найвищою серед пацієнтів 3-ї групи (18,76 ± 1,98 бала, 12,51 ± 1,66 бала, 32,72 ± 3,47 бала відповідно), а в 2-й групі зафіксовано найменшу кількість балів за цими шкалами (10,04 ± 1,53 бала, 5,14 ± 0,95 бала, 18,38 ± 1,48 бала відповідно). Висновки. У ході проведеного дослідження було виявлено стійке підвищення рівнів IL-6 та IL-10 у всіх хворих з ЦД 2-го типу та прямі кореляції між цими показниками, що були найбільш виражені у 1-й та 3-й групах. Аналіз клініко-неврологічної симптоматики за валідованими шкалами MNSI, TSS, NIS-LL виявив пряму сильну кореляцію кількості балів за цими шкалами між собою, а також пряму кореляцію середньої сили з рівнем IL-6 в усіх досліджуваних групах та з рівнем IL-10 у 1-й та 3-й групах.
Background. Over the past 5 years, researchers have reported the prevalence of peripheral polyneuropathy (PPN) to range from 6 to 51 % among patients with diabetes mellitus (DM). Among patients with type 2 DM, distal symmetric polyneuropathy represents the most common type of PPN. Clinicians need to differentiate it from other forms of PPN, particularly chronic inflammatory demyelinating polyneuropathy. In this type of lesion, local and systemic inflammatory processes, especially the interaction between pro- and anti-inflammatory cytokines (IL-6 and IL-10), play a key role. This study aimed to identify the relationship between IL-6 and IL-10 levels and the clinical features of PPN in type 2 DM. Materials and methods. We examined 96 patients diagnosed with type 2 DM complicated by PPN. All of them underwent electroneuromyographic study and, based on its results, formed three groups: 1 — axonal type of peripheral nerve damage (n = 37); 2 — demyelinating type (n = 29); 3 — mixed type (n = 30). We also measured the blood serum levels of IL-6 and IL-10. In addition, all patients completed standardized questionnaires and scales: PainDetect, MNSI, TSS, and NIS-LL. Results. The level of IL-6 in all studied groups was higher than in the control one, with all p-values < 0.05. Group 3 had the highest value (16.40 ± 2.89 pg/ml), while patients with the axonal type of PPN showed the lowest (7.44 ± 0.52 pg/ml). The IL-10 levels in group 1 closely resembled those in controls and were significantly lower than in groups 2 and 3 (both p < 0.005). Patients with axonal degeneration showed stronger correlations between IL-6 and IL-10: r = 0.77 in group 1 and r = 0.83 in group 3 (both p < 0.005). Patients in group 3 reported the most intense symptoms on the MNSI, TSS, and NIS-LL scales (18.76 ± 1.98, 12.51 ± 1.66, and 32.72 ± 3.47 points, respectively), whereas group 2 showed the lowest scores (10.04 ± 1.53, 5.14 ± 0.95, and 18.38 ± 1.48 points, respectively). Conclusions. The study found persistently elevated IL-6 and IL-10 levels in all patients with type 2 DM and identified strong direct correlations between these cytokines, particularly in groups 1 and 3. The analysis of clinical and neurological symptoms using MNSI, TSS, and NIS-LL scales revealed strong correlations between the scores and moderate to strong direct correlations with IL-6 levels across all groups and with IL-10 levels in groups 1 and 3.
цукровий діабет; дистальна симетрична сенсомоторна полінейропатія; хронічна запальна демієлінізуюча полінейропатія; інтерлейкін-6; інтерлейкін-10
diabetes mellitus; distal symmetric polyneuropathy; chronic inflammatory demyelinating polyneuropathy; interleukin-6; interleukin-10