Журнал «Боль. Суставы. Позвоночник» Том 13, №4, 2023
Вернуться к номеру
Зміни деяких сироваткових показників крові при краніоскелетній травмі як можлива ознака акселерації кісткової репарації
Авторы: Бігун Р.Р., Сулима В.С., Кузь У.В., Омельчук В.П.
Івано-Франківський національний медичний університет, м. Івано-Франківськ, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
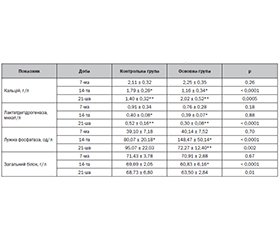
Актуальність. Акселерація кісткової репарації є феноменом, відомим понад 30 років, і спостерігається у пацієнтів з поєднаною краніоскелетною травмою. На сьогодні немає робочої теорії причини феномена. Також триває пошук факторів, що його зумовлюють. Метою дослідження була оцінка змін сироваткових показників як можливих предикторів феномена акселерації зрощення в експерименті. Матеріали та методи. Білих щурів-самок (n = 90) випадковим чином розподілили на 2 групи: контрольну (n = 45) — з моделюванням ізольованого перелому стегнової кістки та основну (n = 45) групу — з краніоскелетною політравмою. Динаміку сироваткових показників визначали на 7-му, 14-ту та 21-шу добу. Результати. Середня активність лактатдегідрогенази знижувалась (р < 0,001) в обох групах на 14-ту добу до статистично однакових значень (р = 0,88). В основній групі активність лактатдегідрогенази на 21-шу добу знижувалась (на 23 %, р = 0,004), тоді як у контрольній групі на 21-шу добу зросла на 30 % (р = 0,015). Активність лужної фосфатази у контрольній групі зростала як на 14-ту (на 105 %, р < 0,001), так і на 21-шу добу (на 19 %, р = 0,06). На 14-ту добу концентрація загального білка зменшилась на 14 % (р < 0,001) лише у тварин з основної групи, тоді як у контрольній групі вірогідних відмінностей показників не виявлено (p > 0,05). Середня концентрація кальцію у тварин основної групи на 14-ту добу порівняно з 7-ю добою вірогідно знизилась (на 48 %, р < 0,001), а на 21-шу добу повернулася до початкових значень(р < 0,001). У контрольній групі спостерігали вірогідне зниження рівня кальцію як на 14-ту (p = 0,007), так і на 21-шу добу (p = 0,001). Висновки. На 14-ту добу експерименту концентрація кальцію знижувалась як у контрольній (на 15%, р < 0,001), так і в основній групі (на 48 %, р < 0,001), тоді як на 14-ту добу концентрація лактатдегідрогенази знижувалась в обох групах, активність лужної фосфатази зростала до пікових значень. Значення загального білка не слід вважати якісним маркером акселерації кісткової репарації.
Background. Acceleration of fracture healing is a phenomenon known for over 30 years and is observed in patients with concomitant cranio-skeletal trauma. To date, there is no single theory explaining the phenomenon. The search for factors that determine this phenomenon is ongoing. The purpose of the study was to assess changes in serum indicators as potential predictors of the phenomenon of accelerated osteogenesis in the experiment. Materials and methods. Experimental animals, female white rats (n = 90), were randomly divided into two groups: control (n = 45) with isolated femoral fracture and experimental (n = 45) with cranio-skeletal polytrauma. The dynamics of serum indices were determined on days 7, 14, and 21. Results. The average lactate dehydrogenase activity decreased (p < 0.001) in both groups on day 14 to equal values (p = 0.88). In the experimental group, lactate dehydrogenase activity remained lower (by 23 %, p = 0.004), while in control group it increased (by 30 %, p = 0.015). The alkaline phosphatase activity in the control group increased both on day 14 (by 105 %, p < 0.001) and on day 21 (by 19 %, p = 0.06). The protein level decreased by 14 % (p < 0.001) compared to day 7 only in polytrauma group, while in control group data were not evident enough (p>0.05). The average blood calcium in polytrauma group decreased (by 48 %, p < 0.001) on day 14 compared to day 7 but increased to baseline values on day 21 (p < 0.001). In control group, a decrease in calcium levels was observed both day 14 (p = 0.007) and day 21 (p = 0.001). Conclusions. On day 14 calcium concentration decreased in both isolated trauma (by 15 %, p < 0.001) and polytrauma (by 48 %, p < 0.001) groups. While lactate dehydrogenase activity decreased in both groups on day 14, alkaline phosphatase activity increased to its peak value. The blood protein should not be considered a relevant marker of fracture healing acceleration.
політравма; кісткова репарація; експериментальна модель; загальний білок; лужна фосфатаза; кальцій; лактатдегідрогеназа
polytrauma; bone regeneration; experimental animal models; blood proteins; alkaline phosphatase; calcium; lactate dehydrogenases
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Mueller M., Schilling T., Minne H.W., Ziegler R. A systemic acceleratory phenomenon (SAP) accompanies the regional acceleratory phenomenon (RAP) during healing of a bone defect in the rat. J. Bone Miner. Res. 1991 Apr. 6(4). 401-10. doi: 10.1002/jbmr.5650060412. PMID: 1858523.
- Morley J., Marsh S., Drakoulakis E., et al. Does traumatic brain injury result in accelerated fracture hea–ling? Injury. 2005 Mar. 36(3). 363-8. doi: 10.1016/j.injury.2004.08.028. PMID: 15710151.
- Stoffel K., Engler H., Kuster M., Riesen W. Changes in biochemical markers after lower limb fractures. Clin. Chem. 2007 Jan. 53(1). 131-4. doi: 10.1373/clinchem.2006.076976. Epub 2006 Nov 27. PMID: 17130179.
- Yoon B.H., Yu W. Clinical Utility of Biochemical Marker of Bone Turnover: Fracture Risk Prediction and Bone Healing. J. Bone Metab. 2018 May. 25(2). 73-78. doi: 10.11005/jbm.2018.25.2.73. Epub 2018 May 31. PMID: 29900156; PMCID: PMC5995756.
- Mukhopadhyay M., Sinha R., Pal M., et al. Role of common biochemical markers for the assessment of fracture union. Indian J. Clin. Biochem. 2011 Jul. 26(3). 274-8. doi: 10.1007/s12291-011-0143-1. Epub 2011 Jun 8. PMID: 22754192; PMCID: PMC3162953.
- Skaliczki G., Schandl K., Weszl M., et al. Serum albumin enhances bone healing in a nonunion femoral defect model in rats: a computer tomography micromorphometry study. Int. Orthop. 2013 Apr. 37(4). 741-5. doi: 10.1007/s00264-012-1770-8. Epub 2013 Jan 15. PMID: 23318937; PMCID: PMC3609985.
- Wiratnaya I.G.E., Mahadhana S., Sutheno A. et al. Lactate dehydrogenase (LDH) and C-reactive protein (CRP) as a potential prognostic factor in metastatic bone disease (MBD) of proximal femur based on Harris hip score (HHS) underwent cephalomedullary nailing and bipolar hemiarthroplasty. Bali Med. J. 2023. 12(2). 2349-2353. doi: 10.15562/bmj.v12i2.4714.
- Morioka K., Marmor Y., Sacramento J.A., et al. Differential fracture response to traumatic brain injury suggests dominance of neuroinflammatory response in polytrauma. Sci. Rep. 2019 Aug 21. 9(1). 12199. doi: 10.1038/s41598-019-48126-z. PMID: 31434912; PMCID: PMC6704103.
- Einhorn T.A., Gerstenfeld L.C. Fracture healing: mechanisms and interventions. Nat. Rev. Rheumatol. 2015 Jan. 11(1). 45-54. doi: 10.1038/nrrheum.2014.164. Epub 2014 Sep 30. PMID: 25266456; PMCID: PMC4464690.
- Hofman M., Koopmans G., Kobbe P., et al. Improved fracture healing in patients with concomitant traumatic brain injury: proven or not? Mediators Inflamm. 2015. 2015. 204842. doi: 10.1155/2015/204842. Epub 2015 Mar 22. PMID: 25873754; PMCID: PMC4385630.
- Lubelska-Sazanów M. Animals as specific objects of obligations under Polish and German law. V&R unipress, 2021. 310 p. doi: 10.14220/9783737010443.
- Percie du Sert N., Hurst V., Ahluwalia A., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 2020 Jul 14. 18(7). e3000410. doi: 10.1371/journal.pbio.3000410. PMID: 32663219; –PMCID: PMC7360023.
- Friese C., Nuyts N., Pardo-Guerra J.P. Cultures of care? Animals and science in Britain. Br. J. Sociol. 2019 Dec. 70(5). 2042-2069. doi: 10.1111/1468-4446.12706. Epub 2019 Nov 4. PMID: 31682001; PMCID: PMC6916317.
- Ahmadi-Noorbakhsh S., Farajli Abbasi M., Ghasemi M., et al. Anesthesia and analgesia for common research models of adult mice. Lab. Anim. Res. 2022 Dec 13. 38(1). 40. doi: 10.1186/s42826-022-00150-3. PMID: 36514128; PMCID: PMC9746144.
- Natividad-Pedreño M., Nuñez-Chia A., Cobo-Valenzuela N., et al. Effect of cefazolin and cefuroxime on fracture healing in rats. Injury. 2016 Sep. 47 Suppl. 3. S3-S6. doi: 10.1016/S0020-1383(16)30599-X. PMID: 27692104.
- Flierl M.A., Stahel P.F., Beauchamp K.M., et al. Mouse closed head injury model induced by a weight-drop device. Nat. Protoc. 2009. 4(9). 1328-37. doi: 10.1038/nprot.2009.148. Epub 2009 Aug 27. PMID: 19713954.
- Aurégan J.C., Coyle R.M., Danoff J.R., et al. The rat model of femur fracture for bone and mineral research: An improved description of expected comminution, quantity of soft callus and incidence of complications. Bone Joint Res. 2013 Aug 8. 2(8). 149-54. doi: 10.1302/2046-3758.28.2000171. PMID: 23929548; –PMCID: PMC3743403.
- Kick B.L., Gumber S., Wang H., Moore R.H., Taylor D.K. Evaluation of 4 Presurgical Skin Preparation Methods in Mice. J. Am. Assoc. Lab. Anim. Sci. 2019 Jan 1. 58(1). 71-77. doi: 10.30802/AALAS-JAALAS-18-000047. Epub 2019 Jan 4. PMID: 30609948; PMCID: PMC6351048.
- Sauerbeck A.D., Fanizzi C., Kim J.H., et al. modCHIMERA: a novel murine closed-head model of mo–derate traumatic brain injury. Sci. Rep. 2018 May 16. 8(1). 7677. doi: 10.1038/s41598-018-25737-6. PMID: 29769541; PMCID: PMC5955903.
- Han J., Yang S., Hao X. et al. Extracellular Vesicle-Derived microRNA-410 From Mesenchymal Stem Cells Protects Against Neonatal Hypoxia-Ischemia Brain Damage Through an HDAC1-Dependent EGR2/Bcl2 Axis. Front. Cell Dev. Biol. 2021 Jan 11. 8. 579236. doi: 10.3389/fcell.2020.579236. PMID: 33505958; PMCID: PMC7829500.
- Yates N.J., Lydiard S., Fehily B., et al. Repeated mild traumatic brain injury in female rats increases lipid peroxidation in neurons. Exp. Brain Res. 2017 Jul. 235(7). 2133-2149. doi: 10.1007/s00221-017-4958-8. Epub 2017 Apr 17. PMID: 28417146.
- Collier C.D., Hausman B.S., Zulqadar S.H., et al. Characterization of a reproducible model of fracture hea–ling in mice using an open femoral osteotomy. Bone Rep. 2020 Feb 5. 12. 100250. doi: 10.1016/j.bonr.2020.100250. Erratum in: Bone Rep. 2021 Apr 29. 14. 101084. PMID: 32090156; PMCID: PMC7025178.
- Kim T.K., Park J.H. More about the basic assumptions of t-test: normality and sample size. Korean J. Anesthesiol. 2019 Aug. 72(4). 331-335. doi: 10.4097/kja.d.18.00292. Epub 2019 Apr 1. PMID: 30929413; –PMCID: PMC6676026.
- Mishra P., Singh U., Pandey C.M., et al. Application of student’s t-test, analysis of variance, and covariance. Ann. Card. Anaesth. 2019 Oct-Dec. 22(4). 407-411. doi: 10.4103/aca.ACA_94_19. PMID: 31621677; PMCID: PMC6813708.
- Tan Y.D. Two-sample tα-test for testing hypo–theses in small-sample experiments. Int. J. Biostat. 2022 Jun 24. 19(1). 1-19. doi: 10.1515/ijb-2021-0047. PMID: 35749155.
- Cadosch D., Gautschi O.P., Thyer M., et al. Humoral factors enhance fracture-healing and callus formation in patients with traumatic brain injury. J. Bone Joint Surg. Am. 2009 Feb. 91(2). 282-8. doi: 10.2106/JBJS.G.01613. Erratum in: J. Bone Joint Surg. Am. 2009 Apr. 91(4). 938. PMID: 19181971.
- Yamada S.M. Changes in bone mineral density in unconscious immobile stroke patients from the acute to chro–nic phases of brain diseases. Osteoporos Sarcopenia. 2022 Sep. 8(3). 106-111. doi: 10.1016/j.afos.2022.08.001. Epub 2022 Sep 21. PMID: 36268498; PMCID: PMC9577216.
- Kesavan C., Rundle C., Mohan S. Repeated mild traumatic brain injury impairs fracture healing in male mice. BMC Res. Notes. 2022 Jan 29. 15(1). 25. doi: 10.1186/s13104-022-05906-7. PMID: 35093144; PMCID: PMC8801079.
- Smith É., Comiskey C., Carroll Á. Prevalence of and risk factors for osteoporosis in adults with acquired brain injury. Ir. J. Med. Sci. 2016 May. 185(2). 473-81. doi: 10.1007/s11845-016-1399-5. Epub 2016 Jan 19. PMID: 26787314.
- Bajwa N.M., Kesavan C., Mohan S. Long-term Consequences of Traumatic Brain Injury in Bone Metabolism. Front. Neurol. 2018 Mar 5. 9. 115. doi: 10.3389/fneur.2018.00115. PMID: 29556212; PMCID: PMC5845384.
- Brady R.D., Shultz S.R., Sun M., et al. Experimental Traumatic Brain Injury Induces Bone Loss in Rats. J. Neurotrauma. 2016 Dec 1. 33(23). 2154-2160. doi: 10.1089/neu.2014.3836. Epub 2016 Oct 24. PMID: 25686841.
- Farhana A., Lappin S.L. Biochemistry, Lactate Dehydrogenase. [Updated 2023 May 1]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK557536.
- Ravi P., Nageswaran J., Ramanujam M., et al. Correlation Between Traumatic Brain Injuries and Callus Formation in Long bone Fractures. Indian J. Orthop. 2022 Jan 5. 56(5). 837-846. doi: 10.1007/s43465-021-00594-0. PMID: 35547339; PMCID: PMC9043063.
- Nascimento da Silva Z., Azevedo de Jesuz V., De Salvo Castro E., et al. Effect of the “protein diet” and bone tissue. Nutr. Hosp. 2014 Jan 1. 29(1). 140-5. doi: 10.3305/nh.2014.29.1.7000. PMID: 24483972.
- Czech T., Oyewumi M.O. Overcoming barriers confronting application of protein therapeutics in bone fracture healing. Drug Deliv. Transl. Res. 2021 Jun. 11(3). 842-865. doi: 10.1007/s13346-020-00829-x. PMID: 32783153.