Международный неврологический журнал Том 19, №7, 2023
Вернуться к номеру
Хронічна післятравматична енцефалопатія: предиктори розвитку когнітивних порушень і функціональної неспроможності
Авторы: Дуве Х.В., Шкробот С.І., Салій З.В.
Тернопільський національний медичний університет імені І.Я. Горбачевського, м. Тернопіль, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
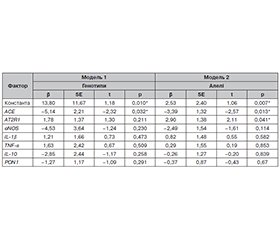
Актуальність. Прогнозування індивідуального ризику розвитку когнітивної дисфункції та функціональної неспроможності в повсякденному житті в пацієнтів із хронічною травматичною енцефалопатією (ХТЕ) дозволить своєчасно призначити адекватне лікування для запобігання розвитку деменції. Тому метою дослідження було розробити математичну модель прогнозування ризику розвитку когнітивних порушень і функціональної неспроможності в пацієнтів з ХТЕ на основі аналізу поліморфних варіантів генів ACE, AT2R1, eNOS, ePON1, IL-1β, IL-10, TNF-α, а також кофакторів (стать, вікова категорія, катамнез і наявність/відсутність соматичної коморбідності). Матеріали та методи. Обстежено 145 пацієнтів із ХТЕ, які перебували на стаціонарному лікуванні на базі комунального некомерційного підприємства «Тернопільська обласна клінічна психоневрологічна лікарня» впродовж 2021–2022 рр. і яких включили в ретроспективний аналіз, з них 26 хворим проводили молекулярно-генетичне дослідження. Молекулярно-генетичну диференціацію досліджуваних поліморфних варіантів генів здійснювали в молекулярно-генетичній лабораторії державного закладу «Референс-центр з молекулярної діагностики МОЗ України», м. Київ. Когнітивні функції оцінювали за допомогою Монреальського когнітивного тесту (MOCA); повсякденну життєдіяльність оцінювали за допомогою індексу Бартел. Статистичний аналіз даних здійснювали за допомогою комп’ютерного програмного забезпечення Microsoft Excel і Statistica 13.0. Для оцінки ймовірності виникнення когнітивних порушень і функціональної неспроможності в пацієнтів із ХТЕ проведено логістичний регресійний аналіз. Результати. Аналізуючи поліморфні варіанти генів ACE, AT2R1, eNOS, ePON1, IL-1β, IL-10, TNF-α, а також такі кофактори, як стать, вікова категорія, катамнез і наявність/відсутність соматичної коморбідності, в контексті розвитку когнітивних порушень у пацієнтів з ХТЕ, встановили, що найбільшу прогностичну цінність має I/D поліморфізм гена ACE (за наявності генотипу D/D імовірність виникнення когнітивних порушень становить 83,33 %). При цьому в пацієнтів з ХТЕ носійство алелі D гена ACE асоціюється з вірогідним зниженням кількості балів за шкалою MOCA порівняно з групою пацієнтів, які не є носіями цієї алелі. Щодо розвитку функціональної неспроможності в пацієнтів із ХТЕ, то найбільшу прогностичну цінність має C108T поліморфізм гена PON1 (за наявності генотипу T/T імовірність виникнення функціональної неспроможності становить 41,49 % з вірогідно нижчими значеннями індексу Бартел порівняно з гомозиготами С/С). Висновки. Встановлено, що I/D поліморфізм гена ACE і C108T поліморфізм гена PON1 вірогідно асоціюються з розвитком когнітивних порушень і функціональної неспроможності в пацієнтів з ХТЕ, що свідчить про доцільність подальших досліджень із залученням більшої вибірки пацієнтів.
Background. Predicting the individual risk of developing cognitive impairment and functional disability in everyday life among patients with chronic traumatic encephalopathy (CTE) will allow timely and adequate treatment to prevent dementia. Therefore, the study aimed to develop a mathematical model for predicting the risk of cognitive disorders and functional disability in patients with CTE based on the analysis of polymorphic variants of the ACE, AT2R1, eNOS, ePON1, IL-1β, IL-10, TNF-α genes, as well as cofactors (gender, age group, follow-up, presence/absence of somatic comorbidity). Materials and methods. We examined 145 individuals with CTE who were undergoing inpatient treatment in the Communal Non-Profit Enterprise “Ternopil Regional Clinical Psychoneurological Hospital” in 2021–2022 and were included in the retrospective analysis. The molecular and genetic testing was performed for 26 patients. The molecular and genetic differentiation of the studied polymorphic variants of genes was carried out in the molecular and genetic laboratory of the State Institution “Reference Centre for Molecular Diagnostics of the Ministry of Health of Ukraine” in Kyiv. Cognitive functions were studied using the Montreal Cognitive Assessment (MoCA), activities of daily living — with the Barthel index. Statistical analysis was done using Microsoft Excel and Statistica 13.0 computer software. A logistic regression analysis was performed to determine the likelihood of cognitive impairment and functional disability in patients with CTE. Results. When analyzing polymorphic variants of the ACE, AT2R1, eNOS, ePON1, IL-1β, IL-10, TNF-α genes, as well as such cofactors as gender, age group, follow-up, presence/absence of somatic comorbidity in the context of the development of cognitive disorders in patients with CTE, it has been found that the I/D polymorphism of the ACE gene has the most significant prognostic value (in the presence of the D/D genotype, the probability of cognitive impairment is 83.33 %). At the same time, patients with CTE who were carriers of the D allele of the ACE gene had a significant decrease in the MoCA score compared to the group of those who didn’t carry this allele. Regarding the development of functional disability in patients with CTE, the C108T polymorphism of the PON1 gene has the most significant prognostic value (in the presence of the T/T genotype, the risk of functional disability is 41.49 %, with significantly lower Barthel index compared to the C/C homozygotes). Conclusions. It was found that the I/D polymorphism of the ACE gene and the C108T polymorphism of the PON1 gene are likely associated with the development of cognitive impairment and functional disability in patients with CTE that indicates the feasibility of further studies involving a larger sample of patients.
хронічна травматична енцефалопатія; когнітивна дисфункція; функціональна неспроможність; поліморфізм генів; прогнозування
chronic traumatic encephalopathy; cognitive impairment; functional disability; gene polymorphism; prognosis