Международный эндокринологический журнал Том 19, №5, 2023
Вернуться к номеру
Тиреотоксичний криз: тактика лікаря, профілактика
Авторы: Кваченюк А.М. (1, 4), Рейзін Д.В. (2), Воронова Л.В. (3), Кваченюк К.Л. (1)
(1) — Національний медичний університет ім. О.О. Богомольця, м. Київ, Україна
(2) — Київська міська клінічна лікарня № 8, м. Київ, Україна
(3) — Київський міський консультативно-діагностичний центр, м. Київ, Україна
(4) — Клініка «Медиком», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
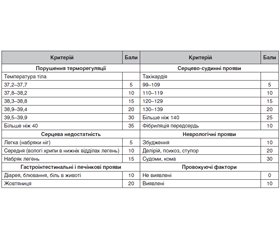
Огляд присвячений одному з найтяжчих критичних станів у практиці ендокринолога — тиреотоксичному кризу (ТК). Наведені сучасні уявлення про етіологію та патогенез цього ускладнення, проаналізовані особливості клінічного перебігу. ТК — це загрозливий для життя стан, що може розвинутися у хворого з некомпенсованим тиреотоксикозом, характеризується різким загостренням його клінічних проявів і прогресуючими розладами гомеостазу; за відсутності адекватного лікування, як правило, завершується летально. Слід узяти за правило: у разі раптового погіршення стану пацієнта з тиреотоксикозом завжди необхідно пам’ятати про можливість розвитку ТК; при цьому на перший план можуть виступати симптоми хвороби, що його спровокувала. Більшість фахівців вважає, що в сумнівних випадках краще помилитися щодо припущення про наявність ТК у даний момент або загрозу його розвитку і все-таки розпочати інтенсивну терапію, аніж проґавити діагноз. Завдяки створенню і впровадженню в широку клінічну практику антитиреоїдних лікарських засобів, β-адреноблокаторів, нейролептиків та інших лікувальних заходів летальність при ТК кардинально знизилася і становить близько 10 %. Вірогідними предикторами песимістичного прогнозу служать прогресуючі гіпертермія, тахіаритмія та порушення діяльності ЦНС, а також приєднання жовтяниці. Смерть може настати внаслідок серцевої та/або дихальної недостатності, шоку, поліорганної недостатності, гіпертермії, дисемінованої внутрішньосудинної коагуляції, сепсису або інших ускладнень. Зрештою, якщо пацієнти виживають, у частини з них спостерігаються необоротні розлади, як-от постгіпоксична енцефалопатія, цереброваскулярна патологія, атрофія м’язів, психози або ниркова недостатність. З урахуванням офіційних міжнародних рекомендацій розглянуті принципи діагностики, лікування та профілактики цього критичного стану. Світовий досвід засвідчує, що невідкладна мультимодальна терапія тиреотоксичного кризу здатна знизити летальність до 10–20 %. Вкрай важливим для лікаря є знання клінічної картини тиреотоксичного кризу чи загрози кризу, що є єдиним правильним підходом до своєчасної діагностики цього небезпечного стану. Чітке дотримання протокольної покрокової схеми лікування тиреотоксичного кризу дозволить значно знизити ускладнення та рівень летальних випадків. Головним у профілактиці розвитку тиреотоксичного кризу є досягнення та підтримання стану компенсації тиреотоксикозу та додавання до комплексної терапії хворих на дифузний тиреотоксичний зоб фітопрепаратів кореня перстачу білого, який має доведений мембраностабілізуючий вплив на тиреоцити та імуномодулюючий вплив на автоімуний патогенез захворювання.
The review deals with one of the most severe critical conditions in the practice of an endocrinologist — thyroid storm (TS). Modern ideas about the etiology and pathogenesis of this complication are given, and the features of the clinical course are analyzed. TS is a life-threatening condition that can develop in a patient with uncompensated thyrotoxicosis, it is characterized by a sharp exacerbation of clinical manifestations and progressive disorders of homeostasis; usually, in the absence of adequate treatment it ends lethally. You should make it a rule: in case of a sudden deterioration in the state of thyrotoxicosis patient, it is always necessary to keep in mind the risk of developing TS; the symptoms of the disease that provoked it may come to the fore. Most experts believe that in doubtful cases it is better to make a mistake in the assumption of TS presence at the moment or the threat of its development and after all to start intensive care than to miss the diagnosis. Owing to the development and introduction of antithyroid drugs, β-adrenoblockers, antipsychotics and other therapeutic measures into wide clinical practice, mortality in TS has dramatically decreased and amounts to about 10 %. Reliable predictors of poor prognosis are progressive hyperthermia, tachyarrhythmia and disorders of the central nervous system, as well as jaundice. Death can occur due to heart and/or respiratory failure, shock, multiple organ failure, hyperthermia, disseminated intravascular coagulation, sepsis or other complications. After all, if patients survive, some of them experience irreversible disorders, such as post-hypoxic encephalopathy, cerebrovascular pathology, muscle atrophy, psychosis, or renal failure. Based on official international guidelines, the principles of diagnosis, treatment and prevention of this critical condition are considered. World experience shows that emergency multimodal therapy of thyroid storm can reduce mortality to 10–20 %. It is extremely important for the doctor to know the clinical picture of thyrotoxic crisis or “threat of crisis”, which is the only correct approach to the timely diagnosis of this dangerous condition. Strict adherence to the protocol step-by-step scheme for the treatment of thyrotoxic crisis will significantly reduce unwanted complications and the rate of deaths. The main thing in the prevention of thyrotoxic crisis is to achieve and maintain a state of compensation of thyrotoxicosis and to add herbal preparations from the root of Potentilla alba to the comprehensive therapy of patients with diffuse thyrotoxic goiter, they have a proven membrane-stabilizing effect on thyrocytes and an immunomodulatory effect on the autoimmune pathogenesis of the disease.
щитоподібна залоза; тиреотоксичний криз; діагностика; лікування; фітотерапія; огляд
thyroid gland; thyroid storm; diagnosis; management; phytotherapy; review
- Taylor P.N., Albrecht D., Scholz A., Gutierrez-Buey G., Laza–rus J.H., Dayan C.M., Okosieme O.E. Global epidemiology of hyperthyroidism and hypothyroidism. Nat. Rev. Endocrinol. 2018 May. 14(5). 301-316. doi: 10.1038/nrendo.2018.18. Epub 2018 Mar 23. PMID: 29569622.
- Guerri G., Bressan S., Sartori M., Costantini A., Benedetti S., Agostini F., Tezzele S., et al. Hypothyroidism and hyperthyroidism. Acta Biomed. 2019 Sep 30. 90(10-S). 83-86. doi: 10.23750/abm.v90i10-S.8765. PMID: 31577260; PMCID: PMC7233645.
- Doubleday A.R., Sippel R.S. Hyperthyroidism. Gland Surg. 2020 Feb. 9(1). 124-135. doi: 10.21037/gs.2019.11.01. PMID: 32206604; PMCID: PMC7082267.
- Kravets I. Hyperthyroidism: Diagnosis and Treatment. Am. Fam. Physician. 2016 Mar 1. 93(5). 363-70. PMID: 26926973.
- Chiha M., Samarasinghe S., Kabaker A.S. Thyroid storm: an updated review. J. Intensive Care Med. 2015 Mar. 30(3). 131-40. doi: 10.1177/0885066613498053. Epub 2013 Aug 5. PMID: 23920160.
- De Almeida R., McCalmon S., Cabandugama P.K. Clinical Review and Update on the Management of Thyroid Storm. Mo Med. 2022 Jul-Aug. 119(4). 366-371. PMID: 36118802; PMCID: PMC9462913.
- de Mul N., Damstra J., Nieveen van Dijkum E.J.M., Fischli S., Kalkman C.J., Schellekens W.M., Immink R.V. Risk of perioperative thyroid storm in hyperthyroid patients: a systematic review. Br. J. Anaesth. 2021 Dec. 127(6). 879-889. doi: 10.1016/j.bja.2021.06.043. Epub 2021 Aug 11. PMID: 34389171.
- Hamed M., Palumbo S., Mendha T. Severe Cardiovascular Effects of Prolonged Untreated Hyperthyroidism Manifesting аs Thyroid Storm. Cureus. 2022 Jun 24. 14(6). e26289. doi: 10.7759/cureus.26289. PMID: 35898385; PMCID: PMC9308973.
- Li X., Chen J., Li Z. PICU treatment of 3 cases of pediatric thyroid storm: Case series and literature review. Medicine (Baltimore). 2023 Apr 7. 102(14). e33447. doi: 10.1097/MD.0000000000033447. PMID: 37026965; PMCID: PMC10082310.
- Amin T., Austin C.P., Udongwo N., Wiseman K., Parhar A.S., Chaughtai S. Iodinated Contrast-Induced Thyroid Storm With Concomitant Cardiac Tamponade: A Case Report. Cureus. 2022 Aug 14. 14(8). e28001. doi: 10.7759/cureus.28001. PMID: 36134087; PMCID: PMC9481223.
- Ross D.S., Burch H.B., Cooper D.S., Greenlee M.C., Laur–berg P., Maia A.L., Rivkees S.A., et al. 2016 American Thyroid Association Guidelines for Diagnosis and Management of Hyperthyroidism and Other Causes of Thyrotoxicosis. Thyroid. 2016 Oct. 26(10). 1343-1421. doi: 10.1089/thy.2016.0229. Erratum in: Thyroid. 2017 Nov. 27(11). 1462. PMID: 27521067.
- Makar R., Pavlovskyi I., Makar O. Thyroid storm: modern understanding, diagnosis and management approaches. International Journal оf Endocrinology (Ukraine). 2022. 16(3). 278-286. https://doi.org/10.22141/2224-0721.16.3.2020.205279.
- Satoh T., Isozaki O., Suzuki A., et al. 2016 Guidelines for the management of thyroid storm from The Japan Thyroid Association and Japan Endocrine Society (First edition). Endocr. J. 2016. 63(12). 1025-1064. doi: 10.1507/endocrj.EJ16-0336.
- Karger S., Führer D. Thyroid storm — thyrotoxic crisis: an update. Dtsch Med. Wochenschr. 2008. 133(10). 479-484. doi: 10.1055/s-2008-1046737 (in German).
- Isozaki O., Satoh T., Wakino S., et al. Treatment and mana–gement of thyroid storm: analysis of the nationwide surveys: The taskforce committee of the Japan Thyroid Association and Japan Endocrine Society for the establishment of diagnostic criteria and nationwide surveys for thyroid storm. Clin. Endocrinol. (Oxf.). 2016. 84(6). 912-918. doi: 10.1111/cen.12949.
- Ylli D., Klubo-Gwiezdzinska J., Wartofsky L. Thyroid emergencies. Pol. Arch. Intern. Med. 2019. 129(7-8). 526-534. doi: 10.20452/pamw.14876.
- Desai D., Zahedpour Anaraki S., Reddy N., Epstein E., Tabatabaie V. Thyroid Storm Presenting as Psychosis. J. Investig. Med. High Impact Case Rep. 2018. 6. 2324709618777014. doi: 10.1177/2324709618777014.
- Kahaly G.J., Bartalena L., Hegedüs L., Leenhardt L., Pop–pe K., Pearce S.H. 2018 European Thyroid Association Guideline for the Management of Graves’ Hyperthyroidism. Eur. Thyroid J. 2018. 7(4). 167-186. doi: 10.1159/000490384.
- Augustynowicz D., Latté K.P., Tomczyk M. Recent phyto–chemical and pharmacological advances in the genus Potentilla L. sensu lato — An update covering the period from 2009 to 2020. J. Ethnopharmacol. 2021 Feb 10. 266. 113412. doi: 10.1016/j.jep.2020.113412. Epub 2020 Sep 25. PMID: 32987127.
- Pankiv V. Thyrotoxicosis syndrome: new clinical opportunities for the correction of thyroid dysfunction. International Journal оf Endocrinology (Ukraine). 2020. 16(1). 58-62. https://doi.org/10.22141/2224-0721.16.1.2020.199129.
- Augustynowicz D., Podolak M., Latté K.P., Tomczyk M. New Perspectives for the Use of Potentilla alba Rhizomes to Treat Thyroid Gland Impairments. Planta Med. 2023 Jan. 89(1). 19-29. doi: 10.1055/a-1663-6461. Epub 2021 Oct 29. PMID: 34715695.
- Pankiv V., Gurianov V., Petrovska L. Dynamics of thyroid gland sizes in patients with diffuse and nodular goiter, autoimmune thyroiditis during monotherapy by Alba® preparation in different regions of Ukraine. International Journal оf Endocrinology (Ukraine). 2017. 13(8). 526-535. https://doi.org/10.22141/2224-0721.13.8.2017.119265.
- Камінський О.В., Кісельова І.А., Тепла Е.В. Клінічні можливості застосування перстачу білого в профілактиці і лікуванні патології щитоподібної залози. Ендокринологія. 2014. 1. 68-75.
- Кваченюк А.М., Кваченюк К.Л. Використання фітотерапії при лікуванні захворювань щитоподібної залози. Лікарська справа. 2012. 1–2. 1-4.
- Jain R.B. Thyroid function and serum copper, selenium, and zinc in general U.S. population. Biol. Trace Elem. Res. 2014. 159 (1–3). 87-98. doi: 10.1007/s12011-014-9992-9.
- Ylli D., Wartofsky L., Burman K.D. Evaluation and Treatment of Amiodarone-Induced Thyroid Disorders. J. Clin. Endocrinol. Metab. 2021 Jan 1. 106(1). 226-236. doi: 10.1210/clinem/dgaa686. PMID: 33159436.
- Elnaggar M.N., Jbeili K., Nik-Hussin N., Kozhippally M., Pappachan J.M. Amiodarone-Induced Thyroid Dysfunction: A Clinical Update. Exp. Clin. Endocrinol. Diabetes. 2018 Jun. 126(6). 333-341. doi: 10.1055/a-0577-7574. Epub 2018 Mar 20. Erratum in: Exp. Clin. Endocrinol. Diabetes. 2018 Jun. 126(6). e1. PMID: 29558786.
- Medić F., Bakula M., Alfirević M., Bakula M., Mucić K., Marić N. Amiodarone аnd Thyroid Dysfunction. Acta Clin. Croat. 2022 Aug. 61(2). 327-341. doi: 10.20471/acc.2022.61.02.20. PMID: 36818930; PMCID: PMC9934045.

/99.jpg)
/100.jpg)