Международный эндокринологический журнал Том 19, №5, 2023
Вернуться к номеру
Підтримка вагінального здоров’я при дисгормональних порушеннях у жінок
Авторы: Єфіменко О.О.
Державна наукова установа «Центр інноваційних медичних технологій НАН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
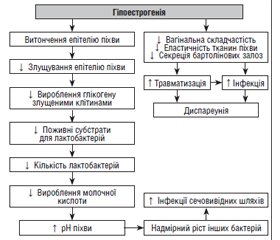
Зміни рівня гормонів на різних етапах життя жінки можуть призвести до порушення функції вульвовагінальної ділянки. У статті описано причини і патогенез вагінального дискомфорту і сухості піхви, пов’язаних зі змінами гормонального профілю. Особливий акцент зроблено на генітоуринарному менопаузальному синдромі (ГУМС), який є найпоширенішою причиною сухості піхви. Основна терапевтична мета при вагінальних проявах гормонального дисбалансу — полегшення симптомів і відновлення вагінального середовища. Вагінальні зволожувачі, що містять гіалуронову кислоту (ГК), визнаються однією з найефективніших стратегій для досягнення цієї мети. Ефективність і безпека використання ГК при ГУМС продемонстрована в рандомізованих контрольованих клінічних дослідженнях і систематичних оглядах, вона порівнянна з ефективністю застосування естрогенів або плацебо. Це можлива альтернатива для жінок, які не можуть або не хочуть використовувати гормональне лікування. На ринку України наявний вагінальний зволожуючий засіб на основі ГК у вигляді вагінальних свічок (супозиторіїв) Верікса, що має регенеративні, антисептичні, протизапальні й імуностимулюючі властивості та використовується для швидкого відновлення і зволоження слизової оболонки піхви та шийки матки. Свічки Верікса позитивно впливають на відновлювальну, протизапальну й дозрівальну функції слизової оболонки піхви, сприяють усуненню суб’єктивних і клінічних проявів захворювання і профілактиці вагінальних інфекцій і запобігають рецидивуванню проявів атрофічного вагініту. Отже, застосування місцевих засобів з ГК, зокрема вагінальних свічок Верікса, може бути перспективною та ефективною терапевтичною опцією для вагінального зволоження і підтримання вагінального здоров’я на різних етапах життя жінок.
Changes in the level of hormones at various periods of a woman’s life can lead to dysfunction of the vulvovaginal region. The article describes the causes and pathogenesis of vaginal discomfort and vaginal dryness associated with changes in the hormonal level. Special emphasis is made on the genitourinary syndrome of menopause, which is the most common cause of vaginal dryness. The main therapeutic goal in vaginal manifestations of hormonal imbalance is to relieve symptoms and restore the vaginal environment. Vaginal moisturizers containing hyaluronic acid (HA) are recognized as one of the most effective strategies for achieving this goal. The effectiveness and safety of HA use in the genitourinary syndrome of menopause has been demonstrated in randomized controlled clinical trials and systematic reviews and is comparable to the effectiveness of estrogen or placebo. It is a possible alternative for women who cannot or do not want to use hormone therapy. Ukrainian Verixa™ vaginal suppositories is a vaginal moisturizer based on HA, it has regenerative, antiseptic, anti-inflammatory and immunostimulating properties and is used to quickly restore and moisturize the mucous membrane of the vagina and cervix. The obtained data show that Verixa™ suppositories have a positive effect on the restorative, anti-inflammatory and maturing functions of the vaginal mucosa, contribute to the elimination of subjective and clinical manifestations of the disease, prevent vaginal infections and the recurrence of manifestations of atrophic vaginitis. Thus, the use of topical HA products, in particular Verixa™ vaginal suppositories, can be a promising and effective therapeutic option for moisturizing and maintaining vaginal health at various stages of women’s lives.
гормональні порушення; жінки; зволоження; сухість піхви; вагінальні супозиторії
hormonal disorders; women; moisturizing; vaginal dryness; vaginal suppositories
/66.jpg)
Висновки
- Pérez-López F.R. et al. Management of postmenopausal vulvovaginal atrophy: recommendations of the International Society for the Study of Vulvovaginal Disease. Gynecol. Endocrinol. 2021 Aug. 37(8). 746-752. doi: 10.1080/09513590.2021.1943346.
- Henneicke-von Zepelin H.H. et al. Clinical trial shows las–ting function of a new moisturizing cream against vaginal dryness. Wien Med. Wochenschr. 2017 May. 167(7-8). 189-195. English. doi: 10.1007/s10354-016-0536-0.
- Edwards D., Panay N. Treating vulvovaginal atrophy/geni–tourinary syndrome of menopause: how important is vaginal lubricant and moisturizer composition? Climacteric. 2016 Apr. 19(2). 151-61. doi: 10.3109/13697137.2015.1124259.
- Carati D. et al. Safety, efficacy, and tolerability of differential treatment to prevent and treat vaginal dryness and vulvovaginitis in diabetic women. Clin. Exp. Obstet. Gynecol. 2016. 43(2). 198-202.
- Cagnacci A. et al.; writing group of the ANGEL study. Vaginal atrophy across the menopausal age: results from the ANGEL study. Climacteric. 2019 Feb. 22(1). 85-89. doi: 10.1080/13697137.2018.–1529748.
- Calik-Ksepka A. et al. Signs and symptoms, evaluation, and management of genitourinary tract consequences of premature ova–rian insufficiency. Prz Menopauzalny. 2018 Sep. 17(3). 131-134. doi: 10.5114/pm.2018.78558.
- Kingsberg S.A. et al. Vulvar and vaginal atrophy in postmenopausal women: findings from the REVIVE (REal Women’s VIews of Treatment Options for Menopausal Vaginal ChangEs) survey. J. Sex. Med. 2013. 10. 1790-9
- Portman D.J., Gass M.L.; Vulvovaginal Atrophy Terminology Consensus Conference Panel. Genitourinary syndrome of menopause: new terminology for vulvovaginal atrophy from the International Society for the Study of Women’s Sexual Health and the North American Menopause Society. Menopause. 2014 Oct. 21(10). 1063-8. doi: 10.1097/GME.0000000000000329.
- Gandhi J. et al. Genitourinary syndrome of menopause: an overview of clinical manifestations, pathophysiology, etiology, eva–luation, and management. Am. J. Obstet. Gynecol. 2016 Dec. 215(6). 704-711. doi: 10.1016/j.ajog.2016.07.045.
- Potter N., Panay N. Vaginal lubricants and moisturizers: a review into use, efficacy, and safety. Climacteric. 2021 Feb. 24(1). 19-24. doi: 10.1080/13697137.2020.1820478.
- Hendaria M.P., Maylita Sari M. The Role of Topical Treatment on Vaginal Tightening. Periodical of Dermatology and Venereology Dec. 2022. Vol. 34. № 3. doi:10.20473/bikk.V34.3.2022.203-209.
- Nappi R.E., Panay N., Bruyniks N. et al. The clinical relevance of the effect of ospemifene on symptoms of vulvar and vaginal atrophy. Climacteric. 2015. 18(2). 233-240.
- Palacios S., Nappi R.E., Bruyniks N. et al. The European Vulvovaginal Epidemiological Survey (EVES): prevalence, symptoms and impact of vulvovaginal atrophy of menopause. Climacteric. 2018. 21(3). 286-291.
- Simon J.A. et al. Vaginal health in the United States: results from the Vaginal Health: Insights, Views & Attitudes survey. Menopause. 2013. 20. 1043-8
- Високомолекулярна гіалуронова кислота: природний компонент у терапії менопаузального синдрому. Здоров’я України. Тематичний номер «Акушерство. Гінекологія. Репродуктологія». 2022. № 3–4 (49–50).
- Society of Obstetricians and Gynaecologists of Canada. SOGC clinical practice guidelines. The detection and management of vaginal atrophy. Number 145, May 2004. Int. J. Gynaecol. Obstet. 2005 Feb. 88(2). 222-8. doi: 10.1016/j.ijgo.2004.11.003.
- NAMS. Management of symptomatic vulvovaginal atrophy: 2013 position statement of The North American Menopause Society. Menopause. 2013. 20(9). 888-902
- Nappi R.E. et al. Effectiveness of hyaluronate-based pessaries in the treatment of vulvovaginal atrophy in postmenopausal wo–men. Climacteric. 2020 Oct. 23(5). 519-524. doi: 10.1080/13697137.–2020.1754386.
- Pilotto L., Gennari G., Zanellato A.M. Pharmaceutical compositions with hydrating and lubricating activity. U.S., 2017 Patent Application no. 15/038,924.
- Dos Santos C.C.M. et al. Hyaluronic Acid in Postmenopause Vaginal Atrophy: A Systematic Review. J. Sex Med. 2021 Jan. 18(1). 156-166. doi: 10.1016/j.jsxm.2020.10.016.
- Costantino D., Guaraldi C. Effectiveness and safety of vaginal suppositories for the treatment of the vaginal atrophy in postmenopausal women: an open, non-controlled clinical trial. Eur. Rev. Med. Pharmacol. Sci. 2008 Nov-Dec. 12(6). 411-6.
- Romanò C.L. et al. Hyaluronic Acid and Its Composites as a Local Antimicrobial/Antiadhesive Barrier. J. Bone Jt Infect. 2017 Jan 1. 2(1). 63-72. doi: 10.7150/jbji.17705.
- Zamboni F., Wong C.K., Collins M.N. Hyaluronic acid association with bacterial, fungal and viral infections: Can hyaluronic acid be used as an antimicrobial polymer for biomedical and pharmaceutical applications? Bioact. Mater. 2022 May 2. 19. 458-473. doi: 10.1016/j.bioactmat.2022.04.023.
- Parolin C. et al. Anti-Candida Activity of Hyaluronic Acid Combined with Lactobacillus crispatus Lyophilised Supernatant: A New Antifungal Strategy. Antibiotics (Basel). 2021 May 25. 10(6). 628. doi: 10.3390/antibiotics10060628.
- Casale M. et al. Hyaluronic acid: Perspectives in dentistry. A systematic review. Int. J. Immunopathol. Pharmacol. 2016 Dec. 29(4). 572-582. doi: 10.1177/0394632016652906.
- Litwiniuk M. et al. Hyaluronic Acid in Inflammation and Tissue Regeneration. Wounds. 2016 Mar. 28(3). 78-88.
- Torretta S. et al. Topical administration of hyaluronic acid in children with recurrent or chronic middle ear inflammations. Int. J. Immunopathol. Pharmacol. 2016 Sep. 29(3). 438-42. doi: 10.1177/0394632016656012.
- Buzzaccarini G. et al. Hyaluronic acid in vulvar and vagi–nal administration: evidence from a literature systematic review. Climacte–ric. 2021 Dec. 24(6). 560-571. doi: 10.1080/13697137.2021.–1898580.
- Trémollieres F.A. et al. Management of postmenopausal women: Collège National des Gynécologues et Obstétriciens Français (CNGOF) and Groupe d’Etude sur la Ménopause et le Vieillissement (GEMVi) Clinical Practice Guidelines. Maturitas. 2022 Sep. 163. 62-81. doi: 10.1016/j.maturitas.2022.05.008.
- Інформація до застосування ВЕРІКСА свічки (супозиторії) для відновлення слизової оболонки піхви. https://behealth.com.ua/veriksa/
- Molazem Z. et al. Aloe vera gel and cesarean wound healing; a randomized controlled clinical trial. Glob. J. Health Sci. 2014 Aug 31. 7(1). 203-9. doi: 10.5539/gjhs.v7n1p203.
- Ratz-Łyko A., Arct J., Pytkowska K. Moisturizing and Antiinflammatory Properties of Cosmetic Formulations Containing Centella asiatica Extract. Indian J. Pharm. Sci. 2016 Jan-Feb. 78(1). 27-33. doi: 10.4103/0250-474x.180247.
- Lu L. et al. Asiaticoside induction for cell-cycle progression, proliferation and collagen synthesis in human dermal fibroblasts. Int. J. Dermatol. 2004 Nov. 43(11). 801-7. doi: 10.1111/j.1365-4632.2004.02047.x.
- Cosentino D., Piro F. Hyaluronic acid for treatment of the radia–tion therapy side effects: a systematic review. Eur. Rev. Med. Pharmacol Sci. 2018 Nov. 22(21). 7562-7572. doi: 10.26355/eurrev_201811_16298.
- Wierzbicka A. et al. Interventions Preventing Vaginitis, Vagi–nal Atrophy after Brachytherapy or Radiotherapy Due to Malignant Tumors of the Female Reproductive Organs-A Systematic Review. Int. J. Environ. Res. Public Health. 2021 Apr 8. 18(8). 3932. doi: 10.3390/ijerph18083932.
- Бенюк В.О., Курочка В.В., Олешко В.Ф., Момот А.А. Cучасний комплексний підхід у лікуванні атрофічного вагініту у жінок менопаузального віку. Репродуктивне здоров’я жінки. 2022. № 5(60).
- Barrett G. et al. Women’s sexual health after childbirth. BJOG. 2000 Feb. 107(2). 186-95. doi: 10.1111/j.1471-0528.2000.tb11689.x.