Журнал «Здоровье ребенка» Том 18, №2, 2023
Вернуться к номеру
Ентеробіоз як фактор агресії запальних процесів сечової та нижніх відділів статевої системи в дівчаток і підлітків (огляд літератури і власні випадки)
Авторы: Склярова В.О. (1, 2), Чайківський Р.А. (1), Коцабин Н.В. (3), Железняков О.Ю. (4), Кишакевич І.Т. (5)
(1) — Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
(2) — Львівський обласний госпіталь інвалідів війни та репресованих ім. Ю. Липи, м. Львів-Винники, Україна
(3) — Медичний центр репродуктивного здоров’я «ДАМІЯ», м. Івано-Франківськ, Україна
(4) — Харківський міський перинатальний центр, м. Харків, Україна
(5) — Івано-Франківський національний медичний університет, м. Івано-Франківськ, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
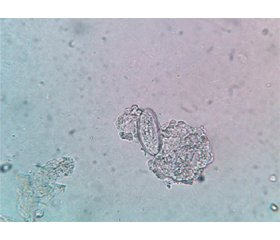
Метою даного дослідження є аналіз епідеміологічної ситуації з ентеробіозу серед дівчат з патологією сечової системи і при ураженнях нижніх відділів статевої системи за даними баз літератури (PubMed, Google Scholar, ResearchGate, PLoS, Hindawi) та висвітлення результатів власних клінічних спостережень. Ми опрацювали понад 200 робіт, присвячених впливу ентеробіозу на розвиток апендициту, близько 70 робіт про виявлення відповідного паразита в жіночій репродуктивній системі і близько 50 публікацій щодо його виявлення в сечовидільній системі. Ми подали 4 клінічні спостереження щодо наявності ентеробіозу в дівчаток і підлітків. Навели фотографії гостриків у центрифугаті сечі й у нижніх відділах жіночої статевої системи з описами негативних впливів паразита на здоров’я дівчаток і підлітків. Ентеробіоз може бути першочерговим чинником хронічних запальних процесів сечової системи та нижніх відділів статевих шляхів у дівчаток і підлітків.
The objective is to study the epidemiological situation on enterobiasis among girls with urinary system pathology and lesions of the lower parts of the reproductive system by analyzing literature databases (PubMed, Google Scholar, ResearchGate, PLoS, Hindawi) and to consider the results of our own clinical observations. We have processed more than 200 works on the effect of enterobiasis on the development of appendicitis, about 70 works on the detection of this parasite in the female reproductive system, and about 50 publications on enterobiasis in the urinary system. We presented 4 clinical cases on the presence of enterobiasis in girls and adolescents. We provided photos of pinworms in the urine centrifuge and in the lower parts of the female reproductive system with descriptions of the negative effects of the parasite on the health of girls and adolescents. Enterobiasis can be a primary factor in chronic inflammatory processes of the urinary system and the lower genital tract in girls and adolescents.
ентеробіоз; сеча; вульва; дівчатка; підлітки; запалення
enterobiasis; urine; vulva; girls; adolescents; inflammation
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Abdolrasouli A., Roushan А., Hart J. Enterobius vermicularis infection of female genital tract. Sex Transm. Infect. 2013. 89(1). 37.
- Abdulsada A. Rahi, Nibras K. Khlaif. Pinworm infection and urogenital tract infection in girls of Wasit province. Journal of Critical Reviews. 2020. 7. 2196-2201.
- Babat S.O., Sirekbasan S., Macin S. et al. Diagnostics of intestinal parasites by light microscopy among the population of children between the ages of 4–12 in eastern Turkey. Trop. Biomed. 2018. 35(4). 1087-1091.
- Bouchaud O. Circumstances for diagnosis and treatment of intestinal parasitosis in France. La Presse Medicale. 2013. 42(1). 84-92.
- Chambliss A.B., Mason H.M., Van T.T. Correlation of chemical urinalysis to microscopic urinalysis and urine culture: implications for reflex urinalysis workflows. J. Appl. Lab. Med. 2020. 5(4). 724-731.
- Chin Tan G., Stalling M., Boue D. et al. That’s not supposed to be there: an unusual finding on urinalysis. Clin. Chem. 2017. 63(10). 1660-1661.
- Choudhury S., Kumar B., Pal D.K. Enterobius vermicularis infestation of urinary tract leading to recurrent urinary tract infection. Trop. Parasitol. 2017. 7(2). 119-121
- Cociancic P., Rinaldi L., Zonta M.L., Navone G.T. Formali–nethyl acetate concentration, FLOTAC Pellet and anal swab techniques for the diagnosis of intestinal parasites. Parasitol. Res. 2018. 117(11). 3567-3573.
- Cymerman R.M., Kaplan Hoffmann R., Rouhani Schaffer P., Pomeranz M.K. Vulvar infections: beyond sexually transmitted infections. Int. J. Dermatol. 2017. 56(4). 361-369.
- de Toro-Peinado I., Concepción Mediavilla-Gradolph M., Tormo-Palop N., Palop-Borrás B. Diagnóstico microbiológico de las infecciones urinarias. Enferm. Infecc. Microbiol. Clin. 2015. 33 Suppl. 2. 34-9.
- Dos Santos V.M. Enterobius vermicularis: uncommon clinical presentations. Arch. Iran Med. 2019. 22(2). 104-105.
- Eder T.I.B., B.A. S.W., Lipek T. Extraintestinal Oxyuriasis. Dtsch Arztebl. Int. 2018. 115(18). 326.
- Egli A., Schrenzel J., Greub G. Digital microbiology. Clin. Microbiol. Infect. 2020. 26(10). 1324-1331.
- Ermolenko A., Rumiantseva E., Bartkova A., Voronok V., Poliakova L. Nematodes of humans in the Primorye Territory. Medical Parasitology. 2013. 1. 31-4.
- Intra J., Sarto C., Manuli E. et al. Multiple Parasitic Infestation in a Nine-month-old Patient: A Case Report. Helminthologia. 2019. 56(1). 53-56.
- Gunaratna G.P., Dempsey S., Ho C., Britton P.N. Diagnosis of enterobius vermicularis infestations. J. Paediatr. Child Health. 2020. 56(12). 1994.
- Kang W.H., Jee S.C. Enterobius vermicularis (Pinworm) Infection. N. Engl. J. Med. 2019. 381(1). e1.
- Khalbuss W.E., Michelow P., Benedict C. et al. Cytomorphology of unusual infectious entities in the Pap test. Cytojournal. 2012. 9. 15.
- Khurana U., Majumdar K., Kapoor N. et al. Spectrum of parasitic infections in centrifuged urine sediments from a newly deve–loped tertiary care centre in Central India. J. Parasit Dis. 2018. 42(4). 608-615.
- Kim D., Cho M., Park M.R. et al. Environmental factors related to enterobiasis in a southeast region of Korea. Korean Journal of Parasito–logy. 2014. 51(1). 139-42.
- Kolman K.B. Cystitis and Pyelonephritis: Diagnosis, Treatment, and Prevention. Prim. Care. 2019. 46(2). 191-202.
- Kyu Choi S., Kyung Kim E., Hong Y.O. et al. Enterobius vermicularis ova in a vaginal smear Korean J. Pathol. 2010. 44. 341-42.
- Lau R., Chris R.B., Phuong M.S. et al. Treatment of soil-transmitted helminth infections in pregnancy: a systematic review and meta-analysis of maternal outcomes. J. Travel. Med. 2020. 14. 41-2.
- Mentessidou A., Theocharides C., Patoulias I., Panteli C. Enterobius Vermicularis-Associated Pelvic Inflammatory Disease in a Child. J. Pediatr. Adolesc. Gynecol. 2016. 29(2). e25-27.
- Neghina R., Dumitrascu V., Neghina A. et al. Epidemiology of ascariasis, enterobiasis and giardiasis in a Romanian western county (Timis), 1993–2006. Acta Tropica. 125 (1). 98-101.
- Ng Y., Ng S., Low J. Enterobius vermicularis infestation of the endometrium — a cause of menstrual irregularity and review of literature. Annals of the Academy of Medicine Singapore. 2011. 40(11). 514-5.
- Özdil K., Karataş N., Zincir H. Low socioeconomic level and enterobius vermicularis: A interventional study to children and their mothers in home. Zoonoses Public Health. 2020. 67(8). 882-891.
- Patel B., Sharma T., Bhatt G.C., Dhingra Bhan B. Enterobius vermicularis: an unusual cause of recurrent urinary tract infestation in a 7-year-old girl: case report and review of the literature. Trop. Doct. 2015. 45(2). 132-134.
- Powell G., Sarmah P., Sethi B., Ganesan R. Enterobius vermicularis infection of the ovary. BMJ Case Rep. 2013.
- Reddy Y.P.S., Senthil Kumaran S., Vanka V. et al. Abdominal pain — a common presentation with unusual diagnosis: a case report. J. Community Hosp. Intern. Med. Perspect. 2020. 10(6). 604-608.
- Reipen J., Becker C., William M. et al. Peritoneal enterobiasis causing endometriosis-like symptoms. Clinical and Experimental Obstetrics and Gynecology. 2012. 39(3). 379-81.
- Rizvi G., Rawat V., Pandey H.S., Kumar M. Acute abdomen: An uncommon presentation of a common intestinal nematode. Trop. Parasitol. 2015. 5(2). 123-26.
- Serpytis M., Seinin D. Fatal case of ectopic enterobiasis: Enterobius vermicularis in the kidneys. Scandinavian Journal of Urology and Nephrology. 2011. 46(1). 70-2.
- Sklyarova V.O. Еpidemiological features of parasitary invasis in women of reproductive age with disorders of reproductive health. Wiad. Lek. 2018. 71 (3 pt 2). 674-677.
- Sklyarova V.O. Vaginal Microbiocinosis in Women with Inferti–lity and Parasite Invasion. International STD Research & Reviews. 2015. 3. 123-130.
- Sklyarova V., Shatylovich K., Sklyarov P., Filipyuk A. Should ascariasis be considered as a reproductology problem. Wiad. Lek. 2021. 74 (9 p. I)
- Sumanto D., Sayono S., Mudawamah P.L. Enterobius vermicularis larvae in urine sample of female student: The first case report in Indonesia. J. Microbiol. Exp. 2021. 9(1). 1-2.
- Taghipour A., Olfatifar M., Javanmard E. et al. The neglected role of Enterobius vermicularis in appendicitis: A systematic review and meta-analysis. PLoS One. 2020. 15(4). e0232143
- Yang C.A., Liang C., Lin C.L. et al. Impact of Enterobius vermicularis infection and mebendazole treatment on intestinal microbiota and host immune response. PLoS Negl. Trop. Dis. 2017. 11(9).
- Yang S., Wang J., Shi D. et al. Polyparasitism of Rhabditis Axei and Enterobius Vermicularis in a Child from Beijing, China. Clin. Lab. 2018. 64(10). 1773-76.
- Young C., Tataryn I., Kowalewska-Grochowska K.T., Balachandra B. Enterobius vermicularis infection of the fallopian tube in an infertile female. Pathol. Res. Pract. 2010. 15(6). 405-7.
- Wendt S., Trawinski H., Schubert S. et al. The Diagnosis and Treatment of Pinworm Infection. Dtsch Arztebl. Int. 2019. 116(13). 213-219.
- Zouari M., Mhiri R. Enterobius Vermicularis: Uncommon Clinical Presentations. Arch. Iran Med. 2019. 22(2). 106.

/71.jpg)
/72.jpg)
/73.jpg)