Журнал «» Том 16, №1-2, 2023
Вернуться к номеру
Каротидний атеросклероз і Н-тип артеріальної гіпертензії
Авторы: Рековець О.Л., Сіренко Ю.М., Торбас О.О., Кушнір С.М., Примак Г.Ф.
ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска»
НАМН України», м. Київ, Україна
Рубрики: Кардиология
Разделы: Клинические исследования
Версия для печати
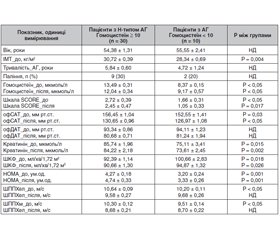
Актуальність. Атеросклеротичне ураження сонних артерій є важливим фактором ризику серцево-судинних захворювань. Останнім часом все більше доказів того, що артеріальна гіпертензія (АГ) зустрічається в поєднанні з гіпергомоцистеїнемією (ГГЦ) і може бути виявлена одночасно з бляшками в сонних артеріях, що впливає на прогноз подальших серцево-судинних подій. Мета: визначення зв’язку атеросклеротичного ураження каротидних артерій з наявністю артеріальної гіпертензії та гіпергомоцистеїнемії. Матеріали та методи. Наше дослідження було виконано в рамках дослідження ХІПСТЕР в Україні. У дослідження було включено 40 пацієнтів з I і II ступенем АГ (середній рівень офісного систолічного (САТ) і діастолічного артеріального тиску (ДАТ) — 155,88 ± 1,63 мм рт.ст. і 92,60 ± 1,43 мм рт.ст. відповідно). Середній вік хворих становив 55,85 ± 2,09 (26–74) року. Пацієнтів з рівнем гомоцистеїну ≥ 10 мкмоль/л визначали як пацієнтів із ГГЦ (Н-тип АГ). Жорсткість судин визначали за швидкістю поширення пульсової хвилі (ШППХ). Пацієнтам проводили дослідження на початку і через 6 місяців лікування. Визначення наявності атеросклерозу каротидних артерій проводили на початку і через 12 місяців спостереження. Результати. Нами виявлено, що oфісний САТ у пацієнтів з Н-типом АГ на початку і через 6 місяців лікування був вищим порівняно з пацієнтами без ГГЦ (156,45 ± 1,04 мм рт.ст. проти 152,55 ± 1,41 мм рт.ст. на початку (р < 0,05) і 130,65 ± 0,96 мм рт.ст. проти 126,97 ± 1,08 мм рт.ст. через 6 місяців (р < 0,05)). Пацієнти з Н-типом АГ порівняно з пацієнтами без ГГЦ мали більш виражений ступінь інсулінорезистентності (індекс НОМА 4,27 ± 0,18 ум.од. проти 3,20 ± 0,24 ум.од., р < 0,05). Атеросклеротичні бляшки в сонних артеріях було виявлено в 56,7 % (n = 17) пацієнтів із Н-типом АГ і 40,0 % (n = 4) пацієнтів з АГ без ГГЦ (p < 0,05 між групами). Пацієнти з Н-типом АГ мали більшу поширеність каротидного атеросклерозу — площа атеросклеротичної бляшки, виміряна за NASCET, становила 43,4 % проти 26,7 % (p < 0,05) і була більшою, ніж у пацієнтів з АГ без ГГЦ. Нові атеросклеротичні бляшки через 12 місяців було виявлено в 3 пацієнтів (10,0 %) із Н-типом АГ і не було виявлено в жодного пацієнта з групи АГ без ГГЦ. При проведенні регресійного аналізу рівень гомоцистеїну в сироватці крові асоціювався з ШППХ незалежно від зниження артеріального тиску на фоні терапії, а також із рівнем холестерину ліпопротеїдів низької щільності й наявністю атеросклеротичних бляшок у сонних артеріях. Гомоцистеїн був пов’язаний із ШППХ артеріями еластичного типу після лікування (β = 0,307; Р = 0,001), холестерином ліпопротеїдів низької щільності до лікування (β = –1,501; Р = 0,017), наявністю атеросклеротичних бляшок після лікування (β = 5,236; Р = 0,031). Висновки. Атеросклеротичне ураження сонних артерій було пов’язане з Н-типом артеріальної гіпертензії.
Background. Atherosclerosis of the carotid arteries is an important risk factor for cardiovascular diseases. Recently, there is increasing evidence that hypertension occurs in combination with yperhomocysteinemia and can be detected simultaneously with plaques in the carotid arteries, which affects the prognosis of subsequent cardiovascular events. The purpose was to determine the relationship between hypertension and hyperhomocysteinemia and the presence of atherosclerotic plaques in the carotid arteries. Materials and methods. Our research was carried out within the framework of the HIPSTER trial in Ukraine. It included 40 patients with hypertension stage I and II (average office systolic/diastolic blood pressure of 155.88/92.60 ± 1.63/1.43 mmHg, respectively). The average age of the patients was 55.85 ± 2.09 (26–74) years. Patients with homocysteine level ≥ 10 μmol/L were defined as patients with hyperhomocysteinemia (H-type hypertension). Vascular stiffness was detected by the pulse wave velocity (PWV). Patients were examined at baseline and after 6 months of treatment. Atherosclerosis of the carotid arteries was detected at baseline and after 12 months. Results. We found that office blood pressure in patients with H-type hypertension at baseline and after 6 months of treatment was higher compared to those without hyperhomocysteinemia (156.45 ± 1.04 mmHg vs. 152.55 ± 1.41 mmHg at baseline (p < 0.05) and 130.65 ± 0.96 mmHg vs. 126.97 ± 1.08 mmHg after 6 months; p < 0.05). Patients with H-type hypertension compared to people without hyperhomocysteinemia had a more severe insulin resistance (HOMA of 4.27 ± 0.18 vs. 3.20 ± 0.24 units, p < 0.05). Atherosclerotic plaques in carotid arteries were found in 17 (56.7 %) patients with H-type hypertension and in 4 (40.0 %) people with hypertension without hyperhomocysteinemia (p < 0.05 between groups). Patients with H-type hypertension had a higher prevalence of carotid atherosclerosis: atherosclerotic plaque area according to the NASCET criteria was 43.4 vs. 26.7 % (p < 0.05) and was greater than in patients with hypertension without hyperhomocysteinemia. Three (10.0 %) patients with H-type hypertension developed new atherosclerotic plaques after 12 months, and no hypertensive patients without hyperhomocysteinemia had them. After regression analysis, serum homocysteine level was associated with PWV regardless of the reduction of blood pressure on the background of therapy, as well as with the level of low-density lipoprotein cholesterol and the presence of atherosclerotic plaques in the carotid arteries. Homocysteine was associated with PWV in elastic arteries after treatment (β = 0.307; P = 0.001), low-density lipoprotein cholesterol before treatment (β = — 1.501; P = 0.017), and the presence of atherosclerotic of plaques in carotid arteries after treatment (β = 5.236; P = 0.031). Conclusions. Atherosclerosis of the carotid arteries was associated with H-type hypertension.
Н-тип артеріальної гіпертензії; гіпергомоцистеїнемія; жорсткість судинної стінки; атеросклероз сонних артерій
H-type hypertension; hyperhomocysteinemia; vascular stiffness; atherosclerosis of carotid arteries