Психосоматична медицина, або консультативно-зв’язкова психіатрія, на сьогодні виступає промоутером мультидисциплінарної організації охорони здоров’я, що долає штучні кордони традиційних медичних спеціальностей і забезпечує концептуальну основу для персоніфікованого й цілісного підходу до курації пацієнта з додаванням психосоціальної оцінки до стандартного медичного обстеження соматичного пацієнта, а також для інтеграції психологічної та психіатричної терапії в профілактику, лікування й реабілітацію будь-якого захворювання [1]. Ідучи корінням у загальну медицину, психосоматика змушена постійно розширювати свої межі, що неминуче приводить до пошуків нових шляхів надання комплексної медичної допомоги пацієнтам багатопрофільних лікарень.
Роль стресу в розвитку соматичних хвороб
Психосоматична медицина, за сучасними поглядами, є холістичним методом лікування і наукою про взаємовідношення й взаємовплив психічних і соматичних процесів, що тісно пов’язують людину з оточуючим середовищем. Сучасне поняття психосоматичних розладів значно перевищує межі «класичних» психосоматозів. Колись до психосоматичних розладів відносили сім патологічних станів: есенціальну гіпертензію, тиреотоксикоз, атопічний дерматит, бронхіальну астму, деякі форми ревматоїдного артриту, виразковий неспецифічний коліт і виразкову хворобу, але зараз у регістр психосоматичного реагування включені поширені захворювання серцево-судинної системи, велика кількість захворювань опорно-рухового апарату, шкіри, урогенітальної сфери, мігрень тощо [2].
Для сучасної медицини вже є типовим екстраполювання консультативної психіатричної допомоги в загальну практику, що обумовлено почастішанням психічних розладів в осіб із соматичними хворобами, недостатньою ефективністю їх діагностики і негативним впливом психопатологічної складової на прояв і перебіг соматичного захворювання, а також необхідністю розробки й застосування адекватних лікувально-профілактичних і реабілітаційних заходів, заснованих на інтегральному міждисциплінарному підході.
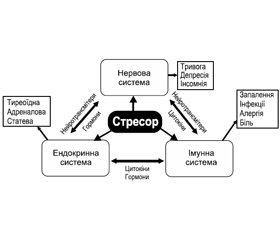
З позицій сучасної психосоматики фізіологічною основою реакції на стрес є дифузна нейроімуноендокринна система (DNIES) — універсальна система реагування на стресорні фактори, контролю й захисту організму (рис. 1) [3].
Роль дистресу у виникненні багатьох захворювань є визнаною, але ще залишаються нез’ясованими багато шляхів впливу стресових і травматичних ситуацій на організм людини, тому численні дослідження, у тому числі щодо наслідків пандемії COVID-19 і самої коронавірусної хвороби, а також впливу дистресу війни на психосоматичне здоров’я, тривають і зараз [4].
Зрушення стресіндукованої нейроімуноендокринної регуляції мають досить значні наслідки для здоров’я, такі як зниження/спотворення імунної відповіді на вакцини, сповільнення загоєння ран, активація прихованих вірусів, а також підвищення ризику виникнення, загострення й ускладнення перебігу хронічних неінфекційних і тяжких інфекційних захворювань. Так, хронічний стрес та індукована ним тривожно-депресивна реакція можуть збільшити периферичну продукцію прозапальних цитокінів, таких як інтерлейкін-6. У свою чергу, високі сироваткові рівні інтерлейкіну-6 пов’язані з ризиками маніфестації серцево-судинних захворювань, цукрового діабету 2-го типу, психічних розладів і деяких видів раку [5].
Гострий і хронічний дистрес, що сьогодні переживає населення України, може викликати виражені зміни вродженої й адаптивної імунної відповіді опосередковано через нейроендокринні медіатори гіпоталамо-гіпофізарно-надниркової системи [4, 6]. Дані систематичних оглядів і метааналізів показують, що психологічний стрес має враховуватись у складних моделях прогнозів соматичних захворювань, поширення пухлинних метастазів, загоєння поранень і післяопераційних ран, а також в епідеміологічних дослідженнях прогресування захворювання і смертності [3, 4, 6]. Хронічний стрес провокує зниження клітинного імунітету (Th1 — «агресивний» спосіб захисту), а гострий стрес запускає надреактивність гуморального імунітету (Th2 — спосіб захисту за типом блокування). Причому хронічний стрес призводить до безперервного зниження рівня імуноглобуліну А, а гострий стрес може призводити до його тимчасового підвищення. Важливо відзначити, що цей вплив не залежить від того, наскільки людина рефлексує свої негативні емоції в момент дії стресора (вона може пригнічувати й витісняти пов’язану зі стресорною ситуацією тривогу), проте, залишаючись пасивно схильною до стресу, не перетворюючи ситуацію, людина в підсумку отримує зниження імунітету й ризик виникнення імунодефіцитної патології [3].
Дослідження, проведені в клінічних популяціях, показали, що високий рівень тривожності пов’язаний з порушенням саме клітинного імунітету. Так, у дослідженні M.E. Bauer (2010) [7] було показано, що посттравматичний стресовий розлад пов’язаний з послабленням функції гіпоталамо-гіпофізарно-надниркової осі та активацією імунних реакцій. Дослідження K.M. Nautiyal (2008) [8] довело важливу роль мастоцитів головного мозку в модуляції тривожного типу поведінки й надало докази поведінкової важливості нейроімунних зв’язків.
Центральне місце в процесі зв’язку між дистресом, метаболічним стресом і хронічними неінфекційними психосоматичними захворюваннями посідає мітохондріальне регулювання енергетичного метаболізму і клітинної сигналізації. Хронічно підвищений рівень глюкози внаслідок дії хронічного стресу може пошкодити мітохондрії і мітохондріальну ДНК, створюючи токсичні продукти, які запускають системне запалення, що змінює експресію генів і прискорює старіння клітин. Введено поняття «мітохондріальне алостатичне навантаження», що визначає згубні структурні й функціональні зміни, яких зазнають мітохондрії у відповідь на стресорно підвищений рівень глюкози [9].
Отже, сучасна психосоматика зробила крок далеко вперед, з’явилися нові напрямки й концепції. На сьогодні не виникає сумніву, що природа психосоматичних розладів складна й опосередкована безліччю зовнішніх і внутрішніх факторів. Саме тому в реальній клінічній практиці лікаря будь-якої спеціальності присутні психотропні препарати, що дозволяють проводити корекцію насамперед психопатологічних порушень, а також позитивно впливати на власне соматичні хвороби.
Психофармакотерапія в загальній медичній практиці
Комплексний план дій ВООЗ у сфері психічного здоров’я на 2013–2030 рр. заохочує регулярний збір і звітність щодо набору основних показників психічного здоров’я, включно з доступністю психотропних препаратів. Був проведений глобальний моніторинг тенденцій споживання психотропних препаратів з 2008 по 2019 рік у 65 країнах і регіонах відповідно до рівня доходу країни й географічного регіону на підставі аналізу даних про продажі фармацевтичних препаратів з багатонаціональної інтегрованої системи аналізу даних IQVIA (IQVIA-MIDAS), що дозволило оцінити ступінь доступності психотропних ліків для пацієнтів різних профілів [10].
Загальне споживання психотропних препаратів включало продажі антидепресантів, антипсихотиків, транквілізаторів, седативних або снодійних засобів і стабілізаторів настрою. Середньорічні тенденції продажів психотропних препаратів, виражені як визначена добова доза (ВДД) на 1000 жителів на день, були оцінені за допомогою моделі випадкових ефектів, скоригованої на рівень доходу й регіон. Відносні зміни річного споживання психотропних препаратів за доходами, виражені як ВДД на 1000 жителів на день, оцінювалися як зміна у відсотках для кожного класу ліків [10].
За результатами дослідження світові продажі психотропних ліків зросли з 28,54 ВДД на 1000 жителів на день у 2008 році до 34,77 ВДД на 1000 жителів на день у 2019 році, що відповідало 4,08 % (95% довірчий інтервал (ДІ) 2,96–5,21) збільшення продажів щорічно. Абсолютний річний приріст був більшим у країнах з високим рівнем доходу (3,31 ВДД на 1000 жителів на день, 95% ДІ 3,01–3,61) порівняно з країнами з рівнем доходу вище від середнього (1,94 ВДД на 1000 жителів на день, 95% ДІ 1,45–2,44) і країнами з низьким/середнім рівнем доходу (0,88 ВДД на 1000 жителів на день, 95% ДІ 0,62–1,13; p < 0,0001). У 2019 році споживання психотропних ліків у регіонах сильно відрізнялося, причому найвищий обсяг продажів усіх класів психотропних препаратів був зареєстрований у Північній Америці (167,54 ВДД на 1000 жителів на день), а найнижчий — в Азії (5,59 ВДД на 1000 жителів на день). 17 країн мали дуже низьке споживання психотропних ліків у 2019 році, включно з країнами з високим рівнем доходу й країнами з високим рівнем поширеності психічних розладів [10].
Автори дійшли висновку, що загальне споживання психотропних ліків зросло протягом 12-річного періоду, і хоча абсолютні темпи зростання були найвищими в країнах з високим рівнем доходу, відносне зростання було найвищим у країнах із середнім/вище від середнього доходом. Вони наголосили на тому, що потрібно більше зусиль для збільшення доступності психотропних ліків у країнах з дуже низьким їх споживанням, що, імовірно, було пов’язано з фінансовими чи культурними причинами, а також з нестачею кваліфікованих медичних працівників для призначення психотропних ліків [10].
Враховуючи те, що призначення психотропних препаратів є значним і вагома частка їх призначається лікарями загальної практики, у Швеції було проведено анкетне дослідження ставлення й поведінки лікарів щодо призначення психотропних препаратів у закладах первинної медичної допомоги [11]. Анкета була роздана лікарям у всіх 199 лікарнях загальної практики в регіоні Вестра-Гьоталанд, Швеція. Питання стосувалися детермінант призначення психотропних препаратів, що були визначені в попередньому якісному дослідженні.
Для аналізу було отримано анкети 516 лікарів (64 % з яких були фахівцями сімейної медицини, 21 % — інтернами сімейної медицини, 15 % — іншими) з 152 лікарень загальної практики (59 % з яких були державними, 72 % — у міській місцевості, із середнім значенням 7808 зареєстрованих пацієнтів), що становило 48 % від розданих анкет. 62 % лікарів загальної практики вважали, що легше почати призначати психотропні препарати, ніж припинити. 81 % лікарів вважали психотерапію більш доцільною, ніж психотропні препарати, у випадках легкого психічного захворювання. Лікарі вважали проблеми, які лікували психотропними препаратами, переважно соціально-економічними (38 %) або переважно медичними (40 %). Лікарі загальної практики були в середньому задоволені рівнем призначення антидепресантів і заспокійливих засобів щодо медичних потреб, а 33 % з них вважали рівень призначення антипсихотичних препаратів занадто низьким [11].
Автори зауважили, що це дослідження проілюструвало складність психотропної терапії в первинній медичній допомозі й визначило потенційні чинники збільшення призначення психотропних препаратів. Різноманітність факторів, медичних і немедичних, що впливали на рішення про призначення, на думку авторів, може пояснити відчуття свавілля навколо лікування психотропними препаратами. Незважаючи на це, лікарі загальної практики, здається, були переважно задоволені своїми призначеннями [11].
Цікаві тенденції щодо змін у щорічних моделях використання психотропних препаратів з 2007 по 2015 рік були показані в австралійському дослідженні [12]. Це дослідження було першим, у якому використано сучасні лонгітюдні дані для кількісної оцінки змін на індивідуальному рівні у вживанні психотропних препаратів серед дорослого населення Австралії. Так, автори відзначили збільшення тривалості лікування антидепресантами без значної кількості нових призначень, що могло бути результатом покращення прихильності пацієнтів і підвищення обізнаності лікарів про важливість тривалого лікування. Разом з тим було визначено тенденції до збільшення тривалості лікування (у середньому 4–5 років) і висловлено припущення, що в деяких випадках йдеться про надмірне використання антидепресантів, яке було виявлено і в інших дослідженнях [13, 14].
Було наголошено, що часте одноразове призначення амітриптиліну й галоперидолу може свідчити про їх використання не за призначенням (наприклад, порушення поведінки при деменції та безсоння), а також автори наголосили на проблемі тривалого застосування бензодіазепінів [12]. Збільшення обсягу застосування амітриптиліну в першу чергу стосувалось збільшення використання 10 мг препарату для лікування хронічного болю й безсоння. Серед антипсихотичних засобів протягом періоду дослідження найбільше зросло використання кветіапіну, і до 2015 року він мав найвищу частоту й поширеність серед усіх антипсихотичних засобів. Автори спостерігали зменшення нових призначень бензодіазепінів, проте приблизно чверть осіб отримували бензодіазепіни тривало (понад 240 днів), що вказувало на порушення стандартів їх використання і ризики формування залежності [12].
Ще одне австралійське дослідження [15] навело дані аналізу використання прописаних психотропних ліків у певний день (25 вересня 2018 р.; Всесвітній день фармацевтів) з акцентом на психотропну поліпрагмазію.
Інгібітори зворотного захоплення серотоніну, інгібітори зворотного захоплення серотоніну-норадреналіну/інгібітори зворотного захоплення норадреналіну, трициклічні антидепресанти й габапентиноїди переважали серед призначених психотропних засобів. Вживання будь-яких психотропних засобів збільшувалося з віком, досягаючи піку у віковій групі 85–89 років і згодом знижуючись.
Комбінації лікарських засобів з одного підкласу, як правило, траплялися з меншою частотою, ніж очікувалося. Однак комбінації, що включають атипові антипсихотики, траплялися частіше, ніж очікувалося; наприклад, 7,4 × із протисудомними засобами та 2,2 × з іншими атиповими антипсихотичними засобами. Це також стосувалося комбінацій седативних засобів, наприклад анксіолітиків зі снодійними бензодіазепінами (3,8 ×). Автори дійшли висновку [15], що застосування психотропних препаратів літніми людьми і певні психотропні комбінації, які недостатньо підтверджені доказами, залишаються поширеними, тому потрібно приділяти більше уваги причинам цього потенційно невідповідного призначення. Такі висновки були дотичними до даних попередніх досліджень, де наголошувалось на надмірному необґрунтованому призначенні психотропних ліків (амітриптилін, хлорпромазин, бензодіазепіни тощо) без урахування їх потенційної побічної дії [5, 16].
У багатьох епідеміологічних дослідженнях спостерігалося, що жінки вживають психотропні препарати частіше за чоловіків. Запитання щодо 12-місячного вживання психотропних засобів (антидепресантів, бензодіазепінів, нейролептиків, стабілізаторів настрою) було поставлено 34 204 респондентам з 10 європейських країн у рамках опитувань EU-World Mental Health [17].
У всіх країнах-учасницях жінки значно частіше, ніж чоловіки, вживали психотропні препарати протягом попередніх 12 місяців (загальне відношення шансів (OR) = 2,04; 95% ДІ: 1,81–2,31). Цей зв’язок залишався значущим після поправки на загальні соціально-демографічні фактори (вік, рівень доходу, статус зайнятості, освіта, сімейний стан) і показники на рівні країни (забезпечення ліками, витрати приватного домогосподарства з власної кишені та індекс гендерного розриву). Але за даними багатофакторного гендерно-стратифікованого аналізу факторів ризику, жінки й чоловіки частіше приймали психотропні препарати зі збільшенням віку, зниженням рівня доходу й використанням психіатричної допомоги протягом останніх 12 місяців без істотних гендерних відмінностей. Тому автори дійшли висновку, що жінки вживають психотропні ліки на постійній основі частіше за чоловіків залежно від конкретного психічного розладу, але причини їх використання є гендерно однаковими [17].
На окрему увагу заслуговують особливості використання антипсихотиків [18–20], які в основному призначені для лікування тяжких психічних захворювань, але також мають доказову клінічну користь у неврології, паліативній допомозі чи загальній практиці.
Так, популяційне дослідження, що ідентифікувало всіх споживачів антипсихотичних препаратів у Данії (населення 5,7 млн) у 1997–2018 роках у Датському національному реєстрі рецептів (DNPR), показало спектр діагнозів і використаних антипсихотиків [18]. Споживачі (амбулаторні й стаціонарні) були розподілені ієрархічно на шість груп: тяжкі психічні розлади (шизофренія, біполярні розлади), хронічні психічні розлади (деменції, розумова відсталість, аутизм), інші психічні розлади (депресивні, тривожні й особистісні розлади), окремі неврологічні захворювання, рак і споживачі антипсихотиків без будь-якого з цих діагнозів.
Загалом було ідентифіковано 630 307 споживачів антипсихотичних препаратів, з яких 127 649 отримували рецепти протягом 2018 року. Найбільшу групу (37 %) становили споживачі без діагнозів, які за стандартами терапії потребують лікування антипсихотиками. Майже третина (34 %) пацієнтів лікувалась з приводу шизофренії і спектра біполярних розладів. Далі йшли інші психічні розлади (15 %), деменція, аутизм і розумова відсталість (11 %), рак (2,2 %) і неврологічні діагнози (2,0 %) [18].
У 2018 році з 37 478 споживачів, яким вперше призначались антипсихотики, 39 % осіб не мали діагнозу, пов’язаного з антипсихотичним лікуванням; 7,9 % осіб страждали від тяжкої депресії, 7,7 % осіб мали невротичні/пов’язані зі стресом розлади та 7,5 % осіб — деменцію. Кветіапін використовувався найчастіше як загалом (51 %), так і серед споживачів без діагнозів, пов’язаних з антипсихотичним лікуванням (58 %). Показово, що особам без діагнозів, стандартно пов’язаних з антипсихотичним лікуванням, терапію антипсихотиками було розпочато лікарем загальної практики (65 %), і лише 17 % таких пацієнтів звернулися до психіатра протягом наступного року. Також приблизно 18 % пацієнтів з розладами адаптації та 14 % пацієнтів без відповідних діагнозів, що передбачають застосування антипсихотичних засобів, продовжували приймати антипсихотики через 5 років після першого призначення [18].
Таке широке призначення антипсихотиків у загальній практиці пацієнтам, які не мали психіатричних, неврологічних або ракових діагнозів як можливих показань для антипсихотичної терапії, засвідчило обізнаність лікарів не тільки в психотропних, але й у соматотропних ефектах цієї групи медикаментів. Тенденція до використання антипсихотиків лікарями непсихіатричної мережі для отримання швидкого й стійкого ефекту поліпшення психосоматичного здоров’я пацієнтів багатопрофільних лікарень і поліклінік набирає обертів [18–20].
Разом з тим потрібні дотримання принципів їх раціонального призначення, адекватний моніторинг побічних ефектів і подальші дослідження причин призначення антипсихотичних засобів і співвідношення ризику/користі [18]. Це обумовлено тим, що клас антипсихотичних засобів залишається одним із найскладніших у всій психофармакології. Основні питання стосуються того, які додаткові властивості мають антипсихотичні засоби і де в організмі препарати проявляють цю свою фармакологічну дію. Наприклад, за даними досліджень щодо лікування болю, найбільш часто призначаються оланзапін, кветіапін, рисперидон, арипіпразол і зипразидон. Оланзапін був єдиним препаратом з надійними клінічними дослідженнями, який продемонстрував стабільну ефективність при фіброміалгії та болі, пов’язаному з мігренню [20].
Потенціал амісульприду в терапії психосоматичних пацієнтів
Амісульприд — антипсихотичний засіб, доступний у Європі ще з 1990-х років, нині переживає своє відродження як у психіатричній, так і в соматичній практиці [21]. Він є високоселективним антагоністом дофамінових рецепторів (Ki = 2,8 нмоль/л для D2-рецепторів і Ki = 3,2 нмоль/л для D3-рецепторів), що має на кілька порядків вищу спорідненість до D2/D3-рецепторів, ніж до будь-яких інших. Амісульприд є заміщеним похідним бензаміду з більш високою спорідненістю до рецепторів дофаміну D2/D3 у лімбічних, а не в нігростріарних структурах, що було пов’язано з низькою частотою екстрапірамідних побічних ефектів, особливо при прийомі низьких доз. Амісульприд має подвійний механізм дії: він вибірково блокує авторецептори D2/D3 пресинаптично у фронтальній корі головного мозку, посилюючи дофамінергічну передачу, і постсинаптично — в лімбічних ділянках, зменшуючи її. Отже, дофамінергічну гіперактивність у фронтальній корі й недостатню активність у лімбічних ділянках можна лікувати одночасно, полегшуючи, наприклад, як позитивні, так і негативні симптоми шизофренії відповідно. Крім того, виявлення того, що амісульприд є високоефективним антидепресантом через антагонізм 5-НТ7-рецепторів, робить його механізм дії унікальним і сприяє подальшій розробці нових ліків — більш селективних антагоністів рецепторів 5-НТ7 для лікування депресії, включно з впливом на нейрогенез у гіпокампі, негативні симптоми, когнітивну дисфункцію, соціальні функції, якість життя, а також тягар для родини й суспільства [21].
У клінічних дослідженнях амісульприд продемонстрував терапевтичну користь із профілем побічних ефектів, подібним до плацебо. Це, а також високоспецифічний рецепторний профіль робить його ідеальним для досягнення антипсихотичної ефективності й низької частоти екстрапірамідних порушень виключно шляхом вибіркової дії на лімбічні кортикальні рецептори дофаміну D2/D3. На додаток до низьких рівнів екстрапірамідних порушень амісульприд також має низьку частоту побічних ефектів, таких як збільшення ваги, що може сприяти покращенню комплаєнсу й підвищенню довгострокової ефективності.
Так, під час курсу лікування в пацієнтів, які отримували амісульприд, спостерігалося значне зниження рівня тригліцеридів натще, загального холестерину, глюкози й резистентності до інсуліну, зниження діастолічного артеріального тиску й частоти пульсу і значне підвищення рівня ліпопротеїнів високої щільності після переходу на амісульприд (усі P < 0,05). Поширеність метаболічного синдрому в пацієнтів, які отримували амісульприд, також значно знизилася — з 65,2 до 30,4 % (тест Мак-Немара, P < 0,0005). Ці результати показують, що перехід на амісульприд може бути ефективним засобом лікування психіатричних пацієнтів з надмірною вагою або ожирінням, які раніше отримували інші атипові антипсихотики [22].
Дійсно, амісульприд має один з найнижчих потенціалів збільшення маси тіла серед усіх антипсихотичних препаратів і пов’язаний з явно меншим використанням протипаркінсонічних препаратів і меншою кількістю відмов від лікування через побічні ефекти, ніж інші антипсихотики [23]. Амісульприд, як і рисперидон і антипсихотичні препарати першого покоління, має виражену дію на підвищення рівня пролактину, що не залежить від дози й тривалості прийому, але залежить від конституціональної вразливості щодо цієї побічної дії. Причому гіперпролактинемія швидко зникає після припинення прийому амісульприду.
Варто зазначити, що амісульприд не має активних метаболітів; він слабко метаболізується системою ізоферментів цитохрому Р450, що дозволяє уникнути клінічно значущих метаболічних взаємодій [24]. Крім того, амісульприд не є інгібітором жодного ферменту цито-хрому Р450 [26]. Нарешті, амісульприд метаболізується нирками, при цьому 25–50 % дози виводиться із сечею в незміненому вигляді [23].
Для пацієнтів психосоматичного профілю корисними виявилися саме продофамінергічні клінічні ефекти амісульприду, що проявляються саме при застосуванні низьких доз — від 50 мг/добу. Допускається повільне підвищення дози амісульприду до 150–300 мг/добу залежно від клінічних потреб пацієнта. Існує досить вагомий пул клінічних досліджень, що підтверджують ефективність низьких доз амісульприду в терапії дистимії, депресивного епізоду, а також симптомів депресії при хронічних захворюваннях, таких як фіброміалгія та рак. Крім того, амісульприд схвалений для лікування дистимії в Італії та інших країнах Європи [26–31].
Так, у 12-тижневому подвійному сліпому дослідженні з паралельними групами за участю 313 амбулаторних пацієнтів з дистимією і/або депресивним епізодом амісульприд (50 мг/д) порівнювали із сертраліном (50–100 мг/д) [27]. Повна терапевтична відповідь за шкалою оцінки депресії Гамільтона (↓ HAM-D щонайменше на 50 %) була вищою при застосуванні амісульприду через 4 тижні (63 % проти 50 %, P < 0,02) і 8 тижнів (82 % проти 69 %, P < 0,009). Час до початкового поліпшення (↓ HAM-D щонайменше на 25 %) був значно коротшим при застосуванні амісульприду (P < 0,0033 і P < 0,0080 відповідно). Швидша реакція на терапію була також у підгрупі пацієнтів із чистою дистимією. Поліпшення загальних балів за шкалами депресії Гамільтона і Монтгомері — Асберг, а також за шкалою загального клінічного враження було значно більшим при застосуванні амісульприду через 4 тижні. Обидва препарати були однаково ефективні на 12-му тижні. Переносимість обох препаратів була задовільною. Отже, амісульприд виявився значно ефективнішим за сертралін протягом перших тижнів лікування дистимії. Причому аналогічне порівняльне дослідження з пароксетином (20 мг/д) не виявило відмінностей між препаратами [28].
Загалом за даними метааналізу 11 досліджень [26], у яких брали участь 2065 пацієнтів з діагнозом дистимії (вісім досліджень), великої депресії (одне дослідження) або шизофренії (два дослідження), амісульприд у дозі 50 мг/добу асоціювався зі значнішим зменшенням симптомів депресії порівняно з плацебо. Цей ефект був порівнянний з таким у селективних інгібіторів зворотного захоплення серотоніну (СІЗЗС), іміпраміну й амітриптиліну в лікуванні дистимії. У хворих на шизо-френію амісульприд, який застосовували у вищих дозах (> 400 мг/добу), був порівнянний за ефектом з оланзапіном і рисперидоном.
У дослідженні порівняння аугментації оланзапіном та амісульпридом із СІЗЗС (флуоксетин й сертралін відповідно) для осіб із стійким до терапії рекурентним депресивним розладом обидві групи продемонстрували значне зменшення симптомів депресії з 10-го дня терапії до кінця дослідження (40-й день) [29]. Було відзначено, що амісульприд поліпшує когнітивні здібності пацієнтів з помітним впливом на сфери уваги, виконавчих функцій і робочої пам’яті [30]. Отже, амісульприд у низьких дозах є дієвим як засіб посилення лікування стійкої до терапії депресії. Додавання 50 мг амісульприду до терапії антидепресантами призвело до значного поліпшення психопатології в більшості пацієнтів. У більшості випадків поліпшення настало рано, лише через 1–2 тижні лікування. Але в деяких пацієнтів зменшення або припинення прийому амісульприду призвело до негайного інтенсивного рецидиву депресивних симптомів, які нагадували синдром відміни [29]. Сукупні дані досліджень свідчать, що його використання можна оцінити у вибраних осіб, наприклад, при пріоритеті ниркової екскреції над печінковим метаболізмом.
Серед популяції онкологічних пацієнтів депресія також є досить частою і важко піддається лікуванню через особливу чутливість онкологічних хворих до побічної дії антидепресантів. Терапія амісульпридом 106 онкологічних пацієнтів з депресією під час хіміотерапії протягом 4 тижнів привела до покращення показників шкал MADRS і CGI (p < 0,002; p < 0,001 відповідно ) зі зменшенням депресивних симптомів, як емоційних (таких як очевидний смуток, озвучений смуток, внутрішня напруга тощо), так і фізичних (таких як відсутність апетиту, зниження ваги, втома й безсоння) з доброю переносимістю (лише двоє пацієнтів вибули). Це було перше дослідження застосування амісульприду в когорті онкологічних пацієнтів з депресією під час хіміотерапії, у якому він продемонстрував високу ефективність і безпеку [31].
Серед сполук, які вважаються потенційно ефективними в пацієнтів із синдромом хронічної втоми (СХВ), що є певним аналогом постковідної втоми, виділяється низька доза амісульприду, який є корисним також для терапії соматоформних розладів [32–35]. У дослідженні пацієнти із СХВ без депресії отримували амісульприд 25 мг 2 рази на добу або флуоксетин 20 мг 1 раз на добу. Пацієнти, які отримували амісульприд, демонстрували значне поліпшення самооцінки; також спостерігалось значне зменшення соматичних скарг, тоді як вплив на рівні тривоги й депресії був більш значним у флуоксетину. Обидва препарати переносилися однаково добре. У підсумку автори зазначили позитивний симптоматичний ефект амісульприду порівняно з лікуванням СІЗЗС у групі пацієнтів із СХВ без депресії [32]. Низькі дози амісульприду переважно зв’язуються з екстрастріарними рецепторами дофаміну, сприяють збільшенню фронтального кровотоку й частково покращують фронтальні когнітивні функції [33]. Автори припустили [32], що вплив амісульприду на рівень втоми може бути опосередкованим через модуляцію активності префронтальної кори. Крім того, активність амісульприду на рівні антагонізму до рецептора 5-HT7 також може позитивно впливати на якість сну і когнітивні здібності в пацієнтів із СХВ, таким чином сприяючи його ефективності в цих пацієнтів.
Щодо терапії соматоформних розладів описано позитивний досвід застосування амісульприду в дозі 100 мг/добу [34, 35]. Ішлося, наприклад, про розлад соматизації з невпинними й мінливими скаргами переважно на шлунково-кишковий тракт, що включали відрижку, відчуття здуття живота, нудоту, блювання й нерегулярну дефекацію. Редукція симптоматики відбулась під впливом амісульприду після попередніх невдалих спроб лікування СІЗЗС, трициклічними антидепресантами й дулоксетином. Соматоформний больовий розлад (постійний біль і поколювання в ділянці шиї протягом року), що не піддавався адекватному впливу есциталопраму й амітриптиліну, також редукувався на 80 % при дозі амісульприду 100 мг/добу. Недиференційований соматоформний розлад (постійні функціональні симптоми з боку верхніх відділів шлунково-кишкового тракту), що не відповідав на застосування кількох антидепресантів різних класів та інтенсивну психотерапію протягом 6 місяців, був на 3/4 редукований амісульпридом при дозі 100 мг/д.
Сучасне розуміння соматоформних розладів полягає в тому, що процеси центральної нервової системи (ЦНС) модулюють сигнали з периферії, і саме ця центральна модуляція лежить в основі свідомого досвіду фізичних симптомів [34]. В описаних вище випадках, можливо, були залучені ділянки мозку, такі як правий передній острівець, передня поясна частина, орбіто-фронтальна кора й навколишні ділянки, які сприймають відчуття від периферичних органів чуття, щоб дати підвищене суб’єктивне усвідомлення стану тіла [35]. Також існував відносний гіподофамінергічний стан у префронтальній і лобовій ділянках [35]. Застосування низьких доз амісульприду привело до збільшення дофамінергічної передачі в кількох кортикальних ділянках, таких як смугасте тіло, префронтальна й лобова частки, таким чином допомагаючи виправити гіподофамінергічний стан. Крім того, це також збільшило фронтальний кровотік, що привело до покращення лобових когнітивних функцій. Активність амісульприду як антагоніста рецептора 5-HT7 на додаток до його впливу на дофамінергічні рецептори позитивно впливала на якість сну і когнітивні функції [33], таким чином, можливо, сприяючи його ефективності в пацієнтів із соматоформними розладами.
Останнім часом було затверджено використання розчину амісульприду для ін’єкцій 2,5 мг/мл для профілактики післяопераційної нудоти й блювання, окремо або в комбінації з протиблювотним засобом іншого класу: 5 мг одноразово внутрішньовенно під час введення в анестезію і 10 мг одноразово внутрішньовенно в разі нудоти і/або блювання після операції.
Активація хеморецепторів тригерної зони передає стимули до центру блювання. У свою чергу, рецептори D2, розташовані в тригерній зоні хеморецепторів, реагують на дофамін, що виділяється з нервових закінчень, тому низькі дози амісульприду демонструють виражену протиеметичну дію [36, 37].
Найновіші дослідження виявили наявність у низьких доз амісульприду протиревматичного потенціалу [38]. Відомо, що психічні розлади є поширеними супутніми захворюваннями ревматоїдного артриту; майже в 1/5 пацієнтів з ревматоїдним артритом розвивається депресія. Було доведено, що сама імунна система може опосередковувати патогенез депресії, оскільки циркулюючі цитокіни, такі як інтерлейкін-6 (IL-6) і фактор некрозу пухлини (TNF), можуть активувати ендотеліальні клітини гематоенцефалічного бар’єра, таким чином дозволяючи циркулюючим медіаторам проникати в ЦНС. Крім того, біль і втома самі по собі можуть активувати імунну відповідь, яка, у свою чергу, може привести до дистимії. Слід зазначити, що біологічні препарати проти TNF були запропоновані для полегшення як симптомів ревматоїдного артриту, так і симптомів депресії. Однак призначення біологічних препаратів схвалено лише в тяжких випадках ревматоїдного артриту, і не всі пацієнти реагують на них, що вимагає частого призначення додаткових антидепресантів.
Авторами передбачалося, що лише один препарат, а саме амісульприд, зазвичай змінює ознаки захворювання та імітує ефект інфліксимабу на артритогенні синовіальні фібробласти — ключові патогенні фактори артриту, що активують TNF. У дослідженні амісульприд був ідентифікований як модифікатор активації артритних фібробластів і поліартриту в мишей. Було виявлено нові потенційні мішені протизапальної дії амісульприду, коли важливі ознаки активації фібробластів, такі як адгезія, змінюються під час лікування. Подібним чином протизапальна активність амісульприду in vivo була перевірена на експериментальній моделі гострого сепсису в мишей дикого типу: введення амісульприду залежно від дози суттєво знижувало підвищені рівні TNF та IL-6 у сироватці крові, виявлені через 1,5 год після індукції [38].
Автори дослідження підтвердили, що амісульприд може забезпечити додатковий сприятливий ефект для пацієнтів, які страждають від ревматоїдного артриту і коморбідної дистимії, оскільки він може зменшити патогенність синовіальних фібробластів паралельно з його антидепресивною дією. Важливо, що амісульприд розглядався як найбільш багатообіцяюча сполука-кандидат з точки зору націлювання на гени, активовані під час хронічного запалення, і навіть може служити провідною сполукою для розробки нових, більш потужних терапевтичних засобів проти хронічних запальних захворювань [38].
Проактивний психосоматичний підхід до терапії
Останніми роками у світі розробляється і впроваджується проактивний підхід до надання психіатричної допомоги пацієнтам багатопрофільних лікарень, що ґрунтується на теоретичних засадах психосоматичної медицини та її клінічному втіленні — консультативно-зв’язковій психіатрії [39]. Підставою для еволюції системи психолого-психіатричної допомоги була необхідність ефективно керувати психологічними й соціальними аспектами будь-якої хвороби, тому що саме ці аспекти почасти є важливою причиною недостатньої ефективності терапії та тривалого перебування пацієнта в лікарні [40]. Перші базові дослідження, метааналізи і консенсуси експертів щодо проактивної психіатричної консультативної допомоги в 2011–2018 роках [40–44] наголошували на тому, що від 20 до 40 % пацієнтів багатопрофільних лікарень також страждають від психічних захворювань, що може суттєво ускладнити перебіг, зменшити ефективність терапії та погіршити прогноз соматичної патології. Психічні порушення пацієнтів багатопрофільних лікарень часто стають на заваді своєчасній виписці зі стаціонару, обумовлюють більшу кількість додаткових консультацій суміжних спеціалістів і збільшують загальну вартість медичної допомоги. На підставі цих досліджень також було визнано, що проактивне психіатричне консультування і раннє призначення психотропної терапії має важливе значення для курації пацієнтів соматичного профілю.
Висновками опублікованого у 2019 році дослідження HOME [45] були більш конкретні рекомендації щодо того, як слід організувати лікарняні психіатричні послуги і які конкретні втручання необхідні для пацієнтів:
1. Рання проактивна біопсихосоціальна оцінка нещодавно госпіталізованих пацієнтів з використанням біопсихосоціального підходу для виявлення всіх проблем, включно з психічними захворюваннями.
2. Створення плану комплексної курації та систематичного менеджменту тих проблем, що створюють потенційні перешкоди для швидкої виписки з лікарні.
3. Реалізація плану комплексної курації з щоденними оглядами пацієнта щодо прогресування психосоматичного стану.
4. Інтегрована робота з персоналом окремих відділень (лікарями, медсестрами, іншими консультантами і спеціалістами соціальної допомоги) і позалікарняними службами для забезпечення виконання плану комплексної курації.
На основі успішного досвіду використання цього підходу під час пандемії COVID-19 проактивні моделі психолого-психіатричної допомоги активно впроваджуються в загальну соматичну практику, становлячи суттєву ланку в курації соматичної патології [46–54]. Наш досвід упровадження проактивної моделі лікування соматизованої тривоги в пацієнтів із хронічними неінфекційними захворюваннями із застосуванням раннього призначення психотропної терапії, психологічної та психіатричної підтримки в загальносоматичній медичній практиці довів її життєздатність і ефективність [55]. Потрібні передові дослідження для створення персоналізованих підходів та отримання подальших доказів їх ефективності для пацієнтів різних нозологічних, вікових, статевих та інших груп.
Конфлікт інтересів. Не заявлений.
UA-SOLE-PIM-032023-007
Отримано/Received 01.02.2023
Рецензовано/Revised 20.02.2023
Прийнято до друку/Accepted 02.03.2023
Список литературы
1. Fava G.A., Cosci F., Sonino N. Current psychosomatic practice. Psychotherapy and Psychosomatics. 2017. 86(1). 13-30.
2. Медична психологія: у 2 т. Т. 2. Спеціальна медична психологія / [Пилягіна Г.Я., Хаустова О.О., Чабан О.С. та ін.] за ред. Г.Я. Пилягіної. Вінниця: Нова Книга, 2020. 496 с.
3. Хаустова О.О. Нейроімуноендокринологія: сучасний погляд на психосоматичний діалог людини зі стресом. Ліки України. 2017. 1 (207). 15-21.
4. Чабан О.С., Хаустова О.О. Медико-психологічні наслідки дистресу війни в Україні: що ми очікуємо та що потрібно враховувати при наданні медичної допомоги? Український медичний часопис. 2022. № 4(150). С. 121-125. DOI: 10.32471/umj.1680-3051.150.232297.
5. Чабан О.О., Хаустова О.О., Абдряхимова Ц.Б., Асанова А.Е., Ассонов Д.О., Коваль І.А. та ін. Практична психосоматика: депресія: Навчальний посібник / За заг. ред. О.С. Чабана, О.О. Хаустової. 2-ге видання, доповнене. К.: Медкнига, 2021. 226 с.
6. Kemeny M.E., Schedlowski M. Understanding the interaction between psychosocial stress and immune-related diseases: a stepwise progression. Brain, behavior, and immunity. 2007. 21(8). 1009-1018.
7. Bauer M.E., Wieck A., Lopes R.P., Teixeira A.L., Grassi-Oliveira R. Interplay between neuroimmunoendocrine systems during post-traumatic stress disorder: a minireview. Neuroimmunomodulation. 2010. 17(3). 192-195.
8. Nautiyal K.M., Ribeiro A.C., Pfaff D.W., Silver R. Brain mast cells link the immune system to anxiety-like behavior. Proceedings of the National Academy of Sciences. 2008. 105(46). 18053-18057.
9. Bobba-Alves N., Juster R.P., Picard M. The energetic cost of allostasis and allostatic load. Psychoneuroendocrinology. 2022. 146. 105951.
10. Brauer R., Alfageh B., Blais J.E., Chan E.W., Chui C.S., Hayes J.F. et al. Psychotropic medicine consumption in 65 countries and regions, 2008–19: a longitudinal study. The Lancet Psychiatry. 2021. 8(12). 1071-1082.
11. Svensson S.A., Hedenrud T.M., Wallerstedt S. M. Attitudes and behaviour towards psychotropic drug prescribing in Swedish primary care: a questionnaire study. BMC family practice. 2019. 20. 1-9.
12. Brett J., Karanges E.A., Daniels B., Buckley N.A., Schneider C., Nassir A. et al. Psychotropic medication use in Australia, 2007 to 2015: changes in annual incidence, prevalence and treatment exposure. Australian & New Zealand Journal of Psychiatry. 2017. 51(10). 990-999.
13. Johnson C.F., Macdonald H.J., Atkinson P., Buchanan A.I., Downes N., Dougall N. Reviewing long-term antidepressants can reduce drug burden: a prospective observational cohort study. British Journal of General Practice. 2012. 62(604). e773-e779.
14. Kjosavik S.R., Gillam M.H., Roughead E.E. Average duration of treatment with antidepressants among concession card holders in Australia. Australian & New Zealand Journal of Psychiatry. 2016. 50(12). 1180-1185.
15. Brett J., Pearson S.A., Daniels B., Wylie C.E., Buckley N.A. A cross sectional study of psychotropic medicine use in Australia in 2018: A focus on polypharmacy. British Journal of Clinical Pharmacology. 2021. 87(3). 1369-1377.
16. Vaismoradi M., Vizcaya Moreno F., Sletvold H., Jordan S. PRN medicines management for psychotropic medicines in long-term care settings: a systematic review. Pharmacy. 2019. 7(4). 157.
17. Boyd A., Van de Velde S., Pivette M., Ten Have M., Florescu S., O’Neill S. et al. Gender differences in psychotropic use across Europe: results from a large cross-sectional, population-based study. European Psychiatry. 2015. 30(6). 778-788.
18. Højlund M., Andersen J.H., Andersen K., Correll C.U., Hallas J. Use of antipsychotics in Denmark 1997–2018: a nation-wide drug utilisation study with focus on off-label use and associated diagnoses. Epidemiology and Psychiatric Sciences. 2021. 30. e28.
19. Crapanzano C., Amendola C., Politano A., Laurenzi P.F., Casolaro I. Olanzapine for the treatment of somatic symptom disorder: biobehavioral processes and clinical implications. Psychosomatic Medicine. 2022. 84(3). 393-395.
20. De La Cruz A. Antipsychotics for Pain Management. US Pharm. 2020. 45(3). 15-19.
21. Hadryś T., Rymaszewska J. Amisulpride-is it as all other medicines or is it different? An update. Psychiatria Polska. 2020. 54(5). 977-989.
22. Kotan Z., Ertepe B., Akkaya C., Sarandol E., Ozkaya G., Kirli S. Metabolic, endocrinologic and cardiac effects of amisulpride: a 24-week follow-up study. Therapeutic advances in psychopharmaco-logy. 2011. 1(6). 189-196.
23. Juruena M.F., de Sena E.P., de Oliveira I.R. Safety and tolerability of antipsychotics: focus on amisulpride. Drug, Healthcare and Patient Safety. 2010. 205-211.
24. Spina E., De Leon J. Metabolic drug interactions with newer antipsychotics: a comparative review. Basic & Clinical Pharmacology & Toxicology. 2007. 100(1). 4-22.
25. Gillet G., Dormerque L., Canal M., Thenot J.P. Amisulpride does not inhibit cytochrome P450 isozymes. European Neuropsychopharmacology. 2000. (10). 331-332.
26. Rittmannsberger H. Amisulpride as an augmentation agent in treatment resistant depression: a case series and review of the literature. Psychiatria Danubina. 2019. 31(2). 148-156.
27. Amore M., Jori M.C. Faster response on amisulpride 50 mg versus sertraline 50-100 mg in patients with dysthymia or double depression: a randomized, double-blind, parallel group study. International Clinical Psychopharmacology. 2001. 16(6). 317-324.
28. Cassano G.B., Jori M.C. Efficacy and safety of amisulpride 50 mg versus paroxetine 20 mg in major depression: a randomized, double-blind, parallel group study. International Clinical Psychopharmacology. 2002. 17(1). 27-32.
29. Zangani C., Giordano B., Stein H.C., Bonora S., D’Agostino A., Ostinelli E.G. Efficacy of amisulpride for depressive symptoms in individuals with mental disorders: A systematic review and meta-analysis. Human Psychopharmacology: Clinical and Experimental. 2021. 36(6). e2801.
30. Mortimer A.M., Joyce E., Balasubramaniam K., Choudhary P.C., Saleem P.T. Treatment with amisulpride and olanzapine improve neuropsychological function in schizophrenia. Human Psychopharmacology: Clinical and Experimental. 2007. 22(7). 445-454.
31. Torta R., Berra C., Binaschi L., Borio R. Amisulpride in the short-term treatment of depressive and physical symptoms in cancer patients during chemotherapies. Supportive Care in Cancer. 2007. 15. 539-546.
32. Pardini M., Guida S., Primavera A., Krueger F., Cocito L., Gialloreti L.E. Amisulpride vs. fluoxetine treatment of chronic fatigue syndrome: a pilot study. European Neuropsychopharmacology. 2011. 21(3). 282-286.
33. Vaiva G., Thomas P., Llorca P.M., Dupont S., Cottencin O., Devos P. et al. SPECT imaging, clinical features, and cognition before and after low doses of amisulpride in schizophrenic patients with the deficit syndrome. Psychiatry Res. 2002. 115 (1–2). 37-48.
34. Goswami K., Saddichha S., Chaturvedi S.K. Amisulpride treatment of somatoform disorders: not just chronic fatigue. American Journal of Therapeutics. 2014. 21(2). e48-e49.
35. Saddichha S., Goswami K., Vishnuvardhan G. Amisulpride in the treatment of somatoform disorders. Australian and New Zealand Journal of Psychiatry. 2011. 45(9). 792-793.
36. Smyla N., Eberhart L., Weibel S., Kranke P. Amisulpride for the prevention and treatment of postoperative nausea and vomiting: a quantitative systematic review (meta-analysis). Drugs Future. 2019. 44. 453.
37. Habib A.S., Kranke P., Bergese S.D. et al. Amisulpride for the rescue treatment of postoperative nausea or vomiting in patients failing prophylaxis: a randomized, placebo-controlled phase III trial. Anesthesiology. 2019. 130. 203-212.
38. Papadopoulou D., Roumelioti F., Tzaferis C., Chouvardas P., Pedersen A.K., Charalampous F. et al. Repurposing of Amisulpride, a known antipsychotic drug, to target synovial fibroblasts activation in arthritis. bioRxiv. 2022. 2022-08.
39. Oldham M.A., Desan P.H., Lee H.B., Bourgeois J.A., Shah S.B., Hurley P.J., Sockalingam S. Proactive Consultation-Liaison Psychiatry: American Psychiatric Association Resource Document. Journal of the Academy of Consultation-Liaison Psychiatry. 2021. Vol. 62. Issue 2. P. 169-185.
40. Leentjens A.F., Rundell J.R., Wolcott D.L., Guthrie E., Kathol R., Diefenbacher A. Reprint of: Psychosomatic medicine and consultation-liaison psychiatry: scope of practice, processes, and competencies for psychiatrists working in the field of CL psychiatry or psychosomatics. A consensus statement of the European Association of Consultation-Liaison Psychiatry and Psychosomatics (EACLPP) and the Academy of Psychosomatic Medicine (APM). Journal of Psychosomatic research. 2011. 70(5). 486-491.
41. Desan P.H., Zimbrean P.C., Lee H.B., Sledge W.H. Proactive psychiatric consultation services for the general hospital of the future. In Integrated Care in Psychiatry. New York: Springer, 2014. Р. 157-181.
42. Sledge W.H., Lee H.B. Proactive psychiatric consultation for hospitalized patients, a plan for the future. Health Affairs. www.healthaffairs.org/do/10.1377/hblog20150528.048026/ full/. Published May 28, 2015.
43. Munjal S. Proactive consultation: A new model of care in consultation-liaison psychiatry. Current Psychiatry. 2018. 17(10). e3-e5.
44. Desan P.H., Zimbrean P.C., Lee H.B., Sledge W.H. Proactive Psychiatric Consultation Services for the General Hospital of the Future. In: Summergrad P., Kathol R. (eds). Integrated Care in Psychiatry. New York: Springer, 2014. https://doi.org/10.1007/978-1-4939-0688-8_10.
45. Walker J., Burke K., Toynbee M., van Niekerk M., Frost C., Magill N. et al. The HOME Study: study protocol for a randomised controlled trial comparing the addition of Proactive Psychological Medicine to usual care, with usual care alone, on the time spent in hospital by older acute hospital inpatients. Trials. 2019. 20(1). 1-9.
46. Augenstein T.M., Pigeon W.R., DiGiovanni S.K., Brazill K.P., Olivares T.E., Lee H.B., Wittink M.N. Creating a novel inpatient psychiatric unit with integrated medical support for patients with COVID-19. NEJM Catalyst Innovations in Care Delivery. 2020.
47. Sharpe M., Toynbee M., Walker J., Consultation T.H.S.P.I. Proactive Integrated Consultation-Liaison Psychiatry: A new service model for the psychiatric care of general hospital inpatients. General Hospital Psychiatry. 2020. 66. 9-15.
48. Shalev D., Nakagawa S., Stroeh O.M., Arbuckle M.R., Rendleman R., Blinderman C.D., Shapiro P.A. The creation of a psychiatry-palliative care liaison team: using psychiatrists to extend palliative care delivery and access during the COVID-19 crisis. Journal of Pain and Symptom Management. 2020. 60(3). e12-e16.
49. Oldham M.A., Chahal K., Lee H.B. A systematic review of proactive psychiatric consultation on hospital length of stay. Gen. Hosp. Psychiatry. 2019. 60. 120-126.
50. Purssell E., Gould D., Chudleigh J. Impact of isolation on hospitalized patients who are infectious: systematic review with meta-analysis. BMJ Open. 2020. 10. e030371.
51. Montalvo C., Kao L.E. A Call to Arms, Not to Disarm: The Importance of Psychiatric Care in the Acute Medical Setting During the COVID-19 Pandemic. Psychosomatics. 2020. 61(5). 581.
52. Jhanwar S., Krishnan V., Rohilla J. Consultation-Liaison Psychiatry During COVID-19 Lockdown: A Retrospective Chart Review. Cureus. October 19, 2020. 12(10). e11048. doi:10.7759/cureus.11048.
53. Norton A., Olliaro P., Sigfrid L., Carson G., Paparella G., Hastie C. et al. Long COVID: tackling a multifaceted condition requires a multidisciplinary approach. The Lancet Infectious Diseases. 2021. 21(5). 601-602.
54. Gray M., Monti K., Katz C., Klipstein K., Lim S. A “Mental Health PPE” model of proactive mental health support for frontline health care workers during the COVID-19 pandemic. Psychiatry Research. 2021. 299. 113878.
55. Khaustova O.O., Markova M.V., Driuchenko M.O. et al. Proactive psychological and psychiatric support of patients with chronic non-communicable diseases in a randomised trial: a Ukrainian experience. General Psychiatry. 2022. 35. e100881. doi:10.1136/ gpsych-2022-100881.

/50.jpg)