Журнал «Здоровье ребенка» Том 17, №8, 2022
Вернуться к номеру
Механізми дії екстрацелюлярних мікроРНК
Авторы: Абатуров О.Є., Бабич В.Л.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
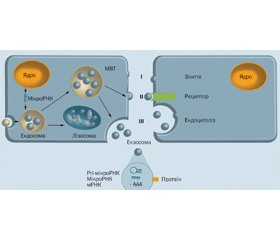
У науковому огляді наведено механізми дії екстрацелюлярних мікроРНК. Для написання статті здійснювався пошук інформації з використанням баз даних Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library. Автори надають інформацію, що мікроРНК генеруються клітинами-продуцентами, а потім упаковуються в екстрацелюлярні везикули й поставляються в інші клітини функціонально активними структурами. Позаклітинні везикули переносять мікроРНК паракринним і ендокринним способом. Підкреслено, що механізм дії екстрацелюлярних мікроРНК залежить від їх асоціації з екстрацелюлярними везикулами. МікроРНК, що асоційовані з екстрацелюлярними везикулами, поглинаються клітинами і діють як внутрішньоклітинні мікроРНК. Асоційовані й неасоційовані з екстрацелюлярними везикулами мікроРНК, взаємодіючи зі специфічними рецепторами, індукують активацію внутрішньоклітинних сигнальних, найчастіше прозапальних шляхів. Екстрацелюлярні везикули взаємодіють з мембраною клітини-реципієнта через їх поверхневі протеїни ліганд-рецепторним способом. Наведено, що специфічні протеїни екстрацелюлярних везикул, такі як білки комплексу MHC I і II типу, рецептори трансферину й тетраспаніни, індукують порушення деяких сигнальних шляхів клітин-мішеней. Науковці вважають, що екзосоми й ектосоми поглинаються клітинами-реципієнтами за допомогою клатрин-залежного ендоцитозу, фагоцитозу і/або макропіноцитозу. Після доставки в клітини-мішені мікроРНК регулюють трансляцію їх генів-мішеней. Вважають, що екстрацелюлярні везикули, які циркулюють у сироватці крові здорових людей, мають антифіброгену дію і містять мікроРНК, які пригнічують активність HSC або пошкоджених гепатоцитів. Науковці вважають, що рецептор-незалежне проникнення вірусу гепатиту С у гепатоцити може здійснюватися за допомогою екзосом. Екзосомні мікроРНК і не пов’язані з екзосомами мікроРНК здатні зв’язуватися з певними клітинними рецепторами й активувати асоційовані з ними внутрішньоклітинні сигнальні шляхи.
The mechanisms of action of extracellular miRNAs are given in the scientific review. To write the article, information was searched using Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library databases. The authors state that miRNAs are generated by producer cells and then packaged in extracellular vesicles and delivered to other cells by functionally active structures. Extracellular vesicles transport miRNA in a paracrine and endocrine manner. It is emphasized that the mechanism of action of extracellular microRNAs depends on their association with extracellular vesicles. MicroRNAs associated with extracellular vesicles are taken up by cells and act as intracellular microRNAs. MicroRNAs associated and not associated with extracellular vesicles, by interacting with specific receptors, induce the activation of intracellular signaling, most often pro-inflammatory pathways. Extracellular vesicles interact with the membrane of the recipient cell through their surface proteins in a ligand-receptor manner. It is shown that specific proteins of extracellular vesicles, such as major histocompatibility complex class I and class II proteins, transferrin receptors and tetraspanins, induce disruption of some signaling pathways of target cells. Scientists believe that exosomes and ectosomes are absorbed by recipient cells using clathrin-mediated endocytosis, phagocytosis, and/or macropinocytosis. After delivery to target cells, miRNAs regulate the translation of their target genes. Extracellular vesicles circulating in the blood serum of healthy people are believed to have antifibrogenic effects and contain miRNAs that inhibit the activity of hematopoietic stem cells or damaged hepatocytes. Scientists believe that receptor-independent penetration of the hepatitis C virus into hepatocytes can be carried out with the help of exosomes. Exosomal miRNAs and miRNAs not associated with exosomes are able to bind to certain cellular receptors and activate intracellular signaling pathways associated with them.
мікроРНК; екстрацелюлярні везикули; вірус гепатиту С; гепатоцити; огляд
microRNA; miRNA; miR; extracellular vesicles; hepatitis C virus; hepatocytes; review
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Bala S., Petrasek J., Mundkur S. et al. Circulating microRNAs in exosomes indicate hepatocyte injury and inflammation in alcoholic, drug-induced, and inflammatory liver diseases. Hepatology. 2012 Nov. 56(5). 1946-57. doi: 10.1002/hep.25873.
- Basu S., Bhattacharyya S.N. Insulin-like growth factor-1 prevents miR-122 production in neighbouring cells to curtail its intercellular transfer to ensure proliferation of human hepatoma cells. Nucleic Acids Res. 2014 Jun. 42(11). 7170-85. doi: 10.1093/nar/gku346.
- Beuzelin D., Kaeffer B. Exosomes and miRNA-Loaded Biomimetic Nanovehicles, a Focus on Their Potentials Preventing Type-2 Diabetes Linked to Metabolic Syndrome. Front. Immunol. 2018. 9. 2711. doi: 10.3389/fimmu.2018.02711.
- Bukong T.N., Momen-Heravi F., Kodys K. et al. Exosomes from hepatitis C infected patients transmit HCV infection and contain replication competent viral RNA in complex with Ago2-miR122-HSP90. PLoS Pathog. 2014 Oct 2. 10(10). e1004424. doi: 10.1371/journal.ppat.1004424.
- Chen C., Luo F., Liu X. et al. NF-kB-regulated exosomal –miR-155 promotes the inflammation associated with arsenite carcinogenesis. Cancer Lett. 2017 Mar 1. 388. 21-33. doi: 10.1016/j.canlet.2016.11.027.
- Chen L., Chen R., Kemper S. et al. Therapeutic effects of serum extracellular vesicles in liver fibrosis. J. Extracell. Vesicles. 2018 Apr 17. 7(1). 1461505. doi: 10.1080/20013078.2018.1461505.
- Chen L., Brigstock D.R. Integrins and heparan sulfate proteoglycans on hepatic stellate cells (HSC) are novel receptors for HSC-derived exosomes. FEBS Lett. 2016 Dec. 590(23). 4263-4274. doi: 10.1002/1873-3468.1.
- Chen X., Liang H., Zhang J. et al. microRNAs are ligands of Toll-like receptors. RNA. 2013 Jun. 19(6). 737-9. doi: 10.1261/rna.036319.112.
- Christianson H.C., Svensson K.J., van Kuppevelt T.H. et al. Cancer cell exosomes depend on cell-surface heparan sulfate proteoglycans for their internalization and functional activity. Proc. Natl Acad. Sci USA. 2013 Oct 22. 110(43). 17380-5. doi: 10.1073/pnas.1304266110.
- Christianson H.C., Belting M. Heparan sulfate proteoglycan as a cell-surface endocytosis receptor. Matrix Biol. 2014 Apr. 35. 51-5. doi: 10.1016/j.matbio.2013.10.004.
- Devhare P.B., Sasaki R., Shrivastava S. et al. Exosome-Mediated Intercellular Communication between Hepatitis C Virus-Infected Hepatocytes and Hepatic Stellate Cells. J. Virol. 2017 Feb 28. 91(6). pii: e02225-16. doi: 10.1128/JVI.02225-16.
- Du Y., Du S., Liu L., Gan F., Jiang X., Wangrao K., Lyu P., Gong P., Yao Y. Radiation-Induced Bystander Effect can be Transmitted Through Exosomes Using miRNAs as Effector Molecules. Radiat. Res. 2020 July 8. 194(1). 89-100. doi: https://doi.org/10.1667/RADE-20-00019.1.
- Fabbri M. MicroRNAs and miRceptors: a new mechanism of action for intercellular communication. Philos. Trans. R. Soc. Lond. B Biol. Sci. 2018 Jan 5. 373(1737). pii: 20160486. doi: 10.1098/rstb.2016.0486.
- Fabbri M., Garzon R., Andreeff M. et al. MicroRNAs and noncoding RNAs in hematological malignancies: molecular, clinical and therapeutic implications. Leukemia. 2008 Jun. 22(6). 1095-105. doi: 10.1038/leu.2008.30.
- Feng Y., Zou L., Yan D. et al. Extracellular MicroRNAs Induce Potent Innate Immune Responses via TLR7/MyD88-Dependent Mechanisms. J. Immunol. 2017 Sep 15. 199(6). 2106-2117. doi: 10.4049/jimmunol.1700730.
- Giugliano S., Kriss M., Golden-Mason L. et al. Hepatitis C virus infection induces autocrine interferon signaling by human liver endothelial cells and release of exosomes, which inhibits viral replication. Gastroenterology. 2015 Feb. 148(2). 392-402.e13. doi: 10.1053/j.gastro.2014.10.040.
- Jiao C., Jiao X., Zhu A. et al. Exosomal miR-34s panel as potential novel diagnostic and prognostic biomarker in patients with hepatoblastoma. J. Pediatr. Surg. 2017 Apr. 52(4). 618-624. doi: 10.1016/j.jpedsurg.2016.09.070.
- Kogure T., Lin W.L., Yan I.K. et al. Intercellular nanovesicle-mediated microRNA transfer: a mechanism of environmental modulation of hepatocellular cancer cell growth. Hepatology. 2011 Oct. 54(4). 1237-48. doi: 10.1002/hep.24504.
- Lee Y.S., Kim S.Y., Ko E. et al. Exosomes derived from palmitic acid-treated hepatocytes induce fibrotic activation of hepatic stellate cells. Sci Rep. 2017 Jun 16. 7(1). 3710. doi: 10.1038/s41598-017-03389-2.
- Lehmann K.A., Bass B.L. Double-stranded RNA adenosine deaminases ADAR1 and ADAR2 have overlapping specificities. Biochemistry. 2000 Oct 24. 39(42). 12875-84. PMID: 11041852.
- Li Y., Xiang G.M., Liu L.L. et al. Assessment of endogenous reference gene suitability for serum exosomal microRNA expression analysis in liver carcinoma resection studies. Mol. Med. Rep. 2015 Sep. 12(3). 4683-91. doi: 10.3892/mmr.2015.3919.
- Lin Q., Zhou C.R., Bai M.J,. Zhu D., Chen J.W., Wang H.F., Li M.A., Wu C., Li Z.R., Huang M.S. Exosome-mediated miRNA delivery promotes liver cancer EMT and metastasis. Am. J. Transl. Res. 2020 Mar 15. 12(3). 1080-1095. PMID: 32269736; PMCID: PMC7137059.
- Liu W., Chen S., Liu B. Diagnostic and prognostic values of serum exosomal microRNA-21 in children with hepatoblastoma: a Chinese population-based study. Pediatr. Surg. Int. 2016 Nov. 32(11). 1059-1065. Doi: 10.1007/s00383-016-3960-8.
- Marques-Rocha J.L., Garcia-Lacarte M., Samblas M. et al. Regulatory roles of miR-155 and let-7b on the expression of inflammation-related genes in THP-1 cells: effects of fatty acids. J. Physiol. Biochem. 2018 May 22. doi: 10.1007/s13105-018-0629-x.
- Masyuk A.I., Masyuk T.V., Larusso N.F. Exosomes in the pathogenesis, diagnostics and therapeutics of liver diseases. J. Hepatol. 2013 Sep. 59(3). 621-5. doi: 10.1016/j.jhep.2013.03.028.
- Momen-Heravi F., Saha B., Kodys K. et al. Increased number of circulating exosomes and their microRNA cargos are potential novel biomarkers in alcoholic hepatitis. J. Transl. Med. 2015 Aug 12. 13. 261. doi: 10.1186/s12967-015-0623-9.
- Povero D., Eguchi А., Li H. et al. Circulating extracellular vesicles with specific proteome and liver microRNAs are potential biomarkers for liver injury in experimental fatty liver disease. PLoS One. 2014 Dec 3. 9(12). e113651. doi: 10.1371/journal.pone.0113651.
- Qian X., Xu C., Fang S. et al. Exosomal MicroRNAs Derived From Umbilical Mesenchymal Stem Cells Inhibit Hepatitis C Virus Infection. Stem. Cells Transl. Med. 2016 Sep. 5(9). 1190-203. doi: 10.5966/sctm.2015-0348.
- Santangelo L., Bordoni V., Montaldo C. et al. Hepatitis C virus direct-acting antivirals therapy impacts on extracellular vesicles –microRNAs content and on their immunomodulating properties. Liver Int. 2018 Jan 22. doi: 10.1111/liv.13700.
- Seo W., Eun H.S., Kim S.Y. et al. Exosome-mediated activation of toll-like receptor 3 in stellate cells stimulates interleukin-17 production by γδ T cells in liver fibrosis. Hepatology. 2016 Aug. 64(2). 616-31. doi: 10.1002/hep.28644.
- Sohn W., Kim J., Kang S.H. et al. Serum exosomal microRNAs as novel biomarkers for hepatocellular carcinoma. 2015 Sep 18. 47. e184. doi: 10.1038/emm.2015.68.
- Sugimachi K., Matsumura Т., Hirata H. et al. Identification of a bona fide microRNA biomarker in serum exosomes that predicts hepatocellular carcinoma recurrence after liver transplantation. Br. J. Cancer. 2015 Feb 3. 112(3). 532-8. doi: 10.1038/bjc.2014.621.
- Szabo G., Momen-Heravi F. Extracellular vesicles in liver disease and potential as biomarkers and therapeutic targets. Nat. Rev. Gastroenterol. Hepatol. 2017 Aug. 14(8). 455-466. doi: 10.1038/nrgastro.2017.71.
- Tang J., Li Y., Liu K. et al. Exosomal miR-9-3p suppresses HBGF-5 expression and is a functional biomarker in hepatocellular carcinoma. Minerva Med. 2018 Feb. 109(1). 15-23. doi: 10.23736/S0026-4806.17.05167-9.
- Thakral S., Ghoshal K. miR-122 is a unique molecule with great potential in diagnosis, prognosis of liver disease, and therapy both as –miRNA mimic and antimir. Curr. Gene Ther. 2015. 15(2). 142-50. Doi: 10.2174/1566523214666141224095610. PMID: 25537773.
- Tkach M., Théry C. Communication by Extracellular Vesicles: Where We Are and Where We Need to Go. Cell. 2016 Mar 10. 164(6). 1226-1232. doi: 10.1016/j.cell.2016.01.043.
- Wang H., Hou L., Li A. et al. Expression of serum exosomal microRNA-21 in human hepatocellular carcinoma. Biomed. Res. Int. 2014. 2014. 864894. doi: 10.1155/2014/864894.
- Wang S., Wang J.Q., Lv X.W. Exosomal miRNAs as biomarkers in the diagnosis of liver disease. Biomark. Med. 2017 May. 11(6). 491-501. doi: 10.2217/bmm-2017-0011.
- Williams C., Royo F., Aizpurua-Olaizola O. et al. Glycosylation of extracellular vesicles: current knowledge, tools and clinical perspectives. Extracell. Vesicles. 2018 Mar 4. 7(1). 1442985. doi: 10.1080/20013078.2018.1442985.
- Yáñez-Mó M., Siljander P.R., Andreu Z. et al. Biological properties of extracellular vesicles and their physiological functions. J. Extracell. Vesicles. 2015 May 14. 4. 27066. doi: 10.3402/jev.v4.27066.
- Yang J., Li C., Zhang L., Wang X. Extracellular Vesicles as Carriers of Non-coding RNAs in Liver Diseases. Front. Pharmacol. 2018 Apr 24. 9. 415. doi: 10.3389/fphar.2018.00415.
- Yu X., Odenthal M., Fries J.W. Exosomes as miRNA Carriers: Formation-Function-Future. Int. J. Mol. Sci. 2016 Dec 2. 17(12). pii: E2028. Doi: 10.3390/ijms17122028.
- Zhang S., Ouyang X., Jiang X. et al. Dysregulated Serum MicroRNA Expression Profile and Potential Biomarkers in Hepatitis C Virus-infected Patients. Int. J. Med. Sci. 2015 Jul 16. 12(7). 590-8. doi: 10.7150/ijms.1.