Журнал «Боль. Суставы. Позвоночник» Том 12, №3, 2022
Вернуться к номеру
Постіммобілізаційний остеопороз: огляд літератури та серія клінічних випадків
Авторы: Григор’єва Н.В. (1), Дєдух Н.В. (1), Парубець М.М. (2), Бистрицька М.А. (1)
(1) — ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України», м. Київ, Україна
(2) — Центральний клінічний госпіталь Державної прикордонної служби України, м. Київ, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
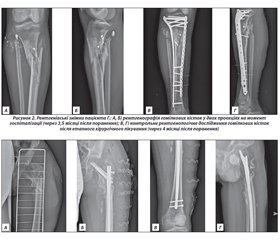
Актуальність. Постіммобілізаційний остеопороз (ПІ-ОП) визначають як вторинну втрату кісткової маси на тлі відсутності чи недостатності механічного навантаження на скелет. Це захворювання може бути пов’язане з різними факторами ризику, серед яких — тривалий ліжковий режим. Мета: проаналізувати сучасні літературні дані щодо механізмів розвитку, принципів діагностики й лікування ПІ-ОП і власні клінічні дані щодо розвитку ПІ-ОП у хворих з множинними пошкодженнями кісток скелета в умовах війни в Україні. Матеріали та методи. Огляд ґрунтується на аналізі джерел літератури з наукометричних баз PubMed, WOS, Scopus, Google, Google Scolar, Cochrane Library за 2007–2022 роки. Пошук проведено за ключовими словами «постіммобілізаційний остеопороз», «іммобілізація», «ліжковий режим», «мінеральна щільність кісткової тканини» (МЩКТ), «кісткове ремоделювання», «регенерація». Результати. Розглянуто дані щодо теорії механостату як ланки у виникненні ПІ-ОП. В умовах іммобілізації сповільнюються процеси регенерації кісткової тканини. Гістоморфометричні дослідження підтверджують зниження трабекулярної щільності кістки, товщини кортикального шару й збільшення його пористості. Простежується зміна кісткової архітектури з двофазністю перебігу. Відзначено порушення синхронності процесів ремоделювання зі зниженням темпів остеобластогенезу й підвищенням остеокластогенезу, акцентовано роль остеоцитів як механосенсорів. Постіммобілізаційний остеопороз призводить до порушення біохімічних показників метаболізму. Ранні лабораторні прояви ліжкового режиму зафіксовано у вигляді порушення метаболізму кальцію, підвищення маркерів резорбції кістки, тоді як маркери кісткоутворення практично не змінюються. Втрата кісткової тканини при ПІ-ОП маніфестує зменшенням показників МЩКТ. Найбільше їх зниження зареєстровано в кістках нижніх кінцівок і хребцях поперекового відділу хребта. Сучасні методи лікування ПІ-ОП передбачають використання антирезорбентів і стимуляторів кісткоутворення, проте клінічні дані обмежені, що потребує проведення багатоцентрових рандомізованих досліджень. У статті наведені 3 клінічних приклади власних спостережень ПІ-ОП у хворих з вогнепальними переломами кісток нижніх кінцівок.
Background. Disuse (рost-immobilization) osteoporosis is defined as secondary loss of bone mass in case of the absence or insufficient mechanical load on the skeleton. This disease can be associated with various risk factors, including long-time bed rest. The purpose of the research was to analyze modern literary data on the mechanisms of development, principles of diagnosis and treatment of disuse osteoporosis and to present own clinical data of disuse osteoporosis in the patients with multiple injuries of the skeleton in the conditions of war in Ukraine. Materials and methods. The review was based on the analysis of literature sources from the PubMed, WOS, Scopus, Google, Google Scholar, Cochrane Library databases for the years 2007–2022. The search was conducted using keywords: disuse osteoporosis, immobilization, bed rest, bone mineral density (BMD), bone remodeling, regeneration. Results. The data on the theory of the mechanostat are considered as links in the appearance of disuse osteoporosis. In conditions of immobilization, bone remodeling processes are slowing down. Histomorphometric studies confirm a decrease in trabecular bone density, thickness of the cortical layer, and an increase in its porosity. A change in bone architecture with a biphasic course is observed. Disruption of the synchronicity of remodeling processes with a decrease in the rate of osteoblastogenesis and an increase in osteoclastogenesis was noted, and the role of osteocytes as mechanosensors was emphasized. Disuse osteoporosis leads to a violation of biochemical marker of bone metabolism. Early laboratory manifestations of bed rest were recorded in the form of a violation of calcium level, an increase in bone resorption markers, while bone formation markers did not change significantly. Bone loss in disuse osteoporosis is manifested by a decrease in BMD indices. The greatest decrease was recorded in the lower extremities’ bones and the vertebrae of the lumbar spine. Modern methods of treatment of disuse osteoporosis involve the use of antiresorptive and osteoanabolic agents but clinical data are limited, which requires multicenter randomized studies. The article presents 3 clinical examples of disuse osteoporosis after gunshot fractures of the lower extremities’ bones.
постіммобілізаційний остеопороз; іммобілізація; ліжковий режим; мінеральна щільність кісткової тканини; ремоделювання кістки; регенерація
disuse osteoporosis; immobilization; bed rest; bone mineral density; bone remodeling; regeneration
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Alexandre C., Vico L. Pathophysiology of bone loss in disuse osteoporosis. Joint Bone Spine. 2011 Dec. 78(6). 572-6. doi: 10.1016/j.jbspin.2011.04.007.
- Rolvien T., Amling M. Disuse Osteoporosis: Clinical and Mechanistic Insights. Calcif. Tissue Int. 2022 May. 110(5). 592-604. doi: 10.1007/s00223-021-00836-1.
- Bloomfield S.A. Disuse osteopenia. Curr. Osteoporos. Rep. 2010 Jun. 8(2). 91-97. doi: 10.1007/s11914-010-0013-4.
- Hargens A.R., Vico L. Long-duration bed rest as an analog to microgravity. J. Appl. Physiol. 2016. 120(8). 891-903. doi: 10.1152/japplphysiol.00935.2015.
- Cappellesso R., Nicole L., Guido A., Pizzol D. Spaceflight osteoporosis: current state and future perspective. Endocr. Regul. 2015 Oct. 49(4). 231-9. doi: 10.4149/endo_2015_04_231. PMID: 26494042.
- Coulombe J.C., Senwar B., Ferguson V.L. Spaceflight-Induced Bone Tissue Changes that Affect Bone Quality and Increase Fracture Risk. Curr. Osteoporos. Rep. 2020 Feb. 18(1). 1-12. doi: 10.1007/s11914-019-00540-y. PMID: 31897866.
- Man J., Graham T., Squires-Donelly G., Laslett A.L. The effects of microgravity on bone structure and function. NPJ Microgravity. 2022 Apr 5. 8(1). 9. doi: 10.1038/s41526-022-00194-8. PMID: 35383182; PMCID: PMC8983659.
- Harris L.R., Jenkin M., Herpers R. Long-duration head down bed rest as an analog of microgravity: Effects on the static perception of upright. J. Vestib. Res. 2022. 32(4). 325-340. doi: 10.3233/VES-210016. PMID: 34719448; PMCID: PMC9398091.
- Chen J.H., Liu C., You L., Simmons C.A. Boning up on Wolff’s Law: mechanical regulation of the cells that make and maintain bone. J. Biomech. 2010. 43(1). 108-118. doi: 10.1016/j.jbiomech.2009.09.016.
- Brent M.B., Brüel A., Thomsen J.S. Animal models of disuse-induced bone loss: study protocol for a systematic review. Syst. Rev. 2020. 9(1). 185. DOI:10.1186/s13643-020-01441-3.
- Li J., Geng J., Lin T., Cai M., Sun Y. A mouse model of disuse osteoporosis based on a movable noninvasive 3D-printed unloading device. J. Orthop. Translat. 2022 Jan 6. 33. 1-12. doi: 10.1016/j.jot.2021.11.009. PMID: 35070713; PMCID: PMC8753063.
- Hart N.H., Newton R.U., Tan J. et al. Biological basis of bone strength: anatomy, physiology and measurement. J. Musculoskelet. Neuronal Interact. 2020. 20(3). 347-371. PMID: 32877972.
- Cabahug-Zuckerman P., Frikha-Benayed D., Majeska R.J. et al. Osteocyte apoptosis caused by Hindlimb unloading is required to trigger osteocyte RANKL production and subsequent resorption of cortical and trabecular bone in mice femurs. J. Bone Miner. Res. 2016. 31. 1356-1365. doi: 10.1002/jbmr.2807.
- Plotkin L.I., Gortazar A.R., Davis H.M. et al. Inhibition of osteocyte apoptosis prevents the increase in osteocytic receptor activator of nuclear factor kappa B ligand (RANKL) but does not stop bone resorption or the loss of bone induced by unloading. J. Biol. Chem. 2015. 290. 18934-18942. doi: 10.1074/jbc.M115.642090.
- Avrunyn A.S., Parshyn L.K., Melnykov B.E. Critical analysis of the mechanostat theory. Clinical and pathogenetic aspects of the reorganization of the skeletal architecture at different stages of its development. Orthopedic genius. 2013. 4. 96-102. https://cyberleninka.ru/article/n/zavisimost-osteogennogo-effekta-ot-harakteristik-mehanicheskih-nagruzok-kostnyh-struktur/viewer.
- Koseki H., Osaki M., Honda Y., Sunagawa S., Imai C., Shida T. et al. Progression of microstructural deterioration in load-bearing immobilization osteopenia. PLoS One. 2022 Nov 4. 17(11). e0275439. doi: 10.1371/journal.pone.0275439. PMID: 36331919; PMCID: PMC9635731.
- Iandolo D., Strigini M., Guignandon A., Vico L. Osteocytes and Weightlessness. Curr. Osteoporos. Rep. 2021 Dec. 19(6). 626-636. doi: 10.1007/s11914-021-00713-8.
- Krempien B., Manegold C., Ritz E., Bommer J. The influence of immobilization on osteocyte morphology: osteocyte differential count and electron microscopical stu–dies. Virchows Arch. A Pathol. Anat. Histol. 1976. 370. 55-68. doi: 10.1007/BF00427310.
- Spatz J.M., Wein M.N., Gooi J.H. et al. The Wnt inhibitor sclerostin is up-regulated by mechanical unloading in osteocytes in vitro. J. Biol. Chem. 2015. 290. 16744-16758. doi: 10.1074/jbc.M114.628313.
- Spatz J.M., Fields E.E., Yu E.W. et al. Serum sclerostin increases in healthy adult men during bed rest. J. Clin. Endocrinol. Metab. 2012. 97. E1736-E1740. DOI: 10.1210/jc.2012-1579.
- Qin L., Liu W., Cao H., Xiao G. Molecular mechanosensors in osteocytes. Bone Res. 2020 Jun 8. 8. 23. doi: 10.1038/s41413-020-0099-y. PMID: 32550039; PMCID: PMC7280204.
- Xu X., Liu S., Liu H. et al. Piezo Channels: Awesome Mechanosensitive Structures in Cellular Mechanotransduction and Their Role in Bone. Int. J. Mol. Sci. 2021 Jun 16. 22(12). 6429. doi: 10.3390/ijms22126429. PMID: 34208464; PMCID: PMC8234635.
- Wang L., You X., Zhang L., Zhang C., Zou W. Mechanical regulation of bone remodeling. Bone Res. 2022 Feb 18. 10(1). 16. doi: 10.1038/s41413-022-00190-4. PMID: 35181672; PMCID: PMC8857305.
- DeLong A., Friedman M.A., Tucker S.M. et al. Protective Effects of Controlled Mechanical Loading of Bone in C57BL6/J Mice Subject to Disuse. JBMR Plus. 2019 Dec 27. 4(3). e10322. doi: 10.1002/jbm4.10322. PMID: 32161839; PMCID: PMC7059829.
- Tiwari R. Piezoelectric Effect and Bone. 2017. https://sciencing.com/piezoelectric-effect-bone-density-5969491.html.
- Bauman W.A., Cardozo C.P. Immobilization Osteoporosis. In: Marcus R., Feldman D., eds. Osteoporosis. Waltham M.A.: Elsevier, 2013. 1139-1171. doi: 10.1016/B978-0-12-415853-5.00047-9.R.
- Tatsumi S., Ishii K., Amizuka N. et al. Targeted ablation of osteocytes induces osteoporosis with defective mechanotransduction. Cell. Metab. 2007. 5(6). 464-475. doi: 10.1016/j.cmet.2007.05.001.
- Phillips J.A., Almeida E.A., Hill E.L. et al. Role for β1 integrins in cortical osteocytes during acute musculoskeletal disuse. Matrix Biol. 2008. 27(7). 609-618. doi: 10.1016/j.matbio.2008.05.003.
- Cabahug-Zuckerman P., Stout R.F., Majeska R.J. et al. Potential role for a specialized beta3 integrin-based structure on osteocyte processes in bone mechanosensation. J. Orthop. Res. 2018. 36. 642-652.
- Riquelme M.A., Cardenas E.R., Xu H., Jiang J.X. The Role of Connexin Channels in the Response of Mechanical Loading and Unloading of Bone. Int. J. Mol. Sci. 2020 Feb 9. 21(3). 1146. doi: 10.3390/ijms21031146. PMID: 32050469; PMCID: PMC7038207.
- Lloyd S.A., Lewis G.S., Zhang Y., Paul E.M., Donahue H.J. Connexin 43 deficiency attenuates loss of trabecular bone and prevents suppression of cortical bone formation during unloading. J. Bone Miner. Res. 2012. 27. 2359-2372. doi: 10.1002/jbmr.1687.
- Zhang L., Li G., Wang K., Wang Y., Dong J., Wang H. et al. MiR-30 family members inhibit osteoblast differentiation by suppressing Runx2 under unloading conditions in MC3T3-E1 cells. Biochem. Biophys. Res. Commun. 2020 Jan 29. 522(1). 164-170. doi: 10.1016/j.bbrc.2019.11.057. Epub 2019 Nov 19. PMID: 31757419.
- Fujita T. Immobilization and Calcium Paradox. J. Osteopor. Phys. Act. 2015. 3. 152. DOI:10.4172/2329-9509.1000152.
- Nigam Y., Knight J., Jones A. Effects of bedrest 3: musculoskeletal and immune systems, skin and self-perception. Nurs. Times. 2009 Jun 16. 105(23). 18-22. PMID:19624052.
- Laurent M.R., Dubois V., Claessens F. et al. Muscle-bone interactions: From experimental models to the clinic? A critical update. Mol. Cell. Endocrinol. 2016 Sep 5. 432. 14-36. doi: 10.1016/j.mce.2015.10.017. Epub 2015 Oct 23. PMID: 26506009.
- Kirk B., Feehan J., Lombardi G., Duque G. Muscle, bone, and fat crosstalk: the biological role of myokines, osteokines, and adipokines. Curr. Osteoporos. Rep. 2020 Aug. 18(4). 388-400. doi: 10.1007/s11914-020-00599-y. PMID: 32529456.
- Tagliaferri C., Wittrant Y., Davicco M.J., Walrand S., Coxam V. Muscle and bone, two interconnected tissues. Ageing Res. Rev. 2015 May. 21. 55-70. doi: 10.1016/j.arr.2015.03.002. Epub 2015 Mar 21. PMID: 25804855.
- Storlino G., Colaianni G., Sanesi L. et al. Irisin prevents disuse-induced osteocyte apoptosis. J. Bone Miner. Res. 2020. 35. 766-775. doi: 10.1002/jbmr.3944.
- Colaianni G., Cuscito C., Mongelli T. et al. The myokine irisin increases cortical bone mass. Proc. Natl. Acad. Sci U S A. 2015. 112. 12157-12162. doi: 10.1073/pnas.1516622112.
- Kovalchuk L.I., Hnatiuk M.S., Smiian S.I. et al. A complex experimental study of an immobilization model of osteoporosis. Bulletin of scientific achievements. 2000. 1. 81-84. http://nbuv.gov.ua/ujrn/vndt_2000_1_35.
- LeBlanc A.D., Schneider V.S., Evans H.J. et al. Bone mineral loss and recovery after 17 weeks of bed rest. J. Bone Miner. Res. 1990. 5(8). 843-850. DOI:10.1002/jbmr.5650050807.
- Shackelford L.C., LeBlanc A.D., Driscoll T.B. et al. Resistance exercise as a countermeasure to disuse induced bone loss. J. Appl. Physiol. 2004. 97. 119-129. doi: 10.1152/japplphysiol.00741.2003.
- Yang C., Chen J., Wu F. et al. Effects of 60-day head-down bed rest on osteocalcin, glycolipid metabolism and their association with or without resistance training. Clin. Endocrinol. 2014. 81. 671-678. doi: 10.1111/cen.12535.
- Weber K. Effects of Immobilization on Bone Physiology and Metabolism. Diploma thesis. Medical University of Graz. 2014. 90. https://webcache.googleusercontent.com/search?q=cache:v4o0h0HeW1sJ:https://online.medunigraz.at/mug_online/wbabs.getDocument%3FpThesisNr%3D45880%26pAutorNr%3D62952%26pOrgNR%3D1&cd=2&hl=uk&ct=clnk&gl=ua.
- Krølner B., Toft B. Vertebral bone loss: an unheeded side effect of therapeutic bed rest. Clinical science (London, England: 1979). 1983. 64(5). 537-540. doi: 10.1042/cs0640537.
- Giannotti S., Bottai V., Dell’osso G., De Paola G., Bugelli G., Pini E., Guido G. Disuse osteoporosis of the upper limb: assessment of thirty patients. Clin. Cases Miner. Bone Metab. 2013 May. 10(2). 129-32. PMID: 24133531; PMCID: PMC3797001.
- Nardo L., Sandman D.N., Virayavanich W. et al. Bone Marrow Changes related to Disuse. Eur. Radiol. 2013. 23(12). 3422-3431. DOI: 10.1007/s00330-013-2943-6.
- Tagliaferri C., Wittrant Y., Davicco M.J., Walrand S., Coxam V. Muscle and bone, two interconnected tissues. Ageing research reviews. 2015. 21. 55-70. doi: 10.1016/j.arr.2015.03.002.
- Belavy D.L., Miokovic T., Armbrecht G. et al. Differential atrophy of the lower-limb musculature during prolonged bed-rest. Eur. J. Appl. Physiol. 2009 Nov. 107(4). 489-99. doi: 10.1007/s00421-009-1136-0.
- Osipov B., Emami A.J., Christiansen B.A. Systemic Bone Loss After Fracture. Clin. Rev. Bone Miner. Metab. 2018 Dec. 16(4). 116-130. doi: 10.1007/s12018-018-9253-0. Epub 2018 Dec 6. PMID: 31363348; PMCID: PMC6667184.
- Uusitalo H., Rantakokko J., Vuorio E., Aro H.T. Bone defect repair in immobilization-induced osteopenia: a pQCT, biomechanical, and molecular biologic study in the mouse femur. Bone. 2005 Jan. 36(1). 142-9. doi: 10.1016/j.bone.2004.09.010.
- Vining K.H., Mooney D.J. Mechanical forces direct stem cell behaviour in development and regeneration. Nat. Rev. Mol. Cell. Biol. 2017. 18. 728-742. doi: 10.1038/nrm.2017.108.
- ISCD Official Positions. https://iscd.org/learn/official-positions.
- Qin Y.X., Xia Y., Muir J., Lin W., Rubin C.T. Quantitative ultrasound imaging monitoring progressive disuse osteopenia and mechanical stimulation mitigation in calcaneus region through a 90-day bed rest human study. J. Orthop. Translat. 2018 Dec 24. 18. 48-58. doi: 10.1016/j.jot.2018.11.004. PMID: 31508307; PMCID: PMC6718925.
- Buehlmeier J., Frings-Meuthen P., Mohorko N. et al. Markers of bone metabolism during 14 days of bed rest in young and older men. J. Musculoskelet. Neuronal Inte–ract. 2017 Mar 1. 17(1). 399-408. PMID: 28250244; PMCID: PMC5383768.
- De Martino E., Hides J., Elliott J.M. et al. The Effects of Reconditioning Exercises Following Prolonged Bed Rest on Lumbopelvic Muscle Volume and Accumulation of Paraspinal Muscle Fat. Front Physiol. 2022 Jun 14. 13. 862793. doi: 10.3389/fphys.2022.862793. PMID: 35774286; PMCID: PMC9237402.
- Sakuma M., Endo N. Space flight/bedrest immobilization and Bone. Exercise training for osteoporosis. Clin. Calcium. 2012 Dec. 22(12). 1903-7. Japanese. PMID: 23187084.
- Norimoto M., Yamashita M., Yamaoka A., Yamashita K., Abe K., Eguchi Y. еt al. Early mobilization reduces the medical care cost and the risk of disuse syndrome in patients with acute osteoporotic vertebral fractures. J. Clin. Neurosci. 2021 Nov. 93. 155-159. doi: 10.1016/j.jocn.2021.09.011. Epub 2021 Sep 20. PMID: 34656240.
- Howe T.E., Shea B., Dawson L.J., Downie F. et al. Exercise for preventing and treating osteoporosis in postmenopausal women. Cochrane Database Syst. Rev. 2011 Jul 6. (7). CD000333. doi: 10.1002/14651858.CD000333.pub2. PMID: 21735380.
- Voet N.B., van der Kooi E.L., van Engelen B.G., Geurts A.C. Strength training and aerobic exercise training for muscle disease. Cochrane Database Syst. Rev. 2019 Dec 6. 12(12). CD003907. doi: 10.1002/14651858.CD003907.pub5. PMID: 31808555; PMCID: PMC6953420.
- Liu X., Gao X., Tong J., Yu L., Xu M., Zhang J. Improvement of Osteoporosis in Rats With Hind-Limb Unloading Treated With Pulsed Electromagnetic Field and Whole-Body Vibration. Phys. Ther. 2022 Oct 6. 102(10). pzac097. doi: 10.1093/ptj/pzac097. PMID: 35906872.
- Watanabe Y., Ohshima H., Mizuno K. et al. Intravenous pamidronate prevents femoral bone loss and renal stone formation during 90-day bed rest. J. Bone Miner. Res. 2004 Nov. 19(11). 1771-1778. doi: 10.1359/JBMR.040811.
- Li C.Y., Price C., Delisser K., Nasser P., Laudier D., Clement M., Jepsen K.J, Schaffler MB. Long-term disuse osteoporosis seems less sensitive to bisphosphonate treatment than other osteoporosis. J. Bone Miner Res. 2005 Jan. 20(1). 117-24. doi: 10.1359/JBMR.041010. Epub 2004 Oct 18. PMID: 15619677.
- Khajuria D.K., Razdana R., Mahapatrab D.R., Deepak Kumar K., Rema R., Debiprosad R.M. Effect of combined treatment with zoledronic acid and propranolol on mechanical strength in an rat rat model of disuse osteoporosis. Revista Brasileira de Reumatologia. 2015. 5. 5(6). 501-511. doi: 10.1016/j.rbre.2014.07.007.
- Khajuria D.K., Dishaa C.H., Razdana R., Mahapatrab D.R. Mahapatra Additive effect of zoledronic acid and alfacalcidol in the treatment of disuse osteoporosis in rats. Revista Brasileira de Reumatologia. 2015. 5. 5(3). 240-250.
- Ding Y., Cui Y., Yang X., Wang X., Tian G., Peng J. et al. Anti-RANKL monoclonal antibody and bortezomib prevent mechanical unloading-induced bone loss. J. Bone Miner. Metab. 2021 Nov. 39(6). 974-983. doi: 10.1007/s00774-021-01246-x. Epub 2021 Jul 1. PMID: 34212247.
- Teguh D.A., Nustad J.L., Craven A.E., Brooks D.J., Arlt H., Hu D. et al. Abaloparatide treatment increases bone formation, bone density and bone strength without increasing bone resorption in a rat model of hindlimb unloading. Bone. 2021 Mar. 144. 115801. doi: 10.1016/j.bone.2020.115801. Epub 2020 Dec 16. PMID: 33338664.
- Ko F.C., Van Vliet M., Ellman R., Grasso D., Brooks D.J., Spatz J.M. et al. Treatment With a Soluble Bone Morphogenetic Protein Type 1A Receptor –(BMPR1A) Fusion Protein Increases Bone Mass and Bone Formation in Mice Subjected to Hindlimb Unloading. JBMR Plus. 2017 Oct 9. 1(2). 66-72. doi: 10.1002/jbm4.10012. PMID: 30283882; PMCID: PMC6124165.