Международный эндокринологический журнал Том 18, №8, 2022
Вернуться к номеру
Ефективність і безпека стовбурових клітин у лікуванні цукрового діабету
Авторы: Ткач С.М., Паньків В.І.
Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
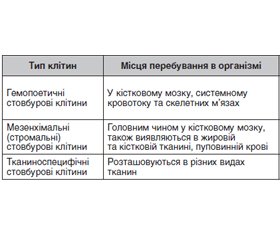
Цукровий діабет 1-го (ЦД1) та 2-го типів (ЦД2) у всьому світі є одним з найбільш поширених хронічних захворювань з високими показниками захворюваності та смертності. Замісна інсулінотерапія та інші різні гіпоглікемічні засоби понад 90 років використовуються для контролю високого рівня глюкози в крові, але вони не можуть точно імітувати секрецію ендогенного інсуліну, здатні викликати реактивну гіпоглікемію і не виключають ймовірності розвитку вторинних ускладнень ЦД (нефропатія, нейропатія, ретинопатія, судинна патологія). Впровадження нових наукових досягнень у клінічну практику в перспективі дозволяє оптимізувати лікування ЦД та його ускладнень, що може суттєво покращити якість життя багатьох хворих. Дуже перспективним методом терапії ЦД є використання стовбурових клітин (СК) як практично необмеженого джерела фізіологічно компетентного замінника первинних острівців Лангерганса. Як відомо, СК здатні перетворюватися (спеціалізуватися) на будь-яку клітину організму і, на відміну від інших, можуть ділитися невизначене число разів. Це дозволяє СК підтримувати певну чисельність їхньої популяції і дозволяє утворювати цілу ієрархію СК в організмі, які запасаються в певних депо. І нарешті, для СК характерний ефект Хоумінга — здатність знаходити зону пошкодження і фіксуватися в ній, заміщуючи втрачену функцію при введенні в організм. Низка проведених досліджень та останніх метааналізів свідчать про те, що після лікування ЦД стовбуровими клітинами відбувається зменшення рівня С-пептиду, рівня глікованого гемоглобіну (HbA1c) та добової потреби в інсулінотерапії, тобто для окремих осіб з ЦД терапія СК може бути безпечним та ефективним втручанням. При ЦД1 добрим джерелом трансплантації СК є гемопоетичні СК кісткового мозку. При ЦД2 рівень HbA1c та добова потреба в інсуліні значно покращувалися після терапії мезенхімальними СК, а терапія мононуклеарними клітинами кісткового мозку значно знижувала потребу в інсуліні та поліпшувала рівні С-пептиду. Ці обнадійливі результати потребують підтвердження у великих рандомізованих подвійних сліпих дослідженнях, а також при більш тривалих періодах спостереження, щоб чітко рекомендувати терапію на основі стовбурових клітин як стандарт лікування ЦД.
Diabetes mellitus type 1 (DM1) and type 2 (DM2) is one of the most common chronic diseases with high rates of morbidity and mortality. Insulin replacement therapy and other various hypoglycemic means have been used for more than 90 years to control high blood glucose levels, but they cannot accurately mimic the secretion of endogenous insulin, can cause reactive hypoglycemia, and do not exclude the risk of secondary complications of diabetes (nephropathy, neuropathy, retinopathy, vascular pathology). The introduction of new scientific achievements into clinical practice in the future allows optimizing the treatment for diabetes and its complications, which can significantly improve the quality of life of many patients. A very promising method of DM therapy is the use of stem cells (SC) as an almost unlimited source of physiologically competent substitute for primary islets of Langerhans. SC can transform (specialize) into any cell of the body and, unlike others, can divide an indefinite number of times. This allows SC to maintain a certain number of their population and allows for the formation of a whole hierarchy of SC in the body, which are stored in certain depots. And, finally, SC are characterized by the Homing effect — the ability to find the damaged zone and fix itself in it, filling the lost function when introduced into the body. A number of studies and recent meta-analyses suggest that C-peptide, HbA1c levels, and daily insulin requirements improve after treatment of DM with stem cells, meaning that SC therapy may be a safe and effective intervention for some individuals with DM. In DM1, bone marrow hematopoietic SC are a good source of SC transplantation. In DM2, HbA1c and daily insulin requirements were significantly improved after mesenchymal SC therapy, and bone marrow mononuclear cell therapy significantly reduced insulin requirements and improved C-peptide levels. These encouraging results require confirmation in large, randomized, double-blind studies, as well as with longer follow-up periods to clearly recommend stem cell-based therapy as the standard of DM management.
цукровий діабет 1-го та 2-го типу; лікування; трансплантація стовбурових клітин
diabetes mellitus type 1 and type 2; treatment; stem cell transplantation
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Sun H., Saeedi P., Karuranga S., Pinkepank M., Ogurtsova K., Duncan B.B., Stein C., et al. IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Res. Clin. Pract. 2022. 183. 109119. doi: 10.1016/j.diabres.2021.109119.
- Peng B.Y., Dubey N.K., Mishra V.K., Tsai F.C., Dubey R., Deng W.P., Wei H.J. Addressing Stem Cell Therapeutic Approa–ches in Pathobiology of Diabetes and Its Complications. J. Diabetes Res. 2018. 2018. 7806435. doi: 10.1155/2018/7806435. PMID: 30046616; PMCID: PMC6036791.
- Lilly M.A., Davis M.F., Fabie J.E., Terhune E.B., Gallicano G.I. Current stem cell based therapies in diabetes. Am. J. Stem. Cells. 2016. 5(3). 87-98. PMID: 27853630; PMCID: PMC5107653.
- Teramura Y., Iwata H. Bioartificial pancreas microencapsulation and conformal coating of islet of Langerhans. Adv. Drug Deliv. Rev. 2010. 62(7-8). 827-40. doi: 10.1016/j.addr.2010.01.005.
- Gaba R.C., Garcia-Roca R., Oberholzer J. Pancreatic islet cell transplantation: an update for interventional radiologists. J. Vasc. Interv. Radiol. 2012. 23(5). 583-94; quiz 594. doi: 10.1016/j.jvir.2012.01.057.
- Robertson R.P. Islet transplantation as a treatment for diabetes — a work in progress. N. Engl. J. Med. 2004. 350. 694-705. DOI: 10.1056/NEJMra032425
- Burns C.J., Persaud S.J., Jones P.M. Stem cell therapy for dia–betes: do we need to make beta cells? J. Endocrinol. 2004. 183(3). 437-43. doi: 10.1677/joe.1.05981. PMID: 15590970.
- Chhabra P., Brayman K.L. Stem cell therapy to cure type 1 diabetes: from hype to hope. Stem Cells Transl. Med. 2013. 2(5). 328-36. doi: 10.5966/sctm.2012-0116.
- Hess D., Li L., Martin M., Sakano S., Hill D., Strutt B., Thyssen S., Gray D.A., Bhatia M. Bone marrow-derived stem cells initiate pancreatic regeneration. Nat. Biotechnol. 2003. 21(7). 763-70. doi: 10.1038/nbt841.
- Pera M.F., Tam P.P. Extrinsic regulation of pluripotent stem cells. Nature. 2010. 465(7299). 713-20. doi: 10.1038/nature09228. PMID: 20535200.
- Voltarelli J.C., Couri C.E., Stracieri A.B., Oliveira M.C., Moraes D.A., Pieroni F., Coutinho M., et al. Autologous nonmye–loablative hematopoietic stem cell transplantation in newly diagnosed type 1 diabetes mellitus. JAMA. 2007. 297(14). 1568-76. doi: 10.1001/jama.297.14.1568. PMID: 17426276.
- Bhansali A., Upreti V., Khandelwal N., Marwaha N., Gupta V., Sachdeva N., Sharma R.R., et al. Efficacy of autologous bone marrow-derived stem cell transplantation in patients with type 2 diabetes mellitus. Stem Cells Dev. 2009. 18(10). 1407-16. doi: 10.1089/scd.2009.0164. PMID: 19686048.
- D’Addio F., Valderrama Vasquez A., Ben Nasr M., Franek E., Zhu D., Li L., Ning G., Snarski E., Fiorina P. Autologous nonmyeloablative hematopoietic stem cell transplantation in new-onset type 1 diabetes: a multicenter analysis. Diabetes. 2014. 63(9). 3041-6. doi: 10.2337/db14-0295.
- Rahim F., Arjmand B., Shirbandi K., Payab M., Larijani B. Stem cell therapy for patients with diabetes: a systematic review and meta-analysis of metabolomics-based risks and benefits. Stem Cell Investig. 2018. 5. 40. doi: 10.21037/sci.2018.11.01. PMID: 30596080; PMCID: PMC6286886.
- El-Badawy A., El-Badri N. Clinical Efficacy of Stem Cell Therapy for Diabetes Mellitus: A Meta-Analysis. PLoS One. 2016. 11(4). e0151938. doi: 10.1371/journal.pone.0151938. PMID: 27073927; PMCID: PMC4830527.
- Zhang Y., Chen W., Feng B., Cao H. The Clinical Efficacy and Safety of Stem Cell Therapy for Diabetes Mellitus: A Systema–tic Review and Meta-Analysis. Aging Dis. 2020. 11(1). 141-153. doi: 10.14336/AD.2019.0421. PMID: 32010488; PMCID: PMC6961772.
- Snarski E., Milczarczyk A., Torosian T., Paluszewska M., Urbanowska E., Król M., Boguradzki P., Jedynasty K., Franek E., Wiktor-Jedrzejczak W. Independence of exogenous insulin foll–wing immunoablation and stem cell reconstitution in newly diagnosed diabetes type I. Bone Marrow Transplant. 2011. 46(4). 562-6. doi: 10.1038/bmt.2010.147.
- Ye L., Li L., Wan B., Yang M., Hong J., Gu W., Wang W., Ning G. Immune response after autologous hematopoietic stem cell transplantation in type 1 diabetes mellitus. Stem Cell Res. Ther. 2017. 8(1). 90. doi: 10.1186/s13287-017-0542-1. PMID: 28420440; PMCID: PMC5395765.
- Zhang X., Ye L., Hu J., Tang W., Liu R., Yang M., Hong J., Wang W., Ning G., Gu W. Acute response of peripheral blood cell to autologous hematopoietic stem cell transplantation in type 1 diabetic patient. PLoS One. 2012. 7(2). e31887. doi: 10.1371/journal.pone.0031887.
- Carlsson P.O., Schwarcz E., Korsgren O., Le Blanc K. Preserved β-cell function in type 1 diabetes by mesenchymal stromal cells. Diabetes. 2015. 64(2). 587-92. doi: 10.2337/db14-0656.
- Couri C.E., Oliveira M.C., Stracieri A.B., Moraes D.A., Pieroni F., Barros G.M., Madeira M.I., et al. C-peptide levels and insulin independence following autologous nonmyeloablative hematopoietic stem cell transplantation in newly diagnosed type 1 diabetes mellitus. JAMA. 2009. 301(15). 1573-9. doi: 10.1001/jama.2009.470. PMID: 19366777.
- Bhansali S., Dutta P., Kumar V., Yadav M.K., Jain A., Mudaliar S., Bhansali S., et al. Efficacy of Autologous Bone Marrow-Derived Mesenchymal Stem Cell and Mononuclear Cell Transplantation in Type 2 Diabetes Mellitus: A Randomized, Placebo-Controlled Comparative Study. Stem Cells Dev. 2017. 26(7). 471-481. doi: 10.1089/scd.2016.0275.
- Jiang R., Han Z., Zhuo G., Qu X., Li X., Wang X., Shao Y., Yang S., Han Z.C. Transplantation of placenta-derived mesenchymal stem cells in type 2 diabetes: a pilot study. Front Med. 2011. 5(1). 94-100. doi: 10.1007/s11684-011-0116-z.
- Liu X., Zheng P., Wang X., Dai G., Cheng H., Zhang Z., Hua R., et al. A preliminary evaluation of efficacy and safety of Wharton’s jelly mesenchymal stem cell transplantation in patients with type 2 diabetes mellitus. Stem Cell Res. Ther. 2014. 5(2). 57. doi: 10.1186/scrt446. PMID: 24759263; PMCID: PMC4055092.
- Bhansali A., Asokumar P., Walia R., Bhansali S., Gupta V., Jain A., Sachdeva N., et al. Efficacy and safety of autologous bone marrow-derived stem cell transplantation in patients with type 2 dia–betes mellitus: a randomized placebo-controlled study. Cell Transplant. 2014. 23(9). 1075-85. doi: 10.3727/096368913X665576. PMID: 23561959.
- Wu Z., Cai J., Chen J., Huang L., Wu W., Luo F., Wu C., Liao L., Tan J. Autologous bone marrow mononuclear cell infusion and hyperbaric oxygen therapy in type 2 diabetes mellitus: an open-label, randomized controlled clinical trial. Cytotherapy. 2014. 16(2). 258-65. doi: 10.1016/j.jcyt.2013.10.004.
- Bhansali S., Dutta P., Yadav M.K., Jain A., Mudaliar S., Hawkins M., et al. Autologous bone marrow-derived mononuclear cells transplantation in type 2 diabetes mellitus: effect on beta-cell function and insulin sensitivity. Diabetol. Metab. Syndr. 2017. 9. 50. doi.org/10.1186/s13098-017-0248-7
- Hu J., Wang Y., Gong H., Yu C., Guo C., Wang F., Yan S., Xu H. Long term effect and safety of Wharton’s jelly-derived mesenchymal stem cells on type 2 diabetes. Exp. Ther. Med. 2016. 12(3). 1857-1866. doi: 10.3892/etm.2016.3544.
- Skyler J.S., Fonseca V.A., Segal K.R., Rosenstock J.; MSB-DM003 Investigators. Allogeneic Mesenchymal Precursor Cells in Type 2 Diabetes: A Randomized, Placebo-Controlled, Dose-Escalation Safety and Tolerability Pilot Study. Diabetes Care. 2015. 38(9). 1742-9. doi: 10.2337/dc14-2830.
- Guan L.X., Guan H., Li H.B., Ren C.A., Liu L., Chu J.J., Dai L.J. Therapeutic efficacy of umbilical cord-derived mesenchymal stem cells in patients with type 2 diabetes. Exp. Ther. Med. 2015. 9(5). 1623-1630. doi: 10.3892/etm.2015.2339.
- Si Y., Zhao Y., Hao H., Liu J., Guo Y., Mu Y., Shen J., et al. Infusion of mesenchymal stem cells ameliorates hyperglycemia in type 2 diabetic rats: identification of a novel role in improving insulin sensitivity. Diabetes. 2012. 61(6). 1616-25. doi: 10.2337/db11-1141. PMID: 22618776; PMCID: PMC3357293.
- Liao W., Xie J., Zhong J., Liu Y., Du L., Zhou B., Xu J., et al. Therapeutic effect of human umbilical cord multipotent mesenchymal stromal cells in a rat model of stroke. Transplantation. 2009. 87(3). 350-9. doi: 10.1097/TP.0b013e318195742e. PMID: 19202439.
- Dong Q.Y., Chen L., Gao G.Q., Wang L., Song J., Chen B., Xu Y.X., Sun L. Allogeneic diabetic mesenchymal stem cells transplantation in streptozotocin-induced diabetic rat. Clin. Invest. Med. 2008. 31(6). E328-37. doi: 10.25011/cim.v31i6.4918. PMID: 19032902.
- Li L., Shen S., Ouyang J., Hu Y., Hu L., Cui W., Zhang N., et al. Autologous hematopoietic stem cell transplantation modulates immunocompetent cells and improves β-cell function in Chinese patients with new onset of type 1 diabetes. J. Clin. Endocrinol. Metab. 2012. 97(5). 1729-36. doi: 10.1210/jc.2011-2188.
- Volarevic V., Al-Qahtani A., Arsenijevic N., Pajovic S., Lukic M.L. Interleukin-1 receptor antagonist (IL-1Ra) and IL-1Ra producing mesenchymal stem cells as modulators of diabetogenesis. Autoimmunity. 2010. 43(4). 255-63. doi: 10.3109/08916930903305641. PMID: 19845478.
- Abdi R., Fiorina P., Adra C.N., Atkinson M., Sayegh M.H. Immunomodulation by mesenchymal stem cells: a potential therapeutic strategy for type 1 diabetes. Diabetes. 2008. 57(7). 1759-67. doi: 10.2337/db08-0180. PMID: 18586907; PMCID: PMC2453631.