Журнал «Здоровье ребенка» Том 17, №7, 2022
Вернуться к номеру
Механізми дії цитоплазматичних мікроРНК. Частина 6. МікроРНК-опосередкована активація трансляції
Авторы: Абатуров О.Є., Бабич В.Л.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
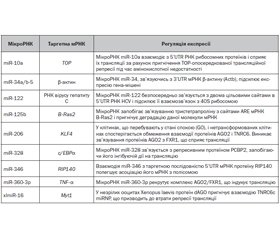
У науковому огляді висвітлені механізми дії цитоплазматичних мікроРНК, зокрема мікроРНК-опосередкована активація трансляції. Для написання статті здійснювався пошук інформації з використанням баз даних Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library. Подані приклади безпосередньої активації трансляції мРНК, що здійснюється мікроРНК. Одним з них є мікроРНК-опосередкована активація трансляції, що асоційована з особливостями стану клітини (ефект спочиваючої клітини). Показано, що протеїн 1 синдрому фрагільної хромосоми X і затримки розумового розвитку (fragile X mental retardation 1 — FMR1) залежно від етапу клітинного циклу може брати участь як в інгібуванні, так і в посиленні трансляції. Відомо, що мікроРНК можуть впливати на активність RNP, зв’язуючись з РНК-зв’язуючими сайтами конкретних мРНК або безпосередньо з молекулами RBP, прямо пригнічуючи їх активність. Протеїн 2, що зв’язується з полі(rC) (poly(rC) binding protein 2 — PCBP2), є багатофункціональною адаптерною молекулою, яка зв’язується з РНК, ДНК, конкуруючи з іншими РНК-зв’язуючими факторами. Протеїн PCBP2 обмежує ініціацію трансляції, перешкоджаючи рекрутингу рибосом. Авторами надана інформація про miR-346-опосередковану активацію трансляції рецептор-взаємодіючого протеїну 140. Підкреслено, що деякі мікроРНК, запобігаючи деградації молекули мРНК, сприяють підвищенню рівня її стабільності, що супроводжується посиленням їх трансляції. МікроРНК стабілізують специфічні мРНК-мішені, запобігаючи асоціації фактора деградації елементів ARE — тристетрапроліну — з мРНК. Наведено дані про активацію трансляції мРНК-мішені факторами, що секвеструють мікроРНК або конкурують з мікроРНК. Різні внутрішньоклітинні фактори і протеїни можуть вступати в конкурентні відносини з мікроРНК і перешкоджати їй або усувати її від таргетної мРНК. Відомо, що активація трансляції може відбуватися за рахунок мікроРНК-інгібування репресорних протеїнів. Автори наводять відомості, що посилення експресії miR-145 супроводжується активацією трансляції міокардину, який індукує проліферацію і міграцію гладком’язових клітин.
In the scientific review, the mechanisms of action of cytoplasmic miRNAs, namely miRNA-mediated activation of translation, are given. To write the article, information was searched using Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library databases. Examples of direct activation of mRNA translation by miRNA are presented. One of them is miRNA-mediated activation of translation, which is associated with the peculiarities of the state of the cell (resting cell effect). It has been shown that protein 1 of the fragile X mental retardation (FMR1) syndrome, depending on the stage of the cell cycle, can participate in both inhibition and enhancement of translation. It is known that microRNAs can influence the activity of RNP by binding to the RNA-binding sites of specific mRNAs or directly to RBP molecules, directly inhibiting their activity. Poly (rC) binding protein 2 (PCBP2) is a multifunctional adapter molecule that binds to RNA and DNA, competing with other RNA-binding factors. The PCBP2 protein limits translation initiation by preventing ribosome recruitment. The authors provided information on miR-346-mediated activation of the translation of receptor-interacting protein 140. It is emphasized that some miRNAs, preventing the degradation of the mRNA molecule, increasе the level of its stability, which is accompanied by an enhancement in their translation. MicroRNAs stabilize specific mRNA targets, preventing the association of the ARE element degradation factor, tristetraprolin, with mRNA. Data are presented on the activation of mRNA target translation by factors that sequester miRNAs or compete with miRNAs. Various intracellular factors and proteins can enter into a competitive relationship with miRNA and interfere with or remove it from the target mRNA. It is known that activation of translation can occur due to microRNA inhibition of repressor proteins. The authors indicate that increased miR-145 expression is accompanied by activation of myocardin translation, which induces the proliferation and migration of smooth muscle cells.
мікроРНК; мікроРНК-опосередкована активація трансляції; мРНК-мішені; репресорні протеїни; огляд
microRNA; miRNA; miR; miRNA-mediated activation of translation; mRNA targets; repressor proteins; review
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Bagni C., Oostra B.A. Fragile X syndrome: From protein function to therapy. Am. J. Med. Genet A. 2013 Nov. 161A(11). 2809-21. doi: 10.1002/ajmg.a.36241.
- Bukhari S., Vasudevan S. FXR1a-associated microRNP: A driver of specialized non-canonical translation in quiescent conditions. RNA Biol. 2017 Feb. 14(2). 137-145. doi: 10.1080/15476286.2016.1265197.
- Bukhari S.I.A., Truesdell S.S., Vasudevan S. Analysis of –MicroRNA-Mediated Translation Activation of In Vitro Transcribed Reporters in Quiescent Cells. Lacorazza, H. (eds). Cellular Quiescence. Methods in Molecular Biology. 2018. 1686. Humana Press, New York, NY. https://doi.org/10.1007/978-1-4939-7371-2_18.
- Chen E., Sharma M.R., Shi X. et al. Fragile X mental retardation protein regulates translation by binding directly to the ribosome. Mol. Cell. 2014 May 8. 54(3). 407-417. doi: 10.1016/j.molcel.2014.03.023.
- Choi H.S., Hwang C.K., Song K.Y. et al. Poly(C)-binding proteins as transcriptional regulators of gene expression. Biochem. Biophys. Res. Commun. 2009 Mar 13. 380(3). 431-6. doi: 10.1016/j.bbrc.2009.01.136.
- Davis J.K., Broadie K. Multifarious Functions of the Fragile X Mental Retardation Protein. Trends Genet. 2017 Oct. 33(10). 703-714. doi: 10.1016/j.tig.2017.07.008.
- Dockendorff T.C., Labrador M. The Fragile X Protein and Genome Function. Mol. Neurobiol. 2018 May 23. doi: 10.1007/s12035-018-1122-9.
- Eiring A.M., Harb J.G., Neviani P. et al. miR-328 functions as an RNA decoy to modulate hnRNP E2 regulation of mRNA translation in leukemic blasts. Cell. 2010 Mar 5. 140(5). 652-65. doi: 10.1016/j.cell.2010.01.007.
- Fernández E., Rajan N., Bagni C. The FMRP regulon: from targets to disease convergence. Front. Neurosci. 2013 Oct 24. 7. 191. doi: 10.3389/fnins.2013.00191.
- Gagan J., Dey B.K., Layer R. et al. MicroRNA-378 targets the myogenic repressor MyoR during myoblast differentiation. J. Biol. Chem. 2011 Jun 3. 286(22). 19431-8. doi: 10.1074/jbc.M111.219006.
- Glorian V., Maillot G., Polès S. et al. HuR-dependent loading of miRNA RISC to the mRNA encoding the Ras-related small GTPase RhoB controls its translation during UV-induced apoptosis. Cell. Death Differ. 2011 Nov. 18(11). 1692-701. doi: 10.1038/cdd.2011.35.
- Kakumani P.K., Harvey L.-M., Houle F., Guitart Т., Gebauer F., Simard M.J. CSDE1 regulates miRNA pathway. Life Science Alliance. 2020. 3(4). e201900632. DOI:10.26508/lsa.201900632.
- Kenny P., Ceman S. RNA Secondary Structure Modulates –FMRP’s Bi-Functional Role in the MicroRNA Pathway. Int. J. Mol. Sci. 2016 Jun 22. 17(6). pii: E985. doi: 10.3390/ijms17060985.
- Kobayashi H., Singer R.H. Single-molecule imaging of –microRNA-mediated gene silencing in cells. Nat. Commun. 2022. 13. 1435. https://doi.org/10.1038/s41467-022-29046-5.
- Krist B., Florczyk U., Pietraszek-Gremplewicz K. et al. The Role of miR-378a in Metabolism, Angiogenesis, and Muscle Biology. Int. J. Endocrinol. 2015. 2015. 281756. doi: 10.1155/2015/281756.
- Letonqueze O., Lee J., Vasudevan S. MicroRNA-mediated posttranscriptional mechanisms of gene expression in proliferating and quiescent cancer cells. RNA Biol. 2012 Jun. 9(6). 871-80. doi: 10.4161/rna.20806.
- Li E.H., Zhao X., Zhang C., Liu W. Fragile X mental retardation protein participates in non-coding RNA pathways. Yi Chuan. 2018 Feb 20. 40(2). 87-94. doi: 10.16288/j.yczz.17-255.
- Lin C.C., Liu L.Z., Addison J.B. et al. A KLF4-miRNA-206 autoregulatory feedback loop can promote or inhibit protein translation depending upon cell context. Mol. Cell Biol. 2011 Jun. 31(12). 2513-27. doi: 10.1128/MCB.01189-10.
- Ma F., Liu X., Li D. et al. MicroRNA-466l upregulates –IL-10 expression in TLR-triggered macrophages by antagonizing RNA-binding protein tristetraprolin-mediated IL-10 mRNA degradation. J. Immunol. 2010 Jun 1. 184(11). 6053-9. doi: 10.4049/jimmunol.0902308.
- Makeyev A.V., Liebhaber S.A. The poly(C)-binding proteins: a multiplicity of functions and a search for mechanisms. RNA. 2002 Mar. 8(3). 265-78. Doi:10.1017.S1355838202024627.
- Murphy A.J., Guyre P.M., Pioli P.A. Estradiol suppresses NF-kappa B activation through coordinated regulation of let-7a and miR-125b in primary human macrophages. J. Immunol. 2010 May 1. 184(9). 5029-37. doi: 10.4049/jimmunol.0903463.
- Napoli I., Mercaldo V., Boyl P.P. et al. The fragile X syndrome protein represses activity-dependent translation through CYFIP1, a new 4E-BP. Cell. 2008 Sep 19. 134(6). 1042-54. doi: 10.1016/j.cell.2008.07.031.
- Napthine S., Treffers E.E., Bell S. et al. A novel role for poly(C) binding proteins in programmed ribosomal frameshifting. Nucleic Acids Res. 2016 Jul 8. 44(12). 5491-503. doi: 10.1093/nar/gkw480.
- Ni W.J., Leng X.M. miRNA-Dependent Activation of mRNA Translation. MicroRNA. 2016. 5(2). 83-86. PMID: 27568791.
- Padmavathi G., Ramkumar K.M. MicroRNA mediated regulation of the major redox homeostasis switch, Nrf2, and its impact on oxidative stress-induced ischemic/reperfusion injury. Archives of Biochemistry and Biophysics. 2021. 698. 108725. https://doi.org/10.1016/j.abb.2020.108725.
- Pérez-Cremades D., Mompeón A., Vidal-Gómez X. et al. miRNA as a New Regulatory Mechanism of Estrogen Vascular Action. Int. J. Mol. Sci. 2018 Feb 6. 19(2). pii: E473. doi: 10.3390/ijms19020473.
- Pu M., Chen J., Tao Z. et al. Regulatory network of miRNA on its target: coordination between transcriptional and post-transcriptional regulation of gene expression. Cell. Mol. Life Sci. 2019. 76. 441-451. https://doi.org/10.1007/s00018-018-2940-7.
- Quinn S.R., O’Neill L.A. The role of microRNAs in the control and mechanism of action of IL-10. Curr. Top. Microbiol. Immunol. 2014. 380. 145-55. doi: 10.1007/978-3-662-43492-5_7.
- Saul M.J., Stein S., Grez M. et al. UPF1 regulates myeloid cell functions and S100A9 expression by the hnRNP E2/miRNA-328 balance. Sci Rep. 2016 Aug 30. 6. 31995. doi: 10.1038/srep31995.
- Shyu K.G., Cheng W.P., Wang B.W. Angiotensin II Downregulates MicroRNA-145 to Regulate Kruppel-like Factor 4 and Myocardin Expression in Human Coronary Arterial Smooth Muscle Cells under High Glucose Conditions. Mol. Med. 2015 Jul 14. 21. 616-25. doi: 10.2119/molmed.2015.00041.
- Tsai N.P., Lin Y.L., Wei L.N. MicroRNA mir-346 targets the 5’-untranslated region of receptor-interacting protein 140 (RIP140) mRNA and up-regulates its protein expression. Biochem J. 2009 Dec 10. 424(3). 411-8. doi: 10.1042/BJ20090915.
- Valinezhad Orang A., Safaralizadeh R., Kazemzadeh-Bavili M. Mechanisms of miRNA-Mediated Gene Regulation from Common Downregulation to mRNA-Specific Upregulation. Int. J. Genomics. 2014. 2014. 970607. doi: 10.1155/2014/970607.
- Vasudevan S. Posttranscriptional upregulation by microRNAs. Wiley Interdiscip. Rev. RNA. 2012 May-Jun. 3(3). 311-30. doi: 10.1002/wrna.121.
- Vasudevan S., Tong Y., Steitz J.A. Switching from repression to activation: microRNAs can up-regulate translation. Science. 2007 Dec 21. 318(5858). 1931-4. Doi: 10.1126/science.1149460.
- Wang C.H., Lee D.Y., Deng Z. et al. MicroRNA miR-328 regulates zonation morphogenesis by targeting CD44 expression. PLoS One. 2008 Jun 18. 3(6). e2420. doi: 10.1371/journal.pone.0002420.
- Ye W., Qin F., Zhang J. et al. Atomistic mechanism of microRNA translation upregulation via molecular dynamics simulations. PLoS One. 2012. 7(8). e43788. doi: 10.1371/journal.pone.0043788.