Вступ
Ішемічний інсульт продовжує чинити величезний вплив на здоров’я населення і, як очікується, буде продовжувати залишатися провідною складовою показника глобальної смертності навіть у нинішньому столітті [1]. Дослідження показали, що пацієнти, які перенесли інсульт, мають широкий спектр несприятливих наслідків, серед них такі, як афазія, постінсультна тривога й депресія. За останнє десятиліття показники здоров’я пацієнтів з гострим ішемічним інсультом вірогідно покращилися, насамперед завдяки кращому загальному менеджменту кожного випадку, доступності індивідуальних лікарських втручань і прогресу в проведенні ендоваскулярних процедур. Однак системи охорони здоров’я стикаються з «розривом у догляді» (care gap), зокрема, через триваючу пандемію COVID-19, а також з іншими факторами, які перешкоджають наданню якісних послуг [2]. Декілька факторів, у тому числі фінансові й інфраструктурні обмеження, обмежений досвід і клінічна невизначеність, усе ще перешкоджають дотриманню науково обґрунтованих клінічних настанов і оптимальних шляхів лікування [3].
Концепції нейропротекції та нейровідновлення після інсульту досліджувалися в багатьох клінічних умовах протягом останніх десятиліть з метою проаналізувати специфічну біологічну взаємодію між різними фармакологічними втручаннями й ендогенними захисними механізмами після ураження. Проте лише кілька досліджень за останні десятиліття дали позитивні результати в широкій сфері захисту й реабілітації мозку [4]. Такий результат може бути пояснено низкою причин, наприклад, ненадійними методологічними підходами, що призвели до суперечливих доказів, схемами лікування, які зосереджені на супресивних стратегіях, або надмірною кількістю досліджень втручань з одним (мономодальним) механізмом дії.
Церебролізин — це комбінація пептидів, що імітують біологічну дію нейротрофічних факторів, і амінокислот, отриманих з високоочищених безліпідних протеїнів головного мозку свиней, що сприяє нейротрофічній стимуляції (виживання й підтримка фенотипу високодиференційованих клітин), нейропротекції щодо впливу шкідливих агентів, нейромодуляції (наприклад, зміни нейрональної і синаптичної пластичності) і метаболічній регуляції (спрямована проти лактатацидозу й на підвищення стійкості до гіпоксичних умов) [5]. Продемонстровано, що Церебролізин успішно долає гематоенцефалічний бар’єр, незважаючи на різноманітні метаболічні й біохімічні процеси, які загалом утруднюють відновлення центральної нервової системи з фармакологічної точки зору [6–8]. Рандомізовані клінічні дослідження підкреслили ефективність і безпеку мультимодального втручання для відновлення рухових і неврологічних функцій після гострого ішемічного інсульту [9, 10].
Церебролізин рекомендований кількома клінічними практичними настановами як фармакологічний засіб при ішемічному інсульті як для гострої фази захворювання, так і для реабілітації після інсульту [11–13]. Попередні метааналізи профілю безпеки Церебролізину дали суперечливі результати. Особливо це стосується двох найбільших останніх метааналізів: Bornstein et al. 2018 р., куди було включено 1879 пацієнтів з дев’яти рандомізованих контрольованих досліджень (РКД) [14], а також огляду Ziganshina et al. 2020 р., у якому аналізували дані 1601 пацієнта із семи РКД [15].
Метою нашого метааналізу було вивчення профілю безпеки Церебролізину з використанням широкого підходу до відбору й оцінки доступної літератури.
Матеріали та методи
Відбір досліджень і джерел інформації
Для того, щоб окреслити питання, на яких фокусується наше дослідження, ми використовували модель РІСО (популяція — ішемічний інсульт, втручання — інфузія Церебролізину, препарат порівняння — плацебо або фізіологічний розчин, результат — параметри безпеки, які будуть детально пояснені далі). Протокол доступний у реєстрі OSF, https://osf.io/cxufq, доступ 18 листопада 2021 року [16]. Перед початком реалізації проєкту ми перевірили наявність подібних оглядів у міжнародному проспективному реєстрі систематичних оглядів PROSPERO, щоб уникнути дублювання.
Критерії включення і виключення
Ми включили рандомізовані подвійні сліпі плацебо-контрольовані клінічні дослідження, завершені до 28 лютого 2021 року, а також оцінку безпеки Церебролізину як додаткового препарату до стандартної терапії ішемічного інсульту. Для включення в цей метааналіз ми брали лише повнотекстові статті. Жодних обмежень не було накладено на мову, публікацію (рік, тип або статус), кінцеву точку дослідження (тривалість, термін спостереження, тип показників результатів) або лікування (вікно лікування, дозування, частота або тривалість). Якщо публікації не містили всіх деталей, необхідних для всебічної оцінки безпеки, у їх авторів ми запитували додаткові документи дослідження, такі як протоколи дослідження або звіти про клінічні дослідження.
З метааналізу були виключені дослідження, які не відповідали критеріям включення, а також такі, за якими не вдалося отримати повні дані про результати або інформацію, необхідну для проведення метааналізу. Параметрами безпеки були побічні явища, серйозні побічні явища, серйозні несприятливі явища без летального результату і смерть, визначені відповідно до поточних критеріїв Європейського агентства з лікарських засобів, описаних у Примітці для настанови з управління даними про клінічну безпеку: визначення і стандарти (CPMP/ICH/377/95).
Інформація була отримана з Embase, PubMed і кокранівської бази даних систематичних оглядів до кінця лютого 2021 року. Для подальшого відбору досліджень для цього огляду ми також перевірили основні посилання на огляди й реєстри досліджень (ClinicalTrials.gov, https://dinicaltrials.gov; реєстр ISRCTN, http://www.isrctn.com, доступ 2 квітня 2021 р.). Ми зв’язалися з авторами неопублікованих, але зареєстрованих досліджень і виробником Церебролізину з проханням надати нам додаткові докази й посилання для проведення метааналізу. Пошуковий термін «Церебролізин» застосовувався до всіх пошукових запитів в електронній базі даних. Стратегія пошуку для Embase була («Церебролізин»/exp АБО Церебролізин), а для PubMed — («Церебролізин» (Додаткова концепція) АБО «Церебролізин» (усі поля)). Фільтри не використовувалися. Далі деталі статті було експортовано й упорядковано за допомогою електронної таблиці. Повторювані записи видалялися автоматично на основі цифрових ідентифікаторів об’єктів і вручну на основі заголовків. Рецензію проводили два незалежні рецензенти (S.S. і D.B.), визначаючи різні оцінки шляхом консенсусу. Програмне забезпечення Abstrakr використовувалося для полегшення перегляду заголовків і резюме (за наявності). Подальший відбір проводився вручну на основі доступних повних текстів. Ми переклали повні тексти звітів про дослідження, опубліковані іншими мовами, крім англійської, які вважалися прийнятними на основі анотації англійською мовою. Дослідження з пошуку цитат перевіряли на придатність і перехресно перевіряли з уже відповідними записами.
Дані з кожної включеної публікації вилучали два рецензенти, які працювали незалежно один від одного й використовували форму вилучення, розроблену для дослідження. Кожне включене РКД було оцінено на предмет відбору, ефективності, виявлення, виснаження й упередженості у звітах та інших упереджень, які могли бути виявлені під час розгляду. Розбіжності щодо виділених елементів, класифікації доказів або оцінки розміру ефекту вирішувались консенсусом; якщо консенсусу не було досягнуто, залучався третій член команди (L.B.). Включення будь-яких додатків для конкретного дослідження було задокументовано у виносках таблиці ризику зміщення (RoB). Крім того, індивідуальні дані пацієнтів були отримані для таких РКД: Gharagozli et al., 2011; Heiss et al., 2012; Lang et al., 2012; Muresanu et al., 2016, і Guekht et al., 2015 [9, 17–20]. Зведені дані з публікацій та індивідуальні дані пацієнтів були перехресно перевірені. У разі розбіжностей зв’язувалися з оригінальними авторами досліджень для уточнення. Усі розбіжності можна було усунути, вони були пов’язані з різними основними наборами даних (безпека, ITT, FAS). Не вдалося отримати інформацію щодо несприятливих подій і серйозних побічних явищ для одного з досліджень [17]. Воно було виключене з відповідних аналізів.
Статистичний аналіз
Результати щодо безпеки були наступними: смертельні випадки з усіх причин, пацієнти з принаймні однією побічною подією (ПП), пацієнти з принаймні однією серйозною побічною подією (СПП) і пацієнти з принаймні однією нефатальною серйозною побічною подією (НФСПП). Усі результати безпеки були проаналізовані на основі співвідношення ризиків (RR) і їхніх 95% довірчих інтервалів (ДI). В одному дослідженні не було інформації про ПП і СПП. Це дослідження було виключено з відповідного аналізу. Ми застосували модель випадкових ефектів (DerSimonian-Laird), засновану на коефіцієнті ризику (RR) як розмірі ефекту для бінарних критеріїв безпеки. Розміри ефекту були подані з 95% ДІ та відповідними значеннями p. Гетерогенність оцінювали за допомогою процедури I-квадрат (I2). Усі метааналізи проводили за допомогою Revman (версія 5.4, Кокранівська співпраця, Лондон, Англія).
На додаток до об’єднаних аналізів у всіх включених рандомізованих дослідженнях проводився аналіз чутливості з використанням наступних категорій стратифікації, включаючи подальше об’єднання підгруп і формальні тести на взаємодію:
— 20–30 мл проти 50 мл;
— 20–30 мл < 20 днів порівняно з 20–30 мл > 20 днів;
— 50 мл < 20 днів проти 50 мл > 20 днів;
— початок лікування протягом 24 годин після інсульту порівняно з початком лікування через > 24 години після розвитку інсульту;
— дослідження, опубліковані незалежно й доступні в Інтернеті.
Для всіх аналізів підгруп проводили тести на підгрупову взаємодію і гетерогенність підгруп на основі критерію хі-квадрат і I2. Як поріг для інтерпретації даних використовувався рівень вірогідності α = 0,05. Оцінка ризику зміщення (RoB) для оцінки безпеки була виконана з використанням доступних даних з оригінальних публікацій. У незрозумілих випадках додаткову інформацію запитували в авторів оригінальних статей. Включення будь-яких додатків для конкретного дослідження було задокументовано у виносках таблиці RoB.
Результати
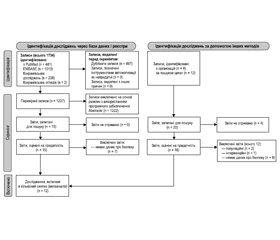
Процес систематичного пошуку дав 1734 результати з баз даних і 20 результатів, отриманих за допомогою інших методів, описаних у методології дослідження. Блок-схема процесу пошуку подана на рис. 1. Дослідження загалом показали низький ризик упередженості за шістьома проаналізованими критеріями (відбір, продуктивність, виявлення, виснаження, звітування та інше), за винятком трьох досліджень, у яких була відсутня інформація, що призвело до нечітких результатів оцінки [17, 21, 22].
Критеріям включення відповідали дванадцять досліджень. У них містилися дані про безпеку застосування Церебролізину у 2202 пацієнтів із загальної кількості 2274 рандомізованих пацієнтів у дослідженнях, відібраних для формального аналізу (табл. 1).
Усі дослідження були плацебо-контрольованими з використанням фізіологічного розчину. У деяких випадках застосовувалися спеціальні процедури, щоб приховати колір інфузійних ліній. Базові характеристики досліджень подані в табл. 2.
Летальні випадки
Загалом з усіх проаналізованих досліджень було отримано дані про 45 летальних випадків серед 1101 пацієнта, які отримували Церебролізин (4,1 %), порівняно з 55 смертями серед 1101 пацієнта, які отримували плацебо (5,0 %). Смертність оцінювали за допомогою співвідношення ризиків. Комбіноване RR для смертей від усіх причин демонструвало невелику перевагу Церебролізину зі зниженням ризику смерті на 17 %, що було статистично невірогідним з р = 0,36 (RR = 0,83; 95% ДІ = 0,57–1,23, р = 0,36, модель випадкових ефектів, рис. 2).
Серйозні побічні події
СПП були зареєстровані в цілому у 85 з 1078 пацієнтів, які отримували Церебролізин (7,9 %), порівняно з 85 із 1076 пацієнтів, які отримували плацебо (7,9 %). Комбіноване RR для пацієнтів із принаймні одною СПП не показало різниці між групами (RR = 0,99; 95% ДІ = = 0,74–1,32, р = 0,95, модель випадкових ефектів, рис. 3).
Побічні події
Побічні події були зареєстровані загалом у 472 із 1078 пацієнтів, які отримували Церебролізин (43,8 %), порівняно з 470 із 1078 пацієнтів, які отримували плацебо (43,6 %). Комбіноване RR для пацієнтів із принаймні одною ПП не показало різниці між групами (RR = 0,98; 95% ДІ = 0,88–1,09; р = 0,73, модель випадкових ефектів, рис. 4).
Нефатальні серйозні побічні події
НФСПП були зареєстровані в цілому в 41 із 1078 пацієнтів, які отримували Церебролізин (3,8 %), порівняно з 32 із 1078 пацієнтів, які отримували плацебо (3,0 %). Комбіноване RR для пацієнтів із принаймні одною НФСПП показало дещо вищу частоту в групі Церебролізину, що є статистично невірогідним із p = 0,46 (RR = 1,18; 95% ДІ = 0,715–1,86; p = 0,46, модель випадкового ефекту, рис. 5).
Аналіз чутливості
Усі результати окремих підгруп, а також усі формально об’єднані результати підгруп були статистично невірогідними, добре підтверджуючи результати грубого об’єднання в усіх включених рандомізованих дослідженнях. Результати цих аналізів подані в табл. 3. Ефекти для підгрупи Церебролізину в дозі 50 мл, у якій лікування тривало протягом 20 днів або більше, не можна було оцінити на основі ідентифікованих даних.
Обговорення
Метою даного дослідження була систематична оцінка результатів безпеки для пацієнтів, які отримували Церебролізин при ішемічному інсульті, у рандомізованих подвійних сліпих плацебо-контрольованих клінічних дослідженнях. Попередні роботи, знайдені в літературних джерелах на цю тему, різнилися за методологією, що призвело до розбіжних висновків [14, 15]. Безпека препарату, подібного до нейротрофічного фактора, раніше оцінювалася в різних дослідженнях, які подали неоднорідні результати щодо демографічних показників, часу включення і введеної дози, а також часу спостереження.
Для усунення повідомлених розбіжностей між дослідженнями, що оцінюють безпеку Церебролізину після гострого ішемічного інсульту, даний метааналіз мав на меті включити максимальну кількість РКД і пацієнтів, а також заповнити наявні прогалини в інформації про безпеку шляхом аналізу первинних посилань і запиту додаткового матеріалу в авторів оригінальних статей і виробника Церебролізину. Прагнення забезпечити додаткову ясність щодо безпеки втручання є важливим з огляду на його широке використання і рекомендації в клінічних настановах [11, 12] у поєднанні з величезним глобальним тягарем ішемічного інсульту [1]. Оскільки поширеність факторів ризику, які були пов’язані з цим захворюванням (наприклад, старіння і спосіб життя), також зростає, майбутні зусилля щодо вдосконалення втручань, спрямованих на пом’якшення його наслідків, повинні посилюватися профілактичними заходами [28].
Наш зведений аналіз 2202 пацієнтів не виявив жодних ознак щодо небезпеки Церебролізину. Це стосується об’єднаних аналізів 12 РКД, а також усіх аналізів підгруп (p > 0,05). Найменшу частоту СПП порівняно з плацебо виявлено в разі застосування найвищої дози Церебролізину (50 мл) — демонструється помірне зниження частоти СПП порівняно з плацебо. Крім того, спостерігається тенденція до загального зниження смертності від усіх причин. Цікаво відзначити, що найменшу частоту СПП і НФСПП виявлено для випадків призначення найвищої дози Церебролізину зі зниженням ризику більше ніж на 25 % порівняно з плацебо.
СПП може бути смерть та інші явища. Ziganshina et al. у 2020 році проводили оцінку шести досліджень смерті від усіх причин (RR = 0,9) [15]. Однак для СПП і нефатальних СПП вони включили лише чотири дослідження. Щодо летальної СПП вищезгадане дослідження включало лише аналіз трьох досліджень, хоча інформація щодо летальної СПП була доступна загалом у шести дослідженнях, а інформація про СПП була доступна для чотирьох досліджень. Gharagozli et al. у 2017 році оцінювалися нефатальні СПП і не оцінювалися фатальні СПП (незважаючи на одну смерть в групі Церебролізину та дві смерті в групі плацебо) [17]. Причина такого підходу може полягати в тому, що «всі смерті сталися протягом семиденного періоду гострої фази після інсульту через тяжкість інсульту». Gharagozli et al. пише в статті: «Троє пацієнтів померли в гострій фазі через тяжкість інсульту». Для узгодженості виключення таких пацієнтів з аналізу летальної СПП зазвичай вимагає подібного підходу для нефатальної СПП. Тому ми стверджуємо, що в дослідженні Ziganshina et al. у 2020 році при оцінці летальних СПП проти нефатальних СПП було два ключових обмеження, які офіційно не розглядаються в огляді: 1) зменшення аналізу летальних СПП до досліджень лише з інформацією про нефатальні СПП; 2) виключення одного дослідження з аналізу фатальних СПП без визначення загального правила, щоб описати відбір як особливу підмножину із загальної популяції летальних СПП.
У наш метааналіз безпеки ми включили 12 досліджень, які надають детальну інформацію про СПП. У всіх дослідженнях про летальні й нефатальні СПП чітко повідомлялося як таких в первинних джерелах. У деяких дослідженнях були лише летальні випадки і відсутні жодні інші СПП (нелетальні = 0). В одному дослідженні не було інформації про СПП [24]. Визначення СПП не пов’язується з передбачуваною причиною побічної події (наприклад, «продовження існуючої госпіталізації» визнається як СПП незалежно від причинно-наслідкового зв’язку з основним захворюванням). Крім того, час виникнення не відіграє жодної ролі в класифікації СПП, за винятком випадків, коли подія сталася протягом періоду дослідження ефектів препарату на людях. Частиною обмежувальних факторів цього метааналізу є висока неоднорідність досліджень щодо початкової тяжкості інсульту: медіани за NIHSS досягали від 7 до 14. Стратифікований аналіз досліджень, у яких був інсульт легкого ступеня (NIHSS < 8), проти досліджень з інсультом помірної тяжкості (NIHSS > 8) не дав ознак впливу на результати безпеки (усі взаємодії p > 0,8), за одним винятком: у разі інсульту легкого ступеня проти інсульту помірної тяжкості тест на відмінності підгруп щодо пацієнтів із принаймні одним побічним ефектом вказав помірну гетерогенність (I2 = 63,6 %, p = 0,10), з нижчими співвідношеннями ризику на користь Церебролізину в підгрупі інсульту помірної тяжкості (RR = 0,95; р = 0,33), порівняно з вищими співвідношеннями ризику в підгрупі інсульту легкого ступеня (RR = 1,26; р = 0,16). Іншим обмеженням є недостатня інформація з деяких із включених досліджень, незважаючи на особливі запити авторам щодо надання додаткової інформації, а також відсутність більш тривалих поздовжніх спостережень безпеки (6 місяців, 1 рік), які були недоступні в рандомізованих клінічних дослідженнях. Це слід враховувати в рамках планів майбутніх досліджень.
Основною перевагою цієї статті є включення найбільшої на сьогодні кількості досліджень з використання Церебролізину в пацієнтів з інсультом, які включають загалом 12 рандомізованих подвійних сліпих досліджень. Важливою перевагою є включення додаткового матеріалу, який за запитом надавався авторами оригінальних досліджень, якщо публікації з узагальненими розділами безпеки не надавали достатньо даних для всіх цікавих результатів безпеки. Це проблема, з якою стикаються багато таких досліджень. Отже, можна було отримати максимум даних щодо безпеки. Іншою сильною стороною є однорідність результатів безпеки в усіх аналізах чутливості, що підтверджує основний результат і демонструє надійність результатів безпеки на всіх шляхах аналізу.
Цей комплексний метааналіз безпеки показує дуже добрий профіль безпеки для пацієнтів, які отримували Церебролізин після гострого ішемічного інсульту, порівняно з плацебо. Хоча жоден з аналізів не надав доказів щодо безпеки, спостерігалася тенденція до переваги Церебролізину в високих дозах і при інсульті помірної тяжкості в плані зменшення частоти серйозних побічних ефектів. Бажано провести подальші рандомізовані клінічні дослідження, щоб надати додаткові докази на основі більшої тривалості спостережень і змішаних або повторюваних циклів лікування. Крім того, розвиток досліджень ефективності також сприятиме посиленню чинності поточних тверджень щодо безпеки Церебролізину.
Оригінал статті надрукований
у Pharmaceuticals. 2021. 14. 1297;
https://doi.org/10.3390/ph14121297
Список литературы
1. Gorelick P.B. The Global Burden of Stroke: Persistent and Disabling. Lancet Neurol. 2019. 18. 417-418.
2. Markus H.S., Brainin M. COVID-19 and Stroke — A Global World Stroke Organization Perspective. Int. J. Stroke. 2020. 15. 361-364.
3. Gache K., Leleu H., Nitenberg G., Woimant F., Ferrua M., Minvielle E. Main Barriers to Effective Implementation of Stroke Care Pathways in France: A Qualitative Study. BMC Health Serv. Res. 2014. 14. 95.
4. Brainin M. Cerebrolysin: A Multi-Target Drug for Recovery after Stroke. Expert Rev. Neurother. 2018. 18. 681-687.
5. Muresanu D.F., Strilciuc S., Stanу A. Current Drug Treatment of Acute Ischemic Stroke: Challenges and Opportunities. CNS Drugs. 2019. 33. 841-847.
6. Muresanu D.F. Neuromodulation with Pleiotropic and Multimodal Drugs — Future Approaches to Treatment of Neurological Disorders. In Proceedings of the Brain Edema XIV. Czernicki Z., Baethmann A., Ito U., Katayama Y., Kuroiwa T., Mendelow D., Eds.; Vienna, Austria: Springer, 2010. Р. 291-294.
7. Muresanu D.F., Ciurea A.V., Gorgan R.M., Gheorghita E., Florian S.I., Stan H., Blaga A., Ianovici N., Iencean S.M., Turliuc D. et al. A Retrospective, Multi-Center Cohort Study Evaluating the Severity-Related Effects of Cerebrolysin Treatment on Clinical Outcomes in Traumatic Brain Injury. CNS Neurol. Disord. Drug Targets. 2015. 14. 587-599.
8. Taylor E.M. The Impact of Efflux Transporters in the Brain on the Development of Drugs for CNS Disorders. Clin. Pharm. 2002. 41. 81-92.
9. Muresanu D.F., Heiss W.-D., Hoemberg V., Bajenaru O., Popescu C.D., Vester J.C., Rahlfs V.W., Doppler E., Meier D., Moessler H. et al. Cerebrolysin and Recovery After Stroke (CARS): A Randomized, Placebo-Controlled, Double-Blind, Multicenter Trial. Stroke. 2016. 47. 151-159.
10. Stan A., Birle C., Blesneag A., Iancu M. Cerebrolysin and Early Neurorehabilitation in Patients with Acute Ischemic Stroke: A Prospective, Randomized, Placebo-Controlled Clinical Study. J. Med. Life. 2017. 10. 216-222.
11. Beghi E., Binder H., Birle C., Bornstein N., Diserens K., Groppa S., Homberg V., Lisnic V., Pugliatti M., Randall G. et al. European Academy of Neurology and European Federation of Neurorehabilitation Societies Guideline on Pharmacological Support in Early Motor Rehabilitation after Acute Ischaemic Stroke. Eur. J. Neurol. 2021. 28. 2831-2845.
12. Platz T. Rehabilitative Therapy for Arm Paresis Following a Stroke. 2020. Available online: https://www.awmf.org/leitlinien/ detail/ll/080-001.html (accessed on 10 October 2021).
13. Teasell R., Hussein N., Mirkowski M., Vanderlaan D., Saikaley M., Longval M., Iruthayarajah J. Stroke Rehabilitation Clinician Handbook. 2020. Available online: http://www.ebrsr.com/sites/default/files/EBRSR%20Handbook%20Chapter%204_Upper% 20Extremity%20Post%20Stroke_ML.pdf (accessed on 10 October 2021).
14. Bornstein N.M., Guekht A., Vester J., Heiss W.-D., Gusev E., Homberg V., Rahlfs V.W., Bajenaru O., Popescu B.O., Muresanu D. Safety and Efficacy of Cerebrolysin in Early Post-Stroke Recovery: A Meta-Analysis of Nine Randomized Clinical Trials. Neurol. Sci. 2018. 39. 629-640.
15. Ziganshina L.E., Abakumova T., Vernay L. Cerebrolysin for Acute Ischaemic Stroke. Cochrane Database Syst. Rev. 2016. 12. CD007026.
16. Strilciuc S. Safety of Cerebrolysin for Neurorecovery after Acute Ischemic Stroke: A Systematic Review and Meta-Analysis of Twelve Randomized-Controlled Trials. OSF Registry. 2021.
17. Gharagozli K., Harandi A.A., Houshmand S., Akbari N., Muresanu D.F., Vester J., Winter S., Moessler H. Efficacy and Safety of Cerebrolysin Treatment in Early Recovery after Acute Ischemic Stroke: A Randomized, Placebo-Controlled, Double-Blinded, Multicenter Clinical Trial. J. Med. Life. 2017. 10. 153-160.
18. Heiss W.-D., Brainin M., Bornstein N.M., Tuomilehto J., Hong Z. Cerebrolysin Acute Stroke Treatment in Asia (CASTA) Investigators Cerebrolysin in Patients with Acute Ischemic Stroke in Asia: Results of a Double-Blind, Placebo-Controlled Randomized Trial. Stroke. 2012. 43. 630-636.
19. Lang W., Stadler C.H., Poljakovic Z., Fleet D.; Lyse Study Group. A Prospective, Randomized, Placebo-Controlled, Double-Blind Trial about Safety and Efficacy of Combined Treatment with Alteplase (Rt-PA) and Cerebrolysin in Acute Ischaemic Hemispheric Stroke. Int. J. Stroke. 2013. 8. 95-104.
20. Guekht A., Vester J., Heiss W.-D., Gusev E., Hoemberg V., Rahlfs V.W., Bajenaru O., Popescu B.O., Doppler E., Winter S. et al. Safety and Efficacy of Cerebrolysin in Motor Function Recovery after Stroke: A Meta-Analysis of the CARS Trials. Neurol. Sci. 2017. 38. 1761-1769.
21. Ladurner G., Kalvach P., Moessler H., Cerebrolysin Study Group. Neuroprotective Treatment with Cerebrolysin in Patients with Acute Stroke: A Randomised Controlled Trial. J. Neural. Transm. 2005. 112. 415-428.
22. Skvortsova V.I., Stakhovskaia L.V., Gubskii L.V., Shamalov N.A., Tikhonova I.V., Smychkov A.S. A randomized, double-blind, placebo-controlled study of Cerebrolysin safety and efficacy in the treatment of acute ischemic stroke. Zhurnal Nevrol. I Psikhiatrii Im. S.S. Korsakova. 2004. 104. 51-55.
23. Shamalov N.A., Stakhovskaia L.V., Burenchev D.V., Kichuk I.V., Tvorogova T.V., Botsina A.I., Smychkov A.S., Kerbikov O.B., Moessler H., Novak P. et al. The effect of cerebrolysin in dosage 50 ml on the volume of lesion in ischemic stroke. Zhurnal Nevrol. I Psikhiatrii Im. S.S. Korsakova . 2010. 110. 34-37.
24. Amiri-Nikpour M.R., Nazarbaghi S., Ahmadi-Salmasi B., Mokari T., Tahamtan U., Rezaei Y. Cerebrolysin Effects on Neurological Outcomes and Cerebral Blood Flow in Acute Ischemic Stroke. Neuropsychiatr. Dis. Treat. 2014. 10. 2299-2306.
25. Chang W.H., Park C., Kim D.Y., Shin Y.-I., Ko M.-H., Lee A., Jang S.Y., Kim Y.-H. Cerebrolysin Combined with Rehabilitation Promotes Motor Recovery in Patients with Severe Motor Impairment after Stroke. BMC Neurology. 2016. 16. 31.
26. Xue L.-X., Zhang T., Zhao Y.-W., Geng Z., Chen J.-J., Chen H. Efficacy and Safety Comparison of DL-3-n-Butylphthalide and Cerebrolysin: Effects on Neurological and Behavioral Outcomes in Acute Ischemic Stroke. Exp. Ther. Med. 2016. 11. 2015-2020.
27. Nilanont Y., Komoltri C., Saposnik G., Cote R., Di Legge S., Jin Y., Prayoonwiwat N., Poungvarin N., Hachinski V. The Canadian Neurological Scale and the NIHSS: Development and Validation of a Simple Conversion Model. Cereb. Dis. 2010. 30. 120-126.
28. Popa-Wagner Dietary Habits, Lifestyle Factors and Neurodegenerative Diseases. Available online: https://www.nrronline. org/article.asp?issn=1673-5374;year=2020;volume=15;issue=3;spage=394;epage=400;aulast=Popa%2DWagner (accessed on 3 December 2021).

/12.jpg)
/13.jpg)
/14.jpg)
/14_2.jpg)
/15.jpg)
/16.jpg)