Журнал «Здоровье ребенка» Том 17, №1, 2022
Вернуться к номеру
Клінічні особливості гіперпролактинемії в дітей: сучасні методи діагностики та лікування
Авторы: Абатуров О.Є. (1), Нікуліна А.О. (1), Алєйникова Т.Д. (2)
(1) — Дніпровський державний медичний університет, м. Дніпро, Україна
(2) — КНП «Міська дитяча клінічна лікарня № 6» ДМР, м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Гіперпролактинемія — поширене ендокринне захворювання, яке може бути пов’язане зі значною захворюваністю та інвалідизацією населення. Проведений систематичний огляд літературних джерел щодо діагностики та результатів лікування пацієнтів з гіперпролактинемією, включаючи медикаментозно-резистентні мікро- та макроаденоми гіпофіза, щоб виділити найбільш суттєві практичні рекомендації. Метою даного літературного огляду є прагнення надання алгоритмів диференціальної діагностики та клінічного спостереження пацієнтів, порівняння ефективності та побічних ефектів лікарських засобів, хірургічних втручань та променевої терапії при лікуванні гіперпролактинемії. Пролактиноми є найбільш поширеними аденомами гіпофіза у дітей старшого віку. Їх питома вага у структурі аденом гіпофіза становить близько 50 %. Клінічна картина залежить від віку, статі дитини, обсягу й особливостей росту пухлини. Провідними клінічними проявами гіперпролактинемії є: порушення репродуктивної системи, в тому числі ознаки розвитку вторинного гіпогонадотропного гіпогонадизму, сексуальна дисфункція, психоемоційні розлади, ендокринно-обмінні порушення. Основним критерієм діагностики гіперпролактинемії є концентрація пролактину в сироватці крові вище від верхньої межі фізіологічної норми. Первинний крок у лікуванні хворих з макроаденомою гіпофіза — це контроль компресійних ефектів пухлини, включаючи здавлення хіазми зорових нервів, з подальшим відновленням функції гонад. Головними напрямками лікування гіперпролактинемії є: відновлення та підтримання нормальної функції статевих залоз; відновлення фертильності; профілактика остеопорозу. Агоністи дофамінових рецепторів є золотим стандартом при лікуванні гіперпролактинемії. Тим не менш низка людей не реагують задовільно на ці лікарські засоби. В такому разі при наявності пухлин гіпофіза, крім медикаментозного лікування використовують оперативне втручання та променеву терапію. Однак оперативне втручання та променева терапія не є методами первинного вибору ведення хворих із пролактинсекретуючими аденомами гіпофіза, перевага передусім віддається медикаментозній терапії. Прогноз перебігу пролактином є сприятливим і ґрунтується на результатах динамічного спостереження та наявності маркерів агресивності даної аденоми.
Hyperprolactinemia is a common endocrine disease that can be associated with significant morbidity and disability in the population. A systematic review of literature sources on the diagnosis and treatment results in patients with hyperprolactinemia, including drug-resistant micro- and macroadenomas of the pituitary gland, was carried out in order to highlight the most significant practical recommendations. The purpose of this literature review is to provide algorithms for differential diagnosis and clinical observation of patients, to compare the efficacy and side effects of drugs, surgeries, and radiation therapy in the treatment of hyperprolactinemia. Prolactinomas are the most common pituitary adenomas in older children. Their share in the structure of pituitary adenomas is about 50 %. The clinical picture depends on the age, sex of the child, volume and characteristics of tumor growth. The leading clinical manifestations of hyperprolactinemia are disorders of the reproductive system, including signs of the development of secondary hypogonadotropic hypogonadism, sexual dysfunction, psychoemotional disorders, and endocrine and metabolic disorders. The main criterion for the diagnosis of hyperprolactinemia is the concentration of prolactin in the blood serum, which is above the upper limit of the physiological norm. The primary step in the treatment of patients with pituitary macroadenoma is to control the compression effects of the tumor, including compression of the optic chiasm, followed by restoration of gonadal function. The main areas of treatment for hyperprolactinemia are restoration and maintenance of the normal function of the gonads; restoration of fertility; prevention of osteoporosis. Dopamine receptor agonists are the gold standard in the treatment of hyperprolactinemia. However, some people do not respond satisfactorily to these drugs. In this case, in the presence of pituitary tumors, in addition to drug treatment, surgery and radiation therapy are used. But surgery and radiation therapy are not the primary methods of choice for the management of patients with prolactin-secreting pituitary adenomas; first of all, preference is given to drug therapy. The prognosis of the course of prolactinomas is favorable and is based on the results of dynamic observation and the presence of markers of the aggressiveness of this adenoma.
гіперпролактинемія; пролактинома; агоністи дофамінових рецепторів; лікування; огляд
hyperprolactinemia; prolactinoma; dopamine receptor agonists; treatment; review
Вступ
Клінічні особливості гіперпролактинемії
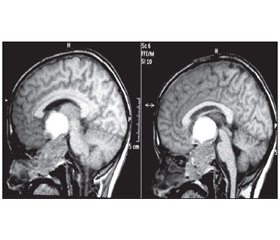
Діагностика та диференціальна діагностика
/38.jpg)
Лікування
Прогноз
- Абатуров О.Є., Нікуліна А.О., Петренко Л.Л. Акромегалія та гіпофізарний гігантизм у дітей. К.: Логос, 2020. 98 с.
- Тронько М.Д., Антипкін Ю.Г., Камінський В.В. та ін. Національний консенсус щодо ведення пацієнтів із гіперпролактинемією 2016. Медичні аспекти здоров’я жінки. 2017. 1(106). 32-42.
- Baldari S., Ferraù F., Alafaci C. et al. First demonstration of the effectiveness of peptide receptor radionuclide therapy (PRRT) with 111In-DTPA-octreotide in a giant PRL-secreting pituitary adenoma resistant to conventional treatment. Pituitary. 2012 Dec. 15 (Suppl. 1). S57-60. doi: 10.1007/s11102-011-0373-5.
- Barlier A., Jaquet P. Quinagolide — a valuable treatment option for hyperprolactinaemia. Eur. J. Endocrinol. 2006 Feb. 154(2). 187-95.
- Bengtsson D., Schrоder H.D., Andersen M. et al. Long-term outcome and MGMT as a predictive marker in 24 patients with atypical pituitary adenomas and pituitary carcinomas given treatment with temozolomide. J. Clin. Endocrinol. Metab. 2015 Apr. 100(4). 1689-98. doi: 10.1210/jc.2014-4350.
- Bolyakov A., Paduch D.A. Prolactin in men’s health and disease. Curr. Opin. Urol. 2011 Nov. 21(6). 527-34. doi: 10.1097/MOU.0b013e32834bdf01.
- Capozzi A., Scambia G., Pontecorvi A., Lello S. Hyperprolactinemia: pathophysiology and therapeutic approach. Gynecol. Endocrinol. 2015 Jul. 31(7). 506-10. doi: 10.3109/09513590.2015.1017810.
- Chaurasia P.K., Singh D., Meher S., Saran R.K., Singh H. Epistaxis as first clinical presentation in a child with giant prolactinoma: Case report and review of literature. J. Pediatr. Neurosci. 2011 Jul. 6(2). 134-7. doi: 10.4103/1817-1745.92840.
- Cookson J., Hodgson R., Wildgust H.J. Prolactin, hyperprolactinaemia and antipsychotic treatment: a review and lessons for treatment of early psychosis. J. Psychopharmacol. 2012 May. 26(5 Suppl.). 42-51. doi: 10.1177/0269881112442016.
- Cooper O., Mamelak A., Bannykh S. et al. Prolactinoma ErbB receptor expression and targeted therapy for aggressive tumors. Endocrine. 2014 Jun. 46(2). 318-27. doi: 10.1007/s12020-013-0093-x.
- Drummond J., Roncaroli F., Grossman A.B. et al. Clinical and Pathological Aspects of Silent Pituitary Adenomas. J. Clin. Endocrinol. Metab. 2019 Jul 1. 104(7). 2473-2489. doi: 10.1210/jc.2018-00688].
- Eren E., Yapıcı Ş., Çakır E.D., Ceylan L.A., Sağlam H., Tarım Ö. Clinical course of hyperprolactinemia in children and adolescents: a review of 21 cases. J. Clin. Res. Pediatr. Endocrinol. 2011. 3(2). 65-9. doi: 10.4274/jcrpe.v3i2.14.
- Fukuoka H., Cooper O., Mizutani J. et al. HER2/ErbB2 receptor signaling in rat and human prolactinoma cells: strategy for targeted prolactinoma therapy. Mol. Endocrinol. 2011 Jan. 25(1). 92-103. doi: 10.1210/me.2010-0353.
- Fusco A., Lugli F., Sacco E. et al. Efficacy of the combined cabergoline and octreotide treatment in a case of a dopamine-agonist resistant macroprolactinoma. Pituitary. 2011 Dec. 14(4). 351-7. doi: 10.1007/s11102-008-0162-y.
- Gao H., Xue Y., Cao L. et al. ESR1 and its antagonist fulvestrant in pituitary adenomas. Mol. Cell Endocrinol. 2017 Mar 5. 443. 32-41. doi: 10.1016/j.mce.2016.12.029.
- Gillam M.P., Molitch M.E., Lombardi G., Colao A. Advances in the treatment of prolactinomas. Endocr. Rev. 2006 Aug. 27(5). 485-534.
- Gordon C.M., Ackerman K.E., Berga S.L. et al. Functional Hypothalamic Amenorrhea: An Endocrine Society Clinical Practice Guideline. J. Clin. Endocrinol. Metab. 2017 May 1. 102(5). 1413-1439. doi: 10.1210/jc.2017-00131.
- Heidari Z., Hosseinpanah F., Shirazian N. Achievement of fertility in an infertile man with resistant macroprolactinoma using high-dose bromocriptine and a combination of human chorionic gonadotropin and an aromatase inhibitor. Endocr. Pract. 2010 Jul-Aug. 16(4). 669-72. doi: 10.4158/EP10026.CR.
- Li Q., Zhu Y., Chen M. et al. Development and Validation of a Deep Learning Algorithm to Automatic Detection of Pituitary Microadenoma From MRI. Front. Med. (Lausanne). 2021 Nov 29. 8. 758690. doi: 10.3389/fmed.2021.758690.
- Li Z., Liu Q., Li C. et al. The role of TGF-β/Smad signaling in dopamine agonist-resistant prolactinomas. Mol. Cell. Endocrinol. 2015 Feb 15. 402. 64-71. doi: 10.1016/j.mce.2014.12.024.
- Loeffler J.S., Shih H.A. Radiation therapy in the management of pituitary adenomas. J. Clin. Endocrinol. Metab. 2011 Jul. 96(7). 1992-2003. doi: 10.1210/jc.2011-0251.
- Maiter D. Management of Dopamine Agonist-Resistant Prolactinoma. Neuroendocrinology. 2019. 109(1). 42-50. doi: 10.1159/000495775.
- Melmed S., Casanueva F.F., Hoffman A.R. et al.; Endocrine Society. Diagnosis and treatment of hyperprolactinemia: an Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab. 2011 Feb. 96(2). 273-88. doi: 10.1210/jc.2010-1692.
- Molitch M.E. Diagnosis and Treatment of Pituitary Adenomas: A Review. JAMA. 2017 Feb 7. 317(5). 516-524. doi: 10.1001/jama.2016.19699.
- Molitch M.E. Endocrinology in pregnancy: management of the pregnant patient with a prolactinoma. Eur. J. Endocrinol. 2015 May. 172(5). R205-13. doi: 10.1530/EJE-14-0848.
- Molitch M.E. Management of medically refractory prolactinoma. J. Neurooncol. 2014. 117(3). 421-8.
- Recouvreux M.V., Camilletti M.A., Rifkin D.B. et al. The pituitary TGFβ1 system as a novel target for the treatment of resistant prolactinomas. J. Endocrinol. 2016 Mar. 228(3). R73-83. doi: 10.1530/JOE-15-0451.
- Shimazu S., Shimatsu A., Yamada S. et al. Resistance to dopamine agonists in prolactinoma is correlated with reduction of dopamine D2 receptor long isoform mRNA levels. Eur. J. Endocrinol. 2012. 166(3). 383-90.
- Shimon I., Sosa E., Mendoza V. et al. Giant prolactinomas larger than 60 mm in size: a cohort of massive and aggressive prolactin-secreting pituitary adenomas. Pituitary. 2016 Aug. 19(4). 429-36. doi: 10.1007/s11102-016-0723-4. PMID: 27138902.
- Trott J.F., Schennink A., Petrie W.K., Manjarin R., VanKlompenberg M.K., Hovey R.C. Triennial Lactation Symposium: Prolactin: The multifaceted potentiator of mammary growth and function. J. Anim. Sci. 2012 May. 90(5). 1674-86. doi: 10.2527/jas.2011-4682.
- Vasilev V., Daly A.F., Vroonen L., Zacharieva S., Beckers A. Resistant prolactinomas. J. Endocrinol. Invest. 2011 Apr. 34(4). 312-6
- Vilar L., Abucham J., Albuquerque J.L. et al. Controversial issues in the management of hyperprolactinemia and prolactinomas — An overview by the Neuroendocrinology Department of the Brazilian Society of Endocrinology and Metabolism. Arch. Endocrinol. Metab. 2018 Mar-Apr. 62(2). 236-263. doi: 10.20945/2359-3997000000032.
- Vilar L., Vilar C.F., Lyra R., Freitas M.D.C. Pitfalls in the Diagnostic Evaluation of Hyperprolactinemia. Neuroendocrinology. 2019. 109(1). 7-19. doi: 10.1159/000499694.
- Wang A.T., Mullan R.J., Lane M.A. et al. Treatment of hyperprolactinemia: a systematic review and meta-analysis. Syst. Rev. 2012 Jul 24. 1. 33. doi: 10.1186/2046-4053-1-33.
- Wang S., Wang A., Zhang Y. et al. The role of MAPK11/12/13/14 (p38 MAPK) protein in dopamine agonist-resistant prolactinomas. BMC Endocr. Disord. 2021 Nov 23. 21(1). 235. doi: 10.1186/s12902-021-00900-9.
- Wang Z., Gao L., Guo X., Feng C., Deng K., Lian W., Xing B. Identification of microRNAs associated with the aggressiveness of prolactin pituitary tumors using bioinformatic analysis. Oncol. Rep. 2019 Aug. 42(2). 533-548. doi: 10.3892/or.2019.7173.

/37.jpg)
/38_2.jpg)
/39.jpg)
/40.jpg)
/41.jpg)