Международный эндокринологический журнал Том 18, №1, 2022
Вернуться к номеру
Стан тиреоїдного гомеостазу в дітей із ожирінням
Авторы: Сорокман Т.В., Попелюк Н.О.
Буковинський державний медичний університет, м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
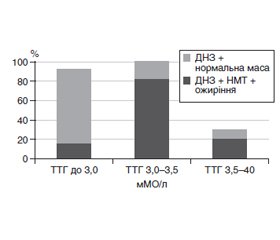
Актуальність. У зв’язку зі швидким зростанням поширеності дитячого ожиріння в Європі протягом останніх років були започатковані різноманітні ініціативи та заходи у відповідь на цю тривожну тенденцію. Упродовж останнього десятиріччя найбільш дискутабельним є питання про взаємовплив ожиріння та патології щитоподібної залози. Мета: оцінити стан тиреоїдного забезпечення в дітей із надлишковою масою тіла. Матеріали та методи. Із 936 осіб відібрано для детального дослідження 160 осіб віком від 7 до 18 років із надлишковою масою тіла (НМТ) та ожирінням. Рівні тиреотропного гормону (ТТГ), вільних трийодтироніну та тироксину (вТ3, вТ4) у сироватці крові визначали імуноферментним методом. Результати. У більшої частини відібраних для дослідження дітей із НМТ та ожирінням, як у хлопчиків, так і у дівчаток, трапляється дифузний нетоксичний зоб (ДНЗ) (51,4 %) із переважанням об’єму ЩЗ, що відповідає першому ступеню зоба. Тільки у невеликої кількості дітей із НМТ та ожирінням (14 із 105 осіб, 13,3 %) показники ТТГ були зміщені у сторону його підвищення (4,31–4,98 мкМО/мл), а при використанні показника ТТГ/вТ4 у 20 (11,5 %) дітей встановлено ознаки лабораторного гіпотиреозу із незначною перевагою гіпертиреотропінемії у хлопчиків (18,5 %) порівняно з дівчатками (15,6 %). Частота рівня ТТГ > 3,0 мкМО/мл зростала зі збільшенням віку хворих — від 12,9 % серед дітей 7–9 років до 16,6 % у групі пацієнтів 10–13 років та 15,1 % — у дітей 14–18 років, без суттєвих відмінностей за статтю. У дітей із НМТ та ожирінням на тлі ДНЗ частіше реєструвалися більш високі показники ТТГ, ніж у дітей із ДНЗ та нормальними показниками маси тіла. Висновки. У дітей із НМТ та ожирінням частіше трапляється дифузний нетоксичний зоб (51,2 %), ніж у дітей із нормальною масою тіла (21,7 %). Оцінка вікових особливостей функціонального стану щитоподібної залози у цих дітей не виявила вірогідних змін показників периферійних тиреоїдних гормонів, однак у 11,5 % осіб показник ТТГ/вТ4 перебував у межах від 0,19 до 0,29 та ще у 13,3 % осіб встановлені ознаки субклінічного гіпотиреозу. Це вказує на необхідність моніторингу функціонального стану щитоподібної залози в дітей із надлишковою масою тіла та ожирінням.
Background. Due to the rapid increase in the prevalence of childhood obesity in Europe in recent years, various initiatives and actions have been launched in response to this alarming tendency. Over the last decade, the question of the interaction between obesity and thyroid pathology has been the most controversial. The study was aimed to assess the state of thyroid supply in overweight children. Materials and methods. Out of 936 people, 160 people aged 7 to 18 years with overweight (OW) and obesity were selected for a detailed study. The levels of thyroid-stimulating hormone (TSH), free triiodothyronine, and thyroxine (fT3, fT4) in serum were determined by enzyme-linked immunosorbent assay. Results. More than half of the children who were selected for the study had both diffuse nontoxic goiter (DNG) both in boys and girls (51.4 %) with a predominance of thyroid volume corresponding to the first degree of goiter. Only in a small number of children with OW and obesity (14 out of 105 people, 13.3 %), TSH levels were shifted toward its increase (4.31–4.98 μIU/ml), and when using TSH/fT4, 20 (11.5 %) children showed signs of laboratory hypothyroidism with a slight predominance of hyperthyrotropinemia in boys (18.5 %) compared to girls (15.6 %). The frequency of TSH levels > 3.0 μIU/ml elevated with increasing age of patients from 12.9 % among children aged 7–9 years to 16.6 % in the group of patients aged 10–13 years and 15.1 % in children aged 14–18 years without significant differences by gender. Children with OW and obesity were more likely to have higher TSH values than children with DNG and normal body weight. Conclusions. Diffuse nontoxic goiter is more common in children with OW and obesity (51.2 %) than in children with normal body weight (21.7 %). The assessment of the age of the functional state of the thyroid gland in these children did not reveal significant changes in peripheral thyroid hormones, but in 11.5 % of people, TSH/fT4 ranged from 0.19 to 0.29 and 13.3 % of people had signs of subclinical hypothyroidism. This indicates the need to monitor the functional state of the thyroid gland in overweight and obese children.
діти; надмірна маса тіла; ожиріння; тиреоїдні гормони
children; overweight; obesity; thyroid hormones
Вступ
Матеріали та методи
Результати
/44_2.jpg)
Обговорення
Висновки
- Lissner L., Wijnhoven T.M.A., Mehlig K., Sjoberg A., Kunesova M., Yngve A., Petrauskiene A. et al. Socioeconomic inequalities in childhood overweight: heterogeneity across five countries in the WHO European Childhood Obesity Surveillance Initiative (COSI-2008). Int. J. Obes. (Lond.). 2016. 40(5). 796-802. doi:10.1038/ijo.2016.12.
- Spinelli A., Buoncristiano M., Kovacs V.A., Yngve A., Spiroski I., Obreja G., Starc G., et al. Prevalence of Severe Obesity among Primary School Children in 21 European Countries. Obes. Facts. 2019. 12(2). 244-258. doi: 10.1159/000500436.
- Rito A.I., Buoncristiano M., Spinelli A., Salanave B., Kunešová M., Hejgaard T., García Solano M., et al. Association between Characteristics at Birth, Breastfeeding and Obesity in 22 Countries: The WHO European Childhood Obesity Surveillance Initiative — COSI 2015/2017. Obes. Facts. 2019. 12(2). 226-243. doi: 10.1159/000500425.
- Williams J., Buoncristiano M., Nardone P., Rito A.I., Spinelli A., Hejgaard T., Kierkegaard L., et al. A Snapshot of European Children’s Eating Habits: Results from the Fourth Round of the WHO European Childhood Obesity Surveillance Initiative (COSI). Nutrients. 2020 Aug 17. 12(8). 2481. doi: 10.3390/nu12082481.
- Wijnhoven T.M., van Raaij J.M., Spinelli A., Starc G., Hassapidou M., Spiroski I., Rutter H., et al. WHO European Childhood Obesity Surveillance Initiative: body mass index and level of overweight among 6–9-year-old children from school year 2007/2008 to school year 2009/2010. BMC Public Health. 2014 Aug 7. 14. 806. doi: 10.1186/1471-2458-14-806.
- Kansra A.R., Lakkunarajah S., Jay M.S. Childhood and Adolescent Obesity: A Review. Front Pediatr. 2021. 8. 581461. doi: 10.3389/fped.2020.581461.
- Venturelli F., Ferrari F., Broccoli S., Bonvicini L., Mancuso P., Bargellini A., Giorgi Rossi P. The effect of Public Health/Pediatric Obesity interventions on socioeconomic inequalities in childhood obesity: A scoping review. Obes. Rev. 2019 Dec. 20(12). 1720-1739. doi: 10.1111/obr.12931.
- Valerio G., Maffeis C., Saggese G., Ambruzzi M.A., Balsamo A., Bellone S., Bergamini M., et al. Diagnosis, treatment and prevention of pediatric obesity: consensus position statement of the Italian Society for Pediatric Endocrinology and Diabetology and the Italian Society of Pediatrics. Ital. J. Pediatr. 2018 Jul 31. 44(1). 88. doi: 10.1186/s13052-018-0525-6.
- Lindberg L., Danielsson P., Persson M., Marcus C., Hagman E. Association of childhood obesity with risk of early all-cause and cause-specific mortality: A Swedish prospective cohort study. PLoS Med. 2020. 17(3). e1003078. doi: 10.1371/journal.pmed.1003078.
- Fornari E., Brusati M., Maffeis C. Nutritional Strategies for Childhood Obesity Prevention. Life (Basel). 2021. 11(6). 532. doi: 10.3390/life11060532.
- Farrag N.S., Cheskin L.J., Farag M.K. A systematic review of childhood obesity in the Middle East and North Africa (MENA) region: Prevalence and risk factors meta-analysis. Adv. Pediatr. Res. 2017. 4. 8. doi: 10.12715/apr.2017.4.8
- Miyawaki A., Evans C.E.L., Lucas P.J., Kobayashi Y. Relationships between social spending and childhood obesity in OECD countries: an ecological study. BMJ Open. 2021. 11(2). e044205. doi: 10.1136/bmjopen-2020-044205.
- Bel-Serrat S., Ojeda-Rodríguez A., Heinen M.M., Buoncristiano M., Abdrakhmanova S., Duleva V., Sant'Angelo V.F., et al. Clustering of Multiple Energy Balance-Related Behaviors in School Children and its Association with Overweight and Obesity — WHO European Childhood Obesity Surveillance Initiative (COSI 2015–2017). Nutrients. 2019 Feb 27. 11(3). 511. doi: 10.3390/nu11030511.
- van Trotsenburg P., Stoupa A., Léger J., Rohrer T., Peters C., Fugazzola L., Cassio A., et al. Congenital Hypothyroidism: A 2020-2021 Consensus Guidelines Update — An ENDO-European Reference Network Initiative Endorsed by the European Society for Pediatric Endocrinology and the European Society for Endocrinology. Thyroid. 2021 Mar. 31(3). 387-419. doi: 10.1089/thy.2020.0333.
- Vigone M.C., Capalbo D., Weber G., Salerno M. Mild Hypothyroidism in Childhood: Who, When, and How Should Be Treated? J. Endocr. Soc. 2018. 2(9). 1024-1039. doi: 10.1210/js.2017-00471.
- Witkowska-Sędek E., Kucharska A., Rumińska M., Pyrżak B. Thyroid dysfunction in obese and overweight children. Endokrynol. Pol. 2017. 68(1). 54-60. doi: 10.5603/EP.2017.0007.
- Stinson S.E., Jonsson A.E., Lund M.A.V., Frithioff-Bøjsøe С., Holm L.A., Pedersen O., Ängquist L. et al. Fasting Plasma GLP-1 Is Associated With Overweight/Obesity and Cardiometabolic Risk Factors in Children and Adolescents. J. Clin. Endocrinol. Metab. 2021. 106(6). 1718-1727. doi: 10.1210/clinem/dgab098.
- Koutny F., Weghuber D., Bollow E., Greber-Platzer S., Hartmann K., Körner A., Reinehr T., et al. Prevalence of prediabetes and type 2 diabetes in children with obesity and increased transaminases in European German-speaking countries. Analysis of the APV initiative. Pediatr. Obes. 2020 Apr. 15(4). e12601. doi: 10.1111/ijpo.12601.
- Ek A., Delisle Nyström C., Chirita-Emandi A., Tur J.A., Nordin K., Bouzas C., Argelich E., et al. A randomized controlled trial for overweight and obesity in preschoolers: the More and Less Europe study — an intervention within the STOP project. BMC Public Health. 2019 Jul 15. 19(1). 945. doi: 10.1186/s12889-019-7161-y.
- De Spiegeleer M., De Paepe E., Van Meulebroek L., Gies I., De Schepper J., Vanhaecke L. Paediatric obesity: a systematic review and pathway mapping of metabolic alterations underlying early disease processes. Mol. Med. 2021. 27(1). 145. doi: 10.1186/s10020-021-00394-0.
- Kalra S., Aggarwal S., Khandelwal D. Thyroid Dysfunction and Dysmetabolic Syndrome: The Need for Enhanced Thyrovigilance Strategies. Int. J. Endocrinol. 2021. 2021. 9641846. Published 2021 Mar 29. doi: 10.1155/2021/9641846.
- Falalyeyeva T., Mamula Y., Scarpellini E., Leshchenko I., Humeniuk A., Pankiv I., Kobyliak N. Probiotics and obesity associated disease: an extended view beyond traditional strains. Minerva Gastroenterology. 2021. 67(4). 348-356. doi: 10.23736/S2724-5985.21.02909-0.
- Pankiv V.I., Yuzvenko T., Pankiv I. Type 2 diabetes mellitus and subclinical hypothyroidism: focusing on the role of cholecalciferol. Problems of Endocrine Pathology. 2019. 2. 46-51. doi: 10.21856/j-PEP.2019.2.07.
- Yuzvenko Т. Correlation of Hypothyroidism and Obesity. International Journal of Endocrinology (Ukraine). 2017. 8(80). 11-14. doi: 10.22141/2224-0721.8.80.2016.89530.

/44.jpg)
/44_3.jpg)